Циклобутан
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
Циклобутан | |||
| Другие имена
Этеновый димер
Биэтилен Диэтилен | |||
| Идентификаторы | |||
| |||
3D model ( JSmol )
|
|||
| 1900183 | |||
| КЭБ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.005.468 | ||
| Номер ЕС |
| ||
| 81684 | |||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
| Число | 2601 | ||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| C4HC4H8 | |||
| Молярная масса | 56.107 g/mol | ||
| Появление | Бесцветный газ | ||
| Плотность | 0,720 г/см 3 | ||
| Температура плавления | -91 ° C (-132 ° F; 182 К) | ||
| Точка кипения | 12,5 ° C (54,5 ° F; 285,6 К) | ||
| Опасности | |||
| СГС Маркировка : | |||
 
| |||
| Опасность | |||
| Х220 , Х280 | |||
| П210 , П377 , П381 , П403 , П410+П403 | |||
| NFPA 704 (огненный алмаз) | |||
| Родственные соединения | |||
Родственный алкан
|
Бутан | ||
Родственные соединения
|
Циклобутен ; циклобутадиен ; Циклопопропан ; Циклопентан | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
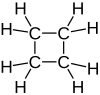
Циклобутан представляет собой циклоалкан и органическое соединение формулы (CH 2 ) 4 . Циклобутан представляет собой бесцветный газ и коммерчески доступен в виде сжиженного газа . Производные циклобутана называются циклобутанами. Сам циклобутан не имеет коммерческого или биологического значения, но более сложные производные важны в биологии и биотехнологии. [ 1 ]
Структура
[ редактировать ]Углы связи между углерода атомами значительно напряжены и поэтому имеют более низкие энергии связи, чем родственные линейные или ненапряженные углеводороды, например бутан или циклогексан . По существу, циклобутан нестабилен при температуре выше 500 °C.
Четыре атома углерода в циклобутане не копланарны; вместо этого кольцо обычно принимает сложенную или «сморщенную» форму . [ 2 ] Это означает, что угол CCC меньше 90°. Один из атомов углерода образует угол 25° с плоскостью, образованной тремя другими атомами углерода. Таким образом, некоторые затменные взаимодействия уменьшаются. Форма также известна как «бабочка». Эквивалентные сморщенные конформации взаимно преобразуются:
Циклобутаны в биологии и биотехнологии
[ редактировать ]Несмотря на присущую ему нагрузку, мотив циклобутана действительно встречается в природе. Одним из примеров является пентациклоанаммоксовая кислота. [ 3 ] который представляет собой ладдеран, состоящий из 5 конденсированных циклобутановых звеньев. Предполагаемая деформация этого соединения в 3 раза выше, чем у циклобутана. Это соединение обнаружено у бактерий, осуществляющих процесс анаммокса , где оно образует часть плотной и очень плотной мембраны, которая, как полагают, защищает организм от токсичного гидроксиламина и гидразина, участвующих в производстве азота и воды из нитрит -ионов и аммиака . [ 4 ] Некоторые родственные фенестраны также встречаются в природе. [ нужна ссылка ]
Циклобутановые фотодимеры (ЦПД) образуются в результате фотохимических реакций , которые приводят к соединению двойных связей C=C пиримидинов . [ 5 ] [ 6 ] [ 7 ] Димеры тимина (димеры ТТ), образующиеся между двумя тиминами, являются наиболее распространенными из CPD. CPD легко репарируются ферментами эксцизионной репарации нуклеотидов . У большинства организмов их также можно восстановить с помощью фотолиаз — семейства светозависимых ферментов. Пигментная ксеродерма — это генетическое заболевание, при котором повреждения не поддаются восстановлению, что приводит к изменению цвета кожи и опухолям, вызванным воздействием УФ-излучения .
Карбоплатин — популярный противораковый препарат , полученный из циклобутан-1,1-дикарбоновой кислоты.
Подготовка
[ редактировать ]Существует множество методов получения циклобутанов. Алкены димеризуются при облучении УФ-светом. 1,4-Дигалогенбутаны при дегалогенировании с восстановителями металлов превращаются в циклобутаны.
Циклобутан был впервые синтезирован в 1907 году Джеймсом Брюсом и Ричардом Вильштеттером путем гидрирования циклобутен в присутствии никеля. [ 8 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Цви Раппопорт, Джоэл Ф. Либман, изд. (2005). Химия циклобутанов . Химия функциональных групп ПАТАИ. Джон Уайли и сыновья. дои : 10.1002/0470864028 . ISBN 9780470864029 .
- ^ «Циклобутан» . Британская энциклопедия . Проверено 8 июля 2022 г.
- ^ Дж. С. Синнингхе Дамсте, М. Строус, WIC Rijpstra, EC Hopmans, JAJ Geenevasen, ACT van Duin, LA van Niftrik и MSM Jetten (2002). «Линейно сцепленные циклобутановые липиды образуют плотную бактериальную мембрану». Природа . 419 (6908): 708–712. Бибкод : 2002Natur.419..708S . дои : 10.1038/nature01128 . ПМИД 12384695 . S2CID 4373854 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Винсент Маскитти и Э. Дж. Кори (2006). «Энантиоселективный синтез пентациклоанаммоксовой кислоты». Дж. Ам. хим. Соц. 128 (10): 3118–9. дои : 10.1021/ja058370g . ПМИД 16522072 . Авторы утверждают, что способ биосинтеза весьма загадочный.
- ^ Р.Б. Сетлоу (1966). «Пиримидиновые димеры циклобутанового типа в полинуклеотидах». Наука . 153 (3734): 379–386. Бибкод : 1966Sci...153..379S . дои : 10.1126/science.153.3734.379 . ПМИД 5328566 . S2CID 11210761 .
- ^ Обзоры экспертов по молекулярной медицине (2 декабря 2002 г.). «Структура основных фотопродуктов, индуцированных УФ-излучением, в ДНК» (PDF) . Издательство Кембриджского университета. Архивировано из оригинала (PDF) 21 марта 2005 года . Проверено 16 августа 2009 г.
- ^ Кристофер Мэтьюз; К.Э. Ван Хольде (1990). Биохимия (2-е изд.). Публикация Бенджамина Каммингса. п. 1168 . ISBN 978-0-8053-5015-9 .
- ^ Ричард Вильштеттер; Джеймс Брюс (1907). «О наших знаниях о циклобутановом ряду». Отчеты Немецкого химического общества . 40 (4): 3979–3999. дои : 10.1002/cber.19070400407 .
Внешние ссылки
[ редактировать ]- на таблицу данных Ссылка