сульфолен
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК
2,5-Дигидро-1H - 1λ 6 -тиофен-1,1-дион | |||
| Другие имена
2,5-Дигидротиофен-1,1-диоксид
Бутадиенсульфон 3-сульфолен | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.000.964 | ||
ПабХим CID
|
|||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| С 4 Н 6 О 2 С | |||
| Молярная масса | 118.15 g·mol −1 | ||
| Температура плавления | От 65 до 66 ° C (от 149 до 151 ° F; от 338 до 339 К) | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
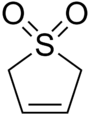
Сульфолен , или бутадиенсульфон, представляет собой циклическое органическое химическое вещество с сульфоновой функциональной группой . Это белое кристаллическое вещество без запаха, хранящееся неопределенно долго, растворяющееся в воде и многих органических растворителях. [ 2 ] Соединение используется в качестве источника бутадиена . [ 3 ]
Производство
[ редактировать ]
Сульфолен образуется в результате хелетропной реакции между бутадиеном и диоксидом серы. Реакцию обычно проводят в автоклаве. Небольшие количества гидрохинона или пирогаллола добавляются для ингибирования полимеризации диена. Реакция протекает при комнатной температуре в течение суток. При 130 °C требуется всего 30 минут. [ 4 ] Аналогичная процедура дает производное изопрена сульфон. [ 5 ]
Реакции
[ редактировать ]Кислотно-щелочная реакционная способность
[ редактировать ]Соединение не подвержено влиянию кислот. Его можно даже перекристаллизовать из конц. ХНО 3 . [ 6 ] [ 7 ]
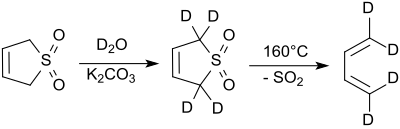
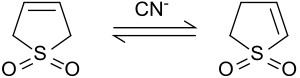
Протоны во 2-м и 5-м положениях быстро обмениваются с оксидом дейтерия в щелочных условиях. [ 8 ] Цианид натрия катализирует эту реакцию. [ 9 ]
Изомеризация в 2-сульфолен
[ редактировать ]В присутствии основания или цианида 3-сульфолен изомеризуется в смесь 2-сульфолена и 3-сульфолена. [ 9 ]
При 50°С получается равновесная смесь, содержащая 42% 3-сульфолена и 58% 2-сульфолена. [ 10 ] Термодинамически более стабильный 2-сульфолен можно выделить из смеси изомеров в виде чистого вещества в виде белых пластинок (т.пл. 48-49 °С) путем нагревания в течение нескольких дней при 100 °С за счет термического разложения 3-сульфолена. -сульфолен при температуре выше 80°С. [ 11 ]
гидрирование
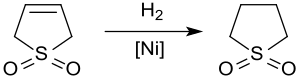
[ редактировать ]Каталитическое гидрирование дает сульфолан — растворитель, используемый в нефтехимической промышленности для экстракции ароматических соединений из потоков углеводородов . Гидрирование никелем 3-сульфолана над Ренея при температуре ок. 20 бар и 60 °С дают сульфолан с выходами до 65% только из-за отравления катализатора сернистыми соединениями. [ 12 ]
ион галогена
[ редактировать ]3-Сульфолен реагирует в водном растворе с бромом с образованием 3,4-дибромтетрогидротиофен-1,1-диоксида , который можно дегидробромировать до тиофен-1,1-диоксида карбонатом серебра . [ 6 ] Тиофен-1,1-диоксид, высокореактивная разновидность, также доступен посредством образования 3,4-бис(диметиламино)тетрагидротиофен-1,1-диоксида и последовательной двойной кватернизации с помощью йодистого метила и элиминирования Гофмана с помощью гидроксида серебра . [ 11 ]
Менее громоздкий двухстадийный синтез - это двукратное дегидробромирование 3,4-дибромтетрогидротиофен-1,1-диоксида порошкообразным гидроксидом натрия в тетрагидрофуране (ТГФ). [ 13 ] или с помощью диспергированного ультразвуком металлического калия . [ 14 ]
Реакции Дильса-Альдера
[ редактировать ]3-сульфолен в основном ценится как заменитель бутадиена. [ 2 ] [ 3 ] Производство на месте и немедленное потребление 1,3-бутадиена в значительной степени позволяет избежать контакта с диеном, который при комнатной температуре представляет собой газ. Одним из потенциальных недостатков, помимо затрат, является то, что выделяющийся диоксид серы может вызывать побочные реакции с чувствительными к кислоте субстратами.
Реакция Дильса-Альдера между 1,3-бутадиеном и диенофилами низкой реакционной способности обычно требует длительного нагревания выше 100 °С. Такие процедуры довольно опасны. Если используется чистый бутадиен, необходимо специальное оборудование для работы под повышенным давлением. В случае сульфолена нельзя ожидать повышения давления бутадиена, поскольку высвобожденный диен расходуется при циклоприсоединении, и поэтому равновесие обратимой реакции экструзии действует как внутренний «предохранительный клапан». [ 15 ]
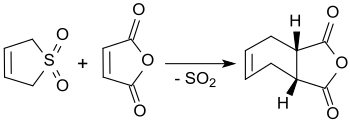
3-Сульфолен реагирует с малеиновым ангидридом в кипящем ксилоле с образованием цис-4-циклогексен-1,2-дикарбонового ангидрида с выходами до 90%. [ 3 ]
3-Сульфолен реагирует также с диенофилами в транс -конфигурации (такими как диэтилфумарат) при 110 °C с удалением SO 2 с выходом 66–73% с образованием диэтилового эфира транс-4-циклогексен-1,2-дикарбоновой кислоты. [ 16 ]
6,7-Дибром-1,4-эпокси-1,4-дигидронафталин (6,7-Дибромнафталин-1,4-эндоксид, доступный после дебромирования из 1,2,4,5-тетрабромбензола с использованием эквивалента н-бутиллития и реакция Дильса-Альдера в фуране с выходом 70%. [ 17 ] ) реагирует с 3-сульфоленом в кипящем ксилоле с образованием трициклического аддукта. Этот предшественник после обработки хлорной кислотой дает дибромдигидроантрацен, который на последней стадии дегидрируется с помощью 2,3-дихлор-5,6-дициано-1,4-бензохинона (DDQ) до 2,3-дибромантрацена. [ 18 ]
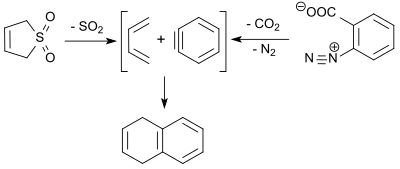
1,3-Бутадиен (образующийся в ретро-хелетрофной реакции 3-сульфолена) реагирует с дегидробензолом ( бензином , полученным термическим разложением бензолдиазоний-2-карбоксилата) по реакции Дильса-Альдера с выходом 9% с образованием 1,4 -дигидронафталин. [ 19 ]
2- и 3-сульфолены как диенофилы
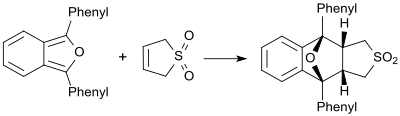
[ редактировать ]В присутствии очень реакционноспособных диенов (например, 1,3-дифенилизобензофурана) бутадиенсульфон ведет себя как диенофил и образует соответствующий аддукт Дильса-Альдера. [ 20 ]
Еще в 1938 году Курт Алдер и его коллеги сообщили об аддуктах Дильса-Альдера из изомерных 2-сульфолена с 1,3-бутадиеном и 2-сульфолана с циклопентадиеном . [ 21 ]
Другие циклоприсоединения
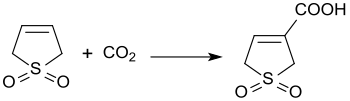
[ редактировать ]Катализируемая основанием реакция 3-сульфолена с диоксидом углерода при давлении 3 бар дает 3-сульфолен-3-карбоновую кислоту с выходом 45%. [ 22 ]
С диазометаном 3-сульфолен образует 1,3-диполярный циклоаддукт: [ 23 ]
Полимеризация
[ редактировать ]В 1935 г. Х. Штаудингер с сотрудниками установили, что реакция бутадиена и SO 2 при комнатной температуре дает, помимо 3-сульфолена, еще один продукт. Этот второй продукт представляет собой аморфный твердый полимер. Радикальной полимеризацией 3-сульфолана в пероксидсодержащем диэтиловом эфире получено до 50% нерастворимого высокомолекулярного полисульфолана. Полимер устойчив к разложению серной и азотной кислотами. [ 7 ]
В последующих исследованиях полимеризацию 3-сульфолена инициировали при температуре выше 100 °С радикальным инициатором азобис(изобутиронитрил) (АИБН). [ 24 ] Однако 3-сульфолен не сополимеризуется с виниловыми соединениями . С другой стороны, 2-сульфолен не гомополимеризуется , а образует сополимеры с виниловыми соединениями, например акрилонитрилом и винилацетатом .
3-сульфолен как растворитель, пригодный для вторичной переработки
[ редактировать ]Обратимость взаимного превращения 3-сульфолена с бута-1,3-диеном и диоксидом серы предполагает использование сульфолена в качестве перерабатываемого апротонного диполярного растворителя вместо диметилсульфоксида (ДМСО), который часто используется, но его трудно отделить и плохо многоразовый. [ 25 ] В качестве модельной реакции исследована реакция бензилазида с цианидом 4-толуолсульфокислоты с образованием 1-бензил-5-(4-толуолсульфонил)тетразола. Образование тетразола также можно провести в одном реакторе без выделения бензилазида с общим выходом 72%.
После реакции растворитель 3-сульфолен разлагается при температуре 135 °C, а летучий бутадиен (т. кип. -4,4 °C) и диоксид серы (т. кип. -10,1 °C) осаждаются в охлаждающей ловушке при температуре -76 °C, наполненной избытком диоксид серы. После добавления гидрохинона для ингибирования полимеризации 3-сульфолы снова образуются количественно при нагревании до комнатной температуры. Однако кажется сомнительным, что 3-сульфолен с диапазоном полезной жидкой фазы от всего 64 до максимум около 100 ° C может использоваться в качестве заменителя ДМСО (простота обращения, низкая стоимость, экологическая совместимость) в промышленной практике.
Использование
[ редактировать ]Помимо своей синтетической универсальности (см. выше), сульфолен используется в качестве добавки при электрохимическом фторировании . Это может увеличить выход перфтороктансульфонилфторида примерно на 70%. [ 26 ] Он «хорошо растворим в безводном HF и увеличивает проводимость раствора электролита». [ 26 ] В этом применении он подвергается раскрытию кольца и фторируется с образованием перфторбутансульфонилфторида .
Дальнейшее чтение
[ редактировать ]- DE 506839 , Х. Штаудингер, «Способ получения мономолекулярных продуктов реакции ненасыщенных углеводородов бутадиенового ряда с диоксидом серы», опубликован 28 августа 1930 г., присвоен Х. Штаудингеру.
Ссылки
[ редактировать ]- ^ Сульфолен в Sigma-Aldrich
- ^ Jump up to: а б Дж. М. Макинтош (2001). «3-Сульфолен». Энциклопедия реагентов для органического синтеза E-EROS . дои : 10.1002/047084289X.rs130 . ISBN 0471936235 .
- ^ Jump up to: а б с Сэмпл, Томас Э.; Хэтч, Льюис Ф. (январь 1968 г.). «3-Сульфолен: источник бутадиена для синтеза Дильса-Альдера». Журнал химического образования . 45 (1): 55. дои : 10.1021/ed045p55 .
- ^ Губен-Вейль (1955). Том IX: Соединения серы, селена и теллура . Методы органической химии (4-е изд.). Штутгарт: Георг Тиме Верлаг. п. 237. ИСБН 978-3-13-208104-8 .
- ^ Роберт Л. Франк, Раймонд П. Севен (1949). «Изопренциклический сульфон». Органические синтезы . 29 : 59. дои : 10.15227/orgsyn.029.0059 .
- ^ Jump up to: а б DE 506839 , Х. Штаудингер, «Способ получения мономолекулярных продуктов реакции ненасыщенных углеводородов бутадиенового ряда с диоксидом серы», опубликовано 1930-8-28, присвоено Х. Штаудингеру.
- ^ Jump up to: а б Х. Штаудингер; Б. Ритценталер (1935). «О высокомолекулярных соединениях, 104-е сообщение: О присоединении диоксида серы к производным этилена». Химические отчеты (на немецком языке). 68 (3): 455–471. дои : 10.1002/cber.19350680317 .
- ^ Дж. Леонард; АБ Гаага; Дж. А. Найт (1998). «6. Получение замещенных 3-сульфоленов и их использование в качестве предшественников диенов Дильса-Альдера». Сероорганическая химия . Том. 2 (4-е изд.). Сан-Диего: Academic Press, Inc., с. 241. ИСБН 0-12-543562-2 .
- ^ Jump up to: а б US 4187231 , RL Cobb, «Цианид-катализируемая изомеризация и обмен дейтерия с альфа- и бета-сульфоленами», опубликован 5 февраля 1980 г., передан компании Phillips Petroleum Co.
- ^ Компакт-диск Броддус (1968). «Равновесия и катализируемый основаниями обмен замещенных олефинов». Отчеты о химических исследованиях . 1 (8): 231–238. дои : 10.1021/ar50008a002 .
- ^ Jump up to: а б У. Дж. Бэйли; Э. У. Камминс (1954 г.). «Циклические диены. III. Синтез тиофен-1,1-диоксида». Журнал Американского химического общества . 76 (7): 1932–1936. дои : 10.1021/ja01636a058 .
- ^ US 4286099 , ME Nash, EE Huxley, «Гидрирование сульфолена», опубликовано 25 августа 1981 г., передано Phillips Petroleum Co.
- ^ Д.М. Лемаль; Г. Д. Гольдман (1988). «Синтез азулена, синего углеводорода». Журнал химического образования . 65 (10): 923. Бибкод : 1988ЖЧЭд..65..923Л . дои : 10.1021/ed065p923 .
- ^ Т.-С. Чжоу; М.-М. Чен (1987). «Хемоселективные реакции диспергированного ультразвуком калия с некоторыми бромированными гидротиофен-S,S-диоксидами». Гетероциклы . 26 (11): 2829–2834. doi : 10.3987/R-1987-11-2829 (неактивен 7 февраля 2024 г.).
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на февраль 2024 г. ( ссылка ) - ^ М.А. Филатов; С. Балущев; И.З. Илиева; В. Энкельманн; Т. Митева; К. Ландфестер; С.Е. Алещенков; А.В. Чепраков (2012). «Тетраарилтетраантра[2,3]порфирины: синтез, структура и оптические свойства». Журнал органической химии . 77 (24): 11119–11131. дои : 10.1021/jo302135q . ПМИД 23205621 .
- ^ «Диэтилтранс-Δ 4 -тетрагидрофталат». Органические синтезы . 50. orgsyn.050.0043 doi : 10.15227/ .
- ^ Х. Харт, А. Башир-Хашеми, Дж. Луо, М. А. Мидор (1986). «Иптицены: расширенные триптицены». Тетраэдр . 42 : 1641–1654. дои : 10.1016/S0040-4020(01)87581-5 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ К.-Т. Лин, Т.-Ц. Чоу (1988). «Синтез 2,3-дибромантрацена». Синтез . 1988 (8): 628–630. дои : 10.1055/s-1988-27659 . S2CID 93109532 .
- ^ Л. Ф. Хэтч, Д. Питер (1968). «Реакция бензина с бутадиеном». Химические коммуникации . 23 (23): 1499. doi : 10.1039/C19680001499 .
- ^ М. П. Кава, Дж. П. ВанМетер (1969). «Конденсированные циклобутановые ароматические соединения. XXX. Синтез некоторых необычных 2,3-нафтохиноноидных гетероциклов. Синтетический путь к производным нафто[2,3-b]бифенилена и антра[b]циклобутена». Журнал органической химии . 34 (3): 538–545. дои : 10.1021/jo01255a012 .
- ^ К. Алдер; Х. Ф. Риккерт; Э. Виндемут (1938). «О знаниях о диеновом синтезе, X. Сообщение: О синтезе диенов с α, β-ненасыщенными нитротелами, сульфонами и тиоэфирами». Химические отчеты . 71 (12): 2451–2461. дои : 10.1002/cber.19380711206 .
- ^ Г.С. Андраде; и др. (2003). «Синтез в одном котле и реакционная способность Дильса-Альдера 2,5-дигидротиофен-1,1-диоксид-3-карбоновой кислоты». Синтетические коммуникации . 33 (20): 3643–3650. дои : 10.1081/SCC-120024845 . S2CID 98504228 .
- ^ Я Брант; Дж. Э. Вульф (2016). «3-Сульфолены и их производные: синтез и применение». Синтез . 48 (1): 1–17. дои : 10.1055/s-0035-1560351 . S2CID 196826278 .
- ^ Э. Дж. Геталс (1967). «О полимеризации и сополимеризации сульфоленов» . Макромолекулярная химия и физика . 109 (1): 132–142. дои : 10.1002/macp.1967.021090113 .
- ^ Ю. Хуан; и др. (2015). «Бутадиенсульфон как« летучий », пригодный для вторичной переработки диполярный апротонный растворитель для проведения реакций замещения и циклоприсоединения» . Устойчивые химические процессы . 3 (13). дои : 10.1186/s40508-015-0040-7 .
- ^ Jump up to: а б Лемлер HJ (март 2005 г.). «Синтез экологически важных фторированных поверхностно-активных веществ - обзор». Хемосфера . 58 (11): 1471–96. Бибкод : 2005Chmsp..58.1471L . doi : 10.1016/j.chemSphere.2004.11.078 . ПМИД 15694468 .