Диол

Диол содержащее – химическое соединение, две гидроксильные группы ( -ОН- группы). [1] Алифатический диол также может называться гликолем . [2] Это сочетание функциональных групп широко распространено, и было идентифицировано множество подкатегорий. Они используются в качестве защитных групп карбонильных групп , что делает их незаменимыми в синтезе органической химии. [3]
Наиболее распространенным промышленным диолом является этиленгликоль . Примеры диолов, в которых гидроксильные функциональные группы разделены более широко, включают 1,4-бутандиол. HO-(CH 2 ) 4 -OH и пропилен-1,3-диол или бета-пропиленгликоль, НО-СН 2 -СН 2 -СН 2 -ОН .
Синтез классов диолов
[ редактировать ]Геминальные диолы
[ редактировать ]
Геминальный диол имеет две гидроксильные группы, связанные с одним и тем же атомом. Эти виды возникают в результате гидратации карбонильных соединений. Гидратация обычно неблагоприятна, но заметным исключением является формальдегид , который в воде существует в равновесии с метандиолом H 2 C(OH) 2 . [4] Другим примером является (F 3 C) 2 C(OH) 2 , гидратированная форма гексафторацетона . Многие гем-диолы подвергаются дальнейшей конденсации с образованием димерных и олигомерных производных. Эта реакция применима к глиоксалю и родственным альдегидам .
Вицинальные диолы
[ редактировать ]В вицинальном диоле две гидроксильные группы занимают вицинальные положения, то есть присоединены к соседним атомам. Эти соединения называются гликолями. [5] (хотя этот термин можно использовать и более широко). Примеры включают этан-1,2-диол или этиленгликоль HO-(CH 2 ) 2 -OH, общий ингредиент антифризов . Другим примером является пропан-1,2-диол , или альфа-пропиленгликоль, HO-CH 2 -CH(OH)-CH 3 , используемый в пищевой и медицинской промышленности, а также относительно неядовитый антифриз.
В промышленных масштабах основным путем получения вицинальных диолов является гидролиз эпоксидов . Эпоксиды получают эпоксидированием алкена. Пример синтеза транс-циклогександиола. [6] или с помощью микрореактора : [7]
фармацевтических областей вицинальные диолы часто получают путем окисления алкенов Для академических исследований и , обычно с помощью разбавленного кислого перманганата калия или четырехокиси осмия. [8] Тетроксид осмия аналогичным образом можно использовать для окисления алкенов до вицинальных диолов. Химическая реакция, называемая асимметричным дигидроксилированием Шарплесса, может быть использована для получения хиральных диолов из алкенов с использованием осматного реагента и хирального катализатора . Другой метод - цис-гидроксилирование Вудворда (цис-диол) и связанная с ним реакция Прево (антидиол), в которых используются йод и серебряная соль карбоновой кислоты.
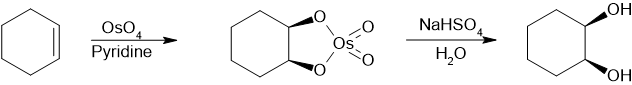
Путь синтеза цис-1,2-диолов с использованием тетраоксида осмия 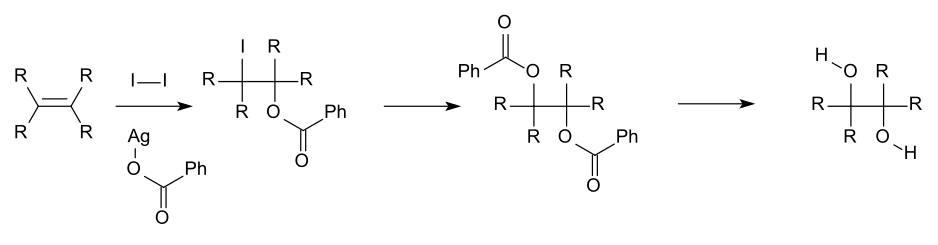
Пример реакции Прево, используемой для синтеза антидиола.
Другие пути получения вик-диолов - это гидрирование ацилоинов. [9] и реакция сочетания пинакола .
1,3-Диол
[ редактировать ]1,3-Диолы часто получают в промышленных масштабах путем альдольной конденсации кетонов с формальдегидом . Для получения син- или анти-1,3-диолов можно использовать множество различных исходных материалов. [10] Полученный карбонил восстанавливают с помощью реакции Канниццаро или каталитического гидрирования :
- RC(O)CH 3 + CH 2 O → RC(O)CH 2 CH 2 OH
- RC(O)CH 2 CH 2 OH + H 2 → RCH(OH)CH 2 CH 2 OH
Таким способом получают 2,2-дизамещенные пропан-1,3-диолы. Примеры включают 2-метил-2-пропил-1,3-пропандиол и неопентилгликоль .
1,3-Диолы можно получить гидратацией α,β-ненасыщенных кетонов и альдегидов. Полученный кетоспирт гидрируют. Другой путь включает гидроформилирование эпоксидов с последующим гидрированием альдегида. Этот метод был использован для получения 1,3-пропандиола из оксида этилена .
Более специализированные пути получения 1,3-диолов включают реакцию между алкеном и формальдегидом , реакцию Принса . 1,3-диолы могут быть получены диастереоселективно из соответствующих β-гидроксикетонов с использованием протоколов восстановления Эванса-Саксена , Нарасаки-Прасада или Эванса-Тищенко .
1,3-Диолы описываются как син- или анти- в зависимости от относительной стереохимии атомов углерода, несущих гидроксильные функциональные группы. Цинкофорин — натуральный продукт , содержащий как син- , так и анти -1,3-диолы.

1,4-, 1,5- и более длинные диолы
[ редактировать ]Диолы, у которых гидроксильные группы разделены несколькими углеродными центрами, обычно получают гидрированием диэфиров соответствующих дикарбоновых кислот :
- (CH 2 ) n (CO 2 R) 2 + 4 H 2 → (CH 2 ) n (CH 2 OH) 2 + 2 H 2 O + 2 ROH
1,4-бутандиол , 1,5-пентандиол , 1,6-гександиол , 1,10-декандиол являются важными предшественниками полиуретанов . [11]
Реакции
[ редактировать ]С промышленной точки зрения доминирующими реакциями диолов являются производство полиуретанов и алкидных смол . [11]
Общие диолы
[ редактировать ]Диолы реагируют как спирты путем этерификации и эфира . образования [12]
Диолы, такие как этиленгликоль, используются в качестве сомономеров в реакциях полимеров, полимеризации с образованием включая некоторые полиэфиры и полиуретаны . [12] другой мономер с двумя идентичными функциональными группами, такой как диилдихлорид Для продолжения процесса полимеризации посредством повторяющихся процессов этерификации требуется или дикарбоновая кислота.
Диол можно превратить в циклический эфир с помощью кислотного катализатора, это циклизация диола . Во-первых, это протонирование гидроксильной группы. Затем, после внутримолекулярного нуклеофильного замещения, вторая гидроксильная группа атакует электронодефицитный углерод. При условии, что атомов углерода достаточно и угловая деформация не слишком велика, циклический эфир может образоваться .

1,2-диолы и 1,3-диолы можно защитить с помощью защитной группы. [13] Защитные группы используются для того, чтобы функциональная группа не реагировала на будущие реакции. Бензилиденовые группы используются для защиты 1,3-диолов. [13] Как показано ниже, защищенные производные углеводов чрезвычайно полезны в биохимии.

Диолы также можно использовать для защиты карбонильных групп. [14] Они широко используются и весьма эффективны при синтезе циклических ацеталей. Они защищают карбонильные группы от реакции дальнейшего синтеза до тех пор, пока не возникнет необходимость их удаления. Реакция ниже показывает, как диол используется для защиты карбонила с помощью тетрахлорида циркония. [15]

Диолы также можно превратить в лактоны с помощью реакции окисления Фетизона .
Вицинальные диолы
[ редактировать ]При расщеплении гликоля связь C-C в вицинальном диоле расщепляется с образованием кетоновых или альдегидных функциональных групп. См. Окисление диолов .
Геминальные диолы
[ редактировать ]Как правило, органические геминальные диолы легко дегидратируются с образованием карбонильной группы .
См. также
[ редактировать ]- Спирты , химические соединения хотя бы с одной гидроксильной группой.
- Триолы , химические соединения с тремя гидроксильными группами.
- Полиолы , химические соединения с несколькими гидроксильными группами.
- Этиленгликоль
- Гликолевая нуклеиновая кислота (ГНК)
Ссылки
[ редактировать ]- ^ Марч, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура, 3-е издание , Нью-Йорк: Wiley, ISBN 9780471854722 , OCLC 642506595 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Диолы ». дои : 10.1351/goldbook.D01748 .
- ^ «Карбонильные защитные группы – стабильность» . www.organic-chemistry.org . Проверено 15 апреля 2024 г.
- ^ Геворг, доктор С. (22 ноября 2021 г.). «Диолы: номенклатура, получение и реакции» . Химические этапы . Проверено 15 апреля 2024 г.
- ^ «Иллюстрированный словарь органической химии - гликоль» . www.chem.ucla.edu . Проверено 15 апреля 2024 г.
- ^ транс-циклогександиола Органический синтез , Сб. Том. 3, с. 217 (1955); Том. 28, стр.35 ( 1948 г. ) http://www.orgsynth.org/orgsyn/pdfs/CV3P0217.pdf .
- ^ Преимущества синтеза транс-1,2-циклогександиола в микрореакторе непрерывного действия по сравнению со стандартным стеклянным аппаратом Андреас Хартунг, Марк А. Кин и Арно Крафт J. Org. хим. 2007 , 72, 10235–10238 два : 10.1021/jo701758p .
- ^ Макмерри, Джон (20 сентября 2023 г.). Органическая химия: десятое издание (1-е изд.). Университет Райса. стр. 259–260. ISBN 978-1-951693-98-5 .
- ^ Бломквист, AT; Гольдштейн, Альберт (1956). «1,2-Циклодекандиол». Органические синтезы . 36:12 . дои : 10.15227/orgsyn.036.0012 .
- ^ Боде, Силке Э.; Вольберг, Майкл; Мюллер, Михаэль (2006). «Стереоселективный синтез 1,3-диолов» . Синтез (на немецком языке). 2006 (4): 557–588. дои : 10.1055/s-2006-926315 . ISSN 0039-7881 .
- ^ Перейти обратно: а б Верле, Питер; Моравец, Маркус; Лундмарк, Стефан; Соренсен, Кент; Карвинен, Эско; Лехтонен, Юха (2008). «Спирты многоатомные». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a01_305.pub2 . ISBN 978-3527306732 .
- ^ Перейти обратно: а б Геворг, доктор С. (22 ноября 2021 г.). «Диолы: номенклатура, получение и реакции» . Химические этапы . Проверено 15 апреля 2024 г.
- ^ Перейти обратно: а б Манабе, Шино (2021), Нишихара, Сёко; Ангата, Киёхико; Аоки-Киношита, Киёко Ф.; Хирабаяши, Джун (ред.), «Бензилиденовая защита диола» , Протоколы Glycoscience (GlycoPODv2) , Сайтама (JP): Японский консорциум гликобиологии и гликотехнологии, PMID 37590710 , получено 14 апреля 2024 г.
- ^ Angewandte Chemie International Edition на английском языке . Уайли. дои : 10.1002/(issn) 1521-3773a .
- ^ «Тетрахлорид циркония (ZrCl4), катализирующий высокохемоселективную и эффективную ацетализацию карбонильных соединений» . www.organic-chemistry.org . Проверено 14 апреля 2024 г.


