Субъединица альфа-5 нейронального рецептора ацетилхолина
| Субъединица альфа-5 нейронального рецептора ацетилхолина | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | CHRNA5 | ||
| Альт. символы | CHRNA5 | ||
| ген NCBI | 1138 | ||
| МОЙ БОГ | 1188505 | ||
| RefSeq | НМ_000745 | ||
| ЮниПрот | P30532 | ||
| Другие данные | |||
| Локус | Хр. 15 q25.1 | ||
| |||
Субъединица нейронального рецептора ацетилхолина альфа-5 или альфа-5 никотиновый ацетилхолиновый рецептор (α5 nAChR), также известный как рецептор α5, представляет собой тип субъединицы лиганд-зависимого нейронального типа никотинового ацетилхолинового рецептора, участвующей в регуляции боли , кодируемой у человека Ген CHRNA5 . Этот рецептор обычно связан с никотиновой зависимостью , иммунотерапией , раком , болью и вниманием .
Обзор
[ редактировать ]
Существует два основных класса ацетилхолиновых рецепторов : никотиновые рецепторы , которые связываются с экзогенным никотином , и мускариновые рецепторы , которые связывают экзогенный мускарин . Никотиновые рецепторы ацетилхолина (нАХР) первоначально были обнаружены при применении и связывании никотина, однако эндогенный ацетилхолин является лигандом, который связывается в нормальных физиологических условиях. nAChR — это одноканальные ионотропные рецепторы, обнаруженные по всему мозгу и телу, которые позволяют катионам проникать в клетки и выходить из них. Эти рецепторы состоят из пяти трансмембранных субъединиц, причем α5-нАХР определяется наличием субъединицы α5. α5-нАХР локализован в различных областях головного мозга, включая кору головного мозга , гиппокамп , гипоталамус , нижние холмики , медиальную часть головы , обонятельную луковицу и полосатое тело . [1] α5-нАХР участвует в модуляции хронического воспаления и повреждения периферических нервов . [2] Ацетилхолин связывается в коре головного мозга, гиппокампе, гипоталамусе, нижних холмиках, полосатом теле и обонятельной луковице. [3] CHRNA5 расположен в кластере генов на хромосоме 15q24 вместе с CHRNA3 и CHRNB4 . [4] Гомопентамерные рецепторы с пятью сайтами связывания ацетилхолина содержат две а-субъединицы (а2-а4 или а6) и две не-а-субъединицы (В2 или В4). Субъединицы альфа5, как правило, являются пятыми, которые не связываются напрямую с ацетилхолином и действуют как вспомогательные субъединицы. Скорее, они могут быть важны для нацеливания и локализации рецепторов на клеточной мембране . [4] Альфа-субъединицы обычно собираются как в альфа3В4-содержащие, так и в альфа4-бета2-содержащие сборки нАХР. Эти рецепторы были обнаружены на дофаминергических нейронах полосатого тела грызунов и участвуют в высвобождении ДА при никотиновой стимуляции. Помимо DA-нейронов, субъединицы альфа5 также экспрессируются на ГАМКергических нейронах VTA и полосатого тела. [4]
Разработка
[ редактировать ]Субъединица альфа5 важна во время развития и созревания префронтальных пирамидных нейронов IV. Холинергическая дисфункция во время развития вызывает дефицит внимания, наблюдаемый при таких заболеваниях, как шизофрения , нарушения нервно-психического развития , аутизм и эпилепсия . Большинство холинергических нейронов у человека развивается в перинатальном периоде. Изменения созревания, которые происходят в дендритах во время развития, отсутствуют у альфа5-/- мышей, что указывает на то, что субъединица альфа5 необходима для правильного созревания префронтальных пирамидных клеток. [5]
Никотиновая зависимость и абстиненция
[ редактировать ]Пристрастие к никотину модулируется мезокортиколимбической дофаминовой системой вознаграждения, которая определяет приносящую удовольствие природу никотина; мезокортиколимбическая система участвует в самостимуляции и обработке вознаграждения окружающей среды . [6] [7] Например, эта система активна при употреблении высококалорийной пищи или во время азартных игр. При введении никотина увеличивается частота возбуждения, опосредованная дофаминовыми нейронами среднего мозга в этой системе. При постоянном воздействии часто возникает зависимость, за которой следуют симптомы абстиненции, такие как тяга, раздражение, беспокойство, нарушения сна , увеличение веса, беспокойство и трудности с концентрацией внимания. [8] [9] Субъединицы, участвующие в синдроме отмены , включают α5, α2 и B4 в составе эпиталамического хабенулярного комплекса и его проекций. [10] Медиальная хабенула (MHb) и ее проекция на межножковое ядро (IPN) содержат плотную экспрессию субъединиц α5 nAChR. [11]

in vivo Исследования
[ редактировать ]Исследования показали, что удаление субъединиц α5 нАХР у мышей (нулевой α5 нАХР) сделает их менее чувствительными к острому воздействию никотина. [12] У мышей наблюдалось снижение двигательной активности в тесте в открытом поле и меньшее количество судорог, вызванных никотином. [11] Другие исследования показали, что мыши с нулевым уровнем α5 nAChR проявляют меньше признаков зависимости и снижают тревожное поведение. [11] Поскольку нокаутные мыши проявляют меньшее отвращение к повышенному потреблению никотина, они склонны самостоятельно вводить гораздо более высокие дозы, чем мыши дикого типа. Однако повторное введение субъединицы альфа-5 в медиальную хабенулу у нокаутных мышей восстанавливало нормальный уровень самостоятельного введения никотина. Это демонстрирует, что экспрессия субъединицы альфа5 в медиальной хабенуле достаточна для восстановления отвращения к никотину. [13] Напротив, целенаправленный нокдаун субъединицы α5 в хабенуло-межножковом пути у мышей дикого типа не изменил стимулирующие эффекты, наблюдаемые у нокаутных мышей, демонстрируя, что субъединица не является необходимой для отвращения к никотину и что другие области мозга могут компенсировать это. поведение. [12]
В исследовании предпочтения места (CPP) исследователи обучали мышей ассоциировать введение никотина с одной камерой и введение физиологического раствора в соседней камере. При низких дозах никотина мыши с нокаутом альфа5 и мыши дикого типа отдавали предпочтение никотиновой камере. Однако при высоких дозах никотина только мыши с нокаутом α5 предпочитали никотиновую камеру. [13] продемонстрировав, что мыши с нокаутом альфа5 все еще испытывали положительные аспекты никотина, но не нормальное отвращение при передозировке никотина.
Исследования Tuesta et al. 2011 показали, что кривая «доза-эффект» аналогична при сравнении мышей с нокаутом и мышами дикого типа, однако мыши с нокаутом потребляли большее количество никотина, что привело к тому, что нисходящая часть кривой «доза-эффект» снижалась медленнее у нокаутных мышей. Была показана повышенная реакция на никотин в восходящей части кривой, демонстрирующей более высокие полезные свойства. [12]
Человеческие исследования
[ редактировать ]Никотин обычно потребляется людьми из-за его полезных свойств, приводящих к зависимости, привыканию и абстиненции. [14] Исследования на людях показали, что люди с однонуклеотидным полиморфизмом (SNP) в гене, кодирующем α5 nAChR ( CHRNA5 , rs16969968), коррелируют с повышенным риском никотиновой зависимости и удовольствия наряду с более тяжелым курением. [11] [15] [16] [17] Этот конкретный SNP приводит к замене аспарагиновой кислоты на аспарагин по аминокислотному остатку 398 (D398N). [12] rs16969968 в составе CHRNA5 вызывает снижение функции рецептора, который участвует в возникновении симптомов абстиненции . Лица с этим SNP обычно встречаются у лиц европейского происхождения; риск никотиновой зависимости примерно на 30% выше у людей, несущих одну копию варианта, и примерно на 50% выше риск у людей с двумя копиями. [12] Другие исследования показали, что у людей с этим SNP развивается никотиновая зависимость в более молодом возрасте. [12] Исследователи приходят к выводу, что меньшее количество аверсивных эффектов никотина будет способствовать возникновению полезных эффектов или гедонистического влечения, которые переведут людей от злоупотребления никотином к зависимости. [11] [18] Кроме того, варианты SNP в пределах rs16969968 в CHRNA5 связаны с поведением, связанным с курением, например, среди курильщиков более высокая распространенность, чем среди некурящих. [19]
Внимание и познание
[ редактировать ]Внимание — это важный аспект памяти , который позволяет удерживать информацию в уме и сохранять концентрацию при наличии отвлекающих факторов для достижения целенаправленного поведения. Рабочая память — это аналогичный аспект обучения , однако основное различие между ними заключается в том, что рабочая память также требует мысленного манипулирования информацией. Структура, чаще всего связанная с вниманием, — это префронтальная кора , которая обеспечивает нисходящий контроль над сложными когнитивными процессами. [20] Ацетилхолин — нейромодулятор, роль которого в обучении и памяти тщательно изучается; он участвует в приобретении, консолидации и отзыве.
in vivo Исследования
[ редактировать ]Исследователи предполагают, что пирамидные нейроны VI слоя в префронтальной коре важны для удержания внимания при выполнении когнитивно сложных задач. Эти нейроны посылают сигналы обратной связи в таламус и очень чувствительны к ацетилхолину . Исследования in vivo показали, что наличие субъединиц альфа5 нАХР на пирамидных нейронах VI слоя в ПФК важно для зрительного внимания. [21] В экспериментах по срезовой электрофизиологии исследователи показали, что субъединицы альфа5 усиливают токи в ПФК взрослой мыши. In vivo исследователи используют задачу последовательной реакции с пятью вариантами ответов. Животным случайным образом дается 1 из 5 световых стимулов, и им необходимо закодировать и вспомнить местоположение стимула, чтобы получить награду. Трансгенные мыши без гена, кодирующего субъединицы альфа5, показали ухудшение производительности при выполнении задания на серийную реакцию с пятью вариантами ответов. Это указывает на то, что мыши с нулевым альфа5 имеют дефицит внимания . [5] Интересно, что удаление субъединиц альфа5 у мышей приводит к усилению регуляции мускариновых рецепторов ацетилхолина в качестве возбуждающей компенсационной реакции на дисфункцию схемы . Из-за эффекта улучшения когнитивных функций агонистов альфа5-нАХР он является частой мишенью нейродегенеративных расстройств с когнитивным дефицитом наряду с СДВГ. [22]
Человеческие исследования
[ редактировать ]Из-за технических ограничений инвазивных процедур существует гораздо меньше исследований, посвященных роли субъединицы альфа5-нАХР и когнитивных функций. Исследования проводили микродиализ у испытуемых, когда они формировали задачи по концентрации внимания, и обнаружили значительно увеличенный выброс ацетилхолина. [5]
Клиническое применение
[ редактировать ]α5-нАХР опосредует острые эффекты алкоголя; делеция этого гена влияет на употребление алкоголя в стрессовых условиях. [23] α5-нАХР также опосредует кратковременные эффекты никотина. [24] Исследования показали, что удаление субъединицы альфа5 у мышей (нокдаун α5 nAChR) увеличивает потребление никотина, которое можно предотвратить повторным введением гена. [25] Исследователи также показали, что удаление субъединицы α5 только в медиальной хабенуле увеличивает самостоятельное введение никотина, демонстрируя, что эта субъединица необходима для нормального потребления никотина, а нарушения внутри этой субъединицы могут способствовать развитию привыкания к никотину. [25] Кроме того, субъединица нАХР альфа5 связана с другими формами зависимости, такими как кокаиновая. [26] Другие исследования показали, что у мышей с нокаутом α5 наблюдались нарушения внимания. [27] Во время высокочастотной вагусной стимуляции у мышей с нокаутом α5 nAChR наблюдается нарушение передачи парасимпатических ганглиев сердца. Исследования in vivo также выявили, что нАХР альфа5 является возможным средством лечения хронического воспаления и нейропатической боли. [28] [29]
Лиганды
[ редактировать ]| Лиганд | Структура | Функция | Использовать |
|---|---|---|---|
| Ацетилхолин | Агонист | Эндогенный | |
| Никотин | 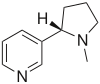 | Агонист | Рекреационный наркотик Внимание |
| Посанилин |  | Частичный агонист | Экспериментальный препарат от СДВГ, [30] болезнь Альцгеймера, [31] и расстройство, связанное с употреблением табака [32] |
| α-конотоксин MII [33] |  | Антагонист | |
| α-конотоксин PnIA [33] |  | Антагонист | |
| α-конотоксин GIC [33] |  | Антагонист | |
| α-Конотоксин TXIA [33] |  | Антагонист |
Интерактивная карта маршрутов
[ редактировать ]Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [§ 1]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «Никотиндофаминергический_WP1602» .
Ссылки
[ редактировать ]- ^ Браун Р.В., Коллинз А.С., Линдстрем Дж.М., Уайтакер П. (октябрь 2007 г.). «Удаление никотиновой субъединицы альфа5 локально снижает активацию высокоаффинного агониста без изменения количества никотиновых рецепторов» . Журнал нейрохимии . 103 (1): 204–215. дои : 10.1111/j.1471-4159.2007.04700.x . ПМИД 17573823 . S2CID 28394031 .
- ^ Багдас Д., АльШарари С.Д., Фрейтас К., Трейси М., Дамадж М.И. (октябрь 2015 г.). «Роль альфа5-никотиновых рецепторов ацетилхолина в мышиных моделях хронической воспалительной и нейропатической боли» . Биохимическая фармакология . Никотиновые рецепторы ацетилхолина как терапевтические мишени: новые горизонты в фундаментальных исследованиях и клинической науке (спутник встречи Общества нейронаук 2015 г.), 14–15 октября, Чикаго, Иллинойс, США. 97 (4): 590–600. дои : 10.1016/j.bcp.2015.04.013 . ПМК 4600420 . ПМИД 25931144 .
- ^ Браун Р.В., Коллинз А.С., Линдстрем Дж.М., Уайтакер П. (октябрь 2007 г.). «Удаление никотиновой субъединицы альфа5 локально снижает активацию высокоаффинного агониста без изменения количества никотиновых рецепторов» . Журнал нейрохимии . 103 (1): 204–215. дои : 10.1111/j.1471-4159.2007.04700.x . ПМИД 17573823 . S2CID 28394031 .
- ^ Jump up to: а б с Гринбаум Л., Лерер Б. (октябрь 2009 г.). «Дифференциальный вклад генетических вариаций в множественных никотиновых холинергических рецепторах мозга в никотиновую зависимость: недавний прогресс и возникающие открытые вопросы» . Молекулярная психиатрия . 14 (10): 912–945. дои : 10.1038/mp.2009.59 . ПМИД 19564872 . S2CID 9769700 .
- ^ Jump up to: а б с Пру Э., Пива М., Тиан М.К., Бэйли К.Д., Ламбе Э.К. (апрель 2014 г.). «Никотиновые рецепторы ацетилхолина в схемах внимания: роль нейронов VI слоя префронтальной коры» . Клеточные и молекулярные науки о жизни . 71 (7): 1225–1244. дои : 10.1007/s00018-013-1481-3 . ПМЦ 3949016 . ПМИД 24122021 .
- ^ де Клоет С.Ф., Мансвелдер Х.Д., Де Врис Т.Дж. (октябрь 2015 г.). «Холинергическая модуляция дофаминовых путей через никотиновые рецепторы ацетилхолина». Биохимическая фармакология . 97 (4): 425–438. дои : 10.1016/j.bcp.2015.07.014 . ПМИД 26208783 .
- ^ Деметра Э., Сартер М. (январь 2013 г.). «Использование кортикальной холинергической системы для повышения внимания» . Нейрофармакология . 64 (1): 294–304. doi : 10.1016/j.neuropharm.2012.06.060 . ПМЦ 3445745 . ПМИД 22796110 .
- ^ Ван Дж.С., Капур М., Гоут А.М. (22 сентября 2012 г.). «Генетика зависимости от веществ» . Ежегодный обзор геномики и генетики человека . 13 (1): 241–261. doi : 10.1146/annurev-genom-090711-163844 . ПМЦ 3474605 . ПМИД 22703173 .
- ^ Виттенберг Р.Э., Вольфман С.Л., Де Биаси М., Дэни Дж.А. (октябрь 2020 г.). «Никотиновые рецепторы ацетилхолина и никотиновая зависимость: краткое введение» . Нейрофармакология . 177 : 108256. doi : 10.1016/j.neuropharm.2020.108256 . ПМЦ 7554201 . ПМИД 32738308 .
- ^ Антолин-Фонтес Б., Аблес Х.Л., Гёрлих А., Ибаньес-Таллон I (сентябрь 2015 г.). «Хабенуло-интерпедункулярный путь при отвращении к никотину и синдроме отмены» . Нейрофармакология . 96 (Часть Б): 213–222. doi : 10.1016/j.neuropharm.2014.11.019 . ПМЦ 4452453 . ПМИД 25476971 .
- ^ Jump up to: а б с д и Де Биаси М., Дэни Дж.А. (21 июля 2011 г.). «Награда, зависимость, отказ от никотина» . Ежегодный обзор неврологии . 34 (1): 105–130. doi : 10.1146/annurev-neuro-061010-113734 . ПМК 3137256 . ПМИД 21438686 .
- ^ Jump up to: а б с д и ж Туэста Л.М., Фаулер CD, Кенни ПиДжей (октябрь 2011 г.). «Последние достижения в понимании механизмов передачи сигналов никотиновых рецепторов, которые регулируют поведение при самостоятельном приеме наркотиков» . Биохимическая фармакология . 82 (8): 984–995. дои : 10.1016/j.bcp.2011.06.026 . ПМК 3163076 . ПМИД 21740894 .
- ^ Jump up to: а б Стокер А.К., Марку А. (август 2013 г.). «Раскрытие нейробиологии никотиновой зависимости с помощью генно-инженерных мышей» . Современное мнение в нейробиологии . 23 (4): 493–499. дои : 10.1016/j.conb.2013.02.013 . ПМЦ 3735838 . ПМИД 23545467 .
- ^ Де Биаси М., Дэни Дж.А. (21 июля 2011 г.). «Награда, зависимость, отказ от никотина» . Ежегодный обзор неврологии . 34 (1): 105–130. doi : 10.1146/annurev-neuro-061010-113734 . ПМК 3137256 . ПМИД 21438686 .
- ^ Импрого М.Р., Скофилд, доктор медицинских наук, Таппер А.Р., Гарднер П.Д. (сентябрь 2010 г.). «От курения к раку легких: связь CHRNA5/A3/B4» . Онкоген . 29 (35): 4874–4884. дои : 10.1038/onc.2010.256 . ПМЦ 3934347 . ПМИД 20581870 .
- ^ Импрого М.Р., Скофилд, доктор медицинских наук, Таппер А.Р., Гарднер П.Д. (октябрь 2010 г.). «Кластер генов никотинового ацетилхолинового рецептора CHRNA5/A3/B4: двойная роль в никотиновой зависимости и раке легких» . Прогресс нейробиологии . 92 (2): 212–226. doi : 10.1016/j.pneurobio.2010.05.003 . ПМЦ 2939268 . ПМИД 20685379 .
- ^ Руссо П., Чезарио А., Рутелла С., Веронези Г., Спаггиари Л., Галетта Д. и др. (31 декабря 2010 г.). «Влияние генетической изменчивости никотиновых рецепторов ацетилхолина на никотиновую зависимость и лечение отказа от курения». Современная медицинская химия . 18 (1): 91–112. дои : 10.2174/092986711793979715 . ПМИД 21110812 .
- ^ Гринбаум Л., Лерер Б. (октябрь 2009 г.). «Дифференциальный вклад генетических вариаций в множественных никотиновых холинергических рецепторах мозга в никотиновую зависимость: недавний прогресс и возникающие открытые вопросы» . Молекулярная психиатрия . 14 (10): 912–945. дои : 10.1038/mp.2009.59 . ПМИД 19564872 . S2CID 9769700 .
- ^ Уэр Джей Джей, ван ден Бри М., Мунафо М.Р. (ноябрь 2012 г.). «От мужчин к мышам: CHRNA5/CHRNA3, курение и болезни» . Исследования никотина и табака . 14 (11): 1291–1299. дои : 10.1093/ntr/nts106 . ПМК 3482013 . ПМИД 22544838 .
- ^ Блум Б., Поортуис Р.Б., Мансвелдер Х.Д. (11 марта 2014 г.). «Холинергическая модуляция медиальной префронтальной коры: роль никотиновых рецепторов во внимании и регуляции активности нейронов» . Границы в нейронных цепях . 8 : 17. doi : 10.3389/fncir.2014.00017 . ПМЦ 3949318 . ПМИД 24653678 .
- ^ Бэйли С.Д., Де Биаси М., Флетчер П.Дж., Ламбе Э.К. (июль 2010 г.). «Субъединица альфа5 никотинового ацетилхолинового рецептора играет ключевую роль в схеме и точности внимания» . Журнал неврологии . 30 (27): 9241–9252. doi : 10.1523/jneurosci.2258-10.2010 . ПМК 3004929 . ПМИД 20610759 .
- ^ Уоллес Т.Л., Баллард Т.М., Пузе Б., Ридель В.Дж., Веттштейн Дж.Г. (август 2011 г.). «Лекарственные средства для улучшения когнитивных функций при нервно-психических расстройствах» (PDF) . Фармакология, биохимия и поведение . 99 (2): 130–145. дои : 10.1016/j.pbb.2011.03.022 . ПМИД 21463652 . S2CID 25911863 .
- ^ Доусон А., Уолстенхолм Дж.Т., Рони М.А., Кэмпбелл В.К., Джексон А., Слейтер С. и др. (август 2018 г.). «Нокаут альфа-5-субъединицы никотиновых ацетилхолиновых рецепторов изменяет опосредованные этанолом поведенческие эффекты и вознаграждение у мышей» . Нейрофармакология . 138 : 341–348. doi : 10.1016/j.neuropharm.2018.06.031 . ПМК 6400055 . ПМИД 29944862 .
- ^ Салас Р., Орр-Уртрегер А., Бройд Р.С., Боде А., Пэйлор Р., Де Биаси М. (май 2003 г.). «Субъединица альфа-5 никотинового ацетилхолинового рецептора опосредует кратковременные эффекты никотина in vivo». Молекулярная фармакология . 63 (5): 1059–1066. дои : 10.1124/моль.63.5.1059 . ПМИД 12695534 . S2CID 97775995 .
- ^ Jump up to: а б Фаулер К.Д., Лу Кью, Джонсон П.М., Маркс М.Дж., Кенни П.Дж. (март 2011 г.). «Передача сигналов субъединицы никотинового рецептора хабенулярного α5 контролирует потребление никотина» . Природа . 471 (7340): 597–601. Бибкод : 2011Natur.471..597F . дои : 10.1038/nature09797 . ПМК 3079537 . ПМИД 21278726 .
- ^ Забудьте Б., Икик Р., Роберт Дж., Коррейя С., Превост М.С., Гилен М. и др. (февраль 2021 г.). «Изменения в гене субъединицы альфа5 никотинового рецептора по-разному влияют на ранние и поздние стадии кокаиновой зависимости: трансляционное исследование на трансгенных крысах и пациентах» (PDF) . Прогресс нейробиологии . 197 : 101898. doi : 10.1016/j.pneurobio.2020.101898 . ПМИД 32841724 . S2CID 221235364 .
- ^ Бэйли С.Д., Де Биаси М., Флетчер П.Дж., Ламбе Э.К. (июль 2010 г.). «Субъединица альфа5 никотинового ацетилхолинового рецептора играет ключевую роль в схеме и точности внимания» . Журнал неврологии . 30 (27): 9241–9252. doi : 10.1523/jneurosci.2258-10.2010 . ПМК 3004929 . ПМИД 20610759 .
- ^ Антолин-Фонтес Б., Аблес Х.Л., Гёрлих А., Ибаньес-Таллон I (сентябрь 2015 г.). «Хабенуло-интерпедункулярный путь при отвращении к никотину и синдроме отмены» . Нейрофармакология . 96 (Часть Б): 213–222. doi : 10.1016/j.neuropharm.2014.11.019 . ПМЦ 4452453 . ПМИД 25476971 .
- ^ Декер М.В., Мейер, доктор медицинских наук, Салливан Дж. П. (октябрь 2001 г.). «Терапевтический потенциал агонистов никотиновых рецепторов ацетилхолина для контроля боли». Экспертное заключение об исследуемых препаратах . 10 (10): 1819–1830. дои : 10.1517/13543784.10.10.1819 . ПМИД 11772288 . S2CID 24924290 .
- ^ «Исследование безопасности и переносимости ABT-089 у взрослых с синдромом дефицита внимания/гиперактивности (СДВГ)» . ClinicalTrials.gov .
- ^ «Исследование долгосрочной безопасности ABT-089 для субъектов с болезнью Альцгеймера легкой и средней степени тяжести» . ClinicalTrials.gov .
- ^ Салливан Дж.П., Доннелли-Робертс Д., Бриггс К.А., Андерсон Д.Д., Гопалакришнан М., Сюэ И.С. и др. (октябрь 1997 г.). «ABT-089 [2-метил-3-(2-(S)-пирролидинилметокси)пиридин]: I. Мощный и селективный модулятор холинергических каналов с нейропротекторными свойствами» . Журнал фармакологии и экспериментальной терапии . 283 (1): 235–246. ПМИД 9336329 .
- ^ Jump up to: а б с д Готти С., Маркс М.Дж., Миллар Н.С., Воннакотт С. (16 сентября 2019 г.). «Никотиновые рецепторы ацетилхолина (версия 2019.4) в базе данных IUPHAR/BPS Guide to Pharmacology» . Руководство IUPHAR/BPS по фармакологии CITE . 2019 (4). дои : 10.2218/gtopdb/F76/2019.4 . ISSN 2633-1020 . S2CID 203817110 .
