Сорбиновая кислота
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК (2 E ,4 E )-Гекса-2,4-диеновая кислота | |
| Идентификаторы | |
3D model ( JSmol ) | |
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.003.427 |
| номер Е | Е200 (консерванты) |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 6 Н 8 О 2 | |
| Молярная масса | 112.128 g·mol −1 |
| Плотность | 1,204 г/см 3 |
| Температура плавления | 135 ° C (275 ° F; 408 К) |
| Точка кипения | 228 ° С (442 ° F; 501 К) |
| 1,6 г/л при 20 °C | |
| Кислотность ( pKa ) | 4,76 и 25 °С |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
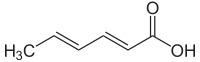
Сорбиновая кислота , или 2,4-гексадиеновая кислота , представляет собой природное органическое соединение, используемое в качестве пищевого консерванта . Имеет химическую формулу CH 3 (CH) 4 CO 2 H и строение H 3 C -CH=CH-CH=CH- C(=O)OH . Это бесцветное твердое вещество, слабо растворяющееся в воде и легко сублимируемое . Впервые он был выделен из незрелых ягод Sorbus aucuparia ( рябины ), отсюда и его название. [1]
Производство
[ редактировать ]Традиционный путь получения сорбиновой кислоты включает конденсацию малоновой кислоты и кротональдегида . [2] Его также можно получить из изомерных гексадиеновых кислот, которые доступны посредством катализируемой никелем реакции аллилхлорида , ацетилена и монооксида углерода . Однако коммерчески используемый путь состоит из кротональдегида и кетена . [3] Ежегодно производится около 30 000 тонн. [1]
История
[ редактировать ]Сорбиновая кислота была выделена в 1859 перегонкой рябинового масла Гофманом А. В. фон . [4] В результате получается парасорбиновая кислота , лактон сорбиновой кислоты, которую он превращает в сорбиновую кислоту путем гидролиза. Его противомикробная активность была обнаружена в конце 1930-х и 1940-х годах, а коммерчески доступным он стал в конце 1940-х и 1950-х годах. Начиная с 1980-х годов сорбиновая кислота и ее соли использовались в качестве ингибиторов Clostridium botulinum в мясных продуктах для замены использования нитритов , которые могут производить канцерогенные нитрозамины . [5]
Свойства и использование
[ редактировать ]При p K a 4,76 сорбиновая кислота примерно такая же кислая, как уксусная кислота.
Сорбиновая кислота и ее соли, особенно сорбат калия и сорбат кальция , являются противомикробными агентами, часто используемыми в качестве консервантов в пищевых продуктах и напитках для предотвращения роста плесени , дрожжей и грибков . Обычно соли предпочтительнее кислотной формы, поскольку они более растворимы в воде, но активной формой является кислота. Оптимальный pH для антимикробной активности ниже pH 6,5. Сорбаты обычно используются в концентрациях от 0,025% до 0,10%. Однако добавление сорбатов в пищу немного повысит pH пищи, поэтому для обеспечения безопасности может потребоваться корректировка pH. Он содержится в таких продуктах, как различные виды сыра, хлеб, кексы, пончики, пироги, печенье, протеиновые батончики, сиропы, лимонады, фруктовые соки, сушеное мясо, колбасы, наггетсы, гамбургеры, сэндвичи, тако, пицца, копченая рыба. маргарин, соусы, супы и многое другое. [6]
Номера E :
- E200 Сорбиновая кислота
- E201 Сорбат натрия
- E202 Сорбат калия
- E203 Сорбат кальция
Некоторые плесени (особенно некоторые Trichoderma и Penicillium штаммы ) и дрожжи способны детоксицировать сорбаты путем декарбоксилирования , производя транс -1,3-пентадиен . Пентадиен проявляется как типичный запах керосина или нефти . Другие реакции детоксикации включают восстановление до 4- гексенола и 4-гексеновой кислоты. [7]
Сорбиновая кислота может также использоваться как добавка к холодной резине и как промежуточный продукт при производстве некоторых пластификаторов и смазок . [8]
Безопасность
[ редактировать ]Сорбиновая кислота и сорбатные соли обладают очень низкой токсичностью и канцерогенностью для млекопитающих. [9] Его LD 50 оценивается в пределах от 7,4 до 10 г/кг. [1]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с Эрих Люк, Мартин Ягер, Нико Рачек (2000). «Сорбиновая кислота». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a24_507 . ISBN 3-527-30673-0 .
{{cite encyclopedia}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ CFH Аллен; Дж. ВанАллан (1944). «Сорбиновая кислота». Орг. Синтез . 24:92 . дои : 10.15227/orgsyn.024.0092 .
- ^ Словарь промышленных химикатов Эшфорда , третье издание, 2011 г., стр. 8482.
- ^ Хофманн, AW (1859). «Новая летучая кислота ягод рябины». Анналы химии и фармации (на немецком языке). 110 (2): 129–140. дои : 10.1002/jlac.18591100202 . Гофман назвал сорбиновую кислоту на с. 133: «Я предлагаю назвать кристаллическую кислоту сорбиновой кислотой , что придает новый смысл старому названию яблочной кислоты, обнаруженной в ягодах рябины». (Для кристаллической кислоты я предлагаю название «сорбиновая кислота», благодаря чему старое название яблочной кислоты, содержащейся в ягодах рябины, приобретает новое значение.)
- ^ А.С. Найду, изд. (2000). Натуральные пищевые антимикробные системы . ЦРК Пресс. п. 637. ИСБН 0-8493-2047-Х .
- ^ «Сорбиновая кислота (E200) – обзор, применение, побочные эффекты и многое другое» . ЗдоровьеРыцарь. 21 мая 2022 г. Проверено 4 августа 2022 г.
- ^ Киндерлерер Дж.Л., Хаттон П.В. (1990). «Грибные метаболиты сорбиновой кислоты». Пищевая добавка Contam . 7 (5): 657–69. дои : 10.1080/02652039009373931 . ПМИД 2253810 .
- ^ Бингэм Э., Корссен Б. (2012). Токсикология Пэтти . Джон Уайли и сыновья. п. 547.
- ^ Пайпер Джей Ди, Пайпер ПВ (2017). «Бензоат и сорбатные соли: систематический обзор потенциальных опасностей этих бесценных консервантов и расширяющийся спектр клинического использования бензоата натрия» . Комплексные обзоры в области пищевой науки и безопасности пищевых продуктов . 16 (5): 868–880. дои : 10.1111/1541-4337.12284 . ПМИД 33371618 .
