Хромосомный кроссовер

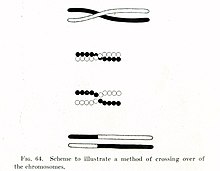
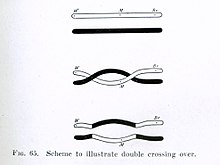
Хромосомный кроссинговер , или кроссинговер , — это обмен генетическим материалом во время полового размножения между двух гомологичных хромосом , несестринскими хроматидами в результате которого образуются рекомбинантные хромосомы . Это одна из заключительных фаз генетической рекомбинации , которая происходит на пахитены стадии профазы I мейоза называемого во время процесса, синапсисом . Синапсис начинается до того, как развивается синаптонемный комплекс , и не завершается почти до конца профазы I. Кроссовер обычно происходит, когда совпадающие области на совпадающих хромосомах разрываются, а затем снова соединяются с другой хромосомой.
Кроссинговер теоретически был описан Томасом Хантом Морганом ; термин «кроссовер» был придуман Морганом и Элет Кеттелл. [3] Хант опирался на открытие Франса Альфонса Янссенса, который описал это явление в 1909 году и назвал его «хиазматипией». [4] Термин хиазма связан, если не тождественен, с хромосомным кроссинговером. Морган сразу же увидел большое значение цитологической интерпретации хиазм Янссенсом для экспериментальных результатов его исследований наследственности дрозофилы . Физическая основа кроссинговера была впервые продемонстрирована Гарриет Крейтон и Барбарой МакКлинток в 1931 году. [5]
Связанная частота кроссинговера между двумя генными локусами ( маркерами ) представляет собой величину кроссинговера . Для фиксированного набора генетических и условий окружающей среды рекомбинация в определенной области структуры сцепления ( хромосомы ) имеет тенденцию быть постоянной, и то же самое верно для значения кроссинговера, которое используется при создании генетических карт . [6] [7]
Когда Хотта и др. в 1977 году сравнив мейотический кроссинговер ( рекомбинацию ) у лилий и мышей, они пришли к выводу, что разнообразные эукариоты имеют общий образец. [8] Это открытие позволило предположить, что хромосомный кроссинговер является общей характеристикой эукариотического мейоза.
Происхождение
[ редактировать ]Существуют две популярные и пересекающиеся теории, объясняющие происхождение кроссинговера, исходящие из разных теорий происхождения мейоза . Первая теория основана на идее, что мейоз развился как еще один метод репарации ДНК , и, таким образом, кроссинговер является новым способом замены возможно поврежденных участков ДНК. [9] Вторая теория исходит из идеи, что мейоз развился в результате бактериальной трансформации с функцией распространения разнообразия. [9]
В 1931 году Барбара МакКлинток открыла триплоидное растение кукурузы. Она сделала ключевые выводы относительно кариотипа кукурузы, включая размер и форму хромосом. МакКлинток использовал профазу и метафазу митоза для описания морфологии хромосом кукурузы, а позже продемонстрировал первую в истории цитологическую демонстрацию кроссинговера при мейозе. Работая со студенткой Харриет Крейтон, МакКлинток также внес значительный вклад в раннее понимание взаимозависимости связанных генов.
теория репарации ДНК
[ редактировать ]Кроссинговер и репарация ДНК — очень похожие процессы, в которых используются одни и те же белковые комплексы. [10] [11] В своем отчете «Значение ответов генома на вызов» МакКлинток исследовала кукурузу, чтобы показать, как геном кукурузы будет меняться, чтобы преодолеть угрозы ее выживанию. Она использовала 450 самоопыляемых растений, получивших от каждого родителя по хромосоме с разорванным концом. Она использовала модифицированные образцы экспрессии генов на разных участках листьев своих растений кукурузы, чтобы показать, что мобильные элементы («контролирующие элементы») прячутся в геноме, а их подвижность позволяет им изменять действие генов в разных локусах. Эти элементы также могут реструктурировать геном — от нескольких нуклеотидов до целых сегментов хромосомы. Рекомбиназы и примазы закладывают основу нуклеотидов последовательности ДНК. Одним из таких конкретных белковых комплексов, консервативных между процессами, является RAD51 , хорошо консервативный белок рекомбиназы, который, как было показано, играет решающую роль в репарации ДНК, а также в кроссинговере. [12] Несколько других генов D. melanogaster также связаны с обоими процессами, показывая, что мутанты в этих специфических локусах не могут подвергаться репарации ДНК или кроссинговеру. К таким генам относятся mei-41, mei-9, hdm, spnA и brca2. [ нужна ссылка ] Эта большая группа консервативных генов между процессами подтверждает теорию тесной эволюционной связи.Более того, было обнаружено, что репарация и кроссинговер ДНК благоприятствуют сходным участкам хромосом. В эксперименте с использованием радиационного гибридного картирования на хромосоме 3B пшеницы ( Triticum aestivum L. ) было обнаружено, что кроссинговер и репарация ДНК происходят преимущественно в одних и тех же участках. [13] Более того, кроссинговер может происходить в ответ на стрессовые условия и, вероятно, повреждающие ДНК. [14] [15]
Ссылки на бактериальную трансформацию
[ редактировать ]Процесс бактериальной трансформации также имеет много общего с хромосомным кроссинговером, особенно в образовании выступов по бокам разорванной цепи ДНК, позволяющих отжигать новую цепь. Сама бактериальная трансформация много раз была связана с восстановлением ДНК. [ нужна ссылка ] Вторая теория исходит из идеи, что мейоз развился в результате бактериальной трансформации с функцией распространения генетического разнообразия. [9] [16] Таким образом, эти данные позволяют предположить, что речь идет о том, связан ли кроссинговер с репарацией ДНК или бактериальной трансформацией, поскольку эти два явления не являются взаимоисключающими. Вполне вероятно, что кроссинговер возник в результате бактериальной трансформации, которая, в свою очередь, развилась в результате репарации ДНК, что объясняет связи между всеми тремя процессами.
Химия
[ редактировать ]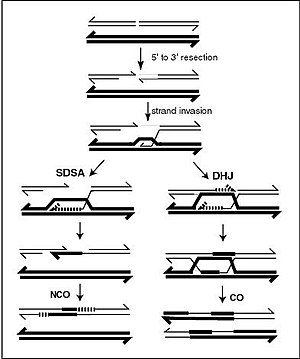
Мейотическая рекомбинация может быть инициирована двухцепочечными разрывами, которые вводятся в ДНК под воздействием повреждающих ДНК агентов. [9] или белок Spo11 . [17] Затем одна или несколько экзонуклеаз переваривают 5'-концы, образовавшиеся в результате двухцепочечных разрывов, с образованием 3'-хвостов одноцепочечной ДНК (см. диаграмму). Специфичная для мейоза рекомбиназа Dmc1 и общая рекомбиназа Rad51 покрывают одноцепочечную ДНК, образуя нуклеопротеиновые нити. [18] Рекомбиназы катализируют инвазию противоположной хроматиды одноцепочечной ДНК с одного конца разрыва. Затем 3'-конец вторгшейся ДНК запускает синтез ДНК, вызывая смещение комплементарной цепи, которая впоследствии отжигается с одноцепочечной ДНК, образовавшейся на другом конце первоначального двухцепочечного разрыва. В результате образуется структура перекрестного обмена , также известная как соединение Холлидея . Контакт между двумя хроматидами, которые вскоре подвергнутся кроссинговеру, известен как хиазма . Соединение Холлидея представляет собой тетраэдрическую структуру, которую могут «тянуть» другие рекомбиназы, перемещая ее по четырехцепочечной структуре.
МШ4 и МШ5
[ редактировать ]Белки MSH4 и MSH5 образуют гетероолигомерную структуру ( гетеродимер ) у дрожжей и человека. [19] [20] [21] В дрожжах Saccharomyces cerevisiae MSH4 и MSH5 действуют специфически, облегчая кроссовер между гомологичными хромосомами во время мейоза . [19] Комплекс MSH4/MSH5 связывает и стабилизирует двойные соединения Холлидея и способствует их расщеплению в продукты кроссовера. MSH4 Гипоморфный (частично функциональный) мутант S. cerevisiae показал 30%-ное снижение числа кроссинговеров по всему геному и большое количество мейозов с необменными хромосомами. [22] Тем не менее, этот мутант дал начало моделям жизнеспособности спор, что позволяет предположить, что сегрегация необменных хромосом происходит эффективно. Таким образом, у S. cerevisiae правильная сегрегация, по-видимому, не полностью зависит от кроссоверов между гомологичными парами.
Хиазма
[ редактировать ]Кузнечика Melanoplus femur-rubrum подвергали воздействию острой дозы рентгеновских лучей на каждой отдельной стадии мейоза и хиазм . измеряли частоту [23] Было обнаружено, что облучение на лептотены - зиготены стадиях мейоза (то есть до периода пахитены , в котором происходит кроссоверная рекомбинация) увеличивает частоту последующих хиазм. Аналогично, у кузнечика Chorthippus brunneus воздействие рентгеновского излучения на стадиях зиготены-ранней пахитены вызывало значительное увеличение средней частоты хиазм клеток. [24] Частоту хиазм оценивали на более поздних стадиях диплотен-диакинеза мейоза. Эти результаты позволяют предположить, что рентгеновские лучи вызывают повреждения ДНК, которые восстанавливаются перекрестным путем, приводящим к образованию хиазм.
Кроссоверы I и II классов.
[ редактировать ]Двухцепочечные разрывы (DSB) восстанавливаются двумя путями с образованием кроссинговеров у эукариот. [25] Большинство из них репарируются гомологами MutL MLH1 и MLH3, что определяет кроссинговеры I класса. Остальные являются результатом пути класса II, который регулируется эндонуклеазой MUS81 и транслоказой FANCM . Между этими двумя путями существуют взаимосвязи — кроссоверы класса I могут компенсировать потерю пути класса II. У мышей, нокаутных по MUS81, кроссоверы класса I повышены, тогда как общее количество кроссинговеров в хиазмах нормальное. Однако механизмы, лежащие в основе этих перекрестных помех, недостаточно изучены. Недавнее исследование предполагает, что в этой регуляции может участвовать каркасный белок SLX4. [26] В частности, мыши с нокаутом SLX4 в значительной степени фенокопируют нокаут MUS81 — опять же, повышенный уровень кроссинговеров класса I при нормальном количестве хиазм. У мышей с нокаутом по FANCM путь класса II гиперактивирован, что приводит к увеличению числа кроссинговеров, независимых от пути MLH1/MLH3. [27]
Последствия
[ редактировать ]
У большинства эукариот клетка , каждая из несет две версии каждого гена которых называется аллелью . Каждый родитель передает по одному аллелю каждому потомку. Отдельная гамета наследует полный гаплоидный набор аллелей на хромосомах, которые независимо выбираются из каждой пары хроматид, выстроенных в метафазную пластинку. Без рекомбинации все аллели этих генов, сцепленных в одной хромосоме, наследовались бы вместе. Мейотическая рекомбинация обеспечивает более независимое разделение между двумя аллелями, занимающими позиции отдельных генов, поскольку рекомбинация перемещает содержимое аллелей между гомологичными хромосомами.
Рекомбинация приводит к новому расположению материнских и отцовских аллелей на одной хромосоме. Хотя одни и те же гены появляются в одном и том же порядке, некоторые аллели различаются. Таким образом, теоретически возможно иметь любую комбинацию родительских аллелей у потомства, и тот факт, что два аллеля появляются вместе у одного потомка, не оказывает никакого влияния на статистическую вероятность того, что у другого потомства будет такая же комбинация. Этот принцип « независимого ассортимента » генов является фундаментальным для генетического наследования. [28] Однако частота рекомбинации на самом деле не одинакова для всех комбинаций генов. Это приводит к понятию « генетической дистанции », которая является мерой частоты рекомбинации , усредненной по (достаточно большой) выборке родословных. Грубо говоря, можно сказать, что это происходит потому, что на рекомбинацию большое влияние оказывает близость одного гена к другому. Если два гена расположены близко друг к другу на хромосоме, вероятность того, что событие рекомбинации разделит эти два гена, меньше, чем если бы они были дальше друг от друга. Генетическое сцепление описывает тенденцию наследования генов вместе в результате их расположения на одной хромосоме. Неравновесие по сцеплению описывает ситуацию, в которой некоторые комбинации генов или генетических маркеров встречаются в популяции более или менее часто, чем можно было бы ожидать, учитывая их расстояние друг от друга. Эта концепция применяется при поиске гена, который может вызвать то или иное заболевание . Это делается путем сравнения встречаемости определенного Последовательность ДНК с появлением заболевания. Когда обнаруживается высокая корреляция между ними, вполне вероятно, что соответствующая последовательность гена действительно ближе. [28]
негомологичный кроссовер
[ редактировать ]Кроссинговеры обычно происходят между гомологичными областями совпадающих хромосом , но сходство последовательностей и другие факторы могут привести к несовпадению выравниваний. Большая часть ДНК состоит из последовательностей пар оснований , повторяющихся очень большое количество раз. [29] Эти повторяющиеся сегменты, часто называемые спутниками, довольно однородны среди видов. [29] Во время репликации ДНК каждая цепь ДНК используется в качестве матрицы для создания новых цепей с использованием частично консервативного механизма; правильное функционирование этого процесса приводит к образованию двух идентичных парных хромосом, часто называемых сестрами. Известно, что события кроссовера сестринских хроматид происходят со скоростью несколько событий кроссовера на клетку на деление у эукариот. [29] Большинство этих событий включают обмен равными объемами генетической информации, но неравный обмен может произойти из-за несоответствия последовательностей. Они называются по-разному, включая негомологичный кроссовер, неравный кроссинговер и несбалансированную рекомбинацию, и приводят к вставке или удалению генетической информации в хромосоме. Хотя эти мутации редки по сравнению с гомологичными событиями кроссовера, они являются радикальными и затрагивают множество локусов одновременно. Они считаются основной движущей силой генерации дупликаций генов и являются общим источником мутаций внутри генома . [30]
Конкретные причины негомологичного кроссовера неизвестны, но известно, что несколько влиятельных факторов увеличивают вероятность неравного кроссовера. Одним из распространенных векторов, приводящих к несбалансированной рекомбинации, является восстановление двухцепочечных разрывов (DSB). [31] DSB часто восстанавливаются с использованием репарации, направленной на гомологию, - процесса, который включает вторжение цепи матрицы DSB (см. рисунок ниже). Близлежащие гомологичные участки цепи матрицы часто используются для репарации, что может привести к вставкам или делециям в геноме, если используется негомологичная, но комплементарная часть цепи матрицы. [31] Сходство последовательностей играет важную роль в кроссовере: события кроссовера с большей вероятностью происходят в длинных участках гена, имеющих близкую идентичность. [32] Это означает, что любой участок генома с длинными участками повторяющейся ДНК склонен к событиям кроссинговера.
Наличие мобильных элементов является еще одним влиятельным элементом негомологичного кроссовера. Повторяющиеся области кода характеризуют мобильные элементы; комплементарные, но негомологичные области встречаются внутри транспозонов повсеместно. Поскольку хромосомные области, состоящие из транспозонов, содержат большое количество идентичного повторяющегося кода в конденсированном пространстве, считается, что области транспозонов, подвергающиеся кроссинговеру, более склонны к ошибочному комплементарному совпадению; [33] то есть участок хромосомы, содержащий множество идентичных последовательностей, если он подвергнется кроссинговеру, с меньшей вероятностью совпадет с совершенно гомологичным участком комплементарного кода и более склонен к связыванию с участком кода на немного другая часть хромосомы. Это приводит к несбалансированной рекомбинации, поскольку генетическая информация может быть либо вставлена, либо удалена в новую хромосому, в зависимости от того, где произошла рекомбинация.
Хотя мотивирующие факторы неравной рекомбинации остаются неясными, элементы физического механизма уже выяснены. репарации ошибочного спаривания (MMR) представляют собой хорошо известное регуляторное семейство белков, ответственных за регуляцию несовпадающих последовательностей ДНК во время репликации и регуляции ускользания. Например, белки [34] Оперативной целью MMR является восстановление родительского генотипа. В частности, один класс MMR, MutSβ, как известно, инициирует коррекцию несоответствий вставки-делеции длиной до 16 нуклеотидов. [34] Мало что известно о процессе вырезания у эукариот, но вырезание E. coli включает расщепление разрыва либо на 5'-, либо на 3'-цепи, после чего ДНК-хеликаза и ДНК-полимераза III связываются и генерируют одноцепочечные белки, которые расщепляются. экзонуклеазами и прикрепляются к цепи лигазой . [34] Множественные пути MMR участвуют в поддержании стабильности генома сложного организма, и любой из многих возможных сбоев в пути MMR приводит к ошибкам редактирования и исправления ДНК. [35] Следовательно, хотя точно не известно, какие именно механизмы приводят к ошибкам негомологичного кроссовера, весьма вероятно, что задействован путь MMR.
См. также
[ редактировать ]- Неравный переход
- Коэффициент совпадения
- Генетическая дистанция
- Независимый ассортимент
- Митотический кроссовер
- Рекомбинантная частота
Ссылки
[ редактировать ]- ^ Гриффитс А.Дж., Гелбарт В.М., Миллер Дж.Х. и др. (1999). «Митотический кроссинговер» . Современный генетический анализ . Нью-Йорк: WH Freeman.
- ^ Ван С., Циклер Д., Клекнер Н., Чжан Л. (1 февраля 2015 г.). «Паттерны мейотического кроссовера: обязательный кроссинговер, интерференция и гомеостаз в одном процессе» . Клеточный цикл . 14 (3): 305–314. дои : 10.4161/15384101.2014.991185 . ПМЦ 4353236 . ПМИД 25590558 .
- ^ Морган Т.Х., Кеттелл Э. (1912). «Данные по изучению сцепленного с полом наследования у дрозофилы» . Журнал экспериментальной зоологии . 13 (1): 79–101. Бибкод : 1912JEZ....13...79M . дои : 10.1002/jez.1400130105 .
- ^ Янссенс Ф.А., Кошул Р., Циклер Д. (июнь 2012 г.). «Теория хиазмотипов. Новая интерпретация делений созревания. 1909 год» . Генетика . 191 (2): 319–346. дои : 10.1534/genetics.112.139725 . ПМЦ 3374304 . ПМИД 22701051 .
- ^ Крейтон Х.Б., МакКлинток Б. (август 1931 г.). «Корреляция цитологического и генетического кроссинговера у Zea Mays» . Труды Национальной академии наук Соединенных Штатов Америки . 17 (8): 492–497. Бибкод : 1931PNAS...17..492C . дои : 10.1073/pnas.17.8.492 . ПМЦ 1076098 . ПМИД 16587654 . (Оригинальная статья)
- ^ Ригер Р., Михаэлис А., Грин М.М. (1976). Глоссарий генетики и цитогенетики: Классический и молекулярный . Гейдельберг – Нью-Йорк: Springer-Verlag. ISBN 978-3-540-07668-1 .
- ^ Кинг Р.С., Стрэнсфилд В.Д. (1998). Словарь генетики . Нью-Йорк и Оксфорд: Издательство Оксфордского университета. ISBN 0-19-50944-1-7 . ISBN 0-19-509442-5 .
- ^ Хотта Ю., Чэндли AC, Стерн Х. (сентябрь 1977 г.). «Мейотический кроссинговер у лилии и мыши». Природа . 269 (5625): 240–242. Бибкод : 1977Natur.269..240H . дои : 10.1038/269240a0 . ПМИД 593319 . S2CID 4268089 .
- ^ Перейти обратно: а б с д Бернштейн Х, Бернштейн С (2010). «Эволюционное происхождение рекомбинации во время мейоза». Бионаука . 60 (7): 498–505. дои : 10.1525/bio.2010.60.7.5 . S2CID 86663600 .
- ^ Дангел, Нью-Джерси, Нолл А., Пухта Х (июнь 2014 г.). «MHF1 играет зависимую и независимую от FANCM роль белка группы M комплементации анемии Фанкони в репарации ДНК и гомологичной рекомбинации у растений» . Заводской журнал . 78 (5): 822–833. дои : 10.1111/tpj.12507 . ПМИД 24635147 .
- ^ Сапонаро М., Каллахан Д., Чжэн Х., Крейчи Л., Хабер Дж.Э., Кляйн Х.Л., Либери Г. (февраль 2010 г.). «Cdk1 нацелен на Srs2, чтобы завершить зависимый от синтеза отжиг цепи и способствовать рекомбинационной репарации» . ПЛОС Генетика . 6 (2): e1000858. дои : 10.1371/journal.pgen.1000858 . ПМК 2829061 . ПМИД 20195513 .
- ^ Эспозито М.С. (сентябрь 1978 г.). «Доказательства того, что спонтанная митотическая рекомбинация происходит на двухцепочечной стадии» . Труды Национальной академии наук Соединенных Штатов Америки . 75 (9): 4436–4440. Бибкод : 1978PNAS...75.4436E . дои : 10.1073/pnas.75.9.4436 . ПМК 336130 . ПМИД 360220 .
- ^ Кумар А., Басси Ф.М., По Э., Аль-Аззам О., де Хименес М.М., Дентон А.М. и др. (июль 2012 г.). «Репарация ДНК и кроссинговер благоприятствуют тем же участкам хромосом, которые обнаружены у радиационного гибрида Triticum» . БМК Геномика . 13 (339): 339. дои : 10.1186/1471-2164-13-339 . ПМЦ 3443642 . ПМИД 22827734 .
- ^ Стейнбёк Ф., Хубманн М., Богуш А., Дорнингер П., Ленгхаймер Т., Хайденрайх Э. (июнь 2010 г.). «Значение окислительного стресса и цитотоксических повреждений ДНК для спонтанного мутагенеза в нереплицирующихся дрожжевых клетках». Мутационные исследования . 688 (1–2): 47–52. дои : 10.1016/j.mrfmmm.2010.03.006 . ПМИД 20223252 .
- ^ Недельку А.М., Марку О., Мишод Р.Э. (август 2004 г.). «Секс как ответ на окислительный стресс: двукратное увеличение количества активных форм кислорода в клетках активирует половые гены» . Слушания. Биологические науки . 271 (1548): 1591–1596. дои : 10.1098/rspb.2004.2747 . ПМК 1691771 . ПМИД 15306305 .
- ^ Шарпантье X, Кей Э., Шнайдер Д., Шуман Х.А. (март 2011 г.). «Антибиотики и УФ-излучение вызывают способность к естественной трансформации Legionella pneumophila» . Журнал бактериологии . 193 (5): 1114–1121. дои : 10.1128/JB.01146-10 . ПМК 3067580 . ПМИД 21169481 .
- ^ Кини С., Жиру С.Н., Клекнер Н. (февраль 1997 г.). «Специфические для мейоза двухцепочечные разрывы ДНК катализируются Spo11, членом широко консервативного семейства белков» . Клетка . 88 (3): 375–384. дои : 10.1016/S0092-8674(00)81876-0 . ПМИД 9039264 . S2CID 8294596 .
- ^ Соважо С., Стасиак А.З., Банвиль И., Плокин М., Стасиак А., Массон Дж.Ю. (июнь 2005 г.). «Делящиеся дрожжи rad51 и dmc1, две эффективные ДНК-рекомбиназы, образующие спиральные нуклеопротеиновые нити» . Молекулярная и клеточная биология . 25 (11): 4377–4387. дои : 10.1128/MCB.25.11.4377-4387.2005 . ПМК 1140613 . ПМИД 15899844 .
- ^ Перейти обратно: а б Почарт П., Уолтеринг Д., Холлингсворт Н.М. (ноябрь 1997 г.). «Консервативные свойства функционально различных гомологов MutS у дрожжей» . Журнал биологической химии . 272 (48): 30345–30349. дои : 10.1074/jbc.272.48.30345 . ПМИД 9374523 .
- ^ Винанд, Нью-Джерси, Panzer JA, Колоднер РД (октябрь 1998 г.). «Клонирование и характеристика гомологов человека и Caenorhabditis elegans гена Saccharomyces cerevisiae MSH5» . Геномика . 53 (1): 69–80. дои : 10.1006/geno.1998.5447 . ПМИД 9787078 .
- ^ Бокер Т., Барусевичус А., Сноуден Т., Расио Д., Герретт С., Роббинс Д. и др. (февраль 1999 г.). «hMSH5: гомолог MutS человека, который образует новый гетеродимер с hMSH4 и экспрессируется во время сперматогенеза». Исследования рака . 59 (4): 816–822. ПМИД 10029069 .
- ^ Кришнапрасад Г.Н., Ананд М.Т., Лин Г., Теккедил М.М., Стейнмец Л.М., Нишант К.Т. (февраль 2015 г.). «Изменения в частоте кроссовера нарушают уверенность кроссовера, не влияя на мейотическую сегрегацию хромосом у Saccharomyces cerevisiae» . Генетика . 199 (2): 399–412. дои : 10.1534/genetics.114.172320 . ПМК 4317650 . ПМИД 25467183 .
- ^ Черч К., Уимбер, Делавэр (март 1969 г.). «Мейоз у кузнечика: частота хиазм после повышенной температуры и рентгена». Канадский журнал генетики и цитологии . 11 (1): 209–216. дои : 10.1139/g69-025 . ПМИД 5797806 .
- ^ Вестерман М. (август 1971 г.). «Влияние рентгеновского облучения на частоту хиазм у Chorthippus brunneus» . Наследственность . 27 (1): 83–91. дои : 10.1038/hdy.1971.73 . ПМИД 5289295 .
- ^ Холлоуэй Дж. К., Бут Дж., Эдельманн В., Макгоуэн Ч., Коэн П. Е. (сентябрь 2008 г.). «MUS81 генерирует подмножество MLH1-MLH3-независимых кроссинговеров в мейозе млекопитающих» . ПЛОС Генетика . 4 (9): e1000186. дои : 10.1371/journal.pgen.1000186 . ПМЦ 2525838 . ПМИД 18787696 .
- ^ Холлоуэй Дж.К., Мохан С., Бальмус Г., Сан Х, Модзелевски А., Борст П.Л. и др. (июнь 2011 г.). «BTBD12 млекопитающих (SLX4) защищает от нестабильности генома во время сперматогенеза млекопитающих» . ПЛОС Генетика . 7 (6): e1002094. дои : 10.1371/journal.pgen.1002094 . ПМК 3107204 . ПМИД 21655083 .
- ^ Цуй В., Лю Р., Новакович С., Стрингер Дж. М., Данливи Дж. Э., Грейнджер Э. и др. (август 2023 г.). « Fancm играет двойную роль в ограничении мейотических кроссинговеров и сохранении зародышевых клеток у млекопитающих» . Клеточная геномика . 3 (8): 100349. doi : 10.1016/j.xgen.2023.100349 . ПМЦ 10435384 . ПМИД 37601968 .
- ^ Перейти обратно: а б Дарлинг Д. «Генетическая рекомбинация» .
- ^ Перейти обратно: а б с Смит ГП (февраль 1976 г.). «Эволюция повторяющихся последовательностей ДНК путем неравного скрещивания». Наука . 191 (4227): 528–535. Бибкод : 1976Sci...191..528S . дои : 10.1126/science.1251186 . JSTOR 1741301 . ПМИД 1251186 .
- ^ Граур Д., Ли WH (2000). Основы молекулярной эволюции . Синауэр. ISBN 9780878932665 .
- ^ Перейти обратно: а б Пухта Х (январь 2005 г.). «Репарация двухцепочечных разрывов у растений: механизмы и последствия для эволюции генома» . Журнал экспериментальной ботаники . 56 (409): 1–14. дои : 10.1093/jxb/eri025 . ПМИД 15557293 .
- ^ Метценберг А.Б., Вурцер Г., Хьюсман Т.Х., Смитис О (май 1991 г.). «Требования к гомологии для неравного кроссинговера у людей» . Генетика . 128 (1): 143–161. дои : 10.1093/генетика/128.1.143 . ПМК 1204444 . ПМИД 2060774 .
- ^ Робберехт С., Воет Т., Замани Эстеки М., Новаковска Б.А., Вермееш Дж.Р. (март 2013 г.). «Неаллельная гомологичная рекомбинация между ретротранспозируемыми элементами является движущей силой несбалансированных транслокаций de novo» . Геномные исследования . 23 (3): 411–418. дои : 10.1101/гр.145631.112 . ПМК 3589530 . ПМИД 23212949 .
- ^ Перейти обратно: а б с Кункель Т.А., Эри Д.А. (2005). «Устранение несоответствия ДНК» . Ежегодный обзор биохимии . 74 (1): 681–710. doi : 10.1146/annurev.biochem.74.082803.133243 . ПМИД 15952900 .
- ^ Сёртиз Дж.А., Аргесо Дж.Л., Алани Э. (2004). «Белки репарации несоответствия: ключевые регуляторы генетической рекомбинации». Цитогенетические и геномные исследования . 107 (3–4): 146–159. дои : 10.1159/000080593 . ПМИД 15467360 . S2CID 19219813 .


