Иммунологическая память
Иммунологическая память — это способность иммунной системы быстро и специфично распознавать антиген , с которым ранее столкнулся организм, и инициировать соответствующий иммунный ответ . Как правило, это вторичные, третичные и другие последующие иммунные реакции на один и тот же антиген. Адаптивная иммунная система и генерация антигенспецифических рецепторов ( TCR , антитела ) отвечают за адаптивную иммунную память. [ нужна ссылка ]
После воспалительного иммунного ответа на опасный антиген некоторые антигенспецифические Т-клетки и В-клетки сохраняются в организме и становятся долгоживущими памяти Т- и В-клетками . После второй встречи с тем же антигеном они распознают антиген и дают более быстрый и устойчивый ответ. Иммунологическая память – основа вакцинации . [1] [2] Новые ресурсы показывают, что даже врожденная иммунная система может инициировать более эффективный иммунный ответ и элиминацию патогена после предыдущей стимуляции патогеном, соответственно, PAMP или DAMP . Врожденная иммунная память (также называемая обученным иммунитетом ) не является ни антигенспецифичной, ни зависимой от перестройки генов , но другая реакция вызвана изменениями в эпигенетическом программировании и сдвигами в клеточном метаболизме . Врожденная иммунная память наблюдалась как у беспозвоночных, так и у позвоночных . [3] [4]
Адаптивная иммунная память
[ редактировать ]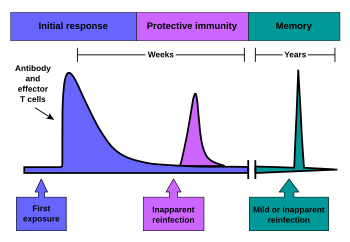
Развитие адаптивной иммунной памяти
[ редактировать ]Иммунологическая память возникает после первичного иммунного ответа на антиген. Таким образом, иммунологическая память создается у каждого человека после предыдущего первоначального воздействия потенциально опасного агента. Течение вторичного иммунного ответа аналогично первичному иммунному ответу. После того, как В-клетка памяти распознает антиген, она представляет комплекс пептид: MHC II близлежащим эффекторным Т-клеткам. Это приводит к активации этих клеток и быстрой пролиферации клеток. После исчезновения первичного иммунного ответа элиминируются эффекторные клетки иммунного ответа. [5]
Однако антитела , которые ранее были созданы в организме, остаются и представляют собой гуморальный компонент иммунологической памяти и представляют собой важный защитный механизм при последующих инфекциях. Помимо образовавшихся антител в организме остается небольшое количество Т- и В-клеток памяти, составляющих клеточный компонент иммунологической памяти. Они остаются в кровообращении в состоянии покоя и при последующей встрече с тем же антигеном эти клетки способны немедленно отреагировать и устранить антиген. Клетки памяти имеют долгую жизнь и сохраняются в организме до нескольких десятилетий. [6] [2]
Иммунитет к ветрянке, кори и некоторым другим заболеваниям сохраняется на всю жизнь. Иммунитет ко многим заболеваниям со временем ослабевает. Реакция иммунной системы на некоторые заболевания, такие как лихорадка денге , контрпродуктивно ухудшает следующую инфекцию ( антителозависимое усиление ). [7]
По состоянию на 2019 год исследователи все еще пытаются выяснить, почему некоторые вакцины дают пожизненный иммунитет, в то время как эффективность других вакцин падает до нуля менее чем за 30 лет (для эпидемического паротита) или менее чем за шесть месяцев (для гриппа H3N2 ). [8]
Эволюция адаптивной иммунной памяти
[ редактировать ]Эволюционное изобретение Т- и В-клеток памяти широко распространено; однако условия, необходимые для разработки этой дорогостоящей адаптации, специфичны. Во-первых, для развития иммунной памяти первоначальная стоимость молекулярного механизма должна быть высокой и потребует потери других характеристик хозяина. Во-вторых, у средне- или долгоживущих организмов больше шансов создать такой аппарат. Стоимость этой адаптации увеличивается, если у хозяина средняя продолжительность жизни, поскольку иммунная память должна быть эффективной в более раннем возрасте. [9]
Более того, исследовательские модели показывают, что окружающая среда играет важную роль в разнообразии клеток памяти в популяции. Сравнение влияния множественных инфекций на конкретное заболевание в отличие от разнообразия болезней в окружающей среде дает доказательства того, что пулы клеток памяти накапливают разнообразие в зависимости от количества отдельных воздействующих патогенов , даже за счет эффективности при столкновении с более распространенными патогенами. Люди, живущие в изолированной среде, например на островах, имеют менее разнообразную популяцию клеток памяти, однако они обладают более устойчивыми иммунными реакциями. Это указывает на то, что окружающая среда играет большую роль в эволюции популяций клеток памяти. [10]
Ранее приобретенная иммунная память может быть истощена корью у непривитых детей, в результате чего они подвергаются риску заражения другими возбудителями в течение нескольких лет после заражения. [11]
В-клетки памяти
[ редактировать ]В-клетки памяти – это плазматические клетки , способные вырабатывать антитела длительное время . В отличие от наивных В-клеток, участвующих в первичном иммунном ответе, реакция В-клеток памяти немного отличается. В-клетка памяти уже претерпела клональную экспансию , дифференцировку и созревание аффинности , поэтому она способна делиться в несколько раз быстрее и производить антитела с гораздо более высоким сродством (особенно IgG ). [1]
Напротив, наивные плазматические клетки полностью дифференцированы и не могут подвергаться дальнейшей стимуляции антигеном для деления или увеличения выработки антител. Активность В-клеток памяти во вторичных лимфатических органах наиболее высока в течение первых 2 недель после заражения . Впоследствии, через 2–4 недели, его реакция снижается. После реакции зародышевого центра плазматические клетки памяти располагаются в костном мозге , который является основным местом выработки антител в рамках иммунологической памяти. [12]
Т-клетки памяти
[ редактировать ]Т-клетки памяти могут быть как CD4+, так и CD8+ . Эти Т-клетки памяти не требуют дальнейшей антигенной стимуляции для пролиферации ; следовательно, им не нужен сигнал через MHC. [13] Т-клетки памяти можно разделить на две функционально различные группы на основе экспрессии хемокинового рецептора CCR7 . Этот хемокин указывает направление миграции во вторичные лимфатические органы . Те Т-клетки памяти, которые не экспрессируют CCR7 (это CCR7-), имеют рецепторы для миграции к месту воспаления в ткани и представляют собой непосредственную популяцию эффекторных клеток. Эти клетки были названы эффекторными Т-клетками памяти (TEM ) . После повторной стимуляции они производят большое количество IFN-γ , IL-4 и IL-5 . Напротив, Т-клетки памяти CCR7+ лишены провоспалительной и цитотоксической функции, но имеют рецепторы для миграции лимфатических узлов . Эти клетки были названы Т-клетками центральной памяти (TCM ) . Они эффективно стимулируют дендритные клетки и после повторной стимуляции способны дифференцироваться в CCR7-эффекторные Т-клетки памяти. Обе популяции этих клеток памяти происходят из наивных Т-клеток и остаются в организме в течение нескольких лет после первоначальной иммунизации . [14]
Экспериментальные методы, используемые для изучения этих клеток, включают измерение антиген-стимулированной пролиферации клеток и высвобождения цитокинов, окрашивание мультимерами пептид-MHC или использование анализа маркеров, индуцированных активацией (AIM). [15]
Врожденная иммунная память
[ редактировать ]многие беспозвоночные, такие как виды пресноводных улиток , веслоногие ракообразные и ленточные черви, активируют врожденную иммунную память, чтобы вызвать более эффективный иммунный ответ на повторную встречу с конкретными патогенами, несмотря на отсутствие адаптивной ветви иммунной системы. Было замечено, что [3] Мыши с дефицитом RAG1 без функциональных Т- и В-клеток смогли пережить введение летальной дозы Candida albicans при предварительном воздействии гораздо меньшего количества, показывая, что позвоночные также сохраняют эту способность. [4] Несмотря на то, что врожденная иммунная система не обладает способностью вырабатывать антитела , как адаптивная иммунная система , она также обладает свойствами иммунной памяти. Врожденная иммунная память (тренированный иммунитет) определяется как долгосрочное функциональное перепрограммирование клеток врожденного иммунитета, вызванное экзогенными или эндогенными воздействиями и приводящее к измененному ответу на второй вызов после возвращения в неактивированное состояние. [16]
Когда врожденные иммунные клетки получают сигнал активации; например, благодаря распознаванию PAMP с PRR они запускают экспрессию провоспалительных генов, инициируют воспалительную реакцию и подвергаются эпигенетическому перепрограммированию. После второй стимуляции активация транскрипции происходит быстрее и надежнее. [17] Иммунологическая память была обнаружена в моноцитах , макрофагах , NK-клетках , ILC1 , ILC2 в ILC3 . , а недавно и [18] [17] В то же время некоторые неиммунные клетки, например, эпителиальные стволовые клетки барьерных тканей или фибробласты , меняют свое эпигенетическое состояние и по-разному реагируют на первичное повреждение. [19]
Механизм врожденной иммунной памяти
[ редактировать ]В устойчивом состоянии нестимулированные клетки имеют пониженную биосинтетическую активность и более конденсированный хроматин со сниженной транскрипцией генов. Взаимодействие экзогенных PAMP ( β-глюкан , мурамилпептид ) или эндогенных DAMP (окисленный ЛПНП , мочевая кислота ) с PRR инициирует клеточный ответ. Запуск внутриклеточных сигнальных каскадов приводит к усилению регуляции метаболических путей, таких как гликолиз , цикл Кребса и метаболизм жирных кислот . Увеличение метаболической активности обеспечивает клетки энергией и строительными блоками, которые необходимы для производства сигнальных молекул, таких как цитокины и хемокины . [17]
Трансдукция сигнала изменяет эпигенетические метки и увеличивает доступность хроматина, позволяя связывать факторы транскрипции и запускать транскрипцию генов, связанных с воспалением. Существует взаимосвязь между метаболизмом и эпигенетическими изменениями, поскольку некоторые метаболиты, такие как фумарат и ацетил-КоА, могут активировать или ингибировать ферменты, участвующие в ремоделировании хроматина . [16] После прекращения действия стимула необходимость в выработке иммунных факторов отпадает, и их экспрессия в иммунных клетках прекращается. Сохранилось несколько эпигенетических модификаций, возникших во время стимуляции. Характерной эпигенетической перестройкой в обученных клетках является накопление H3K4me3 на промоторах иммунных генов и увеличение H3k4me1 и H3K27ac на энхансерах. При этом клеточный метаболизм не возвращается к состоянию до стимуляции, а обученные клетки остаются в подготовленном состоянии. Этот статус может длиться от недель до нескольких месяцев и может передаваться в дочерние клетки. Вторичная стимуляция вызывает новую реакцию, более быструю и сильную. [16] [17]
Эволюция врожденной иммунной памяти
[ редактировать ]Иммунная память дает большое эволюционное преимущество, когда организм сталкивается с повторяющимися инфекциями. Воспаление обходится очень дорого, а повышенная эффективность реакции ускоряет элиминацию патогена и предотвращает повреждение собственных тканей хозяина. Классическая адаптивная иммунная память развилась у челюстных позвоночных и у бесчелюстных рыб ( миноги ), составляющих примерно 1% живых организмов. Таким образом, некоторая форма иммунной памяти имеется и у других видов. У растений и беспозвоночных после вторичного заражения могут наблюдаться более быстрая кинетика, усиление иммунного ответа и повышение выживаемости. Иммунная память присуща подавляющему большинству видов биоразнообразия на Земле. [20]
Было высказано предположение, что иммунная память при врожденном и адаптивном иммунитете представляет собой эволюционный континуум, в котором сначала развился более устойчивый иммунный ответ, опосредованный эпигенетическим перепрограммированием. Напротив, у некоторых позвоночных специфичность через антигенспецифические рецепторы развилась позже. [21]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Мерфи, Кеннет; Уивер, Кейси (2017). Иммунология Джейнвей (9-е изд.). Нью-Йорк и Лондон: Garland Science. стр. 473–475. ISBN 9780815345510 .
- ^ Перейти обратно: а б Хаммарлунд, Эрика и др. (2003). «Продолжительность противовирусного иммунитета после прививки от оспы». Природная медицина 9.9, 1131.
- ^ Перейти обратно: а б Кришан, Таня О.; Нетя, Михай Г.; Йостен, Лео AB (апрель 2016 г.). «Врожденная иммунная память: последствия для реакций хозяина на молекулярные паттерны, связанные с повреждением» . Европейский журнал иммунологии . 46 (4): 817–828. дои : 10.1002/eji.201545497 . ISSN 0014-2980 . ПМИД 26970440 .
- ^ Перейти обратно: а б Гурбаль, Бенджамин; Пино, Сильвен; Беккерс, Джерольд Дж. М.; Ван дер Меер, Йос ВМ; Конрат, Уве; Нетеа, Михай Г. (17 апреля 2018 г.). «Врожденная иммунная память: эволюционная перспектива» . Иммунологические обзоры . 283 (1): 21–40. дои : 10.1111/imr.12647 . ISSN 0105-2896 . ПМИД 29664574 . S2CID 4891922 .
- ^ Срент, Джонатан и Сьюзан Р. Уэбб. «Интратимическая и экстратимическая клональная делеция Т-клеток». Текущее мнение по иммунологии 7.2 (1995): 196-205.
- ^ Кротти, Шейн и др. «Авангард: долговременная память В-клеток у людей после вакцинации против оспы». Журнал иммунологии 171.10 (2003): 4969-4973.
- ^ Эд Йонг. «Иммунология – это место, где интуиция умирает» .2020.цитата: «От некоторых болезней — ветряной оспы, кори — иммунитет сохраняется на всю жизнь, но со временем ослабевает от многих других».цитата: «Для некоторых заболеваний, таких как лихорадка денге, реакция антител на одну инфекцию может, как это ни парадоксально, сделать следующую инфекцию более тяжелой».
- ^ Джон Коэн. «Как долго действуют вакцины?» .2019.
- ^ С уважением, Алекс; Хойл, Энди (6 июня 2013 г.). «Эволюция дорогостоящей приобретенной иммунной памяти» . Экология и эволюция . 3 (7): 2223–2232. Бибкод : 2013EcoEv...3.2223B . дои : 10.1002/ece3.611 . ISSN 2045-7758 . ПМЦ 3728959 . ПМИД 23919164 .
- ^ Грау, Фредерик; Магнус, Карстен; Регоес, Роланд Р. (2010). «Теоретический анализ эволюции иммунной памяти» . Эволюционная биология BMC . 10 (1): 380. Бибкод : 2010BMCEE..10..380G . дои : 10.1186/1471-2148-10-380 . ISSN 1471-2148 . ПМК 3018457 . ПМИД 21143840 .
- ^ Мина М.Дж., Кула Т., Ленг Ю., Ли М., Врис Р.Д., Книп М. и др. (01.11.2019). «Инфекция вирусом кори уменьшает количество ранее существовавших антител, обеспечивающих защиту от других патогенов» . Наука . 366 (6465): 599–606. Бибкод : 2019Sci...366..599M . дои : 10.1126/science.aay6485 . hdl : 10138/307628 . ISSN 0036-8075 . ПМК 8590458 . ПМИД 31672891 . S2CID 207815213 .
- ^ Слифка, Марк К., Мехрдад Матлубиан и Рафи Ахмед (1995). «Костный мозг является основным местом длительного производства антител после острой вирусной инфекции». Журнал вирусологии , 69 (3) , 1895–1902 гг.
- ^ Кассиотис, Джордж и др. «Нарушение иммунологической памяти при отсутствии MHC, несмотря на выживание Т-клеток памяти». Природная иммунология 3.3 (2002): 244.
- ^ Саллусто, Федерика и др. «Два подмножества Т-лимфоцитов памяти с различными потенциалами самонаведения и эффекторными функциями». Природа 401.6754 (1999): 708.
- ^ Полони, Чад; Шонхофер, Коул; Айвисон, Сабина; Левингс, Меган К.; Штайнер, Теодор С.; Кук, Лаура (24 февраля 2023 г.). «Анализ маркеров, индуцированных активацией Т-клеток, в здоровье и болезни» . Иммунология и клеточная биология . 101 (6): 491–503. дои : 10.1111/imcb.12636 . ISSN 1440-1711 . ПМЦ 10952637 . ПМИД 36825901 .
- ^ Перейти обратно: а б с Нетя, Михай Г.; Домингес-Андрес, Хорхе; Баррейро, Луис Б.; Чавакис, Триантафиллос; Дивангахи, Мазиар; Фукс, Элейн; Йоостен, Лео А.Б.; ван дер Меер, Йос ВМ; Мхланга, Муса М.; Малдер, Уиллем Дж. М.; Риксен, Нильс П.; Шлитцер, Андреас; Шульце, Иоахим Л.; Стабель Бенн, Кристина; Сан, Джозеф К. (июнь 2020 г.). «Определение тренированного иммунитета и его роли в здоровье и болезни» . Обзоры природы Иммунология . 20 (6): 375–388. дои : 10.1038/s41577-020-0285-6 . ISSN 1474-1741 . ПМК 7186935 . ПМИД 32132681 .
- ^ Перейти обратно: а б с д Фануччи, Стефани; Домингес-Эндрюс, Хорхе; Йоостен, Лео А.Б.; Нетеа, Люди Г.; Вуд, Муса М. (12 января 2021 г.). «Пересечение эпигенетики и метаболизма в тренированном иммунитете» . Иммунитет . 54 (1): 32–43. doi : 10.1016/j.immuni.2020.10.011 . hdl : 2066/229964 . ISSN 1074-7613 . ПМИД 33220235 . S2CID 227124221 .
- ^ Хартунг, Франциска; Эссер-фон Бирен, Юлия (5 сентября 2022 г.). «Обученный иммунитет при иммунных реакциях 2 типа» . Иммунология слизистой оболочки . 15 (6): 1158–1169. дои : 10.1038/s41385-022-00557-0 . ISSN 1935-3456 . ПМЦ 9705254 . ПМИД 36065058 .
- ^ Ордовас-Монтанес, Хосе; Беяз, Семир; Ракофф-Нахум, Сет; Шалек, Алекс К. (май 2020 г.). «Распределение и хранение воспалительной памяти в барьерных тканях» . Обзоры природы Иммунология . 20 (5): 308–320. дои : 10.1038/s41577-019-0263-z . ISSN 1474-1741 . ПМЦ 7547402 . ПМИД 32015472 .
- ^ Нетя, Михай Г.; Шлитцер, Андреас; Пласек, Катажина; Йостен, Лео А.Б.; Шульце, Иоахим Л. (9 января 2019 г.). «Врожденная и адаптивная иммунная память: эволюционный континуум в ответе хозяина на патогены» . Клетка-хозяин и микроб . 25 (1): 13–26. дои : 10.1016/j.chom.2018.12.006 . ISSN 1931-3128 . ПМИД 30629914 . S2CID 58623144 .
- ^ Дивангахи, Мазиар; Ааби, Питер; Хадер, Шабаана Абдул; Баррейро, Луис Б.; Беккеринг, Сирун; Чавакис, Триантафиллос; ван Кревель, Рейнаут; Кертис, Найджел; Динардо, Эндрю Р.; Домингес-Андрес, Хорхе; Дуивенворден, Рафаэль; Фануччи, Стефани; Файад, Захи; Фукс, Элейн; Хамон, Мелани (январь 2021 г.). «Обученный иммунитет, толерантность, прайминг и дифференциация: различные иммунологические процессы» . Природная иммунология . 22 (1): 2–6. дои : 10.1038/s41590-020-00845-6 . ISSN 1529-2916 . ПМК 8020292 . ПМИД 33293712 .