Врожденные лимфоидные клетки 3-го типа
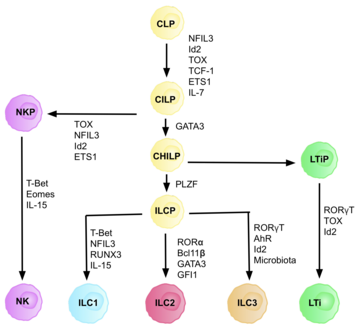
Врожденные лимфоидные клетки типа 3 ( ILC3 ) – это иммунные клетки лимфоидной линии , которые являются частью врожденной иммунной системы . Эти клетки участвуют во врожденных механизмах на слизистых оболочках , способствуя гомеостазу тканей, мутуализму хозяин-комменсал и выведению патогенов. Они являются частью гетерогенной группы врожденных лимфоидных клеток , которую традиционно делят на три подгруппы на основании экспрессии ими главных факторов транскрипции, а также секретируемых эффекторных цитокинов — ILC1, ILC2 и ILC3. [2]
Характеристика
[ редактировать ]Семейство ILC 3 можно разделить на две подгруппы на основании экспрессии ими естественных рецепторов цитотоксичности (NCR), обозначенных как NCR. + ILC3 и НКР − ILC3. Эти рецепторы обычно обнаруживаются на естественных клетках-киллерах и некоторых субпопуляциях врожденных и адаптивных клеток. Они участвуют в активации и цитотоксической активности NK-клеток, включая лизис клеток и секрецию провоспалительных цитокинов. [3] Клетки LTi (клетки, индуцирующие лимфоидную ткань) представляют собой субпопуляцию, важную для развития вторичных лимфоидных органов в эмбриогенезе . Клетки ILC3 продуцируют цитокины, типичные для популяции лимфоцитов- хелперов Th17 . Характерной особенностью ILC3 является экспрессия транскрипционного фактора RORγt , который необходим для его развития и экспрессии хемокинового рецептора CCR6 . [2] Эта группа КМП производит Ил-17 (особенно Ил-17А ) [4] и Ил-22 . [5] Оба цитокина могут продуцироваться ILC 3 одновременно или по отдельности, при условии, что когда IL-22 продуцируется отдельно, это вопрос NCR. + ILC3. [5] ILC3 экспрессируют IL-23R, а продукция IL-17 и IL-22 стимулируется IL-23 и IL-1β . [6] Для ILC3 характерна экспрессия транскрипционного фактора RORγt и частично также Ahr ( арилуглеводородный рецептор ), поскольку взаимодействия этих двух транскрипционных факторов вызывают накопление ILC-3 и продукцию IL-22 в кишечнике. [7] Существует высокая гетерогенность поверхностных маркеров клеток ILC3, при этом тканеспецифичные популяции могут различаться по функциям в зависимости от контекста. [8] Клетки ILC3 также обладают фенотипической пластичностью и, как наблюдалось, при определенных обстоятельствах приобретают ILC1-подобный фенотип. [8] [9]
Функция
[ редактировать ]ILC 3 представляют собой гетерогенную популяцию, имеющую решающее значение для защиты от внеклеточных паразитов и поддержания гомеостаза кишечника. [2] Они участвуют в эффективной противомикробной защите посредством производства IL-17 и IL-22. Роль IL-22 у человека и мышей несколько различна. На мышиной модели было обнаружено, что IL-22 играет роль в улучшении течения воспалительного заболевания кишечника и восстановлении эпителия при потере защитного муцинового барьера в толстой кишке . [10] [11] Однако у людей с воспалительным заболеванием кишечника IL-22 оказывает влияние на патологию заболевания. [12] IL-22 является важным цитокином для поддержания гомеостаза кишечника. Действие IL-22 способствует усилению защиты поверхности слизистой оболочки кишечника за счет ослабления муцинового слоя. [11] и его способность вырабатывать противомикробные агенты, такие как β-дефензины , является мощным механизмом, помогающим поддерживать гомеостаз кишечника. [13] Сообщалось о повышении уровня IL-22 вместе с увеличением экспрессии β-дефензина при воспалительных заболеваниях кожи, таких как псориаз . Таким образом, IL-22, как и IL-17, может быть вовлечен в развитие этих заболеваний кожи, поскольку у людей без этих проблем экспрессия IL-22 не зарегистрирована. [14] Эффекты IL-17 и IL-22 могут дополнять друг друга и стимулировать увеличение количества антимикробных пептидов в месте действия. [13] Подобно ILC2, ILC 3 может экспрессировать MHC II и выполнять функцию антигенпредставляющих клеток. [15] Однако у ILC отсутствуют костимулирующие рецепторы, необходимые для правильной активации и инициации иммунного ответа. ILC, напротив, могут привести Т-хелперные лимфоциты в состояние анергии . В случае ILC 3 способность экспрессировать MHC II, по-видимому, служит для поддержания толерантности к комменсальным бактериям в кишечнике. Они подавляют реакцию CD4 + Т-лимфоцитов на безвредные и полезные кишечные бактерии. Если эта толерантность не поддерживается, может произойти развитие нежелательных патологических состояний. [15] С другой стороны, действие IL-23 или IL-17 не всегда полезно. Он вызывает некоторые аутоиммунные заболевания, такие как рассеянный склероз. [16] или ревматоидный артрит . [17] IL-17A специфически нацелен на кератиноциты и является основным цитокином, вызывающим патогенез псориаза кожи. [18] Кроме того, IL-17A также экспрессируется в возрастающей степени у пациентов с воспалительными заболеваниями кишечника. [19] ILC 3 может играть роль уже в пренатальном периоде устойчивости организма к инфекциям. LTi-клетки играют важную роль в возникновении и развитии вторичных лимфоидных органов. Было обнаружено, что дифференцировка и передача сигналов LTi-клеток зависят от ретиноевой кислоты (компонента витамина А). Поглощение ретиноевой кислоты матерью с пищей напрямую влияет на развитие клеток LTi и размер вторичных лимфоидных органов плода, что может оказывать влияние в более позднем возрасте. [20]
Клетки ILC3 при заболевании
[ редактировать ]Клетки ILC3 действуют как стражи желудочно-кишечного тракта. Они участвуют в поддержании гомеостаза и толерантности к комменсалам, но также важны для защиты от вторжения патогенов. [21] Их транскрипционный и цитокиновый профиль очень похож на клетки Th17 , и ILC3 также могут стать патогенными при определенных обстоятельствах, способствуя прогрессированию заболевания и воспалению. ILC3 связан с прогрессированием воспалительного заболевания кишечника , которое является общим термином, описывающим хронические воспалительные состояния желудочно-кишечного тракта, которые связаны с множеством факторов, включая иммунную дисрегуляцию и сигналы окружающей среды, а также генетическую предрасположенность. Наиболее известными типами ВЗК являются болезнь Крона и язвенный колит . Более высокое количество клеток ILC3 было обнаружено в изолятах толстой кишки пациентов с ВЗК. НКР − Было показано, что ILC3 являются патогенными в контексте ВЗК, но не NCR. + ILC3. [22] [23] Точный вклад подмножеств ILC3 в прогрессирование заболевания до конца не изучен. Некоторые исследования показывают, что у пациентов с болезнью Крона снижается количество NCR. + ILC3, которые являются ключевыми производителями IL-22 . IL-22 имеет решающее значение для поддержания и целостности кишечного эпителиального барьера, а его пониженная концентрация может предрасполагать к нарушениям функций эпителиального барьера. [23] Однако другие исследования указывают на чрезмерную активацию ILC3 как на мышиных моделях ВЗК, так и на людях, где также были обнаружены высокие уровни IL-22. [24] Было показано, что кишечные макрофаги ускоряют воспаление кишечника, индуцируя выработку IL-22 с помощью ILC3 слизистой оболочки. [24] Было обнаружено, что ILC3 при определенных обстоятельствах трансдифференцируется в IFN-γ -продуцирующие ILC1- подобные клетки посредством передачи сигналов IL-23 и IL-12, что приводит к хроническому воспалению. [24] В случаях обширной инвазии патогенов в эпителий кишечника сверхэкспрессия IL-22 и IL-17 с помощью ILC3 может привести к чрезмерному притоку нейтрофилов , повышению проницаемости эпителия и воспалению. [24]
Клетки ILC3 в последние годы также были связаны с иммунными ответами на грибковый патоген Candida albicans . [25] Этот условно-патогенный микроорганизм индуцирует иммунный ответ Th17. Это подтверждается тем фактом, что клетки ILC3 отражают фенотип клеток Th17, а также недавно было обнаружено, что подмножество клеток ILC3 обладает мощными антигенпрезентирующими свойствами. [26] ILC3 способствуют иммунному ответу на этот патоген, опосредуя иммунный ответ посредством секреции цитокинов, таких как IL-17A . [25]
Также было показано, что они играют роль в здоровье легких и прогрессировании заболеваний легких, поскольку ось IL-17/IL-22 имеет решающее значение для правильного функционирования легких, а ее дисбаланс может привести к патологии. [27] Группа ILC2 широко изучалась в отношении здоровья легких, поскольку нарушение регуляции ответов Th2 связано с астмой и другими патологиями. Эта подгруппа также важна для восстановления тканей. Однако ILC3 являются наиболее распространенными из популяций врожденных лимфоидных клеток в легочной ткани. Балансирование гомеостаза слизистой оболочки легких и соответствующих иммунных реакций при инфекциях имеет решающее значение. Считается, что клетки ILC3 играют важную роль при вирусных инфекциях легких. При инфекциях гриппа высокие уровни IL-17A обнаруживаются вскоре после заражения, что приводит к повреждению легких, вызванному обширным рекрутированием нейтрофилов в ткани. IL-22, полученный из ILC3, противодействовал этим эффектам, защищая ткани хозяина. Дефицит IL-22 приводит к обширному повреждению тканей. С другой стороны, недостаточный уровень IL-17A при гриппе и сочетанной бактериальной инфекции приводил к вторичной бактериальной пневмонии . Клетки ILC3, вероятно, играют важную роль в балансировании иммунного ответа и защите от вторичных инфекций в разрушенном эпителии слизистой оболочки, но в случаях нарушения регуляции их активность может привести к повреждению тканей. [27]
При бактериальных инфекциях легких ILC3 являются одной из популяций-источников IL-17, ключевого цитокина для бактериального клиренса. Было замечено, что моноциты, рекрутированные в легкие в ответ на повреждение тканей и PAMP, продуцируют TNF , увеличивая количество секретирующих IL-17 ILC3, что впоследствии приводит к притоку нейтрофилов. IL-22, производный от ILC3, способствует пролиферации эпителия и выработке антимикробных молекул. [27]
ILC3 также играет важную роль в рассеянном склерозе и оси кишечник-мозг. Рассеянный склероз — это аутоиммунное заболевание, вызываемое аутореактивными Т-клетками , главным образом Th1 клетками и Th17. Нарушение гомеостаза кишечника изучается в связи с развитием рассеянного склероза, поскольку гомеостаз кишечника, по-видимому, имеет важное значение для профилактики этого заболевания. Клетки ILC3, как предполагается, играют важную роль в патогенезе этого заболевания, поскольку они являются ключевой популяцией для гомеостаза и толерантности кишечника. Клетки ILC3 экспрессируют несколько поверхностных рецепторов как для пищевых соединений, так и для микробных продуктов, таких как рецепторы SCFA . У пациентов с рассеянным склерозом или на моделях мышей EAE уровни SCFAs в фекалиях снижены, что указывает на возможную связь между содержимым просвета кишечника и гомеостазом, опосредованным ILC3. Было показано, что пероральное введение SCFAs оказывает благотворное влияние на EAE, стимулируя активность Treg . [28]
Ссылки
[ редактировать ]- ^ Вивье Э., Артис Д., Колонна М., Дифенбах А., Ди Санто Дж. П., Эберл Г. и др. (август 2018 г.). «Врожденные лимфоидные клетки: 10 лет спустя» . Клетка . 174 (5): 1054–1066. дои : 10.1016/j.cell.2018.07.017 . ПМИД 30142344 .
- ^ Перейти обратно: а б с Спитс Х., Артис Д., Колонна М., Дифенбах А., Ди Санто Дж.П., Эберл Г. и др. (февраль 2013 г.). «Врожденные лимфоидные клетки — предложение по единой номенклатуре» . Обзоры природы. Иммунология . 13 (2): 145–149. дои : 10.1038/nri3365 . ПМИД 23348417 . S2CID 2228459 .
- ^ Барроу А.Д., Мартин СиДжей, Колонна М (07.05.2019). «Естественные рецепторы цитотоксичности в здоровье и болезнях» . Границы в иммунологии . 10 :909. дои : 10.3389/fimmu.2019.00909 . ПМК 6514059 . ПМИД 31134055 .
- ^ Такатори Х., Канно Ю., Уотфорд В.Т., Тато К.М., Вайс Г., Иванов II, Литтман Д.Р., О'Ши Дж.Дж. (январь 2009 г.). «Клетки, подобные индукторам лимфоидной ткани, являются врожденным источником IL-17 и IL-22» . Журнал экспериментальной медицины . 206 (1): 35–41. дои : 10.1084/jem.20072713 . ПМЦ 2626689 . ПМИД 19114665 .
- ^ Перейти обратно: а б Селла М., Фукс А., Верми В., Факетти Ф., Отеро К., Леннерц Дж.К., Доэрти Дж.М., Миллс Дж.К., Колонна М. (февраль 2009 г.). «Подмножество естественных киллеров человека обеспечивает врожденный источник IL-22 для иммунитета слизистой оболочки» . Природа . 457 (7230): 722–5. Бибкод : 2009Natur.457..722C . дои : 10.1038/nature07537 . ПМЦ 3772687 . ПМИД 18978771 .
- ^ Селла М., Отеро К., Колонна М. (июнь 2010 г.). «Экспансия клеток NK-22 человека с помощью IL-7, IL-2 и IL-1beta обнаруживает внутреннюю функциональную пластичность» . Труды Национальной академии наук Соединенных Штатов Америки . 107 (24): 10961–6. Бибкод : 2010PNAS..10710961C . дои : 10.1073/pnas.1005641107 . ПМЦ 2890739 . ПМИД 20534450 .
- ^ Цю Дж., Хеллер Дж. Дж., Го X, Чен З. М., Фиш К., Фу YX, Чжоу Л. (январь 2012 г.). «Арильный углеводородный рецептор регулирует иммунитет кишечника посредством модуляции врожденных лимфоидных клеток» . Иммунитет . 36 (1): 92–104. doi : 10.1016/j.immuni.2011.11.011 . ПМЦ 3268875 . ПМИД 22177117 .
- ^ Перейти обратно: а б Мейнингер И., Карраско А., Рао А., Сойни Т., Коккину Э., Мьёсберг Дж. (октябрь 2020 г.). «Тканевые особенности врожденных лимфоидных клеток» . Тенденции в иммунологии . 41 (10): 902–917. дои : 10.1016/j.it.2020.08.009 . ПМИД 32917510 .
- ^ Тициан С., Ламанн А., Хёльскен О., Косовану С., Кофоед-Бранцк М., Генрих Ф. и др. (февраль 2020 г.). Рат С., Уизерс Д. (ред.). «c-Maf сдерживает T-bet-зависимое программирование CCR6-негативных врожденных лимфоидных клеток группы 3» . электронная жизнь . 9 : е52549. дои : 10.7554/eLife.52549 . ПМК 7025824 . ПМИД 32039762 .
- ^ Сугимото К., Огава А., Мидзогучи Е., Симомура Ю., Андох А., Бхан А.К. и др. (февраль 2008 г.). «IL-22 уменьшает воспаление кишечника на мышиной модели язвенного колита» . Журнал клинических исследований . 118 (2): 534–544. дои : 10.1172/JCI33194 . ПМК 2157567 . ПМИД 18172556 .
- ^ Перейти обратно: а б Совран Б., Лунен Л.М., Лу П., Хугенхольц Ф., Белзер С., Столте Э.Х. и др. (март 2015 г.). «Путь IL-22-STAT3 играет ключевую роль в поддержании гомеостаза подвздошной кишки у мышей, у которых отсутствует секретируемый слизистый барьер» . Воспалительные заболевания кишечника . 21 (3): 531–542. дои : 10.1097/MIB.0000000000000319 . ПМИД 25636123 . S2CID 5998736 .
- ^ Андо А., Чжан З., Инатоми О., Фуджино С., Дегучи Ю., Араки Ю. и др. (сентябрь 2005 г.). «Интерлейкин-22, член подсемейства IL-10, индуцирует воспалительные реакции в субэпителиальных миофибробластах толстой кишки» . Гастроэнтерология . 129 (3): 969–984. дои : 10.1053/j.gastro.2005.06.071 . ПМИД 16143135 .
- ^ Перейти обратно: а б Лян С.К., Тан XY, Люксенберг Д.П., Карим Р., Дунусси-Джоаннопулос К., Коллинз М., Фаузер Л.А. (октябрь 2006 г.). «Интерлейкин (IL)-22 и IL-17 совместно экспрессируются клетками Th17 и совместно усиливают экспрессию антимикробных пептидов» . Журнал экспериментальной медицины . 203 (10): 2271–2279. дои : 10.1084/jem.20061308 . ПМК 2118116 . ПМИД 16982811 .
- ^ Волк К., Кунц С., Витте Э., Фридрих М., Асадулла К., Сабат Р. (август 2004 г.). «IL-22 повышает врожденный иммунитет тканей» . Иммунитет . 21 (2): 241–54. doi : 10.1016/j.immuni.2004.07.007 . ПМИД 15308104 .
- ^ Перейти обратно: а б Хепворт М.Р., Монтичелли Л.А., Фунг Т.С., Зиглер К.Г., Грюнберг С., Синха Р. и др. (июнь 2013 г.). «Врожденные лимфоидные клетки регулируют реакцию CD4+ Т-клеток на кишечные комменсальные бактерии» . Природа . 498 (7452): 113–117. Бибкод : 2013Natur.498..113H . дои : 10.1038/nature12240 . ПМЦ 3699860 . ПМИД 23698371 .
- ^ Матусевичиус Д., Кивисакк П., Хе Б., Костулас Н., Озенци В., Фредриксон С., Линк Х. (апрель 1999 г.). «Экспрессия мРНК интерлейкина-17 в мононуклеарных клетках крови и спинномозговой жидкости увеличивается при рассеянном склерозе». Рассеянный склероз (Хаундмиллс, Бейзингсток, Англия) . 5 (2): 101–4. дои : 10.1177/135245859900500206 . ПМИД 10335518 . S2CID 45449835 .
- ^ Циолковска М, Коч А, Лущикович Г, Ксезопольска-Петшак К, Климчак Е, Хвалинска-Садовска Х, Маслински В (март 2000 г.). «Высокие уровни IL-17 у пациентов с ревматоидным артритом: IL-15 запускает выработку IL-17 in vitro посредством механизма, чувствительного к циклоспорину А» . Журнал иммунологии . 164 (5): 2832–2838. дои : 10.4049/jimmunol.164.5.2832 . ПМИД 10679127 . S2CID 2861840 .
- ^ Линд К.В., Пулен Ю., Вендер Р., Бурсье М., Халил С. (июль 2014 г.). «Интерлейкин 17А: к новому пониманию патогенеза псориаза». Журнал Американской академии дерматологии . 71 (1): 141–50. дои : 10.1016/j.jaad.2013.12.036 . ПМИД 24655820 .
- ^ Фуджино С., Андо А., Бамба С., Огава А., Хата К., Араки Ю., Бамба Т., Фудзияма Ю. (январь 2003 г.). «Повышение экспрессии интерлейкина 17 при воспалительных заболеваниях кишечника» . Гут . 52 (1): 65–70. дои : 10.1136/gut.52.1.65 . ПМК 1773503 . ПМИД 12477762 .
- ^ ван де Паверт С.А., Феррейра М., Домингес Р.Г., Рибейро Х., Моленаар Р., Морейра-Сантос Л. и др. (апрель 2014 г.). «Материнские ретиноиды контролируют врожденные лимфоидные клетки 3-го типа и устанавливают иммунитет потомства» . Природа . 508 (7494): 123–127. Бибкод : 2014Natur.508..123V . дои : 10.1038/nature13158 . ПМЦ 4932833 . ПМИД 24670648 .
- ^ Хараде А., Ди Санто Дж.П., Серафини Н. (октябрь 2021 г.). «Врожденные лимфоидные клетки группы 3 опосредуют защиту хозяина от прикрепления и уничтожения патогенов» . Современное мнение в микробиологии . 63 : 83–91. дои : 10.1016/j.mib.2021.06.005 . ПМИД 34274597 .
- ^ Саес А., Гомес-Брис Р., Эрреро-Фернандес Б., Мингоранс С., Риус К., Гонсалес-Гранадо Х.М. (июль 2021 г.). «Врожденные лимфоидные клетки в кишечном гомеостазе и воспалительных заболеваниях кишечника» . Международный журнал молекулярных наук . 22 (14): 7618. doi : 10.3390/ijms22147618 . ПМЦ 8307624 . ПМИД 34299236 .
- ^ Перейти обратно: а б Буэла К.А., Оменетти С., Писарро Т.Т. (ноябрь 2015 г.). «Взаимосвязь между врожденными лимфоидными клетками 3 типа и микробиотой кишечника при воспалительных заболеваниях кишечника» . Современное мнение в гастроэнтерологии . 31 (6): 449–455. дои : 10.1097/MOG.0000000000000217 . ПМЦ 4682364 . ПМИД 26398682 .
- ^ Перейти обратно: а б с д Цзэн Б., Ши С., Эшворт Г., Донг С., Лю Дж., Син Ф. (апрель 2019 г.). «ILC3 действует как палка о двух концах при воспалительных заболеваниях кишечника» . Смерть клеток и болезни . 10 (4): 315. дои : 10.1038/s41419-019-1540-2 . ПМК 6453898 . ПМИД 30962426 .
- ^ Перейти обратно: а б Павлова А, Шарафутдинов И (сентябрь 2020 г.). «Распознавание Candida albicans и роль врожденного иммунитета 17 типа при кандидозе полости рта» . Микроорганизмы . 8 (9): 1340. doi : 10.3390/microorganisms8091340 . ПМЦ 7563233 . ПМИД 32887412 .
- ^ Ямано Т., Добеш Дж., Воборжил М., Штайнерт М., Брабец Т., Зентара Н. и др. (май 2019 г.). «Aire-экспрессирующие ILC3-подобные клетки в лимфатических узлах обладают мощными свойствами APC» . Журнал экспериментальной медицины . 216 (5): 1027–1037. дои : 10.1084/jem.20181430 . ПМК 6504225 . ПМИД 30918005 .
- ^ Перейти обратно: а б с Ардайн А., Портерфилд Дж.З., Клёверприс Х.Н., Лесли А. (2019). «ILC 3 типа при заболеваниях легких» . Границы в иммунологии . 10:92 . дои : 10.3389/fimmu.2019.00092 . ПМК 6361816 . ПМИД 30761149 .
- ^ Милькович Д., Евтич Б., Стоянович И., Димитриевич М. (2021). «ILC3, центральный компонент врожденного иммунитета оси кишечник-мозг при рассеянном склерозе» . Границы в иммунологии . 12 : 657622. дои : 10.3389/fimmu.2021.657622 . ПМК 8071931 . ПМИД 33912185 .