Т-клетка
| Т-клетка | |
|---|---|
 Анимация Т-клетки | |
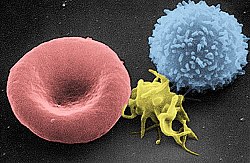 Сканирующая электронная микрофотография эритроцита ( слева), тромбоцита (в центре) и Т-лимфоцита (справа); раскрашенный | |
| Подробности | |
| Система | Иммунная система |
| Идентификаторы | |
| латинский | лимфоцит Т |
| МеШ | Д013601 |
| ТД | Х2.00.04.1.02007 |
| ФМА | 62870 |
| Анатомические термины микроанатомии | |
Т-клетки являются одним из важных типов лейкоцитов иммунной системы и играют центральную роль в адаптивном иммунном ответе . Т-клетки можно отличить от других лимфоцитов по наличию рецептора Т-клеток (TCR) на их поверхности .
Т-клетки рождаются из гемопоэтических стволовых клеток . [1] обнаружен в костном мозге . Развивающиеся Т-клетки затем мигрируют в вилочковую железу для развития (или созревания). Т-клетки получили свое название от тимуса . [2] [3] После миграции в тимус клетки-предшественники созревают в несколько различных типов Т-клеток. Дифференцировка Т-клеток продолжается и после того, как они покинули тимус. Группы специфических дифференцированных подтипов Т-клеток выполняют множество важных функций по контролю и формированию иммунного ответа .
Одной из этих функций является иммуноопосредованная гибель клеток, и она осуществляется двумя основными подтипами: CD8+ «киллерными» (цитотоксическими) и CD4+ «хелперными» Т-клетками. (Они названы в честь присутствия белков клеточной поверхности CD8 или CD4 .) CD8+ Т-клетки, также известные как «Т-клетки-киллеры», цитотоксичны – это означает, что они способны непосредственно убивать инфицированные вирусом клетки, а также раковые клетки. CD8+ Т-клетки также способны использовать небольшие сигнальные белки, известные как цитокины , для рекрутирования других типов клеток при формировании иммунного ответа. Другая популяция Т-клеток, CD4+ Т-клеток, действует как «клетки-помощники». В отличие от Т-клеток-киллеров CD8+, Т-хелперные Т-клетки CD4+ функционируют путем дальнейшей активации В-клеток памяти и цитотоксических Т-клеток, что приводит к усилению иммунного ответа. Специфический адаптивный иммунный ответ, регулируемый Т- клеткой , зависит от ее подтипа (например, Т-хелпер1, Т-хелпер2, Т-хелпер17, регуляторная Т-клетка), [4] который отличается типами секретируемых ими цитокинов. [2]
Регуляторные Т-клетки — это еще одна особая популяция Т-клеток, обеспечивающая критический механизм толерантности , посредством которого иммунные клетки способны отличать вторгающиеся клетки от «собственных». Это предотвращает неадекватную реакцию иммунных клеток против собственных клеток, известную как « аутоиммунный » ответ. По этой причине эти регуляторные Т-клетки также называют «супрессорными» Т-клетками. Эти же регуляторные Т-клетки также могут быть использованы раковыми клетками для предотвращения распознавания опухолевых клеток и иммунного ответа против них.
Разработка
[ редактировать ]Происхождение, раннее развитие и миграция в тимус.
[ редактировать ]Все Т-клетки происходят из c-kit + Ска1 + гемопоэтические стволовые клетки (ГСК), находящиеся в костном мозге. В некоторых случаях источником может быть печень плода во время эмбрионального развития . Затем HSC дифференцируются в мультипотентные предшественники (MPP), которые сохраняют потенциал стать как миелоидными , так и лимфоидными клетками . Затем процесс дифференцировки переходит к общему лимфоидному предшественнику (CLP), который может дифференцироваться только в Т-, В- или NK-клетки. [5] Эти клетки CLP затем мигрируют через кровь в тимус, где приживляются: . Отныне они известны как тимоциты , незрелая стадия Т-клетки.
Самые ранние клетки, попавшие в тимус, обычно называют дважды негативными , поскольку они не экспрессируют ни CD4 , ни CD8 корецептор . Вновь прибывшие клетки CLP представляют собой CD4. − CD8 − CD44 + CD25 − кит + клетки и называются ранними клетками-предшественниками тимуса (ETP). [6] Эти клетки затем подвергаются циклу деления и подавляют c-kit и называются клетками с двойной негативностью (DN1). Чтобы стать Т-клетками, тимоциты должны пройти несколько стадий ДН, а также положительный и отрицательный отбор.
Двойно-негативные тимоциты можно идентифицировать по поверхностной экспрессии CD2 , CD5 и CD7 . Тем не менее, во время двойной негативной стадии экспрессия CD34 прекращается и CD1 экспрессируется . Экспрессия CD4 и CD8 делает их дважды положительными и созревает в клетки CD4+ или CD8+.
разработка ТКР
[ редактировать ]Критическим шагом в созревании Т-клеток является создание функционального рецептора Т-клеток (TCR). Каждая зрелая Т-клетка в конечном итоге будет содержать уникальный TCR, который реагирует на случайный образец, позволяя иммунной системе распознавать множество различных типов патогенов . Этот процесс важен для развития иммунитета к угрозам, с которыми иммунная система раньше не сталкивалась, поскольку из-за случайных изменений всегда будет хотя бы один TCR, соответствующий любому новому патогену.
Тимоцит может стать активной Т-клеткой только тогда, когда он переживет процесс развития функционального TCR. TCR состоит из двух основных компонентов: альфа- и бета-цепей. Оба они содержат случайные элементы, предназначенные для создания самых разных TCR, но из-за такого огромного разнообразия их необходимо протестировать, чтобы убедиться, что они вообще работают. Сначала тимоциты пытаются создать функциональную бета-цепь, проверяя ее на соответствие «фиктивной» альфа-цепи. Затем они пытаются создать функциональную альфа-цепочку. После того, как рабочий TCR создан, клетки должны проверить, правильно ли их TCR идентифицирует угрозы, а для этого необходимо распознать главный комплекс гистосовместимости организма (MHC) в процессе, известном как положительный отбор. Тимоцит также должен гарантировать, что он не реагирует неблагоприятно на «собственные» антигены , что называется негативным отбором. Если как положительный, так и отрицательный отбор успешны, TCR становится полностью работоспособным, и тимоцит становится Т-клеткой.
Выбор β-цепи TCR
[ редактировать ]На стадии DN2 (CD44 + CD25 + ), клетки активируют гены рекомбинации RAG1 и RAG2 и перестраивают локус TCRβ , объединяя гены рекомбинации VDJ и гены константной области в попытке создать функциональную цепь TCRβ. По мере того, как развивающийся тимоцит достигает стадии DN3 (CD44 − CD25 + ), тимоцит экспрессирует инвариантную α-цепь, называемую пре-Tα, рядом с геном TCRβ. Если перестроенная β-цепь успешно спаривается с инвариантной α-цепью, вырабатываются сигналы, которые прекращают реаранжировку β-цепи (и заглушают альтернативный аллель). [7] Хотя эти сигналы требуют присутствия pre-TCR на поверхности клетки, они не зависят от связывания лиганда с pre-TCR. Если цепи успешно спариваются, образуется пре-TCR и клетка подавляет CD25 и называется клеткой DN4 (CD25 − CD44 − ). Затем эти клетки подвергаются циклу пролиферации и начинают перестраивать локус TCRα на стадии двойного положительного результата .
Положительный выбор
[ редактировать ]Процесс положительного отбора занимает 3–4 дня и происходит в коре тимуса. [8] Дважды положительные тимоциты (CD4 + /CD8 + ) мигрируют глубоко в кору тимуса , где презентируются аутоантигенами . Эти аутоантигены экспрессируются кортикальными эпителиальными клетками тимуса на молекулах MHC, которые находятся на поверхности кортикальных эпителиальных клеток. Только тимоциты, которые хорошо взаимодействуют с MHC-I или MHC-II, получат жизненно важный «сигнал выживания», тогда как те, которые не могут взаимодействовать достаточно сильно, не получат сигнала и погибнут из-за пренебрежения. Этот процесс гарантирует, что выжившие тимоциты будут иметь «родство к MHC», что означает, что они могут выполнять полезные функции в организме, реагируя на молекулы MHC, помогая иммунным ответам. Подавляющее большинство развивающихся тимоцитов не проходят положительный отбор и погибают во время этого процесса. [9]
Судьба тимоцита определяется в ходе положительного отбора. Двойные положительные клетки (CD4 + /CD8 + ), которые хорошо взаимодействуют с молекулами MHC класса II, в конечном итоге станут CD4. + «хелперные» клетки, тогда как тимоциты, которые хорошо взаимодействуют с молекулами MHC класса I, созревают в CD8. + «клетки-киллеры». Тимоцит становится CD4 + клетку путем подавления экспрессии ее рецепторов на клеточной поверхности CD8. Если клетка не потеряет свой сигнал, она продолжит подавлять CD8 и станет CD4. + , оба CD8 + и CD4 + клетки теперь представляют собой одиночные положительные клетки. [10]
Этот процесс не фильтрует тимоциты, которые могут вызвать аутоиммунитет . Потенциально аутоиммунные клетки удаляются с помощью следующего процесса негативной селекции, который происходит в мозговом веществе тимуса.
Отрицательный выбор
[ редактировать ]Отрицательный отбор удаляет тимоциты, способные прочно связываться с «собственными» молекулами MHC. Тимоциты, пережившие положительный отбор, мигрируют к границе коркового и мозгового вещества тимуса. Находясь в мозговом веществе, им снова представлен аутоантиген, представленный комплексом MHC медуллярных эпителиальных клеток тимуса (mTEC). [11] mTECs должны быть положительными по отношению к аутоиммунным регуляторам (AIRE + ) для правильной экспрессии аутоантигенов из всех тканей организма на их MHC класса I. пептидах Некоторые mTEC фагоцитируются дендритными клетками тимуса ; это делает их AIRE − антигенпредставляющие клетки (APC), позволяющие презентировать аутоантигены на молекулах MHC класса II (положительно отобранных CD4 + клетки должны взаимодействовать с этими молекулами MHC класса II, поэтому для CD4 должны присутствовать APC, которые обладают MHC класса II. + Т-клеточный негативный отбор). Тимоциты, которые слишком сильно взаимодействуют с аутоантигеном, получают апоптотический сигнал, который приводит к гибели клеток. Однако некоторые из этих клеток отбираются и становятся Treg -клетками. Остальные клетки покидают тимус в виде зрелых наивных Т-клеток , также известных как недавние эмигранты из тимуса. [12] Этот процесс является важным компонентом центральной толерантности и служит для предотвращения образования аутореактивных Т-клеток, способных вызывать аутоиммунные заболевания у хозяина.
Краткое описание разработки TCR
[ редактировать ]β-селекция является первой контрольной точкой, где тимоцитам, способным образовывать функциональный пре-TCR (с инвариантной альфа-цепью и функциональной бета-цепью), разрешается продолжить развитие в тимусе. Затем положительный отбор проверяет, что тимоциты успешно реаранжировали свой локус TCRα и способны распознавать молекулы MHC с соответствующим сродством. Негативный отбор в мозговом веществе затем устраняет тимоциты, которые слишком сильно связываются с аутоантигенами, экспрессируемыми на молекулах MHC. Эти процессы отбора обеспечивают толерантность иммунной системы к себе. Типичные наивные Т-клетки, покидающие тимус (через кортикомедуллярное соединение), являются самоограничивающимися, самотолерантными и единично положительными.
Тимический выход
[ редактировать ]Около 98% тимоцитов погибают во время процессов развития в тимусе из-за неудачи положительного или отрицательного отбора, тогда как остальные 2% выживают и покидают тимус, чтобы стать зрелыми иммунокомпетентными Т-клетками. [13] С возрастом тимус производит меньше клеток. Поскольку тимус сокращается примерно на 3% [14] В течение года в среднем возрасте происходит соответствующее снижение производства наивных Т-клеток в тимусе, в результате чего расширение и регенерация периферических Т-клеток играют большую роль в защите пожилых людей.
Типы Т-клеток
[ редактировать ]Т-клетки сгруппированы в ряд подмножеств в зависимости от их функции. Т-клетки CD4 и CD8 отбираются в тимусе, но подвергаются дальнейшей дифференцировке на периферии в специализированные клетки, имеющие разные функции. Подпопуляции Т-клеток изначально определялись по функциям, но также имели связанные с ними закономерности экспрессии генов или белков.
Обычные адаптивные Т-клетки
[ редактировать ]Хелперные CD4+ Т-клетки
[ редактировать ]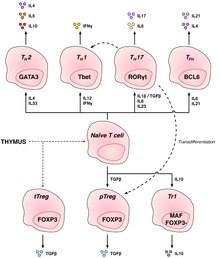
Т-хелперные клетки (Т -Н -клетки) помогают другим лимфоцитам, включая созревание В-клеток в плазматические клетки и В-клетки памяти , а также активацию цитотоксических Т-клеток и макрофагов . Эти клетки также известны как CD4. + Т-клетки , экспрессирующие гликопротеин CD4 на своей поверхности. Т-хелперы активируются, когда им презентируются пептидные антигены молекулами MHC класса II , которые экспрессируются на поверхности антигенпрезентирующих клеток (APC). После активации они быстро делятся и выделяют цитокины , которые регулируют или помогают иммунному ответу. Эти клетки могут дифференцироваться в один из нескольких подтипов, выполняющих разные роли. Цитокины направляют Т-клетки в определенные подтипы. [15]
| Тип ячейки | Цитокины производятся | Ключевой фактор транскрипции | Роль в иммунной защите | Сопутствующие заболевания |
|---|---|---|---|---|
| Th1 | ИФНγ , ИЛ-2 | Тбет | Вызывают воспалительную реакцию, которая является ключом к защите от внутриклеточных бактерий, вирусов и рака. | РС, диабет 1 типа |
| Понедельник | Ил-4, Ил-5, Ил-13 | ГАТА-3 | Иммунологически важен против внеклеточных патогенов, таких как глистные инфекции. | Астма и другие аллергические заболевания |
| Th17 | Ил-17Ф, Ил-17А, Ил-22 | РОРγt | Защита от кишечных патогенов и барьеров слизистой оболочки | рассеянный склероз, ревматоидный артрит, псориаз |
| Th9 [16] [17] | Ил-9 | ИРФ4, ПУ.1 | Защита от гельминтов (паразитических червей) и клеточно-зависимого аллергического воспаления. | Рассеянный склероз |
| Тфх | Ил-21, Ил-4 | Бкл-6 | Помогите В-клеткам вырабатывать антитела | Астма и другие аллергические заболевания |
| декабрь [18] [17] | Ил-22 | АХР | Патогенез заболеваний дыхательных путей аллергического и преимущественно противовоспалительного характера. | Болезнь Крона, ревматоидный артрит, опухоли |
Цитотоксические CD8+ Т-клетки
[ редактировать ]
Цитотоксические Т-клетки (TC - клетки, CTL, Т-киллеры, Т-киллеры) разрушают инфицированные вирусом клетки и опухолевые клетки, а также участвуют в отторжении трансплантата . Эти клетки характеризуются экспрессией белка CD8 на их клеточной поверхности. Цитотоксические Т-клетки распознают свои мишени путем связывания с короткими пептидами ( 8-11 аминокислот длиной ), связанными с молекулами MHC класса I , присутствующими на поверхности всех ядросодержащих клеток. Цитотоксические Т-клетки также продуцируют ключевые цитокины IL-2 и IFNγ. Эти цитокины влияют на эффекторные функции других клеток, в частности макрофагов и NK-клеток.
Т-клетки памяти
[ редактировать ]Антиген-наивные Т-клетки размножаются и дифференцируются в память и эффекторные Т-клетки после того, как они встречают родственный антиген в контексте молекулы MHC на поверхности профессиональной антигенпрезентирующей клетки (например, дендритной клетки). Чтобы этот процесс произошел, во время встречи с антигеном должна присутствовать соответствующая костимуляция. Исторически считалось, что Т-клетки памяти относятся либо к эффекторному, либо к центральному подтипу памяти, каждый из которых имеет свой собственный отличительный набор маркеров клеточной поверхности (см. ниже). [19] Впоследствии были обнаружены многочисленные новые популяции Т-клеток памяти, включая тканерезидентные Т-клетки памяти (Trm), стволовые клетки TSCM памяти и Т-клетки виртуальной памяти. Единственная объединяющая тема для всех подтипов Т-клеток памяти заключается в том, что они долгоживущие и могут быстро размножаться до большого количества эффекторных Т-клеток при повторном воздействии родственного им антигена. Благодаря этому механизму они обеспечивают иммунной системе «память» против ранее встречавшихся патогенов. Т-клетки памяти могут быть либо CD4 + или CD8 + и обычно экспрессируют CD45RO . [20]
Подтипы Т-клеток памяти:
- Т-клетки центральной памяти (Т- СМ- клетки) экспрессируют CD45RO, рецептор хемокинов CC типа 7 (CCR7) и L-селектин (CD62L). Т-клетки центральной памяти также имеют экспрессию CD44 от средней до высокой . Эта субпопуляция памяти обычно встречается в лимфатических узлах и периферическом кровообращении. (Примечание. Экспрессия CD44 обычно используется для того, чтобы отличить наивные мышиные Т-клетки памяти от Т-клеток памяти).
- Эффекторные Т-клетки памяти ( ТЕМ клетки и клетки ТЕМРА ) экспрессируют CD45RO, но не имеют экспрессии CCR7 и L-селектина . Они также имеют среднюю и высокую экспрессию CD44 . Эти Т-клетки памяти лишены рецепторов, ориентированных на лимфатические узлы, и поэтому обнаруживаются в периферическом кровообращении и тканях. [21] T EMRA означает терминально дифференцированные эффекторные клетки памяти, повторно экспрессирующие CD45RA, который является маркером, обычно обнаруживаемым на наивных Т-клетках. [22]
- Т-резидентные Т-клетки памяти (TRM ) занимают ткани (кожу, легкие и т. д.) без рециркуляции. Одним из маркеров клеточной поверхности, который связан с TRM , является интерн αeβ7, также известный как CD103. [23]
- Т-клетки виртуальной памяти (TVM ) отличаются от других подмножеств памяти тем, что они не возникают после сильного события клональной экспансии. Таким образом, хотя эта популяция в целом широко распространена в периферическом кровообращении, отдельные клоны Т-клеток виртуальной памяти обитают с относительно низкими частотами. Одна из теорий состоит в том, что гомеостатическая пролиферация приводит к возникновению этой популяции Т-клеток. Хотя Т-клетки виртуальной памяти CD8 были описаны первыми, [24] теперь известно, что также существуют ячейки виртуальной памяти CD4. [25]
Регуляторные CD4+ Т-клетки
[ редактировать ]Регуляторные Т-клетки имеют решающее значение для поддержания иммунологической толерантности . Их основная роль заключается в отключении Т-клеточного иммунитета к концу иммунной реакции и подавлении аутореактивных Т-клеток , которые избежали процесса негативной селекции в тимусе.
Два основных класса CD4 + Т- reg -клетки — FOXP3. Описаны + Т- рег -клетки и FOXP3 − Т- рег- клетки.
Регуляторные Т-клетки могут развиваться либо во время нормального развития в тимусе и тогда известны как Treg-клетки тимуса, либо могут индуцироваться периферически и называются Treg-клетками периферического происхождения. Эти два подмножества ранее назывались «естественными» и «адаптивными» (или «индуцированными») соответственно. [26] Обе подгруппы требуют экспрессии фактора транскрипции FOXP3 , который можно использовать для идентификации клеток. Мутации гена FOXP3 могут предотвратить развитие регуляторных Т-клеток, вызывая смертельное аутоиммунное заболевание IPEX .
Некоторые другие типы Т-клеток обладают супрессивной активностью, но не экспрессируют FOXP3 конститутивно. К ним относятся клетки Tr1 и Th3 , которые, как полагают, возникают во время иммунного ответа и действуют путем производства подавляющих молекул. Клетки Tr1 связаны с IL-10, а клетки Th3 — с TGF-бета . Недавно клетки Th17 . к этому списку добавились [27]
Врожденные Т-клетки
[ редактировать ]Врожденные Т-клетки или нетрадиционные Т-клетки представляют собой некоторые подмножества Т-клеток, которые по-разному ведут себя в иммунитете. Они вызывают быстрые иммунные ответы, независимо от экспрессии главного комплекса гистосовместимости (MHC), в отличие от своих обычных аналогов (Т-хелперных клеток CD4 и цитотоксических Т-клеток CD8), которые зависят от распознавания пептидных антигенов в контексте молекулы MHC. В целом существует три большие популяции нетрадиционных Т-клеток: NKT-клетки, MAIT-клетки и гамма-дельта-Т-клетки. Теперь их функциональные роли уже хорошо известны в контексте инфекций и рака. [28] Более того, эти субпопуляции Т-клеток используются во многих методах лечения злокачественных новообразований, таких как, например, лейкемия. [29]
Естественные Т-клетки-киллеры
[ редактировать ]Естественные Т-клетки-киллеры (NKT-клетки – не путать с естественными киллерными клетками врожденной иммунной системы) соединяют адаптивную иммунную систему с врожденной иммунной системой . В отличие от обычных Т-клеток, которые распознают белково-пептидные антигены, представленные молекулами главного комплекса гистосовместимости (MHC), NKT-клетки распознают гликолипидные антигены, представленные CD1d . После активации эти клетки могут выполнять функции, приписываемые как хелперным, так и цитотоксическим Т-клеткам: выработка цитокинов и высвобождение цитолитических/клеточных молекул. Они также способны распознавать и уничтожать некоторые опухолевые клетки и клетки, зараженные вирусами герпеса. [30]
Инвариантные Т-клетки, ассоциированные со слизистой оболочкой
[ редактировать ]Связанные со слизистой оболочкой инвариантные Т-клетки (MAIT) обладают врожденными эффекторными свойствами. [31] [32] У людей клетки MAIT обнаруживаются в крови, печени, легких и слизистой оболочке , защищая от микробной активности и инфекций. [31] , Белок MHC класса I MR1 , отвечает за представление продуцируемых бактериями метаболитов витамина B клеткам MAIT. [33] [34] [35] После презентации чужеродного антигена с помощью MR1 клетки MAIT секретируют провоспалительные цитокины и способны лизировать бактериально инфицированные клетки. [31] [35] Клетки MAIT также могут быть активированы посредством независимой от MR1 передачи сигналов. [35] В дополнение к функциям, подобным врожденным, эта подгруппа Т-клеток поддерживает адаптивный иммунный ответ и имеет фенотип, подобный памяти. [31] Кроме того, считается, что клетки MAIT играют роль в аутоиммунных заболеваниях , таких как рассеянный склероз , артрит и воспалительные заболевания кишечника . [36] [37] хотя окончательные доказательства еще не опубликованы. [38] [39] [40] [41]
Гамма-дельта Т-клетки
[ редактировать ]Гамма-дельта-Т-клетки (γδ-Т-клетки) представляют собой небольшую подгруппу Т-клеток, которые обладают TCR γδ, а не αβ TCR на поверхности клетки. Большинство Т-клеток экспрессируют цепи αβ TCR. Эта группа Т-клеток гораздо реже встречается у людей и мышей (около 2% от общего числа Т-клеток) и обнаруживается в основном в слизистой оболочке кишечника , в популяции интраэпителиальных лимфоцитов . У кроликов, овец и кур количество γδ Т-клеток может достигать 60% от общего числа Т-клеток. Антигенные молекулы, активирующие γδ Т-клетки, до сих пор по большей части неизвестны. Однако γδ Т-клетки не ограничены MHC и, по-видимому, способны распознавать целые белки, а не требуют, чтобы пептиды были представлены молекулами MHC на APC . Некоторые мышиные γδ Т-клетки распознают молекулы MHC класса IB. Т-клетки γδ человека, которые используют фрагменты генов Vγ9 и Vδ2, составляют основную популяцию γδ-Т-клеток в периферической крови. Эти клетки уникальны тем, что они специфически и быстро реагируют на набор непептидных фосфорилированных предшественников изопреноидов , под общим названием фосфоантигены , которые продуцируются практически всеми живыми клетками. Наиболее распространенными фосфоантигенами клеток животных и человека (включая раковые клетки) являются изопентенилпирофосфат (IPP) и его изомер диметилаллилпирофосфат (DMPP). производят активное соединение гидрокси-DMAPP ( HMB-PP Многие микробы , помимо IPP и DMAPP, ) и соответствующие мононуклеотидные конъюгаты. Растительные клетки продуцируют оба типа фосфоантигенов. Лекарства, активирующие Т-клетки Vγ9/Vδ2 человека, включают синтетические фосфоантигены и аминобисфосфонаты , которые активируют эндогенный IPP/DMAPP.
Активация
[ редактировать ]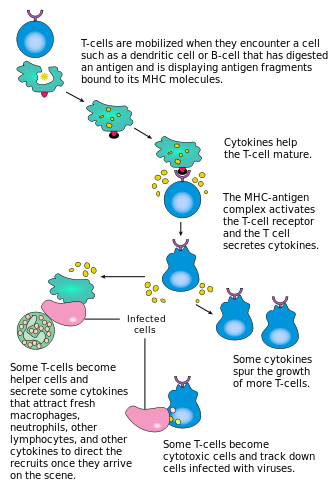
Активация CD4 + Т-клетки происходят за счет одновременного взаимодействия рецептора Т-клеток и костимулирующей молекулы (например, CD28 или ICOS главного комплекса гистосовместимости (MHCII) ) на Т-клетке с помощью пептида и костимулирующих молекул на APC . Оба необходимы для создания эффективного иммунного ответа; в отсутствие совместной стимуляции передача сигналов Т-клеточным рецептором сама по себе приводит к анергии . Сигнальные пути, расположенные ниже костимулирующих молекул, обычно включают путь PI3K , генерирующий PIP3 на плазматической мембране и рекрутирующий домен PH, содержащий сигнальные молекулы, такие как PDK1 , которые необходимы для активации PKC-θ и возможной IL-2 продукции . Оптимальный CD8 + Ответ Т-клеток зависит от CD4 + сигнализация. [43] CD4 + клетки полезны для начальной антигенной активации наивных CD8 Т-клеток и поддержания памяти CD8. + Т-клетки после острой инфекции. Следовательно, активация CD4 + Т-клетки могут быть полезны для действия CD8 + Т-клетки. [44] [45] [46]
Первый сигнал обеспечивается связыванием рецептора Т-клеток с родственным ему пептидом, представленным на MHCII на APC. MHCII ограничен так называемыми профессиональными антигенпрезентирующими клетками , такими как дендритные клетки, B-клетки и макрофаги, и это лишь некоторые из них. Пептиды, представленные CD8 + Т-клетки молекул MHC класса I имеют длину 8–13 аминокислот; пептиды, представленные CD4 + клетки по молекулам MHC класса II длиннее, обычно 12–25 аминокислот в длину, [47] поскольку концы связывающей щели молекулы MHC класса II открыты.
Второй сигнал исходит от костимуляции, при которой поверхностные рецепторы АПК индуцируются относительно небольшим количеством стимулов, обычно продуктов патогенов, но иногда и продуктов распада клеток, таких как некротические тельца или белки теплового шока . Единственным костимулирующим рецептором, конститутивно экспрессируемым наивными Т-клетками, является CD28, поэтому костимуляция этих клеток происходит от белков CD80 и CD86 , которые вместе составляют белок B7 (B7.1 и B7.2 соответственно) на БТР. Другие рецепторы экспрессируются при активации Т-клетки, такие как OX40 и ICOS, но их экспрессия во многом зависит от CD28. Второй сигнал разрешает Т-клетке реагировать на антиген. Без него Т-клетка становится анергической , и ей становится труднее активироваться в будущем. Этот механизм предотвращает неадекватные реакции на себя, поскольку аутопептиды обычно не подвергаются подходящей совместной стимуляции. Как только Т-клетка была соответствующим образом активирована (т.е. получила сигнал один и сигнал два), она изменяет экспрессию на своей клеточной поверхности различных белков. Маркеры активации Т-клеток включают CD69, CD71 и CD25 (также маркер Treg-клеток) и HLA-DR (маркер активации Т-клеток человека). Экспрессия CTLA-4 также усиливается на активированных Т-клетках, которые, в свою очередь, конкурируют с CD28 за связывание с белками B7. Это механизм контрольной точки, предотвращающий чрезмерную активацию Т-клеток. Активированные Т-клетки также меняют профиль гликозилирования клеточной поверхности. [48]
Рецептор Т-клеток существует в виде комплекса нескольких белков. Фактический рецептор Т-клеток состоит из двух отдельных пептидных цепей, которые производятся независимыми генами альфа- и бета-рецепторов Т-клеток ( TCRα и TCRβ ). Другими белками в комплексе являются белки CD3 : гетеродимеры CD3εγ и CD3εδ и, что наиболее важно, гомодимер CD3ζ, который имеет в общей сложности шесть ITAM мотивов . Мотивы ITAM на CD3ζ могут фосфорилироваться с помощью Lck и, в свою очередь, рекрутировать ZAP-70 . Lck и/или ZAP-70 также могут фосфорилировать тирозины многих других молекул, не в последнюю очередь CD28, LAT и SLP-76 , что позволяет агрегировать сигнальные комплексы вокруг этих белков.
Фосфорилированный LAT рекрутирует SLP-76 на мембрану, где он затем может приносить PLC-γ , VAV1 , Itk и потенциально PI3K . PLC-γ расщепляет PI(4,5)P2 на внутреннем листке мембраны с образованием активных посредников диацилглицерина ( DAG ), инозитол-1,4,5-трифосфата ( IP3 ); PI3K также действует на PIP2, фосфорилируя его с образованием фосфатидлиинозитол-3,4,5-трифосфата (PIP3). DAG связывает и активирует некоторые PKC. Наиболее важной в Т-клетках является PKC-θ, имеющая решающее значение для активации факторов транскрипции NF-κB и AP-1. IP3 высвобождается из мембраны с помощью PLC-γ и быстро диффундирует, активируя рецепторы кальциевых каналов в ЭР , что индуцирует высвобождение кальция в цитозоль. Низкий уровень кальция в эндоплазматическом ретикулуме вызывает кластеризацию STIM1 на мембране ЭР и приводит к активации каналов CRAC клеточной мембраны, что позволяет дополнительному кальцию поступать в цитозоль из внеклеточного пространства. Этот агрегированный цитозольный кальций связывает кальмодулин, который затем может активировать кальциневрин . Кальцинеурин, в свою очередь, активирует NFAT , который затем транслоцируется в ядро. NFAT является фактором транскрипции , который активирует транскрипцию плейотропного набора генов, наиболее примечательным из которых является IL-2, цитокин, который способствует долгосрочной пролиферации активированных Т-клеток.
PLC-γ также может инициировать путь NF-κB . DAG активирует PKC-θ, которая затем фосфорилирует CARMA1, заставляя ее разворачиваться и функционировать как каркас. Цитозольные домены связывают адаптер BCL10 через CARD домены (домены активации и рекрутирования каспаз); который затем связывает TRAF6, который убиквитинирован по адресу K63. : 513–523 [49] Эта форма убиквитинирования не приводит к деградации белков-мишеней. Скорее, он служит для рекрутирования NEMO, IKKα и -β, а также TAB1-2/TAK1. [50] ТАК 1 фосфорилирует IKK-β, который затем фосфорилирует IκB, обеспечивая убиквитинирование K48: приводит к протеасомной деградации. Затем Rel A и p50 могут проникнуть в ядро и связать ответный элемент NF-κB. Это в сочетании с передачей сигналов NFAT позволяет полностью активировать ген IL-2. [49]
Хотя в большинстве случаев активация зависит от распознавания антигена TCR, были описаны альтернативные пути активации. Например, было показано, что цитотоксические Т-клетки активируются при воздействии на них других Т-клеток CD8, что приводит к толеризации последних. [51]
Весной 2014 года был запущен эксперимент «Активация Т-клеток в космосе » (TCAS) на Международной космической станции в рамках миссии SpaceX CRS-3 для изучения того, как «недостатки иммунной системы человека зависят от микрогравитации». [52]
Активация Т-клеток модулируется активными формами кислорода . [53]
Дискриминация антигенов
[ редактировать ]Уникальной особенностью Т-клеток является их способность различать здоровые и аномальные (например, инфицированные или раковые) клетки в организме. [54] Здоровые клетки обычно экспрессируют большое количество собственных pMHC на своей клеточной поверхности, и хотя рецептор антигена Т-клеток может взаимодействовать, по крайней мере, с подмножеством этих собственных pMHC, Т-клетки обычно игнорируют эти здоровые клетки. Однако, когда эти самые клетки содержат даже незначительное количество pMHC, полученного из патогена, Т-клетки способны активироваться и инициировать иммунные ответы. Способность Т-клеток игнорировать здоровые клетки, но реагировать, когда эти же самые клетки содержат pMHC, полученный из патогена (или рака), известна как дискриминация антигена. Молекулярные механизмы, лежащие в основе этого процесса, являются спорными. [54] [55]
Клиническое значение
[ редактировать ]Дефицит
[ редактировать ]
Причины дефицита Т-клеток включают лимфоцитопению Т-клеток и/или дефекты функции отдельных Т-клеток. Полная недостаточность функции Т-клеток может быть результатом наследственных заболеваний, таких как тяжелый комбинированный иммунодефицит (ТКИД), синдром Оменна и гипоплазия хрящевых волос . [56] Причины частичной недостаточности функции Т-клеток включают синдром приобретенного иммунодефицита (СПИД) и наследственные состояния, такие как синдром ДиДжорджа (DGS), синдромы хромосомных поломок (CBS), а также комбинированные заболевания В-клеток и Т-клеток, такие как атаксия-телеангиэктазия (АТ). ) и синдром Вискотта-Олдрича (WAS). [56]
Основными патогенами, вызывающими озабоченность при дефиците Т-клеток, являются внутриклеточные патогены , включая вирус простого герпеса , микобактерии и листерии . [57] Кроме того, грибковые инфекции также более распространены и тяжелы при дефиците Т-клеток. [57]
Рак
[ редактировать ]Рак Т-клеток называется Т-клеточной лимфомой и составляет примерно один из десяти случаев неходжкинской лимфомы . [58] Основными формами Т-клеточной лимфомы являются:
- Экстранодальная Т-клеточная лимфома
- Кожные Т-клеточные лимфомы : синдром Сезари и грибовидный микоз.
- Анапластическая крупноклеточная лимфома
- Ангиоиммунобластная Т-клеточная лимфома
Утомление
[ редактировать ]Было предложено разделить этот раздел на другую статью под названием «Истощение Т-клеток» . ( Обсудить ) (май 2023 г.) |
Истощение Т-клеток — плохо определенный или неоднозначный термин. [59] [60] Существует три подхода к его определению. [59] «Первый подход в первую очередь определяет как истощенные клетки, которые демонстрируют одну и ту же клеточную дисфункцию (как правило, отсутствие ожидаемого эффекторного ответа). Второй подход в первую очередь определяет как истощенные клетки, которые производятся по определенной причине (обычно, но не обязательно). Наконец, третий подход в первую очередь определяет как истощенные клетки, которые имеют одни и те же молекулярные маркеры (обычно белок запрограммированной гибели клеток 1 [PD-1])». [59]
Дисфункциональные Т-клетки характеризуются прогрессирующей потерей функции, изменениями профилей транскрипции и устойчивой экспрессией ингибирующих рецепторов. Сначала клетки теряют способность продуцировать IL-2 и TNFα , что сопровождается потерей высокой пролиферативной способности и цитотоксического потенциала и в конечном итоге приводит к их делеции. Истощение Т-клеток обычно указывает на более высокие уровни CD43 , CD69 и ингибирующих рецепторов в сочетании с более низкой экспрессией CD62L и CD127 . Истощение может развиться при хронических инфекциях, сепсисе и раке. [61] Истощенные Т-клетки сохраняют свое функциональное истощение даже после повторного воздействия антигена. [62]
При хронической инфекции и сепсисе
[ редактировать ]Истощение Т-клеток может быть вызвано несколькими факторами, такими как постоянное воздействие антигена и отсутствие помощи Т-клеток CD4. [63] Воздействие антигена также влияет на течение истощения, поскольку более длительное время воздействия и более высокая вирусная нагрузка увеличивают тяжесть истощения Т-клеток. Для установления истощения требуется не менее 2–4 недель воздействия. [64] Другим фактором, способным вызвать истощение, являются ингибирующие рецепторы, в том числе белок 1 запрограммированной гибели клеток (PD1), CTLA-4 , белок 3 Т-клеточной мембраны (TIM3) и белок гена активации лимфоцитов 3 (LAG3). [65] [66] Растворимые молекулы, такие как цитокины IL-10 или TGF-β, также способны вызывать истощение. [67] [68] Последними известными факторами, которые могут играть роль в истощении Т-клеток, являются регуляторные клетки. Treg- клетки могут быть источником IL-10 и TGF-β и, следовательно, могут играть роль в истощении Т-клеток. [69] Более того, истощение Т-клеток возвращается после истощения Treg-клеток и блокады PD1. [70] Истощение Т-клеток также может возникнуть во время сепсиса в результате цитокинового шторма. Позже, после первоначального заражения, противовоспалительные цитокины и проапоптотические белки начинают защищать организм от повреждений. Сепсис также несет в себе высокую антигенную нагрузку и воспаление. На этой стадии сепсиса истощение Т-клеток увеличивается. [71] [72] В настоящее время проводятся исследования, направленные на использование блокады ингибирующих рецепторов при лечении сепсиса. [73] [74] [75]
Во время трансплантации
[ редактировать ]В то время как во время инфекции истощение Т-клеток может развиться после постоянного воздействия антигена после трансплантации трансплантата, аналогичная ситуация возникает и с присутствием аллоантигена. [76] Было показано, что реакция Т-клеток снижается со временем после трансплантации почки. [77] Эти данные позволяют предположить, что истощение Т-клеток играет важную роль в толерантности трансплантата, главным образом, за счет истощения аллореактивных Т-клеток CD8. [72] [78] Несколько исследований показали положительное влияние хронической инфекции на приживление трансплантата и его долгосрочную выживаемость, частично опосредованное истощением Т-клеток. [79] [80] [81] Было также показано, что истощение Т-клеток реципиента обеспечивает достаточные условия для переноса NK-клеток . [82] Хотя есть данные, показывающие, что индукция истощения Т-клеток может быть полезна для трансплантации, она также несет в себе недостатки, среди которых можно назвать увеличение количества инфекций и риск развития опухоли. [83]
Во время рака
[ редактировать ]Во время рака истощение Т-клеток играет роль в защите опухоли. Согласно исследованиям, некоторые рак-ассоциированные клетки, а также сами опухолевые клетки могут активно вызывать истощение Т-клеток в месте опухоли. [84] [85] [86] Истощение Т-клеток также может играть роль в рецидивах рака, как это было показано на примере лейкемии. [87] Некоторые исследования показали, что можно предсказать рецидив лейкемии на основе экспрессии Т-клетками ингибирующих рецепторов PD-1 и TIM-3. [88] Многие эксперименты и клинические испытания были сосредоточены на блокаторах иммунных контрольных точек в терапии рака, причем некоторые из них были одобрены как эффективные методы лечения и в настоящее время используются в клинической практике. [89] Ингибирующие рецепторы, на которые нацелены эти медицинские процедуры, жизненно важны при истощении Т-клеток, и их блокирование может обратить вспять эти изменения. [90]
См. также
[ редактировать ]- Т-клетка химерного антигенного рецептора
- Домой, специфичный для кишечника
- Иммунобласт
- Иммуностарение
- Парафолликулярная клетка, также называемая С-клеткой.
Ссылки
[ редактировать ]- ^ «5. Гематопоэтические стволовые клетки» . Информация о стволовых клетках . Бетесда, доктор медицинских наук: Национальные институты здравоохранения Министерства здравоохранения и социальных служб США. 17 июня 2001 г. Архивировано из оригинала 29 октября 2016 г. Проверено 21 декабря 2021 г.
- ^ Перейти обратно: а б Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Т-хелперы и активация лимфоцитов» . Молекулярная биология клетки (4-е изд.). Гирляндная наука.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Т-хелперы и активация лимфоцитов» . Молекулярная биология клетки (4-е изд.). Гирляндная наука. п. 1367.
Т-клетки... получили свое [название] от органов, в которых они развиваются. Т-клетки развиваются [созревают] в тимусе
- ^ Лакхирам Р.В., Чжоу Р., Верма А.Д., Ся Б (2012). «CD4⁺T-клетки: дифференцировка и функции» . Клиническая и развивающая иммунология . 2012 : 925135. doi : 10.1155/2012/925135 . ПМЦ 3312336 . ПМИД 22474485 .
- ^ Кондо М (декабрь 2016 г.). «Одна ниша для управления как сохранением, так и потерей стволовости HSC» . Иммунитет . 45 (6): 1177–1179. doi : 10.1016/j.immuni.2016.12.003 . ПМИД 28002722 .
- ^ Осборн Л.К., Дханджи С., Сноу Дж.В., Приатель Дж.Дж., Ма М.К., Майнерс М.Дж. и др. (март 2007 г.). «Нарушение памяти Т-клеток CD8 и первичные реакции Т-клеток CD4 у мышей с мутацией IL-7R альфа» . Журнал экспериментальной медицины . 204 (3): 619–631. дои : 10.1084/jem.20061871 . ПМК 2137912 . ПМИД 17325202 .
- ^ Мерфи, Кеннет (2011). Иммунобиология Джейнвей (8-е изд.). Гирляндная наука. стр. 301–305. ISBN 9780815342434 .
- ^ Росс Дж.О., Меличар Х.Дж., Ау-Юнг Б.Б., Херцмарк П., Вайс А., Роби Э.А. (июнь 2014 г.). «Отличные фазы положительной селекции CD8+ Т-клеток, отличающиеся внутритимической миграцией и паттернами передачи сигналов рецепторов Т-клеток» . Труды Национальной академии наук Соединенных Штатов Америки . 111 (25): Е2550–Е2558. Бибкод : 2014PNAS..111E2550R . дои : 10.1073/pnas.1408482111 . ПМЦ 4078834 . ПМИД 24927565 .
- ^ Старр Т.К., Джеймсон СК, Хогквист К.А. (1 января 2003 г.). «Положительный и отрицательный отбор Т-клеток». Ежегодный обзор иммунологии . 21 (1): 139–176. doi : 10.1146/annurev.immunol.21.120601.141107 . ПМИД 12414722 .
- ^ Зерран Дж., Хелд В., Раулет Д.Х. (март 1997 г.). «Реактивность MHC репертуара Т-клеток до положительного и отрицательного отбора» . Клетка . 88 (5): 627–636. дои : 10.1016/S0092-8674(00)81905-4 . ПМИД 9054502 . S2CID 15983629 .
- ^ Хинтербергер М., Айхингер М., Празерес да Коста О., Ферингер Д., Хоффманн Р., Кляйн Л. (июнь 2010 г.). «Автономная роль медуллярных эпителиальных клеток тимуса в центральной толерантности Т-клеток CD4 (+)» (PDF) . Природная иммунология . 11 (6): 512–519. дои : 10.1038/ni.1874 . ПМИД 20431619 . S2CID 33154019 .
- ^ Пекальски М.Л., Гарсия А.Р., Феррейра Р.К., Рэйнбоу Д.Б., Смит DJ, Машар М., Брэйди Дж., Савиных Н., Допико XC, Махмуд С., Дули С., Стивенс Х.Э., Уокер Н.М., Катлер А.Дж., Уолдрон-Линч Ф., Дангер Д.Б., Шеннон-Лоу С., Коулз А.Дж., Джонс Дж.Л., Уоллес С., Тодд Дж.А., Уикер Л.С. (август 2017 г.). «Недавние эмигранты из тимуса у новорожденных и взрослых продуцируют IL-8 и экспрессируют рецепторы комплемента CR1 и CR2» . JCI-инсайт . 2 (16). doi : 10.1172/jci.insight.93739 . ПМК 5621870 . ПМИД 28814669 .
- ^ Мерфи, Кеннет (2011). Иммунобиология Джейнвей (8-е изд.). Гирляндная наука. п. 297. ИСБН 9780815342434 .
- ^ Хейнс Б.Ф., Маркерт М.Л., Семповски Г.Д., Патель Д.Д., Хейл Л.П. (2000). «Роль тимуса в восстановлении иммунитета при старении, трансплантации костного мозга и инфекции ВИЧ-1». Анну. Преподобный Иммунол . 18 : 529–560. doi : 10.1146/annurev.immunol.18.1.529 . ПМИД 10837068 .
- ^ Гатчер И, Бехер Б (2007). «Цитокины, производные APC, и поляризация Т-клеток при аутоиммунном воспалении» . Дж. Клин. Инвестируйте . 117 (5): 1119–27. дои : 10.1172/JCI31720 . ПМЦ 1857272 . ПМИД 17476341 .
- ^ Ван В., Сунг Н., Гилман-Сакс А., Квак-Ким Дж. (18 августа 2020 г.). «Профили Т-хелперов (Th) клеток при беременности и привычных потерях беременности: клетки Th1/Th2/Th9/Th17/Th22/Tfh» . Границы в иммунологии . 11 : 2025. дои : 10.3389/fimmu.2020.02025 . ПМЦ 7461801 . ПМИД 32973809 .
- ^ Перейти обратно: а б Саравиа Дж., Чепмен Н.М., Чи Х. (июль 2019 г.). «Дифференцировка Т-хелперов» . Клеточная и молекулярная иммунология . 16 (7): 634–643. дои : 10.1038/s41423-019-0220-6 . ПМК 6804569 . ПМИД 30867582 .
- ^ Цзя Л, Ву Ц (2014). «Биология и функции клеток Th22». Дифференцировка Т-хелперов и их функции . Достижения экспериментальной медицины и биологии. Том. 841. стр. 209–230. дои : 10.1007/978-94-017-9487-9_8 . ISBN 978-94-017-9486-2 . ПМИД 25261209 .
- ^ Саллусто Ф., Лениг Д., Фёрстер Р., Липп М., Ланзавеккья А. (1999). «Два подмножества Т-лимфоцитов памяти с различными потенциалами самонаведения и эффекторными функциями». Природа . 401 (6754): 708–712. Бибкод : 1999Natur.401..708S . дои : 10.1038/44385 . ПМИД 10537110 . S2CID 4378970 .
- ^ Акбар А.Н., Терри Л., Тиммс А., Беверли ПК, Яносси Г. (апрель 1988 г.). «Потеря CD45R и усиление реактивности UCHL1 является особенностью примированных Т-клеток» . Дж. Иммунол . 140 (7): 2171–8. дои : 10.4049/jimmunol.140.7.2171 . ПМИД 2965180 . S2CID 22340282 .
- ^ Виллинджер Т., Фриман Т., Хасегава Х., МакМайкл А.Дж., Каллан М.Ф. (2005). «Молекулярные сигнатуры отличают центральную память человека от подмножеств CD8 Т-клеток эффекторной памяти» (PDF) . Журнал иммунологии . 175 (9): 5895–903. дои : 10.4049/jimmunol.175.9.5895 . ПМИД 16237082 . S2CID 16412760 .
- ^ Кох С., Ларби А., Дерхованессян Е., Озчелик Д., Наумова Е., Павелец Г. (2008). «Многопараметрический проточный цитометрический анализ подпопуляций Т-клеток CD4 и CD8 у молодых и пожилых людей» . Иммунитет и старение . 5 (6): 6. дои : 10.1186/1742-4933-5-6 . ПМК 2515281 . ПМИД 18657274 .
- ^ Шин Х, Ивасаки А (сентябрь 2013 г.). «Тканерезидентные Т-клетки памяти» . Иммунологические обзоры . 255 (1): 165–81. дои : 10.1111/imr.12087 . ПМЦ 3748618 . ПМИД 23947354 .
- ^ Ли Ю.Дж., Джеймсон СК, Хогквист К.А. (2011). «Альтернативная память в линии CD8 Т-клеток» . Тенденции в иммунологии . 32 (2): 50–56. дои : 10.1016/j.it.2010.12.004 . ПМК 3039080 . ПМИД 21288770 .
- ^ Марусина А.И., Оно Ю., Мерлеев А.А., Симода М., Огава Х., Ван Э.А., Кондо К., Олни Л., Люксарди Г., Миямура Ю., Йилма Т.Д., Вильялобос И.Б., Бергстрем Дж.В., Кроненберг Д.Г., Сулика А.М., Адамопулос И.Е., Маверакис Э. (2017). «Виртуальная память CD4 +: Т-клетки, не обладающие антигеном, находятся в компартментах наивных, регуляторных и Т-клеток памяти с одинаковой частотой, что имеет значение для аутоиммунитета» . Журнал аутоиммунитета . 77 : 76–88. дои : 10.1016/j.jaut.2016.11.001 . ПМК 6066671 . ПМИД 27894837 .
- ^ Аббас А.К., Бенуа С., Блюстоун Дж.А., Кэмпбелл Д.Д., Гош С., Хори С., Цзян С., Кухру В.К., Матис Д., Ронкароло М.Г., Руденски А., Сакагучи С., Шевач Э.М., Виньяли Д.А., Циглер С.Ф. (2013). «Регуляторные Т-клетки: рекомендации по упрощению номенклатуры» . Нат. Иммунол . 14 (4): 307–8. дои : 10.1038/день.2554 . ПМИД 23507634 . S2CID 11294516 .
- ^ Сингх Б., Шварц Дж.А., Сэндрок С., Беллемор С.М., Никопур Э. (2013). «Модуляция аутоиммунных заболеваний с помощью интерлейкина (IL)-17, продуцирующего регуляторные Т-хелперные клетки (Th17)» . Индийский Дж. Мед. Рез . 138 (5): 591–4. ПМЦ 3928692 . ПМИД 24434314 .
- ^ Годфри Д.И., Ульдрих А.П., Маккласки Дж., Россджон Дж., Муди Д.Б. (ноябрь 2015 г.). «Растущее семейство нетрадиционных Т-клеток». Природная иммунология . 16 (11): 1114–1123. дои : 10.1038/ni.3298 . ПМИД 26482978 . S2CID 30992456 .
- ^ де Араужо Н.Д., Гама Ф.М., де Соуза Баррос М., Рибейру Т.Л., Алвес Ф.С., Хабрегас Л.А. и др. (2021). «Перевод нетрадиционных Т-клеток и их роль в противоопухолевом иммунитете при лейкемии» . Журнал иммунологических исследований . 2021 : 6633824. doi : 10.1155/2021/6633824 . ПМЦ 7808823 . ПМИД 33506055 .
- ^ Маллевей Т., Фонтейн Дж., Брой Л., Пейджет С., Кастро-Келлер А., Вендевиль С., Капрон М., Лейте-де-Мораес М., Троттен Ф., Фавеу К. (май 2007 г.). «Инвариантные и неинвариантные естественные Т-киллеры Т-клетки оказывают противоположные регуляторные функции на иммунный ответ при шистосомозе мышей» . Инфекция и иммунитет . 75 (5): 2171–80. дои : 10.1128/IAI.01178-06 . ПМЦ 1865739 . ПМИД 17353286 .
- ^ Перейти обратно: а б с д Нэпьер Р.Дж., Адамс Э.Дж., Голд MC, Левинсон DM (06.07.2015). «Роль инвариантных Т-клеток, ассоциированных со слизистой оболочкой, в антимикробном иммунитете» . Границы в иммунологии . 6 : 344. дои : 10.3389/fimmu.2015.00344 . ПМЦ 4492155 . ПМИД 26217338 .
- ^ Gold MC, Lewinson DM (август 2011 г.). «Инвариантные Т-клетки, ассоциированные со слизистой оболочкой, и иммунный ответ на инфекцию» . Микробы и инфекции . 13 (8–9): 742–8. дои : 10.1016/j.micinf.2011.03.007 . ПМК 3130845 . ПМИД 21458588 .
- ^ Экл С.Б., Корбетт А.Дж., Келлер А.Н., Чен З., Годфри Д.И., Лю Л., Мак Дж.Ю., Фэрли Д.П., Россджон Дж., МакКласки Дж. (декабрь 2015 г.). «Распознавание предшественников и побочных продуктов витамина B инвариантными Т-клетками, ассоциированными со слизистой оболочкой» . Журнал биологической химии . 290 (51): 30204–11. дои : 10.1074/jbc.R115.685990 . ПМЦ 4683245 . ПМИД 26468291 .
- ^ Ашер Дж. Э., Кленерман П., Уиллберг CB (08 октября 2014 г.). «Инвариантные Т-клетки, ассоциированные со слизистой оболочкой: новые игроки в антибактериальном иммунитете» . Границы в иммунологии . 5 : 450. дои : 10.3389/fimmu.2014.00450 . ПМК 4189401 . ПМИД 25339949 .
- ^ Перейти обратно: а б с Хаусон Л.Дж., Салио М., Серундоло В. (16 июня 2015 г.). «MR1-ограниченные инвариантные Т-клетки, ассоциированные со слизистой оболочкой, и их активация во время инфекционных заболеваний» . Границы в иммунологии . 6 : 303. дои : 10.3389/fimmu.2015.00303 . ПМЦ 4468870 . ПМИД 26136743 .
- ^ Хинкс Т.С. (май 2016 г.). «Инвариантные Т-клетки, ассоциированные со слизистой оболочкой, при аутоиммунитете, иммуноопосредованных заболеваниях и заболеваниях дыхательных путей» . Иммунология . 148 (1): 1–12. дои : 10.1111/imm.12582 . ПМЦ 4819138 . ПМИД 26778581 .
- ^ Бьянкини Э., Де Биази С., Симона А.М., Ферраро Д., Сола П., Коссарицца А., Пинти М. (март 2017 г.). «Инвариантные естественные Т-киллеры Т-клетки и инвариантные Т-клетки, связанные со слизистой оболочкой, при рассеянном склерозе». Письма по иммунологии . 183 : 1–7. дои : 10.1016/j.imlet.2017.01.009 . ПМИД 28119072 .
- ^ Серриари Н.Е., Эоч М., Ламотт Л., Лайон Дж., Фюмери М., Марсело П., Шателен Д., Барре А., Нгуен-Хак Е., Ланц О., Дюпас Дж.Л., Трейнер Э. (май 2014 г.). «Врожденные инвариантные Т-клетки, ассоциированные со слизистой оболочкой (MAIT), активируются при воспалительных заболеваниях кишечника» . Клиническая и экспериментальная иммунология . 176 (2): 266–74. дои : 10.1111/cei.12277 . ПМЦ 3992039 . ПМИД 24450998 .
- ^ Хуанг С., Мартин Э., Ким С., Ю Л., Судайс С., Фремонт Д.Х., Ланц О., Хансен Т.Х. (май 2009 г.). «Презентация антигена MR1 инвариантным Т-клеткам, ассоциированным со слизистой оболочкой, была высококонсервативной в эволюции» . Труды Национальной академии наук Соединенных Штатов Америки . 106 (20): 8290–5. Бибкод : 2009PNAS..106.8290H . дои : 10.1073/pnas.0903196106 . ПМЦ 2688861 . ПМИД 19416870 .
- ^ Чуа В.Дж., Хансен Т.Д. (ноябрь 2010 г.). «Бактерии, инвариантные Т-клетки, ассоциированные со слизистой оболочкой, и MR1» . Иммунология и клеточная биология . 88 (8): 767–9. дои : 10.1038/icb.2010.104 . ПМИД 20733595 . S2CID 27717815 .
- ^ Кьер-Нильсен Л., Патель О., Корбетт А.Дж., Ле Нурс Дж., Михан Б., Лю Л., Бхати М., Чен З., Костенко Л., Реантрагун Р., Уильямсон Н.А., Перселл А.В., Дудек Н.Л., МакКонвилл М.Дж., О'Хэйр Р.А., Хайраллах Г.Н., Годфри Д.И., Фэрли Д.П., Россджон Дж., Маккласки Дж. (ноябрь 2012 г.). «MR1 представляет микробные метаболиты витамина B клеткам MAIT» (PDF) . Природа . 491 (7426): 717–23. Бибкод : 2012Natur.491..717K . дои : 10.1038/nature11605 . ПМИД 23051753 . S2CID 4419703 .
- ^ « NIAID Справочный буклет Понимание иммунной системы (pdf)» .
- ^ Уильямс М.А., Беван М.Дж. (1 января 2007 г.). «Дифференциация эффекторных и CTL памяти». Ежегодный обзор иммунологии . 25 (1): 171–92. doi : 10.1146/annurev.immunol.25.022106.141548 . ПМИД 17129182 .
- ^ Янссен Э.М., Лемменс Э.Э., Вулф Т., Кристен У., фон Херрат М.Г., Шёнбергер С.П. (февраль 2003 г.). «CD4+ Т-клетки необходимы для вторичной экспансии и памяти в CD8+ Т-лимфоцитах». Природа . 421 (6925): 852–6. Бибкод : 2003Natur.421..852J . дои : 10.1038/nature01441 . ПМИД 12594515 . S2CID 574770 .
- ^ Шедлок-ди-джей, Шен Х (апрель 2003 г.). «Потребность в помощи Т-клеток CD4 в создании функциональной памяти Т-клеток CD8». Наука . 300 (5617): 337–9. Бибкод : 2003Sci...300..337S . дои : 10.1126/science.1082305 . ПМИД 12690201 . S2CID 38040377 .
- ^ Сан Дж.К., Уильямс М.А., Беван М.Дж. (сентябрь 2004 г.). «CD4+ Т-клетки необходимы для поддержания, а не программирования CD8+ Т-клеток памяти после острой инфекции» . Природная иммунология . 5 (9): 927–33. дои : 10.1038/ni1105 . ПМК 2776074 . ПМИД 15300249 .
- ^ Дженнифер Ролланд и Робин О'Хехир, «Выключение Т-клеток: пептиды для лечения аллергических заболеваний», Today's Life Science Publishing, 1999, стр. 32
- ^ Маверакис Э., Ким К., Шимода М., Гершвин М., Патель Ф., Уилкен Р., Райчаудхури С., Рухаак Л.Р., Лебрилла CB (2015). «Гликаны в иммунной системе и теория аутоиммунитета с измененными гликанами» . Дж. Аутоиммун . 57 (6): 1–13. дои : 10.1016/j.jaut.2014.12.002 . ПМЦ 4340844 . ПМИД 25578468 .
- ^ Перейти обратно: а б Тэтхэм П., Гомпертс Б.Д., Крамер И.М. (2003). Трансдукция сигнала . Амстердам: Elsevier Academic Press. ISBN 978-0-12-289632-3 .
- ^ Ву Х, Аррон-младший (ноябрь 2003 г.). «TRAF6, молекулярный мост, соединяющий адаптивный иммунитет, врожденный иммунитет и остеоиммунологию». Биоэссе . 25 (11): 1096–105. дои : 10.1002/bies.10352 . ПМИД 14579250 . S2CID 28521713 .
- ^ Мильштейн О., Хейгин Д., Ласк А., Райх-Целигер С., Шезен Е., Офир Е., Эйдельштейн Ю., Афик Р., Антеби Ю.Е., Дастин М.Л., Райснер Ю. (январь 2011 г.). «ЦТЛ реагируют активацией и секрецией гранул, когда служат мишенями для распознавания Т-клеток» . Кровь . 117 (3): 1042–52. doi : 10.1182/blood-2010-05-283770 . ПМК 3035066 . ПМИД 21045195 .
- ^ Грэм В. (14 апреля 2014 г.). «SpaceX готова к запуску CRS-3 Dragon и новым вехам» . NASAspaceflight.com . Проверено 14 апреля 2014 г.
- ^ Беликов А.В., Шравен Б., Симеони Л. (октябрь 2015 г.). «Т-клетки и активные формы кислорода» . Журнал биомедицинской науки . 22:85 . дои : 10.1186/s12929-015-0194-3 . ПМК 4608155 . ПМИД 26471060 .
- ^ Перейти обратно: а б Файнерман О, Жермен РН, Альтан-Бонне Г (2008). «Количественные проблемы в понимании дискриминации лигандов Т-клетками алфавита» . Мол. Иммунол . 45 (3): 619–31. дои : 10.1016/j.molimm.2007.03.028 . ПМК 2131735 . ПМИД 17825415 .
- ^ Душек О., ван дер Мерве П.А. (2014). «Модель индуцированного повторного связывания дискриминации антигенов» . Тенденции Иммунол . 35 (4): 153–8. дои : 10.1016/j.it.2014.02.002 . ПМЦ 3989030 . ПМИД 24636916 .
- ^ Перейти обратно: а б Заболевания Т-клеток в электронной медицине
- ^ Перейти обратно: а б Джонс Дж., Баннистер Б.А., Гиллеспи С.Х., ред. (2006). Инфекция: микробиология и управление . Уайли-Блэквелл. п. 435. ИСБН 978-1-4051-2665-6 .
- ^ «Лимфомы» (PDF) . Общество лейкемии и лимфомы. Май 2006. с. 2 . Проверено 7 апреля 2008 г.
- ^ Перейти обратно: а б с Камински Х., Лемуан М., Праде Т. (сентябрь 2021 г.). «Иммунологическое истощение: как воплотить в жизнь разрозненную концепцию?» . ПЛОС Патогены . 17 (9): e1009892. дои : 10.1371/journal.ppat.1009892 . ПМЦ 8460019 . ПМИД 34555119 .
- ^ Бланк КУ, Хейнинг В.Н., Хелд В., Хоган П.Г., Каллис А., Лугли Э. и др. (ноябрь 2019 г.). «Определение «истощения Т-клеток» » . Обзоры природы. Иммунология . 19 (11): 665–674. дои : 10.1038/s41577-019-0221-9 . ПМЦ 7286441 . ПМИД 31570879 .
- ^ Йи Дж.С., Кокс М.А., Заджак А.Дж. (апрель 2010 г.). «Истощение Т-клеток: характеристики, причины и преобразование» . Иммунология . 129 (4): 474–81. дои : 10.1111/j.1365-2567.2010.03255.x . ПМЦ 2842494 . ПМИД 20201977 .
- ^ Ван Ц, Пан В, Лю И, Луо Дж, Чжу Д, Лу Ю, Фэн Икс, Ян Икс, Диттмер Ю, Лу М, Ян Д, Лю Дж (2018). «Специфические к вирусу гепатита B CD8+ Т-клетки поддерживают функциональное истощение после повторного воздействия антигена в условиях острой активации иммунной среды» . Фронт Иммунол . 9 : 219. дои : 10.3389/fimmu.2018.00219 . ПМК 5816053 . ПМИД 29483916 .
- ^ Матлубиан М., Консепсьон Р.Дж., Ахмед Р. (декабрь 1994 г.). «CD4+ Т-клетки необходимы для поддержания CD8+ цитотоксических Т-клеточных ответов во время хронической вирусной инфекции» . Журнал вирусологии . 68 (12): 8056–63. doi : 10.1128/JVI.68.12.8056-8063.1994 . ПМК 237269 . ПМИД 7966595 .
- ^ Ангелосанто Дж. М., Блэкберн С.Д., Кроуфорд А., Верри Э.Дж. (август 2012 г.). «Прогрессирующая потеря потенциала Т-клеток памяти и склонность к истощению во время хронической вирусной инфекции» . Журнал вирусологии . 86 (15): 8161–70. дои : 10.1128/JVI.00889-12 . ПМК 3421680 . ПМИД 22623779 .
- ^ Уэрри Э.Дж. (июнь 2011 г.). «Т-клеточное истощение». Природная иммунология . 12 (6): 492–9. дои : 10.1038/ni.2035 . ПМИД 21739672 . S2CID 11052693 .
- ^ Окагава Т., Коннаи С., Нишимори А., Маекава Н., Гото С., Икебути Р., Кохара Дж., Сузуки Ю., Ямада С., Като Ю., Мурата С., Охаси К. (июнь 2018 г.). «+ Т-клетки при заражении вирусом лейкоза крупного рогатого скота» . Ветеринарное исследование . 49 (1):50.doi 10.1186 : /s13567-018-0543-9 . ПМК 6006750 . ПМИД 29914540 .
- ^ Брукс Д.Г., Трифило М.Дж., Эдельманн К.Х., Тейтон Л., Макгаверн Д.Б., Олдстоун М.Б. (ноябрь 2006 г.). «Интерлейкин-10 определяет клиренс или персистенцию вируса in vivo» . Природная медицина . 12 (11): 1301–9. дои : 10.1038/nm1492 . ПМЦ 2535582 . ПМИД 17041596 .
- ^ Тиноко Р., Алькальде В., Ян Й., Зауэр К., Зунига Э.И. (июль 2009 г.). «Внутренняя передача сигналов трансформирующего фактора роста бета опосредует вирусспецифическую делецию CD8+ Т-клеток и персистенцию вируса in vivo» . Иммунитет . 31 (1): 145–57. doi : 10.1016/j.immuni.2009.06.015 . ПМК 3039716 . ПМИД 19604493 .
- ^ Вейга-Парга Т., Сехрават С., Роуз Б.Т. (сентябрь 2013 г.). «Роль регуляторных Т-клеток при вирусной инфекции» . Иммунологические обзоры . 255 (1): 182–96. дои : 10.1111/imr.12085 . ПМЦ 3748387 . ПМИД 23947355 .
- ^ Пеналоза-МакМастер П., Камфорст А.О., Виланд А., Араки К., Айер С.С., Вест Э.Э., О'Мара Л., Янг С., Конечны Б.Т., Шарп А.Х., Фриман Г.Дж., Руденский А.Ю., Ахмед Р. (август 2014 г.). «Взаимодействие между регуляторными Т-клетками и PD-1 в модуляции истощения Т-клеток и вирусном контроле во время хронической инфекции LCMV» . Журнал экспериментальной медицины . 211 (9): 1905–18. дои : 10.1084/jem.20132577 . ПМК 4144726 . ПМИД 25113973 .
- ^ Отто Г.П., Соссдорф М., Клаус Р.А., Рёдель Дж., Менге К., Рейнхарт К., Бауэр М., Ридеманн Н.К. (июль 2011 г.). «Поздняя фаза сепсиса характеризуется повышенной микробиологической нагрузкой и смертностью» . Критическая помощь . 15 (4): 183 р. дои : 10.1186/cc10332 . ПМЦ 3387626 . ПМИД 21798063 .
- ^ Перейти обратно: а б Бумер Дж.С., То К., Чанг К.С., Такасу О., Осборн Д.Ф., Уолтон А.Х., Брикер Т.Л., Джарман С.Д., Крейзель Д., Крупник А.С., Шривастава А., Суонсон П.Е., Грин Дж.М., Хотчкисс Р.С. (декабрь 2011 г.). «Иммуносупрессия у пациентов, умерших от сепсиса и полиорганной недостаточности» . ДЖАМА . 306 (23): 2594–605. дои : 10.1001/jama.2011.1829 . ПМЦ 3361243 . ПМИД 22187279 .
- ^ Шиндо Ю., Макдонаф Дж.С., Чанг К.С., Рамачандра М., Сасикумар П.Г., Хотчкисс Р.С. (февраль 2017 г.). «Пептид анти-PD-L1 улучшает выживаемость при сепсисе» . Журнал хирургических исследований . 208 : 33–39. дои : 10.1016/j.jss.2016.08.099 . ПМК 5535083 . ПМИД 27993215 .
- ^ Патера А.С., Дрюри А.М., Чанг К., Бейтер Э.Р., Осборн Д., Хотчкисс Р.С. (декабрь 2016 г.). «Передовая наука: Дефекты иммунной функции у пациентов с сепсисом связаны с экспрессией PD-1 или PD-L1 и могут быть восстановлены антителами, нацеленными на PD-1 или PD-L1» . Журнал биологии лейкоцитов . 100 (6): 1239–1254. дои : 10.1189/jlb.4hi0616-255r . ПМК 5110001 . ПМИД 27671246 .
- ^ Вэй З, Ли П, Яо Ю, Дэн Х, И С, Чжан С, У Х, Се Х, Ся М, Хэ Р, Ян ХР, Тан ЧЖ (июль 2018 г.). «Альфа-лактоза устраняет повреждение печени посредством блокады Тим-3-опосредованного апоптоза CD8 при сепсисе». Клиническая иммунология . 192 : 78–84. дои : 10.1016/j.clim.2018.04.010 . ПМИД 29689313 . S2CID 21657071 .
- ^ Уэллс А.Д., Ли XC, Стром Т.Б., Турка Л.А. (май 2001 г.). «Роль делеции периферических Т-клеток в толерантности к трансплантации» . Философские труды Лондонского королевского общества. Серия Б, Биологические науки . 356 (1409): 617–23. дои : 10.1098/rstb.2001.0845 . ПМЦ 1088449 . ПМИД 11375065 .
- ^ Халлоран П.Ф., Чанг Дж., Фамульски К., Идальго Л.Г., Салазар И.Д., Мерино Лопес М., Матас А., Пиктон М., де Фрейтас Д., Бромберг Дж., Серон Д., Селларес Дж., Эйнеке Г., Рив Дж. (июль 2015 г.). «Исчезновение Т-клеточного отторжения, несмотря на продолжающееся антитело-опосредованное отторжение у реципиентов поздней трансплантации почки» . Журнал Американского общества нефрологов . 26 (7): 1711–20. дои : 10.1681/ASN.2014060588 . ПМЦ 4483591 . ПМИД 25377077 .
- ^ Стегер У., Денеке С., Савицки Б., Карим М., Джонс Н.Д., Вуд К.Дж. (май 2008 г.). «Исчерпывающая дифференциация аллореактивных CD8+ Т-клеток: имеет решающее значение для определения принятия или отторжения трансплантата» (PDF) . Трансплантация . 85 (9): 1339–47. дои : 10.1097/TP.0b013e31816dd64a . ПМИД 18475193 . S2CID 33409478 .
- ^ де Маре-Бредемайер Э.Л., Ши XL, Манчам С., ван Гент Р., ван дер Хайде-Малдер М., де Бур Р., Хемскерк М.Х., де Йонге Дж., ван дер Лаан Л.Дж., Метселаар Х.Дж., Квеккебум Дж. (август 2015 г.). «Индуцированная цитомегаловирусом экспрессия CD244 после трансплантации печени связана с гипочувствительностью CD8+ Т-клеток к аллоантигену» . Журнал иммунологии . 195 (4): 1838–48. doi : 10.4049/jimmunol.1500440 . ПМИД 26170387 .
- ^ Гасса А., Цзян Ф., Калкаван Х., Духан В., Хонке Н., Шаабани Н., Фридрих С.К., Дольф С., Валерс Т., Криббен А., Хардт С., Ланг П.А., Витцке О., Ланг К.С. (2016). «IL-10 вызывает истощение Т-клеток во время трансплантации сердца, инфицированного вирусом» . Клеточная физиология и биохимия . 38 (3): 1171–81. дои : 10.1159/000443067 . ПМИД 26963287 .
- ^ Ши XL, де Маре-Бредемайер Э.Л., Тапирдамаз О., Хансен Б.Е., ван Гент Р., ван Кампенхаут М.Дж., Манчам С., Литженс Н.Х., Бетджес М.Г., ван дер Эйк А.А., Ся К., ван дер Лаан Л.Дж., де Йонге Дж., Метселаар HJ, Квеккебум Дж. (сентябрь 2015 г.). «Первичная ЦМВ-инфекция связана с донорско-специфической гипореактивностью Т-клеток и меньшим количеством поздних острых отторжений после трансплантации печени» . Американский журнал трансплантологии . 15 (9): 2431–42. дои : 10.1111/ajt.13288 . ПМИД 25943855 . S2CID 5348557 .
- ^ Уильямс Р.Л., Кули С., Бачанова В., Блазар Б.Р., Вайсдорф Д.Д., Миллер Дж.С., Вернерис М.Р. (март 2018 г.). «Истощение Т-клеток-реципиентов и успешный адоптивный перенос гаплоидентичных естественных клеток-киллеров» . Биология трансплантации крови и костного мозга . 24 (3): 618–622. дои : 10.1016/j.bbmt.2017.11.022 . ПМЦ 5826878 . ПМИД 29197679 .
- ^ Ву С.Р., Тернис М.Э., Голдберг М.В., Банкоти Дж., Селби М., Ниршль С.Дж., Беттини М.Л., Гравано Д.М., Фогель П., Лю К.Л., Тангсомбатвизит С., Гроссо Дж.Ф., Нетто Дж., Смельцер М.П., Шо А., Утц П.Дж., Уоркман С.Дж. , Пардолл Д.М., Корман А.Дж., Дрейк К.Г., Виньяли Д.А. (февраль 2012 г.). «Иммунно-ингибирующие молекулы LAG-3 и PD-1 синергически регулируют функцию Т-клеток, способствуя ускользанию опухолевого иммунитета» . Исследования рака . 72 (4): 917–27. дои : 10.1158/0008-5472.CAN-11-1620 . ПМК 3288154 . ПМИД 22186141 .
- ^ Целле-Ризер С., Тангавадивель С., Бидерманн Р., Бруннер А., Стоицнер П., Вилленбахер Е. и др. (ноябрь 2016 г.). «Т-клетки при множественной миеломе демонстрируют признаки истощения и старения в месте опухоли» . Журнал гематологии и онкологии . 9 (1): 116. дои : 10.1186/s13045-016-0345-3 . ПМК 5093947 . ПМИД 27809856 .
- ^ Лакинс М.А., Горани Э., Мунир Х., Мартинс К.П., Шилдс Дж.Д. (март 2018 г.). «Связанные с раком фибробласты индуцируют антигенспецифическую делецию CD8. + Т-клетки для защиты опухолевых клеток» . Nature Communications . 9 (1): 948. Bibcode : 2018NatCo...9..948L . doi : /s41467-018-03347-0 . PMC 5838096. 10.1038 PMID 29507342 .
- ^ Конфорти Л (февраль 2012 г.). «Сеть ионных каналов в Т-лимфоцитах, мишень для иммунотерапии». Клиническая иммунология . 142 (2): 105–106. дои : 10.1016/j.clim.2011.11.009 . ПМИД 22189042 .
- ^ Лю Л., Чанг Ю.Дж., Сюй Л.П., Чжан С.Х., Ван Ю., Лю К.Ю., Хуан XJ. (май 2018 г.). «Истощение Т-клеток, характеризующееся нарушением цитотоксической активности MHC класса I и II, связано с рецидивом острого B-лимфобластного лейкоза после аллогенной трансплантации гемопоэтических стволовых клеток». Клиническая иммунология . 190 : 32–40. дои : 10.1016/j.clim.2018.02.009 . ПМИД 29477343 .
- ^ Конг Ю., Чжан Дж., Клэкстон Д.Ф., Эманн В.К., Рыбка В.Б., Чжу Л. и др. (июль 2015 г.). «Т-клетки PD-1(hi)TIM-3(+) ассоциированы и предсказывают рецидив лейкемии у пациентов с ОМЛ после аллогенной трансплантации стволовых клеток» . Журнал рака крови . 5 (7): е330. дои : 10.1038/bcj.2015.58 . ПМК 4526784 . ПМИД 26230954 .
- ^ «Ингибиторы иммунных контрольных точек и иммунотерапия, одобренные FDA США» . Агентство медицинских писателей | 香港醫學作家 | МедиПР | MediPaper Гонконг . 21 августа 2018 г. Проверено 22 сентября 2018 г.
- ^ Бхадра Р., Гигли Дж. П., Вайс Л. М., Хан И. А. (май 2011 г.). «Контроль реактивации токсоплазмы путем спасения дисфункционального ответа CD8+ Т-клеток посредством блокады PD-1-PDL-1» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (22): 9196–9201. Бибкод : 2011PNAS..108.9196B . дои : 10.1073/pnas.1015298108 . ПМК 3107287 . ПМИД 21576466 .
Дальнейшее чтение
[ редактировать ]- Джейнвей-младший, Калифорния, Трэверс П., Уолпорт М., Шломчик М.Дж. (2001). Иммунобиология 5: иммунная система в здоровье и болезни (5-е изд.). Нью-Йорк: Garland Science. ISBN 978-0-8153-3642-6 .
- «Иммунная система» (PDF) . Национальный институт аллергии и инфекционных заболеваний . Сентябрь 2003 г. Архивировано из оригинала (PDF) 25 июня 2009 г.