Т-клетка памяти
Т-клетки памяти представляют собой подмножество Т-лимфоцитов , которые могут выполнять некоторые из тех же функций, что и В-клетки памяти . Их происхождение неясно.
Функция
[ редактировать ]Антиген -специфические Т-клетки памяти, специфичные к вирусам или другим микробным молекулам, могут быть обнаружены как в центральных Т-клеток памяти (T CM ) , так и в эффекторных Т-клетках памяти (T EM ) подгруппах . Хотя большая часть информации в настоящее время основана на наблюдениях за субпопуляцией цитотоксических Т-клеток ( CD8 -положительных), схожие популяции, по-видимому, существуют как для Т-хелперов ( CD4 -положительных), так и для цитотоксических Т-клеток. Основная функция клеток памяти — усиление иммунного ответа после реактивации этих клеток путем повторного введения соответствующего патогена в организм. Важно отметить, что эта область интенсивно изучается, и некоторая информация может быть еще недоступна.
- Т-клетки центральной памяти (TCM ) : лимфоциты TCM имеют несколько общих свойств со стволовыми клетками, наиболее важным из которых является способность к самообновлению, главным образом из-за высокого уровня фосфорилирования ключевого фактора транскрипции STAT5 . Было доказано, что у мышей T CM обеспечивает более мощный иммунитет против вирусов. [1] бактерии [1] и раковые клетки, [2] по сравнению с ТЕМ - лимфоцитами в нескольких экспериментальных моделях.
- Эффекторные Т-клетки памяти (ТЕМ ) : лимфоциты ТЕМ и ТЕМРА в первую очередь активны как варианты CD8 и, таким образом, несут основную ответственность за цитотоксическое действие против патогенов. [3]
- Т-клетки резидентной памяти (TRM ) . Поскольку лимфоциты TRM присутствуют в течение длительного периода времени в тканях или, что более важно, в барьерных тканях (например, в эпителии), они имеют решающее значение для быстрого реагирования на нарушение барьера и реакции на любое присутствует соответствующий возбудитель. Одним из механизмов, используемых TRM для ограничения патогенов, является секреция гранзима B. [4] [5]
- Т-клетки памяти, подобные стволовым клеткам (T SCM ) : эти лимфоциты способны к самообновлению, как и лимфоциты T CM , а также способны генерировать субпопуляции как T CM , так и T EM . [6] Присутствие этой популяции у людей в настоящее время исследуется.
- Т-клетка виртуальной памяти (TVM ) . На данный момент единственной функцией, наблюдаемой в TVM - клетках, является выработка различных цитокинов, [7] [8] но есть предположения об их влиянии на подавление нежелательных иммунологических состояний и их использовании при лечении аутоиммунных заболеваний. [9]
Гомеостатическое поддержание
[ редактировать ]Клоны Т-клеток памяти, экспрессирующие специфический рецептор Т-клеток, могут сохраняться в нашем организме десятилетиями. Поскольку Т-клетки памяти имеют более короткий период полураспада, чем наивные Т-клетки, в процессе поддержания, вероятно, участвуют непрерывная репликация и замена старых клеток. [3] В настоящее время механизм поддержания Т-клеток памяти до конца не изучен. Активация через рецептор Т-клеток может играть роль. [3] Обнаружено, что Т-клетки памяти могут иногда реагировать на новые антигены, что потенциально вызвано внутренним разнообразием и широтой мишеней связывания рецепторов Т-клеток. [3] Эти Т-клетки могут перекрестно реагировать на антигены окружающей среды или резидентные антигены в нашем организме (например, на бактерии в кишечнике) и размножаться. Эти события помогут сохранить популяцию Т-клеток памяти. [3] Механизм перекрестной реактивности может быть важен для Т-клеток памяти в тканях слизистой оболочки, поскольку эти участки имеют более высокую плотность антигена. [3] Для тех, кто находится в крови, костном мозге, лимфоидных тканях и селезенке, передача сигналов гомеостатических цитокинов (включая IL-17 и IL-15 ) или главного комплекса гистосовместимости II (MHCII) может быть более важной. [3]
Обзор срока службы
[ редактировать ]Т-клетки памяти претерпевают разные изменения и играют разные роли на разных этапах жизни человека. При рождении и раннем детстве Т-клетки периферической крови в основном представляют собой наивные Т-клетки. [10] В результате частого воздействия антигена популяция Т-клеток памяти накапливается. Это стадия формирования памяти, которая длится от рождения примерно до 20–25 лет, когда наша иммунная система сталкивается с наибольшим количеством новых антигенов. [3] [10] На следующем этапе гомеостаза памяти количество Т-клеток памяти стабилизируется и стабилизируется за счет поддержания гомеостаза. [10] На этом этапе иммунный ответ больше смещается в сторону поддержания гомеостаза, поскольку новых антигенов встречается мало. [10] На этом этапе также становится важным наблюдение за опухолями. [10] На более поздних этапах жизни, примерно в 65–70 лет, наступает стадия иммуностарения , на которой наблюдаются стадии иммунной дисрегуляции, снижение функции Т-клеток и повышенная восприимчивость к патогенам. [3] [10]
Дебаты о происхождении
[ редактировать ]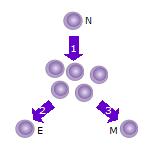
- После того, как наивная Т-клетка (N) встречает антиген, она активируется и начинает пролиферировать ( делиться ) на множество клонов или дочерних клеток.
- Некоторые из клонов Т-клеток дифференцируются в эффекторные Т-клетки (Е), которые будут выполнять функцию этой клетки (например, продуцировать цитокины в случае Т-хелперных клеток или вызывать уничтожение клеток в случае цитотоксических Т-клеток ).
- Некоторые из клеток образуют Т-клетки памяти (М), которые будут выживать в неактивном состоянии в организме хозяина в течение длительного периода времени, пока они повторно не встретят тот же антиген и не реактивируются.
По состоянию на апрель 2020 года родственные связи между эффекторными Т-клетками и Т-клетками памяти неясны. [11] [12] [13] Существуют две конкурирующие модели. Одна из них называется моделью «Вкл-Выкл-Вкл». [12] Когда наивные Т-клетки активируются посредством связывания Т-клеточного рецептора (TCR) с антигеном и его нижестоящим сигнальным путем, они активно пролиферируют и образуют большой клон эффекторных клеток. Эффекторные клетки подвергаются активной секреции цитокинов и другим эффекторным действиям. [11] После клиренса антигена некоторые из этих эффекторных клеток образуют Т-клетки памяти либо случайным образом, либо выбраны на основе их превосходной специфичности. [11] Эти клетки перейдут от активной эффекторной роли к состоянию, более похожему на состояние наивных Т-клеток, и снова «включатся» при следующем воздействии антигена. [13] Эта модель предсказывает, что эффекторные Т-клетки могут переходить в Т-клетки памяти и выживать, сохраняя способность к пролиферации. [11] Это также предсказывает, что определенные профили экспрессии генов будут следовать схеме «включено-выключено» на стадиях наивности, эффектора и памяти. [13] Доказательства, подтверждающие эту модель, включают обнаружение генов, связанных с выживанием и хомингом, которые следуют схеме экспрессии «вкл-выкл-вкл», включая рецептор интерлейкина-7 альфа (IL-7Rα), Bcl-2, CD26L и другие. [13]

В этой модели Т-клетки памяти генерируют эффекторные Т-клетки, а не наоборот.
Другая модель — это модель дифференциации развития. [12] Эта модель утверждает, что эффекторные клетки, продуцируемые высокоактивированными наивными Т-клетками, будут подвергаться апоптозу после клиренса антигена. [11] Вместо этого Т-клетки памяти производятся наивными Т-клетками, которые активируются, но никогда не вступают в полную силу в эффекторную стадию. [11] Потомство Т-клеток памяти не активируется полностью, поскольку они не так специфичны к антигену, как расширяющиеся эффекторные Т-клетки. Исследования, изучающие историю деления клеток, показали, что длина теломер и активность теломеразы были уменьшены в эффекторных Т-клетках по сравнению с Т-клетками памяти, что позволяет предположить, что Т-клетки памяти не подвергаются такому же интенсивному клеточному делению, как эффекторные Т-клетки, что несовместимо с модель «Вкл-Выкл-Вкл». [11] Повторяющаяся или хроническая антигенная стимуляция Т-клеток, например, ВИЧ-инфекция , может вызывать повышение эффекторных функций, но ухудшать память. [12] Было также обнаружено, что массово пролиферирующие Т-клетки с большей вероятностью образуют короткоживущие эффекторные клетки, тогда как минимально пролиферирующие Т-клетки образуют более долгоживущие клетки. [11]
Эпигенетические модификации
[ редактировать ]Эпигенетические модификации участвуют в переходе от наивных Т-клеток. [14] Например, в CD4 + Т-клетки памяти, положительные модификации гистонов отмечают ключевые гены цитокинов , активация которых активируется во время вторичного иммунного ответа, включая IFNγ , IL4 и IL17A . [14] Некоторые из этих модификаций сохраняются после удаления антигена, создавая эпигенетическую память, которая обеспечивает более быструю активацию при повторной встрече с антигеном. [14] Для CD8 + Т-клетки памяти, некоторые эффекторные гены, такие как IFNγ , не будут экспрессироваться, но они транскрипционно готовы к быстрой экспрессии при активации. [14] Кроме того, усиление экспрессии определенных генов также зависит от силы начальной передачи сигналов TCR для потомства Т-клеток памяти, что коррелирует с активацией регуляторного элемента, которая напрямую изменяет уровень экспрессии генов. [14]
Подгруппы населения
[ редактировать ]Исторически считалось, что Т-клетки памяти принадлежат либо к эффекторным (ТЕМ - клетки), либо к подтипам центральной памяти (Т- СМ- клетки), каждый из которых имеет свой собственный отличительный набор маркеров клеточной поверхности (см. ниже). [15] Впоследствии были обнаружены многочисленные дополнительные популяции Т-клеток памяти, включая тканерезидентные Т-клетки памяти (TRM ) , стволовые Т-клетки памяти SCM и Т-клетки виртуальной памяти . Единственная объединяющая тема для всех подтипов Т-клеток памяти заключается в том, что они долгоживущие и могут быстро размножаться до большого количества эффекторных Т-клеток при повторном воздействии родственного им антигена. Благодаря этому механизму они обеспечивают иммунной системе «память» против ранее встречавшихся патогенов. Т-клетки памяти могут быть либо CD4 + или CD8 + и обычно экспрессируют CD45RO и в то же время лишены CD45RA. [16]
Подтипы Т-клеток памяти
[ редактировать ]- Т-клетки центральной памяти (Т- СМ- клетки) экспрессируют CD45RO, рецептор хемокинов CC типа 7 (CCR7) и L-селектин (CD62L). Т-клетки центральной памяти также имеют среднюю или высокую экспрессию CD44 . Эта субпопуляция памяти обычно встречается в лимфатических узлах и периферическом кровообращении.
- Эффекторные Т-клетки памяти (ТЕМ - клетки) экспрессируют CD45RO, но не имеют экспрессии CCR7 и L-селектина . Они также имеют среднюю и высокую экспрессию CD44 . Поскольку у этих Т-клеток памяти отсутствуют рецепторы CCR7, направляющие лимфатические узлы, они обнаруживаются в периферическом кровообращении и тканях. [17] T EMRA означает терминально дифференцированные эффекторные клетки памяти, повторно экспрессирующие CD45RA, который является маркером, обычно обнаруживаемым на наивных Т-клетках. [18]
- Подтип Т-клеток периферической памяти (Т- РМ- клеток) был идентифицирован на основании промежуточной экспрессии CX3CR1. Эти клетки могут мигрировать в ткани из крови и перемещаться в лимфатические узлы CD62L-независимым образом для исследования тканей. [19]
- Т-резидентные Т-клетки памяти (TRM ) занимают ткани (кожу, легкие, желудочно-кишечный тракт и т. д.) без рециркуляции. Некоторыми маркерами клеточной поверхности, которые связаны с TRM , являются CD69 и интегрин αeβ7 (CD103). [20] Однако стоит отметить, что клетки Т -РМ, обнаруженные в разных тканях, экспрессируют разные наборы маркеров клеточной поверхности. [20] В то время как CD103+ TRM - клетки ограниченно локализуются в эпителиальных и нейрональных тканях, TRM - клетки, локализованные в слюнных железах, поджелудочной железе и женских репродуктивных путях у мышей, не экспрессируют ни CD69, ни CD103. [20] [21] Т- РМ- клетки играют важную роль в защитном иммунитете против патогенов. Считается, что [5] [22] Исследования также показали двойную роль клеток T RM в защите и регуляции. [10] По сравнению с клетками TEM , клетки TRM секретируют более высокие уровни цитокинов, связанных с защитным иммунитетом, и экспрессируют более низкие уровни маркера пролиферации Ki67. [10] Было высказано предположение, что эти характеристики могут помочь в долгосрочном поддержании клеток T RM , а также в поддержании баланса между быстрым ответом на инвазию антигена и предотвращением ненужного повреждения тканей. [10] Дисфункциональные клетки TRM вовлечены в аутоиммунные заболевания, такие как псориаз , ревматоидный артрит и воспалительные заболевания кишечника . [22] Специфическими для Т -РМ- лимфоцитов являются гены, участвующие в метаболизме липидов , обладающие высокой активностью, примерно в 20–30 раз более активные, чем в других типах Т-клеток. [22]
- Т-клетки виртуальной памяти (TVM ) отличаются от других подмножеств памяти тем, что они не возникают после сильного события клональной экспансии. Таким образом, хотя эта популяция в целом широко распространена в периферическом кровообращении, отдельные клоны Т-клеток виртуальной памяти обитают с относительно низкими частотами. Одна из теорий состоит в том, что гомеостатическая пролиферация приводит к возникновению этой популяции Т-клеток. Хотя Т-клетки виртуальной памяти CD8 были описаны первыми, [23] теперь известно, что также существуют ячейки виртуальной памяти CD4. [24]
Было предложено множество других субпопуляций Т-клеток памяти. Исследователи изучили клетки стволовой памяти Т- СКМ- . Подобно наивным Т-клеткам, Т- СКМ- клетки представляют собой CD45RO-, CCR7 +, CD45RA+, CD62L+ ( L-селектин ), CD27+, CD28+ и IL-7Rα+, но они также экспрессируют большие количества CD95, IL-2Rβ, CXCR3 и LFA-1 и демонстрируют многочисленные функциональные признаки, характерные для клеток памяти. [6]
TCR-независимая (свидетельная) активация
[ редактировать ]Т-клетки обладают способностью активироваться независимо от стимуляции их родственным антигеном, т.е. без стимуляции TCR. На ранних стадиях инфекции Т-клетки, специфичные к несвязанному антигену, активируются только при наличии воспаления. Это происходит в воспалительной среде, возникающей в результате микробной инфекции, рака или аутоиммунитета как у мышей, так и у людей, и происходит локально, а также систематически. [25] [26] [27] [28] [29] . Более того, активированные «свидетелем» Т-клетки могут мигрировать к месту инфекции из-за повышенной экспрессии CCR5 . [26]
Этот феномен наблюдался преимущественно в CD8+ Т-клетках памяти, которые имеют меньшую чувствительность к цитокиновой стимуляции по сравнению с их наивными аналогами и легче активируются таким образом. [25] CD8+ Т-клетки виртуальной памяти также демонстрируют повышенную чувствительность к активации, индуцированной цитокинами, на моделях мышей, но это не было непосредственно продемонстрировано на людях. [26] И наоборот, TCR-независимая активация наивных CD8+ Т-клеток остается спорной. [26] [28]
Помимо инфекций, важную роль в противоопухолевом иммунитете играет и свидетельная активация. [30] В раковых тканях человека обнаружено большое количество вирусспецифичных, а не опухолеспецифичных CD8+ Т-клеток. [30] Считается, что этот тип активации полезен для хозяина с точки зрения эффективности лечения рака. [26]
Драйверы свидетеля активации
[ редактировать ]Основными факторами активации свидетелей являются цитокины , такие как IL-15 , IL-18 , IL-12 или IFN типа I, часто действующие синергически. [25] [26] [28] [29] IL-15 отвечает за цитотоксическую активность Т-клеток, активированных сторонним наблюдателем. Он индуцирует экспрессию NKG2D (рецептор, обычно экспрессируемый на NK-клетках ) на CD8+ Т-клетках памяти, что приводит к врожденной цитотоксичности, т.е. распознаванию лигандов NKG2D как индикаторов инфекции, клеточного стресса и трансформации клеток, а также разрушению измененных клеток в клетках. в стиле НК. [25] [26] [28] [29] Было показано, что активация TCR аннулирует опосредованную IL-15 экспрессию NKG2D на Т-клетках. [28] [29] Кроме того, IL-15 индуцирует экспрессию цитолитических молекул, расширение клеток и усиливает клеточный ответ на IL-18. [25] [26] [29] IL-18 является еще одним цитокином, участвующим в этом процессе, обычно действующим совместно с IL-12, усиливая дифференцировку Т-клеток памяти в эффекторные клетки, т.е. он индуцирует продукцию IFN-γ и пролиферацию клеток. [25] [26] [29] Toll-подобные рецепторы (TLR), особенно TLR2 , также связаны с TCR-независимой активацией CD8+ Т-клеток при бактериальной инфекции. [25] [29]
Свидетельная активация CD4+ Т-клеток
[ редактировать ]Несмотря на то, что TCR-независимая активация более подробно изучается в CD8+ Т-клетках, имеются четкие доказательства того, что это явление происходит в CD4+ Т-клетках . Однако он считается менее эффективным, предположительно из-за более низкой экспрессии CD122 (также известного как IL2RB или IL15RB). [31] [32] Подобно своим аналогам CD8+, Т-клетки памяти и эффекторные CD4+ проявляют повышенную чувствительность к TCR-независимой активации. [26] [32] IL-1β синергически с IL-12 и IL-23 стимулирует CD4+ Т-клетки памяти и стимулирует Th17 . ответ [32] Более того, IL-18, IL-12 и IL-27 индуцируют экспрессию цитокинов в эффекторных CD4+ Т-клетках памяти и эффекторных клетках. [32] а IL-2 считается сильным индуктором активации CD4+ Т-клеток, который может заменить стимуляцию TCR даже в наивных клетках. [32] Сообщалось также, что TLR2 присутствует на CD4+ Т-клетках памяти, которые реагируют на свой агонист продукцией IFNγ, даже без стимуляции TCR. [32]
Роль в патогенности
[ редактировать ]Активация свидетеля играет роль в предотвращении распространения инфекции на ранних стадиях и способствует уничтожению опухоли. Однако этот тип активации также может иметь пагубные последствия, особенно при хронических инфекциях и аутоиммунных заболеваниях . [26] [27] [28] [29] Поражение печени при хроническом вирусном гепатите В является результатом инфильтрации в ткань неспецифических для HBV CD8+ Т-клеток. [26] Аналогичная ситуация возникает при острой инфекции вирусом гепатита А. [26] и активированные несвязанные с вирусом CD4+ Т-клетки способствуют поражению глаз при инфекциях, вызванных вирусом простого герпеса . [26] [32]
Повышенная экспрессия IL-15 и последующая чрезмерная экспрессия NKG2D были связаны с обострением некоторых аутоиммунных заболеваний, таких как диабет I типа , рассеянный склероз и воспалительные заболевания кишечника , например, болезнь Крона и целиакия . [25] Кроме того, повышенная экспрессия TLR2 наблюдалась в суставах, хрящах и костях пациентов с ревматоидным артритом , а присутствие его лиганда, пептидогликана , было обнаружено в их синовиальной жидкости . [25]
Ссылки
[ редактировать ]- ^ Jump up to: а б Уэрри Э.Дж., Тейхгребер В., Беккер Т.К., Масопуст Д., Каех С.М., Антиа Р. и др. (март 2003 г.). «Родственные связи и защитный иммунитет подмножеств Т-клеток памяти CD8» . Природная иммунология . 4 (3): 225–34. дои : 10.1038/ni889 . ПМИД 12563257 . S2CID 7209417 .
- ^ Клебанофф К.А., Гаттинони Л., Тораби-Паризи П., Керстанн К., Кардонес А.Р., Финкельштейн С.Е. и др. (июль 2005 г.). «Само-/опухолереактивные CD8+ Т-клетки центральной памяти обеспечивают превосходный противоопухолевый иммунитет по сравнению с эффекторными Т-клетками памяти» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (27): 9571–6. Бибкод : 2005PNAS..102.9571K . дои : 10.1073/pnas.0503726102 . ПМЦ 1172264 . ПМИД 15980149 .
- ^ Jump up to: а б с д и ж г час я Фарбер Д.Л., Юданин Н.А., Рестифо Н.П. (январь 2014 г.). «Т-клетки памяти человека: генерация, компартментализация и гомеостаз» . Обзоры природы. Иммунология . 14 (1): 24–35. дои : 10.1038/nri3567 . ПМК 4032067 . ПМИД 24336101 .
- ^ Гебхардт Т., Ваким Л.М., Эйдсмо Л., Ридинг ПК, Хит В.Р., Карбон Ф.Р. (май 2009 г.). «Т-клетки памяти в нелимфоидной ткани, обеспечивающие усиление местного иммунитета при заражении вирусом простого герпеса». Природная иммунология . 10 (5): 524–30. дои : 10.1038/ni.1718 . ПМИД 19305395 . S2CID 24388 .
- ^ Jump up to: а б Шин Х, Ивасаки А (сентябрь 2013 г.). «Тканерезидентные Т-клетки памяти» . Иммунологические обзоры . 255 (1): 165–81. дои : 10.1111/imr.12087 . ПМЦ 3748618 . ПМИД 23947354 .
- ^ Jump up to: а б Гаттинони Л., Лугли Э., Джи Й., Пос З., Паулос С.М., Куигли М.Ф. и др. (сентябрь 2011 г.). «Подмножество Т-клеток памяти человека со свойствами, подобными стволовым клеткам» . Природная медицина . 17 (10): 1290–7. дои : 10.1038/нм.2446 . ПМЦ 3192229 . ПМИД 21926977 .
- ^ Уайт Дж.Т., Кросс Э.В., Кедл Р.М. (июнь 2017 г.). «+ Т-клетки: откуда они берутся и зачем они нам нужны» . Обзоры природы. Иммунология . 17 (6): 391–400. дои : 10.1038/nri.2017.34 . ПМК 5569888 . ПМИД 28480897 .
- ^ Ли Дж.И., Гамильтон С.Е., Акуэ А.Д., Хогквист К.А., Джеймсон СК (август 2013 г.). «Т-клетки виртуальной памяти CD8 обладают уникальными функциональными свойствами» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (33): 13498–503. Бибкод : 2013PNAS..11013498L . дои : 10.1073/pnas.1307572110 . ПМЦ 3746847 . ПМИД 23898211 .
- ^ Дробек А., Мудра А., Мюллер Д., Хуранова М., Хоркова В., Прибикова М. и др. (июль 2018 г.). «Сильные гомеостатические сигналы TCR вызывают образование самотолерантных CD8 Т-клеток виртуальной памяти» . Журнал ЭМБО . 37 (14). дои : 10.15252/embj.201798518 . ПМК 6043851 . ПМИД 29752423 .
- ^ Jump up to: а б с д и ж г час я Кумар Б.В., Коннорс Т.Дж., Фарбер Д.Л. (февраль 2018 г.). «Развитие, локализация и функционирование Т-клеток человека на протяжении всей жизни» . Иммунитет . 48 (2): 202–213. doi : 10.1016/j.immuni.2018.01.007 . ПМЦ 5826622 . ПМИД 29466753 .
- ^ Jump up to: а б с д и ж г час Рестифо Н.П., Гаттинони Л. (октябрь 2013 г.). «Линейные взаимоотношения эффекторных Т-клеток и Т-клеток памяти» . Современное мнение в иммунологии . Спецраздел: Системная биология и биоинформатика / Иммуногенетика и трансплантация. 25 (5): 556–63. дои : 10.1016/j.coi.2013.09.003 . ПМЦ 3858177 . ПМИД 24148236 .
- ^ Jump up to: а б с д Хеннинг А.Н., Ройчоудхури Р., Рестифо Н.П. (май 2018 г.). «+ Т-клеточная дифференцировка» . Обзоры природы. Иммунология . 18 (5): 340–356. дои : 10.1038/nri.2017.146 . ПМК 6327307 . ПМИД 29379213 .
- ^ Jump up to: а б с д Янгблад Б., Хейл Дж.С., Ахмед Р. (июль 2013 г.). «Дифференциация Т-клеточной памяти: данные транскрипционных сигнатур и эпигенетики» . Иммунология . 139 (3): 277–84. дои : 10.1111/imm.12074 . ПМК 3701173 . ПМИД 23347146 .
- ^ Jump up to: а б с д и Шмидл С., Делачер М., Хюэн Дж., Фойерер М. (сентябрь 2018 г.). «Эпигенетические механизмы, регулирующие Т-клеточные ответы» . Журнал аллергии и клинической иммунологии . 142 (3): 728–743. дои : 10.1016/j.jaci.2018.07.014 . ПМИД 30195378 .
- ^ Саллюсто Ф., Лениг Д., Фёрстер Р., Липп М., Ланзавеккья А. (октябрь 1999 г.). «Два подмножества Т-лимфоцитов памяти с различными потенциалами самонаведения и эффекторными функциями». Природа . 401 (6754): 708–12. Бибкод : 1999Natur.401..708S . дои : 10.1038/44385 . ПМИД 10537110 . S2CID 4378970 .
- ^ Акбар А.Н., Терри Л., Тиммс А., Беверли ПК, Яносси Г. (апрель 1988 г.). «Потеря CD45R и усиление реактивности UCHL1 является особенностью примированных Т-клеток» . Журнал иммунологии . 140 (7): 2171–8. дои : 10.4049/jimmunol.140.7.2171 . ПМИД 2965180 . S2CID 22340282 .
- ^ Виллинджер Т., Фриман Т., Хасегава Х., МакМайкл А.Дж., Каллан М.Ф. (ноябрь 2005 г.). «Молекулярные сигнатуры отличают центральную память человека от подмножеств CD8 Т-клеток эффекторной памяти» . Журнал иммунологии . 175 (9): 5895–903. дои : 10.4049/jimmunol.175.9.5895 . hdl : 20.500.11820/f28e936e-a6a7-4f06-bdc9-79a1355c5f02 . ПМИД 16237082 .
- ^ Кох С., Ларби А., Дерхованессян Е., Озчелик Д., Наумова Е., Павелец Г. (июль 2008 г.). «Многопараметрический проточный цитометрический анализ подпопуляций Т-клеток CD4 и CD8 у молодых и пожилых людей» . Иммунитет и старение . 5 (6): 6. дои : 10.1186/1742-4933-5-6 . ПМК 2515281 . ПМИД 18657274 .
- ^ Герлах, Кармен; Моузман, Э. Эшли; Локхед, Скотт М.; Альварес, Дэвид; Звиненбург, Энтони Дж.; Ваандерс, Лизетт; Гарг, Рохит; де ла Торре, Хуан К.; фон Андриан, Ульрих Х. (декабрь 2016 г.). «Хемокиновый рецептор CX3CR1 определяет три подмножества Т-клеток CD8, испытывающих антиген, с различными ролями в иммунном надзоре и гомеостазе» . Иммунитет . 45 (6): 1270–1284. doi : 10.1016/j.immuni.2016.10.018 . ПМК 5177508 . ПМИД 27939671 .
- ^ Jump up to: а б с Мюллер С.Н., Маккей Л.К. (февраль 2016 г.). «Тканерезидентные Т-клетки памяти: местные специалисты по иммунной защите». Обзоры природы. Иммунология . 16 (2): 79–89. дои : 10.1038/nri.2015.3 . ПМИД 26688350 . S2CID 3155731 .
- ^ Штайнерт Э.М., Шенкель Дж.М., Фрейзер К.А., Беура Л.К., Манлав Л.С., Идьярто Б.З. и др. (май 2015 г.). «Количественное определение CD8 Т-клеток памяти показывает регионализацию иммунонадзора» . Клетка . 161 (4): 737–49. дои : 10.1016/j.cell.2015.03.031 . ПМЦ 4426972 . ПМИД 25957682 .
- ^ Jump up to: а б с «Исследование выявило возможную ахиллесову пяту в ключевых клетках иммунной памяти» .
- ^ Ли Ю.Дж., Джеймсон СК, Хогквист К.А. (февраль 2011 г.). «Альтернативная память в линии CD8 Т-клеток» . Тенденции в иммунологии . 32 (2): 50–6. дои : 10.1016/j.it.2010.12.004 . ПМК 3039080 . ПМИД 21288770 .
- ^ Марусина А.И., Оно Ю., Мерлеев А.А., Симода М., Огава Х., Ван Е.А. и др. (февраль 2017 г.). «+ виртуальная память: Т-клетки, не обладающие антигеном, находятся в компартментах наивных, регуляторных и Т-клеток памяти с одинаковой частотой, что имеет значение для аутоиммунитета» . Журнал аутоиммунитета . 77 : 76–88. дои : 10.1016/j.jaut.2016.11.001 . ПМК 6066671 . ПМИД 27894837 .
- ^ Jump up to: а б с д и ж г час я Уайтсайд, Сара К.; Снук, Джереми П.; Уильямс, Мэтью А.; Вайс, Янис Дж. (декабрь 2018 г.). «Т-клетки-свидетели: баланс между друзьями и врагами» . Тенденции в иммунологии . 39 (12): 1021–1035. дои : 10.1016/j.it.2018.10.003 . ПМК 6269193 . ПМИД 30413351 .
- ^ Jump up to: а б с д и ж г час я дж к л м н Ли, Хойёнг; Чон, Сонджу; Шин, Ый-Чоль (январь 2022 г.). «Значение активации Т-клеток-свидетелей при микробной инфекции» . Природная иммунология . 23 (1): 13–22. дои : 10.1038/s41590-021-00985-3 . ISSN 1529-2908 . ПМИД 34354279 . S2CID 236933989 .
- ^ Jump up to: а б Пачеко, Йована; Акоста-Ампудиа, Новый; Монсальве, Диана М.; Чанг, Кристофер; Гершвин, М. Эрик; Анайя, Хуан-Мануэль (сентябрь 2019 г.). «Активация свидетеля и аутоиммунитет» . Журнал аутоиммунитета . 103 : 102301. doi : 10.1016/j.jaut.2019.06.012 . ПМИД 31326230 . S2CID 198133084 .
- ^ Jump up to: а б с д и ж Морис, Николас Дж.; Табер, Алексис К.; Прлич, Мартин (01 февраля 2021 г.). «Гадкий утенок превратился в лебедя: изменение в восприятии активированных свидетелем Т-клеток памяти CD8» . Журнал иммунологии . 206 (3): 455–462. doi : 10.4049/jimmunol.2000937 . ISSN 0022-1767 . ПМЦ 7839146 . PMID 33468558 .
- ^ Jump up to: а б с д и ж г час Ким, Тэ-Шин; Шин, Ыи-Чоль (декабрь 2019 г.). «Активация CD8+ Т-клеток-свидетелей и их роль в вирусной инфекции» . Экспериментальная и молекулярная медицина . 51 (12): 1–9. дои : 10.1038/s12276-019-0316-1 . ISSN 1226-3613 . ПМК 6906361 . ПМИД 31827070 .
- ^ Jump up to: а б Боррас Д.М., Вербандт С., Ауссерхофер М. и др. (ноябрь 2023 г.). «Динамика специфичности опухоли в сравнении с активностью свидетеля в CD8+ Т-клетках определяет разнообразие иммунных ландшафтов при колоректальном раке» . Открытие клеток . 9 (114): 114. дои : 10.1038/s41421-023-00605-4 . ПМК 10652011 . ПМИД 37968259 .
- ^ Бойман, Онур (апрель 2010 г.). «Свидетель активации CD4 + Т-клеток: ОСНОВНЫЕ ОСОБЕННОСТИ» . Европейский журнал иммунологии . 40 (4): 936–939. дои : 10.1002/eji.201040466 . ПМИД 20309907 . S2CID 7918378 .
- ^ Jump up to: а б с д и ж г Ли, Хонг Гюн; Чо, Мин-Зи; Чой, Дже-Мин (август 2020 г.). «Свидетели CD4 + Т-клетки: перекресток между врожденным и адаптивным иммунитетом» . Экспериментальная и молекулярная медицина . 52 (8): 1255–1263. дои : 10.1038/s12276-020-00486-7 . ISSN 1226-3613 . ПМК 8080565 . ПМИД 32859954 .