Деферасирокс
 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | от ФЕР до сэра Окса |
| Торговые названия | Эксджаде, другие |
| Другие имена | CGP-72670, ICL-670A, IC L670 |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а606002 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Биодоступность | 70% |
| Связывание с белками | 99% |
| Метаболизм | печени Глюкуронидация |
| Период полувыведения | от 8 до 16 часов |
| Экскреция | Кал (84%) и почки (8%) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| КЭБ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.211.077 |
| Химические и физические данные | |
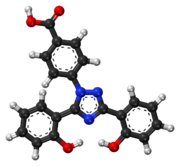
| Формула | С 21 Н 15 Н 3 О 4 |
| Молярная масса | 373.368 g·mol −1 |
| 3D model ( JSmol ) | |
| Плотность | 1,4±0,1 г/см 3 [ 3 ] |
| | |
Деферасирокс , продаваемый, среди прочего, под торговой маркой Exjade , представляет собой пероральный железа хелатор . Его основное назначение — уменьшить хроническую перегрузку железом у пациентов, которым длительное время переливают кровь по поводу таких состояний, как бета- талассемия и другие хронические анемии . [ 4 ] [ 5 ] Это первый пероральный препарат, одобренный в США для этой цели. [ 6 ]
США Он был одобрен Управлением по контролю за продуктами и лекарствами (FDA) в ноябре 2005 года. [ 4 ] [ 6 ] По данным FDA (май 2007 г.), почечной недостаточности и цитопении у пациентов, получавших таблетки деферазирокса для пероральной суспензии, были зарегистрированы случаи . Он одобрен в Европейском Союзе Европейским агентством лекарственных средств (EMA) для детей шести лет и старше при хронической перегрузке железом в результате повторных переливаний крови. [ 7 ] [ 8 ] [ 9 ] Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [ 10 ]
В июле 2020 года компания Teva решила прекратить прием деферазирокса. [ 11 ] Он доступен в виде непатентованного лекарства . [ 12 ]
Характеристики
[ редактировать ]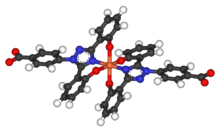
Период полувыведения деферазирокса составляет от 8 до 16 часов, что позволяет принимать его один раз в день. Две молекулы деферазирокса способны связываться с 1 атомом железа, которое впоследствии выводится с фекалиями. Низкая молекулярная масса и высокая липофильность позволяют принимать препарат перорально, в отличие от дефероксамина , который необходимо вводить внутривенно (внутривенно). Вместе с деферипроном деферасирокс, по-видимому, способен удалять железо из клеток (миоцитов сердца и гепатоцитов), а также выводить железо из крови.
Синтез
[ редактировать ]Деферасирокс можно получить из простых коммерчески доступных исходных материалов (салициловой кислоты, салициламида и 4-гидразинобензойной кислоты) в следующей двухстадийной синтетической последовательности:

Конденсация салицилоилхлорида (образующегося in situ из салициловой кислоты и тионилхлорида) с салициламидом в условиях дегидратирующей реакции приводит к образованию 2-(2-гидроксифенил)-1,3(4H ) -бензоксазин-4-она. Это промежуточное соединение выделяют и подвергают реакции с 4-гидразинобензойной кислотой в присутствии основания с получением 4-(3,5-бис(2-гидроксифенил)-1,2,4-триазол-1-ил)бензойной кислоты (деферазирокса). [ 13 ]
Риски
[ редактировать ]Деферазирокс занял второе место в списке препаратов, наиболее часто подозреваемых в зарегистрированных случаях смерти пациентов, составленном Институтом безопасной медицинской практики за 2019 год , с 1320 подозрениями на смерть. [ 14 ] В том же году было добавлено предупреждение в рамке в отношении почечной недостаточности , печеночной недостаточности и желудочно-кишечных кровотечений . [ 15 ] Предполагается, что основной причиной такого всплеска предполагаемых смертей является повторный анализ данных о нежелательных явлениях, проведенный компанией Novartis . [ 14 ]
Ссылки
[ редактировать ]- ^ «Список всех лекарств с предупреждениями о черном ящике, полученный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»).» . nctr-crs.fda.gov . FDA . Проверено 22 октября 2023 г.
- ^ «Эксжад ЭПАР» . Европейское агентство по лекарственным средствам . 28 августа 2006 г. Проверено 21 июня 2024 г.
- ^ «Паспорт безопасности материала (MSDS): Деферазирокс» . Химический институт . 2018.
- ^ Jump up to: а б Чоудри, вице-президент, Найтани Р. (август 2007 г.). «Текущий статус перегрузки железом и хелатирования деферазироксом». Индийский журнал педиатрии . 74 (8): 759–64. дои : 10.1007/s12098-007-0134-7 . ПМИД 17785900 . S2CID 19930076 . Полный текст бесплатно. Архивировано 29 апреля 2014 г. в Wayback Machine.
- ^ Ян Л.П., Ким С.Дж., Китинг Г.М. (2007). «Деферазирокс: обзор его использования в лечении трансфузионной хронической перегрузки железом». Наркотики . 67 (15): 2211–30. дои : 10.2165/00003495-200767150-00007 . ПМИД 17927285 . S2CID 195686285 .
- ^ Jump up to: а б «FDA одобрило первый пероральный препарат для лечения хронической перегрузки железом» (пресс-релиз). США Управление по контролю за продуктами и лекарствами . 9 ноября 2005 года . Проверено 31 октября 2007 г.
- ^ «Эксжад – деферасирокс» (PDF) . Европейское агентство лекарственных средств. 2018. Архивировано из оригинала (PDF) 29 декабря 2017 года . Проверено 26 ноября 2012 г.
- ^ Контогиоргес Г.Дж. (апрель 2013 г.). «Закрывать глаза на токсичность деферазирокса?» . Ланцет . 381 (9873): 1183–4. дои : 10.1016/S0140-6736(13)60799-0 . ПМИД 23561999 . S2CID 27794849 .
- ^ «Обзор: побочные эффекты Exjade» . Архивировано из оригинала 4 марта 2016 года . Проверено 20 апреля 2013 г.
- ^ Всемирная организация здравоохранения (2023 г.). Выбор и использование основных лекарств до 2023 г.: веб-приложение A: Типовой список основных лекарств Всемирной организации здравоохранения: 23-й список (2023 г.) . Женева: Всемирная организация здравоохранения. hdl : 10665/371090 . ВОЗ/MHP/HPS/EML/2023.02.
- ^ «Отмена деферазирокса» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . Проверено 20 июля 2020 г.
- ^ «Drugs@FDA: препараты, одобренные FDA» . Управление по контролю за продуктами и лекарствами США . Проверено 15 августа 2020 г. .
- ^ Штайнхаузер С., Хайнц У., Бартоломя М., Вейхермюллер Т., Ник Х., Хегетшвайлер К. (2004). «Комплексное образование ICL670 и родственных лигандов с Fe III и Fe II ". Европейский журнал неорганической химии . 2004 (21): 4177–4192. doi : 10.1002/ejic.200400363 . ]
- ^ Jump up to: а б «QuarterWatch™ (итог за 4-й квартал и 2009 г.): зарегистрированная смертность пациентов увеличилась на 14% в 2009 г.» . Институт безопасной медицинской практики . Проверено 28 июня 2021 г.
- ^ Педиатрия А.А. (19 февраля 2010 г.). «В Exjade добавлено предупреждение о черном ящике» . Новости ААП . doi : 10.1542/aapnews.20100219-1 (неактивен 31 января 2024 г.). ISSN 1073-0397 . Архивировано из оригинала 28 июня 2021 года . Проверено 28 июня 2021 г.
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на январь 2024 г. ( ссылка )