Синаптическая стабилизация

Синаптическая стабилизация имеет решающее значение для развивающейся и взрослой нервной системы и считается результатом поздней фазы долгосрочной потенциации (LTP). Механизм включает укрепление и поддержание активных синапсов за счет увеличения экспрессии элементов цитоскелета и внеклеточного матрикса и белков постсинаптического каркаса , одновременно сокращая менее активные. Например, молекулы клеточной адгезии (CAM) играют большую роль в поддержании и стабилизации синапсов. Джеральд Эдельман открыл САМ и изучил их функцию в процессе развития, что показало, что САМ необходимы для миграции клеток и формирования всей нервной системы. [1] [2] В нервной системе взрослого человека САМ играют важную роль в синаптической пластичности, связанной с обучением и памятью . [3]
Типы CAM
[ редактировать ]SynCAM
[ редактировать ]Молекулы синаптической клеточной адгезии (CAM) играют решающую роль в поиске путей аксонов и установлении синапсов между нейронами во время развития нервной системы и являются неотъемлемыми участниками многих синаптических процессов, включая правильное выравнивание пре- и постсинаптических путей передачи сигнала , везикулярную рециркуляцию в отношении эндоцитоза. и экзоцитоз , интеграция постсинаптических рецепторов и прикрепление к цитоскелету для обеспечения стабильности синаптических компонентов. [4]
SynCAM (также известный как Cadm или нектиноподобные молекулы) представляют собой особый тип синаптической CAM, обнаруженный у позвоночных , который способствует росту и стабилизации возбуждающих (не тормозящих) синапсов. SynCAM локализуются преимущественно в головном мозге как в пре-, так и в постсинаптических участках, а их структуры состоят из внутриклеточных связывающих доменов FERM и PDZ, одного трансмембранного домена и трех внеклеточных Ig-доменов . Во время развития нервной системы SynCAM, такие как SynCAM1, действуют как «контактные датчики» конусов роста аксонов , быстро накапливаясь при образовании аксо-дендритных связей и помогая сформировать стабильный адгезивный комплекс. [5]
SynCAM1 наряду с нейролигином являются двумя CAM, которые, как известно, достаточны для инициации образования пресинаптических терминалей, поскольку добавление synCAM1 к среде совместно культивируемых нейрональных и ненейрональных клеток приводит к образованию пресинаптических терминалей. Гомофильное связывание двух молекул synCAM1 на филоподиях конуса роста аксона и дендритного шипа позволяет установить первоначальный контакт между пре- и постсинаптической клеткой. [6]
synCAMs принадлежат к Ig суперсемейству белков . Цитозольные PDZ-домены synCAM, встроенные в постсинаптическую мембрану, взаимодействуют с постсинаптическим каркасным белком PSD-95 , который помогает закрепить комплекс к нижележащему цитоскелету. [7]
Кадерин-катенин
[ редактировать ]
Кадгерины представляют собой кальций-зависимые гомофильные молекулы клеточной адгезии , которые образуют комплексы с цитозольными партнерами, известными как катенины . [8] Компоненты этого комплекса связываются с рядом различных каркасных белков, фосфотаз, киназ и рецепторов. [9] Классические кадгерины имеют пять внеклеточных повторяющихся структур, которые связывают кальций, один трансмембранный домен и внутриклеточный хвост с дистальным цитозольным доменом, который связывает партнера-катенин. [9] [10] Недавние работы показали, что комплекс кадгерин-катенин участвует в ряде различных процессов центральной нервной системы, таких как синаптическая стабилизация и пластичность . [8] [9] [10]
Многие кадгерины в центральной нервной системе демонстрируют отчетливые паттерны пространственной и временной экспрессии. [9] Например, N-кадгерин широко экспрессируется в развивающемся синапсе и позже остается вблизи зрелой активной зоны, что указывает на то, что этот комплекс может хорошо подходить для обеспечения связи между структурными изменениями и синаптической стабильностью. [9] Фактически, изменения локальной синаптической активности влияют на экспрессию комплексов кадгерин-катенин . [9] Увеличение активности определенного шипика приводит к димеризации N-кадгерина, который затем расщепляется, что приводит к репрессии транскрипции CBP/ CREB . [9] Это подавление имеет множество последствий, связанных с развитием и пластичностью.
В случае дендритных шипов формирования и обрезки была предложена и подтверждена гипотеза конкуренции. [11] [12] Эта гипотеза предполагает, что относительные уровни комплексов кадгерин-катенин, которые распределяются среди шипиков в локальной области в зависимости от активности, определяют судьбу отдельных шипиков. То есть конкуренция между шипами за β-катенин определяет, будет ли шип созревать (увеличенное количество комплексов) или сокращаться (уменьшенное количество комплексов). [12] Это критический механизм в процессе совершенствования корковых схем, происходящего на протяжении всего развития. [11]
Нектин
[ редактировать ]Нектины представляют собой отдельное семейство молекул клеточной адгезии . Эти САМ участвуют в начальном контакте пресинаптических и постсинаптических нейрональных процессов во время образования синапсов. имеется только четыре хорошо охарактеризованных нектина В синапсе : нектин-1, 2, 3 и 4. [13] Все мембраносвязанные нектиновые клетки имеют внеклеточную область с тремя иммуноглобулиноподобными петлями. Самая дальняя от мембраны петля называется петлей V-типа, а две петли, расположенные дальше от мембраны, относятся к петлям C2-типа. Несколько нектинов на одной клеточной мембране соединяются вместе в петле V-типа, образуя кластер нектиновых белков. Этот процесс называется цис-кластеризацией . Когда две клетки, имеющие отдельные цис-кластеры, вступают в контакт, они образуют прочный комплекс, называемый транс-взаимодействием , которое обеспечивает адгезию и, в некоторых случаях, передачу сигналов между двумя клетками. [14]
Наиболее надежные знания о роли нектина в синаптической стабилизации получены из синапсов, образованных между окончаниями мшистых волокон и пирамидальных клеток дендритами в области CA3 гиппокампа . [15] Нектинами, участвующими в формировании и стабилизации этого синапса, являются нектин-1 и нектин-3, которые выступают из плазматической мембраны постсинаптической клетки и пресинаптической клетки соответственно, образуя гетерофильные внеклеточные контакты. Внутриклеточный домен всех нектинов напрямую связывается с белком L- афадином . L-афадин представляет собой актин- связывающий белок, который связывается с F-актином актинового цитоскелета . Таким образом, нектин формирует ребристые соединения актиновой архитектуры клеток, позволяя синапсу развиваться в контролируемой и стабильной среде. [16]
По мере созревания синапсов в регионе СА3 нектины и кадгерины, которые тесно связаны друг с другом при стабилизации синапсов, смещаются к периферии активной зоны и образуют соединение puncta Адгезив (PAJ). PAJ функционирует во многом подобно слипчивым соединениям в эпителиальных тканях . Смещение этих CAM и образование этого соединения обеспечивает зарождающимся синаптическим мембранам пространство для взаимодействия и созревания, одновременно отделяя окружающую мембрану и обеспечивая фиксацию цитоскелета. [14]
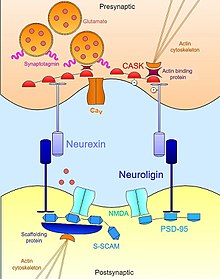
Нейрексин-нейролигин
[ редактировать ]Взаимодействия нейрексин - нейролигин помогают установить транссинаптическую функциональную асимметрию, необходимую для стабилизации и поддержания правильной синаптической передачи . [17] Пресинаптический нейрексин и его партнер по постсинаптическому связыванию нейролигин образуют комплексы на ранних стадиях развития нейронов и оба известны как мощные индукторы синаптогенеза . [18] Ненейрональные клетки, которые искусственно экспрессируют нейрексин, достаточны для мобилизации постсинаптической специализации в совместно культивируемых нейронах; [19] Клетки, экспрессирующие нейролигин, также способны индуцировать маркеры пресинаптической дифференцировки в соседних нейронах. [20] [21] Однако, хотя оба они играют важную роль в синаптогенезе, эти молекулы клеточной адгезии не необходимы для формирования нейронных связей во время развития. [22] Мыши с тройным нокаутом по нейрексинам или нейролигинам демонстрируют нормальное количество синапсов, но экспрессируют эмбриональный летальный фенотип из-за нарушения нормальной синаптической передачи. [23] Следовательно, они не необходимы для формирования синапсов сами по себе , но необходимы для созревания и интеграции синапсов в функциональные цепи, необходимые для выживания.
Помимо внеклеточного контакта друг с другом, нейрексины и нейролигины также внутриклеточно связываются с обширной сетью адаптерных белков и каркасных структур, которые совместно с актиновым цитоскелетом помогают локализовать необходимые компоненты синаптической передачи. Например, первый обнаруженный нейролигин ( NLGN1 ) был идентифицирован по его домену PDZ , который связывается с PSD95 , хорошо известным каркасным белком в глутаматергических синапсах , который функционально связывает рецепторы NMDA с соответствующей постсинаптической локализацией. [21] [24] Аналогичным образом, другая изоформа нейролигина ( NLGN2 ) взаимодействует с гефирином , каркасным белком, специфичным для ГАМК-ергических синапсов , и отвечает за активацию синаптического белка-адаптора коллибистина . [25] В случае нейрексинов их внутриклеточные связывающие взаимодействия одинаково важны для задействования необходимого механизма синаптической передачи в активной зоне. Как и нейролигины, нейрексины обладают PDZ-доменом, который ассоциируется с CASK ( кальций-кальмодулин-зависимой протеинкиназой ). [24] Помимо фосфорилирования себя и нейрексина, CASK способствует взаимодействиям между нейрексинами и актинсвязывающими белками, обеспечивая тем самым прямую связь, с помощью которой нейрексин может модулировать динамику цитоскелета, что важно для синаптической стабильности и пластичности. Нейрексин также может связывать синаптотагмин , белок, встроенный в мембрану синаптических везикул, а также может способствовать ассоциациям с потенциалзависимыми кальциевыми каналами , которые опосредуют поток ионов, необходимый для нейротрансмиттера экзоцитоза при синаптической стимуляции. [26] [23] Таким образом, нейрексин и нейролигин координируют морфологические и функциональные аспекты синапса, что, в свою очередь, позволяет зарождающимся незрелым контактам стабилизироваться в полноценные функциональные платформы для нейротрансмиссии.
Передача сигналов эфрин-эф
[ редактировать ]
Нетрадиционные молекулы адгезии, такие как эфрины , также помогают стабилизировать синаптические контакты. Рецепторы Eph и их мембраносвязанные лиганды, эфрины, участвуют в различных клеточных процессах во время развития и созревания, включая наведение аксонов , миграцию нейронов , синаптогенез и обрезку аксонов . [27] [28] В гиппокампе морфология дендритных шипов может регулироваться астроцитами посредством двунаправленной передачи сигналов эфрин/EphA. [29] Астроциты и их отростки экспрессируют эфрин А3 , тогда как рецептор EphA4 богат нейронами гиппокампа. Это взаимодействие, опосредованное передачей сигналов эфрина A3/EphA4, индуцирует рекрутирование и активацию циклин-зависимой киназы 5 (Cdk5), которая затем фосфорилирует фактор обмена гуанина (GEF), эфексин-1. [30] Фосфорилированный эфексин1 может затем активировать малую ГТФазу RhoA , что приводит к последующей активации ее эффектора Rho-киназы (ROCK), что приводит к перестройке актиновых филаментов. [30] Благодаря этому механизму астроцитарные процессы способны стабилизировать отдельные дендритные выпячивания, а также их созревание в шипики посредством передачи сигналов эфрина/EphA. Прямая передача сигналов, включающая активацию EphA4, приводит к стабилизации синаптических белков в нервно-мышечном соединении . [30] Как и во взаимодействии нейрон-глия, опосредованном EphA4/ephrinA3, этот процесс регулирует динамику актинового цитоскелета путем активации ROCK посредством эфексина. [30]
Передача сигналов эфрина B/EphB также участвует в стабилизации синапсов посредством различных механизмов. Эти молекулы содержат цитоплазматические хвосты, которые взаимодействуют с каркасными белками через свои домены PDZ, стабилизируя вновь образованные синапсы ЦНС. [28] Например, эфрин B3 взаимодействует с белком-адаптером 1, взаимодействующим с глутаматными рецепторами (GRIP-1), чтобы регулировать развитие возбуждающих синапсов дендритного стержня. [28] Этот процесс, который был идентифицирован в культурах нейронов гиппокампа, показал, что обратная передача сигналов Eph/ephrin B3 рекрутирует GRIP1 на мембрану постсинаптического стержня. [31] Оказавшись на стержне мембраны, GRIP1 помогает закрепить рецепторы глутамата ниже пресинаптического терминала. Этот процесс также включает фосфорилирование остатка серина вблизи карбоксильного конца эфрина-B (проксимальнее мотива связывания PDZ), что приводит к стабилизации рецепторов AMPA в синапсах. [27]
Другой механизм, обнаруженный в нейронах гиппокампа, показал, что передача сигналов EphB может способствовать созреванию позвоночника путем модуляции активности Rho GTPase, как это наблюдается с EphAs. [32] Однако, в отличие от EphAs, рецептор EphB2, как было показано, взаимодействует с постсинаптическими рецепторами N-метил-D-аспартата (NMDAR), рекрутируя GEF Tiam1 в комплекс при связывании ephrinB. [32] [30] [33] Фосфорилирование Tiam1 происходит в ответ на активность NMDAR, что обеспечивает приток кальция, который активирует Tiam1. Этот механизм также приводит к модуляции актинового цитоскелета. Было обнаружено, что в результате этой стабилизации как прямая передача сигналов EphB2, так и обратная передача сигналов эфрина-B3 индуцируют LTP через NMDAR. [34]
Ссылки
[ редактировать ]- ^ Рутисхаузер У, Джесселл ТМ (июль 1988 г.). «Молекулы клеточной адгезии в развитии нейронов позвоночных». Физиологические обзоры . 68 (3): 819–57. дои : 10.1152/physrev.1988.68.3.819 . ПМИД 3293093 .
- ^ «Биография Джеральда М. Эдельмана» . Нобелевская премия . Проверено 13 марта 2018 г.
- ^ Бенсон Д.Л., Шнапп Л.М., Шапиро Л., Хантли Г.В. (ноябрь 2000 г.). «Сохранение воспоминаний: молекулы клеточной адгезии в синаптической пластичности». Тенденции в клеточной биологии . 10 (11): 473–82. дои : 10.1016/S0962-8924(00)01838-9 . ПМИД 11050419 .
- ^ Букало, Елена; Дитятьев, Александр (27 декабря 2012 г.). «Молекулы синаптической клеточной адгезии». Синаптическая пластичность . Достижения экспериментальной медицины и биологии. Том. 970. Вена: Шпрингер, Вена. стр. 97–128. дои : 10.1007/978-3-7091-0932-8_5 . ISBN 978-3-7091-0932-8 . ПМИД 22351053 .
- ^ Бидерер, Томас; Мисслер, Маркус; Зюдхоф, Томас (2012). «Синаптическая клеточная адгезия» . Перспективы Колд-Спринг-Харбор в биологии . 4 (4). Лабораторный пресс Колд-Спринг-Харбор: a005694. doi : 10.1101/cshperspect.a005694 . ПМК 3312681 . ПМИД 22278667 . Проверено 12 марта 2018 г.
- ^ Уошборн, Филип; Дитятев, Александр; Шайффеле, Питер; Бидерер, Томас; Вайнер, Джошуа А.; Кристоферсон, Карен С.; Эль-Хусейни, Алаа (20 октября 2004 г.). «Молекулы клеточной адгезии в формировании синапсов» . Журнал неврологии . 24 (42): 9244–9249. doi : 10.1523/JNEUROSCI.3339-04.2004 . ПМК 6730099 . ПМИД 15496659 .
- ^ Далва, Мэтью; Макклелланд, Эндрю; Кайзер, Мэтью (14 февраля 2007 г.). «Молекулы клеточной адгезии: сигнальные функции в синапсе» . Природа . 8 (3): 206–220. дои : 10.1038/nrn2075 . ПМК 4756920 . ПМИД 17299456 .
- ^ Jump up to: а б Бамджи SX (июль 2005 г.). «Кадгерины: актин с цитоскелетом образует синапсы» . Нейрон . 47 (2): 175–8. дои : 10.1016/j.neuron.2005.06.024 . ПМИД 16039559 .
- ^ Jump up to: а б с д и ж г Ариккат Дж., Райхардт Л.Ф. (сентябрь 2008 г.). «Кадгерины и катенины в синапсах: роль в синаптогенезе и синаптической пластичности» . Тенденции в нейронауках . 31 (9): 487–94. дои : 10.1016/j.tins.2008.07.001 . ПМК 2623250 . ПМИД 18684518 .
- ^ Jump up to: а б Сон Э, Юань Л, Ариккат Дж (апрель 2015 г.). «Кадгерины и катенины в морфогенезе дендритов и синапсов» . Адгезия и миграция клеток . 9 (3): 202–13. дои : 10.4161/19336918.2014.994919 . ПМЦ 4594442 . ПМИД 25914083 .
- ^ Jump up to: а б Уолли К. (октябрь 2015 г.). «Нервное развитие: сложная конкуренция за шипы» . Обзоры природы. Нейронаука . 16 (10): 577. дои : 10.1038/nrn4024 . ПМИД 26307326 .
- ^ Jump up to: а б Бянь WJ, Мяо WY, Хэ SJ, Цю Z, Ю X (август 2015 г.). «Координированное сокращение и созревание позвоночника, опосредованное межпозвонковой конкуренцией за комплексы кадгерин/катенин» . Клетка . 162 (4): 808–22. дои : 10.1016/j.cell.2015.07.018 . ПМИД 26255771 .
- ^ Санес Д. (25 января 2011 г.). Развитие нервной системы (3-е изд.). Эльзевир. ISBN 978-0-08-092320-8 .
- ^ Jump up to: а б Ирие К., Симидзу К., Сакисака Т., Икеда В., Такай Ю. (декабрь 2004 г.). «Роль и механизмы действия нектинов в межклеточной адгезии». Семинары по клеточной биологии и биологии развития . 15 (6): 643–56. дои : 10.1016/s1084-9521(04)00088-6 . ПМИД 15561584 .
- ^ Рикитаке Ю., Мандай К., Такай Ю. (август 2012 г.). «Роль нектинов в различных типах межклеточной адгезии» . Журнал клеточной науки . 125 (Часть 16): 3713–22. дои : 10.1242/jcs.099572 . ПМИД 23027581 .
- ^ Такай Ю, Симидзу К, Оцука Т (октябрь 2003 г.). «Роль кадгеринов и нектинов в формировании межнейронных синапсов». Современное мнение в нейробиологии . 13 (5): 520–6. дои : 10.1016/j.conb.2003.09.003 . ПМИД 14630213 . S2CID 10053035 .
- ^ Крейг А.М., Кан Ю (февраль 2007 г.). «Передача сигналов нейрексин-нейролигин в развитии синапсов» . Современное мнение в нейробиологии . 17 (1): 43–52. дои : 10.1016/j.conb.2007.01.011 . ПМК 2820508 . ПМИД 17275284 .
- ^ Дин С., Дресбах Т. (январь 2006 г.). «Нейролигины и нейрексины: связь клеточной адгезии, образования синапсов и когнитивной функции». Тенденции в нейронауках . 29 (1): 21–9. дои : 10.1016/j.tins.2005.11.003 . ПМИД 16337696 . S2CID 11664697 .
- ^ Нам Чи, Чен Л (апрель 2005 г.). «Постсинаптическая сборка, индуцированная взаимодействием нейрексин-нейролигин и нейромедиатор» . Труды Национальной академии наук Соединенных Штатов Америки . 102 (17): 6137–42. Бибкод : 2005PNAS..102.6137N . дои : 10.1073/pnas.0502038102 . ПМК 1087954 . ПМИД 15837930 .
- ^ Брэди С.Т., Сигел Г.Дж., Альберс Р.В., Прайс Д.Л. (2012). Основная нейрохимия: принципы молекулярной, клеточной и медицинской нейробиологии (Восьмое изд.). Уолтем, Массачусетс. ISBN 978-0-12-374947-5 . OCLC 754167839 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Jump up to: а б Мисслер М, Зюдхоф ТЦ, Бидерер Т (апрель 2012 г.). «Синаптическая клеточная адгезия» . Перспективы Колд-Спринг-Харбор в биологии . 4 (4): а005694. doi : 10.1101/cshperspect.a005694 . ПМК 3312681 . ПМИД 22278667 .
- ^ Хорч М (2009). «Краткая история синапса - Гольджи против Рамона и Кахаля». В Хорч М., Умемори Х (ред.). Липкий синапс . Спрингер, Нью-Йорк, штат Нью-Йорк. стр. 1–9. дои : 10.1007/978-0-387-92708-4_1 . ISBN 978-0-387-92707-7 .
- ^ Jump up to: а б Мисслер М., Чжан В., Рольманн А., Каттенстрот Г., Хаммер Р.Э., Готтманн К., Зюдхоф TC (июнь 2003 г.). «Альфа-нейрексины соединяют каналы Ca2+ с экзоцитозом синаптических пузырьков». Природа . 423 (6943): 939–48. Бибкод : 2003Natur.423..939M . дои : 10.1038/nature01755 . ПМИД 12827191 . S2CID 10315093 .
- ^ Jump up to: а б Сквайр ЛР (2009). Энциклопедия нейробиологии . Амстердам: Академическая пресса. ISBN 978-0-08-096393-8 . OCLC 503584095 .
- ^ Чжан С., Атасой Д., Арас Д., Ян Х, Фучилло М.В., Робисон А.Дж., Ко Дж., Брунгер А.Т., Зюдхоф Т.К. (май 2010 г.). «Нейрексины физически и функционально взаимодействуют с рецепторами ГАМК (А)» . Нейрон . 66 (3): 403–16. дои : 10.1016/j.neuron.2010.04.008 . ПМЦ 3243752 . ПМИД 20471353 .
- ^ Хата Ю, Давлетов Б, Петренко А.Г., Ян Р., Зюдхоф ТЦ (февраль 1993 г.). «Взаимодействие синаптотагмина с цитоплазматическими доменами нейрексинов». Нейрон . 10 (2): 307–15. дои : 10.1016/0896-6273(93)90320-Q . ПМИД 8439414 . S2CID 12954601 .
- ^ Jump up to: а б Лизабет Э.М., Фаливелли Дж., Паскуале Э.Б. (сентябрь 2013 г.). «Передача сигналов рецептора Eph и эфрины» . Перспективы Колд-Спринг-Харбор в биологии . 5 (9): а009159. doi : 10.1101/cshperspect.a009159 . ПМЦ 3753714 . ПМИД 24003208 .
- ^ Jump up to: а б с Бьянки Л. (2018). Развивающая нейробиология . Нью-Йорк, штат Нью-Йорк: Garland Science. стр. 299–302. ISBN 9780815344827 .
- ^ Болтон М.М., Эроглу С. (октябрь 2009 г.). «Посмотрите, кто плетет нейронную сеть: глиальный контроль образования синапсов». Современное мнение в нейробиологии . 19 (5): 491–7. дои : 10.1016/j.conb.2009.09.007 . ПМИД 19879129 . S2CID 44625935 .
- ^ Jump up to: а б с д и Рубинштейн Дж. (май 2013 г.). Клеточная миграция и формирование нейрональных связей: комплексная нейробиология развития . Сан-Диего, Калифорния: Elsevier Science & Technology. стр. 659–669. ISBN 978-0-12-397266-8 .
- ^ Фланнери Д.Б. (сентябрь 1988 г.). «Нерасхождение при синдроме Дауна». Американский журнал медицинской генетики . 31 (1): 181–2. дои : 10.1002/ajmg.1320310123 . ПМИД 2975924 .
- ^ Jump up to: а б Лернер А.М. (октябрь 1990 г.). «Вирусный миокардит как случайное открытие» . Больничная практика . 25 (10): 81–4, 87–90. дои : 10.1016/j.brainres.2006.11.033 . ПМК 2170431 . ПМИД 2170431 .
- ^ Арванитис Д., Дэви А. (февраль 2008 г.). «Передача сигналов эф/эфрина: сети» . Гены и развитие . 22 (4): 416–29. дои : 10.1101/gad.1630408 . ПМЦ 2731651 . ПМИД 18281458 .
- ^ Лундгрен А., Тибблинг Л., Хенрикссон Н.Г. (март 2018 г.). «ДК-определяемое смещение нистагмического толчка при ротационных пробах» . Оторино-ларингологическая практика . 31 (1): 54–64. дои : 10.3892/etm.2018.5702 . ПМЦ 5795627 . ПМИД 5795627 .