Активная зона
| Активная зона | |
|---|---|
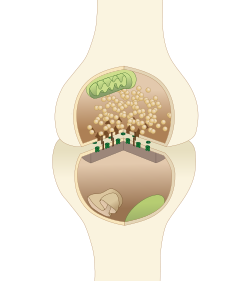 Схема типичного синапса центральной нервной системы. Белки активной зоны представлены темно-коричневыми пирамидками на верхнем нейронном окончании. | |
| Подробности | |
| Идентификаторы | |
| латинский | активная зона |
| ТД | Х2.00.06.2.00012 |
| Анатомические термины микроанатомии | |
Активная зона или синаптическая активная зона — это термин, впервые использованный Куто и Пеко-Дешавассиненом в 1970 году для определения места высвобождения нейротрансмиттера . Два нейрона вступают в тесный контакт через структуры, называемые синапсами, позволяющие им общаться друг с другом. Как показано на диаграмме рядом, синапс состоит из пресинаптического бутона одного нейрона, который хранит пузырьки , содержащие нейротрансмиттер (самый верхний на рисунке), и второго, постсинаптического нейрона, несущего рецепторы нейромедиатора (внизу), вместе с разрыв между ними, называемый синаптической щелью (с молекулами синаптической адгезии, SAM, удерживающими их вместе [1] ). Когда потенциал действия достигает пресинаптического бутона, содержимое везикул высвобождается в синаптическую щель, а высвободившийся нейромедиатор проходит через щель к постсинаптическому нейрону (нижняя структура на рисунке) и активирует рецепторы на постсинаптической мембране.
Активная зона — это область пресинаптического бутона, которая обеспечивает высвобождение нейромедиатора и состоит из пресинаптической мембраны и плотного скопления белков, называемого цитоматрицей в активной зоне (CAZ). CAZ рассматривается под электронным микроскопом как темная (электронно-плотная) область, расположенная рядом с мембраной. Белки внутри CAZ привязывают синаптические пузырьки к пресинаптической мембране и опосредуют слияние синаптических пузырьков , тем самым позволяя нейромедиатору надежно и быстро высвобождаться при появлении потенциала действия.
Функция [ править ]
Функция активной зоны заключается в том, чтобы гарантировать, что нейротрансмиттеры могут надежно высвобождаться в определенном месте нейрона и высвобождаться только тогда, когда нейрон запускает потенциал действия. [2] По мере того, как потенциал действия распространяется вниз по аксону, он достигает окончания аксона, называемого пресинаптическим бутоном. В пресинаптическом бутоне потенциал действия активирует кальциевые каналы (VDCC), которые вызывают локальный приток кальция. Увеличение кальция фиксируется белками активной зоны и заставляет пузырьки, содержащие нейротрансмиттер, сливаться с мембраной. В результате слияния везикул с мембраной нейротрансмиттеры высвобождаются в синаптическую щель (пространство между пресинаптической бутоном и постсинаптической мембраной). Затем нейротрансмиттеры диффундируют через щель и связываются с лиганд-зависимыми ионными каналами и рецепторами, связанными с G-белком, на постсинаптической мембране. Связывание нейротрансмиттеров с постсинаптическими рецепторами затем вызывает изменения в постсинаптическом нейроне. Процесс высвобождения нейромедиаторов и связывания с постсинаптическим рецептором, вызывающий изменения в постсинаптическом нейроне, называется нейротрансмиссией.
Структура [ править ]

Активная зона присутствует во всех исследованных до сих пор химических синапсах и присутствует у всех видов животных. Рассмотренные до сих пор активные зоны имеют по крайней мере две общие черты: все они имеют плотный белковый материал, который выступает из мембраны и привязывает синаптические везикулы близко к мембране, а также имеют длинные нитевидные отростки, берущие начало у мембраны и заканчивающиеся везикулами, расположенными немного дальше от мембраны. пресинаптическая мембрана. Плотные выступы белка различаются по размеру и форме в зависимости от типа исследуемого синапса. Одним из ярких примеров плотной проекции является ленточный синапс (см. ниже), который содержит «ленту» из плотного белкового материала, окруженную ореолом синаптических пузырьков и простирающуюся перпендикулярно пресинаптической мембране, а ее длина может достигать 500 нм. [3] Глутаматный синапс содержит более мелкие пирамидоподобные структуры, которые простираются примерно на 50 нм от мембраны. [4] Нервно-мышечный синапс содержит два ряда везикул с длинной белковой полоской между ними, соединенной с равномерно расположенными горизонтальными ребрами, идущими перпендикулярно полоске и параллельно мембране. Эти ребра затем соединяются с пузырьками, каждый из которых расположен над выступом в мембране (предположительно кальциевым каналом). [5] Предыдущие исследования показали, что активная зона глутаматергических нейронов содержит очень регулярный массив плотного белкового материала пирамидальной формы, и указали на то, что эти пирамиды соединены нитями. Эта структура напоминала геометрическую решетку, в которой везикулы направлялись в отверстия решетки. [4] Эта привлекательная модель оказалась под вопросом в результате недавних экспериментов. Недавние данные показывают, что глутаматергическая активная зона действительно содержит выступы плотного белкового материала, но эти выступы не располагались в регулярном порядке и содержали длинные нити, выступающие в цитоплазму примерно на 80 нм. [6]
Существует по крайней мере пять основных каркасных белков, которые сосредоточены в активной зоне; UNC13B /Munc13, RIMS1 (молекула, взаимодействующая с Rab3), Фагот, Пикколо /aczonin, ELKS и липрины-α . Считается, что эти каркасные белки являются составляющими плотных пирамидоподобных структур активной зоны и, как полагают, приближают синаптические пузырьки к пресинаптической мембране и кальциевым каналам. Белок ELKS связывается с белком клеточной адгезии , β-нейрексином и другими белками в составе комплекса, такими как Piccolo и Bassoon. [7] Затем β-нейрексин связывается с молекулой клеточной адгезии нейролигином , расположенной на постсинаптической мембране. Затем нейролигин взаимодействует с белками, которые связываются с постсинаптическими рецепторами. Белковые взаимодействия, подобные тем, которые наблюдаются между пикколо/ELKS/β-нейрексином/нейролигином, гарантируют, что механизм, который опосредует слияние везикул, находится в непосредственной близости от кальциевых каналов и что слияние везикул примыкает к постсинаптическим рецепторам. Такое близкое слияние везикул и постсинаптических рецепторов обеспечивает небольшую задержку между активацией постсинаптических рецепторов и высвобождением нейротрансмиттеров.
высвобождения Механизм нейротрансмиттера

Высвобождение нейромедиатора осуществляется путем слияния везикул нейромедиатора с пресинаптической мембраной. Хотя детали этого механизма все еще изучаются, существует консенсус по некоторым деталям процесса. Известно, что слияние синаптических пузырьков с пресинаптической мембраной требует местного увеличения кальция. [9] всего лишь из одного, тесно связанных кальциевых каналов [10] и образование высокостабильных комплексов SNARE . Одна из преобладающих моделей слияния синаптических пузырьков заключается в том, что образование комплекса SNARE катализируется белками активной зоны, такими как Munc18, Munc13 и RIM. Считается, что образование этого комплекса «готовит» везикулу к слиянию везикул и высвобождению нейротрансмиттера (см. ниже: высвобождаемый пул). После того, как везикула примирована, комплексин связывается с комплексом SNARE, это называется «суперпримированием». Суперпраймированные везикулы находятся в легко высвобождаемом пуле (см. ниже) и готовы к быстрому высвобождению. Появление потенциала действия открывает потенциалзависимые кальциевые каналы вблизи комплекса SNARE/комплексин. Затем кальций связывается, изменяя конформацию синаптотагмина . Это изменение конформации позволяет синаптотагмину затем вытеснять комплексин, связываться с комплексом SNARE и связываться с целевой мембраной. Когда синаптотагмин связывается как с комплексом SNARE, так и с мембраной, это вызывает механическое воздействие на мембрану, вызывающее слияние мембраны везикул и пресинаптической мембраны. Это слияние открывает мембранную пору, которая высвобождает нейромедиатор. Пора увеличивается в размерах до тех пор, пока вся мембрана пузырька не станет неотличима от пресинаптической мембраны. [11] [12] [13]
Цикл синаптических пузырьков [ править ]

Пресинаптический бутон имеет эффективно организованный процесс слияния везикул с пресинаптической мембраной для высвобождения нейротрансмиттеров и регенерации везикул нейромедиаторов. Этот процесс, называемый циклом синаптических пузырьков, поддерживает количество пузырьков в пресинаптическом бутоне и позволяет синаптическому терминалу быть автономной единицей. Цикл начинается с (1) участка аппарата Гольджи отщемляется с образованием синаптического пузырька, и этот везикула транспортируется к синаптическому окончанию. На конце (2) везикула заполнена нейромедиатором. (3) Везикула транспортируется в активную зону и пристыковывается в непосредственной близости к плазматической мембране. (4) Во время потенциала действия везикула сливается с мембраной, высвобождает нейромедиатор и позволяет мембранным белкам, ранее находящимся на везикуле, диффундировать в периактивную зону. (5) В периактивной зоне мембранные белки секвестрируются и эндоцитозируются, образуя везикулу , покрытую клатрином . (6) Затем везикула наполняется нейротрансмиттером и транспортируется обратно в активную зону.
Механизм эндоцитоза медленнее механизма экзоцитоза . Это означает, что при интенсивной активности везикула в терминале может истощиться и стать недоступной для высвобождения. Чтобы предотвратить истощение синаптических везикул, увеличение содержания кальция во время интенсивной активности может активировать кальциневрин , который дефосфорилирует белки, участвующие в клатрин-опосредованном эндоцитозе. [14]
Пулы везикул [ править ]
Синапс содержит по крайней мере два кластера синаптических пузырьков: легковысвобождаемый пул и резервный пул. Легковысвобождаемый пул расположен внутри активной зоны и непосредственно связан с пресинаптической мембраной, тогда как резервный пул кластеризован цитоскелетом и не связан напрямую с активной зоной.
Высвобождаемый пул [ править ]
Высвобождаемый пул расположен в активной зоне и связан непосредственно с пресинаптической мембраной. Он стабилизируется белками активной зоны и связывается с пресинаптической мембраной белками SNARE . Эти везикулы готовы к высвобождению посредством единственного потенциала действия и пополняются везикулами из резервного пула. Высвобождаемый пул иногда подразделяют на легковысвобождаемый пул и освобождаемый пул.
Резервный пул [ править ]
Резервный пул не связан напрямую с активной зоной. Увеличение пресинаптической концентрации кальция активирует кальций-кальмодулин-зависимую протеинкиназу (СаМК). СаМК фосфорилирует белок синапсин , который обеспечивает кластеризацию везикул резервного пула и прикрепление к цитоскелету. Фосфорилирование синапсина мобилизует везикулы в резервном пуле и позволяет им мигрировать в активную зону и пополнять легковысвобождаемый пул. [15] [16]
Периактивная зона [ править ]
Периактивная зона окружает активную зону и является местом эндоцитоза пресинаптического окончания. В периактивной зоне каркасные белки, такие как интерсектин 1, рекрутируют белки, которые опосредуют эндоцитоз, такие как динамин , клатрин и эндофилин. [17] У дрозофилы гомолог интерсектина, Dap160, расположен в периактивной зоне нервно-мышечного соединения, а мутантный Dap160 истощает синаптические пузырьки во время высокочастотной стимуляции. [18]
Активная зона ленточного синапса [ править ]
Ленточный синапс представляет собой особый тип синапса, обнаруженный в сенсорных нейронах , таких как фоторецепторные клетки , биполярные клетки сетчатки и волосковые клетки . Ленточные синапсы содержат плотную белковую структуру, которая связывает множество везикул перпендикулярно пресинаптической мембране. На электронной микрофотографии он выглядит как лентообразная структура, перпендикулярная мембране. В отличие от «традиционных» синапсов, ленточные синапсы могут поддерживать постепенное высвобождение везикул. Другими словами, чем более деполяризован нейрон, тем выше скорость слияния пузырьков. Активная зона ленточного синапса разделена на две области: архиформную плотность и ленту. Архиформная плотность является местом слияния везикул, а лента хранит высвобождаемый пул везикул. Ленточная структура состоит в основном из белка RIBEYE, составляющего около 64–69% объема ленты, и привязана к архиформной плотности с помощью каркасных белков, таких как Bassoon. [19]
Белки [ править ]
| Белок | Структура/Функция |
| Структурные белки | |
| Маленький | |
| Для баса | |
| RIM-диски | |
| ELKS (ERC или CAST) | |
| БОЧКА | |
| Как | |
| Липрин-альфа-1 | |
| Стыковка и грунтовка | |
| Работа-13 | |
| Работа-18 | |
| ЛОВУШКИ | |
| SNAP25 | |
| ВАМП2 | |
| синтаксин | Расположен на синаптической мембране и связывается с SNAP-25 и синаптобревином, опосредуя слияние везикул. |
| Цитоскелетные белки | |
| Актин | |
| Тубулин | |
| миозин Множественные молекулы миозина II генерируют силу в скелетных мышцах посредством механизма силового удара, подпитываемого энергией, высвобождаемой в результате гидролиза АТФ. | |
| спектрин | |
| β-катенин | |
| Кальциевый канал | |
| Потенциал-зависимый кальциевый канал (VDCC) | Обеспечивает быстрый приток кальция во время потенциала действия. |
нейротрансмиттеров высвобождения Измерение

Высвобождение нейромедиатора можно измерить путем определения амплитуды постсинаптического потенциала после запуска потенциала действия в пресинаптическом нейроне. Измерение высвобождения нейромедиатора таким способом может быть проблематичным, поскольку эффект постсинаптического нейрона на одно и то же количество высвобождаемого нейромедиатора может меняться со временем. Другой способ — измерить слияние пузырьков с пресинаптической мембраной непосредственно с помощью патч-пипетки . Клеточную мембрану можно рассматривать как конденсатор , в котором положительные и отрицательные ионы накапливаются по обе стороны мембраны. Чем больше площадь мембраны, тем больше ионов необходимо для поддержания определенного потенциала мембраны. В электрофизиологии это означает, что введение тока в терминал займет меньше времени, чтобы зарядить мембрану до заданного потенциала до слияния пузырьков, чем после слияния пузырьков. Время зарядки мембраны до потенциала и измеряется сопротивление мембраны, и с помощью этих значений емкость мембраны может быть рассчитана по уравнению Тау/Сопротивление = Емкость. С помощью этого метода исследователи могут напрямую измерить высвобождение синаптических пузырьков, измеряя увеличение мембранной емкости пресинаптического терминала. [20]
См. также [ править ]
Ссылки [ править ]
- ^ Мисслер М, Зюдхоф ТЦ, Бидерер Т (2012). «Синаптическая клеточная адгезия» . Колд Спринг Харб Перспектива Биол . 4 (4): а005694. doi : 10.1101/cshperspect.a005694 . ПМК 3312681 . ПМИД 22278667 .
- ^ Крейг К. Гарнер и Кан Шен. Структура и функции активных зон позвоночных и беспозвоночных. Структура и функциональная организация синапса. Эд: Йоханнес Хелл и Майкл Элерс. Спрингер, 2008.
- ^ Чжай Р. Грейс; Беллен Хьюго Дж. (2004). «Архитектура активной зоны пресинаптического нервного окончания». Физиология . 19 (5): 262–270. дои : 10.1152/физиол.00014.2004 . ПМИД 15381754 . S2CID 9609266 .
- ^ Jump up to: Перейти обратно: а б Филлипс ГР; и др. (2001). «Сеть пресинаптических частиц: ультраструктура, состав, растворение и восстановление» . Нейрон . 32 (1): 63–77. дои : 10.1016/s0896-6273(01)00450-0 . ПМИД 11604139 . S2CID 5996555 .
- ^ Марк Л.; и др. «Харлоу и др. Архитектура материала активной зоны нервно-мышечного соединения лягушки». Природа . 409 : 2001.
- ^ Сиксу; и др. (2007). «Трехмерная архитектура пресинаптической терминальной цитоматрицы» . Журнал неврологии . 27 (26): 6868–6877. doi : 10.1523/jneurosci.1773-07.2007 . ПМК 6672225 . ПМИД 17596435 .
- ^ Зив, Гарнер (2004). «Клеточные и молекулярные механизмы пресинаптической сборки». Обзоры природы Неврология . 5 (5): 385–399. дои : 10.1038/nrn1370 . ПМИД 15100721 . S2CID 21516580 .
- ^ Георгиев, Данко Д.; Джеймс Ф. Глейзбрук (2007). «Субнейронная обработка информации одиночными волнами и случайными процессами» . В Лышевском, Сергей Эдвард (ред.). Справочник по нано- и молекулярной электронике . Серия «Нано и микроинженерия». ЦРК Пресс. стр. 17-1–17-41. дои : 10.1201/9781315221670-17 . ISBN 978-0-8493-8528-5 . S2CID 199021983 .
- ^ Гейдельбергер; и др. (1994). «Кальций-зависимость скорости экзоцитоза в синаптическом терминале». Природа . 371 (6497): 513–515. Бибкод : 1994Natur.371..513H . дои : 10.1038/371513a0 . ПМИД 7935764 . S2CID 4316464 .
- ^ Стэнли Э.Ф. (1993). «Одиночные кальциевые каналы и высвобождение ацетилхолина в пресинаптическом нервном окончании». Нейрон . 11 (6): 1007–1011. дои : 10.1016/0896-6273(93)90214-c . ПМИД 8274272 . S2CID 7311805 .
- ^ Атасой и Кавалали. Механизм высвобождения нейромедиаторов: компоненты нейронального комплекса SNARE и их функции. Структурная и функциональная организация синаптического ада и Элерса (ред.), 2008 г.
- ^ Панг З.; Судхоф Т. (2010). «Клеточная биология экзоцитоза, запускаемого Ca2+» . Современное мнение в области клеточной биологии . 22 (4): 496–505. дои : 10.1016/j.ceb.2010.05.001 . ПМЦ 2963628 . ПМИД 20561775 .
- ^ Карр К.; Мансон М. (2007). «Отметить командное действие в синапсе» . Отчеты ЭМБО . 8 (9): 834–838. дои : 10.1038/sj.embor.7401051 . ЧВК 1973957 . ПМИД 17767192 .
- ^ Юнг Надя; Хауке Волкер (2007). «Клатрин-опосредованный эндоцитоз в синапсах» . Трафик . 8 (9): 1129–1136. дои : 10.1111/j.1600-0854.2007.00595.x . ПМИД 17547698 . S2CID 11320827 .
- ^ Пинг Чи; Пол Грингард; Тимоти А. Райан (10 апреля 2003 г.). «Мобилизация синаптических везикул регулируется различными путями фосфорилирования синапсина I с разной частотой» . Нейрон . 38 (1): 69–78. дои : 10.1016/S0896-6273(03)00151-X . ПМИД 12691665 . S2CID 17405359 .
- ^ Сеска и др. (2010) Синапсины: ключевые участники функции и пластичности синапсов. Прогресс нейробиологии. Том. 91. 313-348.
- ^ Дергай; и др. (2010). «Интерсектин 1 образует комплексы с SGIP1 и Reps1 в ямках, покрытых клатрином». Связь с биохимическими и биофизическими исследованиями . 402 (2): 408–413. дои : 10.1016/j.bbrc.2010.10.045 . ПМИД 20946875 .
- ^ Мари; и др. (2004). «Dap160/Intersectin поддерживает периактивную зону для достижения высокоточного эндоцитоза и нормального синаптического роста» . Нейрон . 43 (2): 207–219. дои : 10.1016/j.neuron.2004.07.001 . ПМИД 15260957 . S2CID 16296285 .
- ^ Джордж Занацци и Гэри Мэтьюз. Молекулярная архитектура ленточных пресинаптических терминалей. Мол Нейробиол (2009) 39: 130-148.
- ^ Герсдорф Х. и Мэтьюз Г. (1994)Динамика слияния синаптических пузырьков и восстановления мембран в синаптических окончаниях. Природа. Том 367. 735-739.