Арилгалогенид
В органической химии арилгалогенид кольцом , (также известный как галогенарен ) представляет собой ароматическое соединение , в котором один или несколько атомов водорода, непосредственно связанных с ароматическим заменены галогенидом . Галоарены отличаются от галогеналканов , поскольку они имеют множество различий в методах получения и свойствах. Наиболее важными членами являются арилхлориды, но класс соединений настолько широк, что существует множество производных и применений.
Классификация по галоиду
[ редактировать ]Арилфториды
[ редактировать ]Арилфториды используются в качестве синтетических промежуточных продуктов, например, для приготовления фармацевтических препаратов, пестицидов и жидких кристаллов. [ 1 ] Превращение солей диазония в арилфториды — хорошо зарекомендовавший себя путь. Таким образом, анилины являются предшественниками арилфторидов. В классической Шимана реакции тетрафторборат донором фторида является :
- [C 6 H 5 N + 2 ]BF − 4 → C 6 H 5 F + N 2 + BF 3
В некоторых случаях фторидную соль применяют:
- [С 6 Н 5 Н + 2 ]F − → С 6 Ч 5 Ж + Н 2
Многие коммерческие арилфториды производятся из арилхлоридов по процессу Halex . Этот метод часто используется для арилхлоридов, также несущих электроноакцепторные группы . Показательным является синтез 2-фторнитробензола из 2-нитрохлорбензола : [ 2 ]
- O 2 NC 6 H 4 Cl + KF → O 2 NC 6 H 4 F + KCl
Арилхлориды
[ редактировать ]Арилхлориды — это арилгалогениды, производимые в крупнейших коммерческих масштабах: 150 000 тонн в год только в США (1994 г.). Уровень производства снижается из-за экологических проблем. Хлорбензолы используются главным образом в качестве растворителей. [ 3 ]
Галогенирование Фриделя-Крафтса или «прямое хлорирование» является основным путем синтеза. Кислоты Льюиса , например хлорид железа(III) , катализируют реакции. Наиболее широко производимый арилгалогенид, хлорбензол , производится следующим путем: [ 4 ]
- C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl
Монохлорирование бензола сопровождается образованием производных дихлорбензола . [ 3 ] Арены с электронодонорными группами реагируют с галогенами даже в отсутствие кислот Льюиса. Например, фенолы и анилины быстро реагируют с хлорной и бромной водой с образованием мультигалогенированных продуктов. Доступно множество подробных лабораторных процедур. [ 5 ] Для производных алкилбензола, например, толуола , алкильные положения имеют тенденцию к галогенированию под действием свободных радикалов , тогда как галогенирование кольца благоприятствует в присутствии кислот Льюиса. [ 6 ] Обесцвечивание бромной воды богатыми электронами аренами используется в бромном тесте .
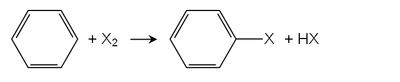
Оксихлорирование : бензола хорошо изучено, что обусловлено отсутствием HCl в качестве побочного продукта при прямом галогенировании [ 3 ]
- 4 C 6 H 6 + 4 HCl + O 2 → 4 C 6 H 5 Cl + H 2 O
Однако эта технология не получила широкого распространения.
Реакцию Гаттермана также можно использовать для превращения солей диазония в хлорбензолы с использованием реагентов на основе меди. Из-за высокой стоимости солей диазония этот метод предназначен для специальных хлоридов.
Арилбромиды
[ редактировать ]Основными промышленно выпускаемыми арилбромидами являются тетрабромфталевый ангидрид , декабромдифениловый эфир и тетрабромбисфенол-А . Эти материалы используются в качестве антипиренов . Их получают прямым бромированием фенолов и ариловых эфиров. Фталевый ангидрид плохо реагирует с бромом, что приводит к необходимости использования кислых сред.
Реакцию Гаттермана также можно использовать для превращения солей диазония в бромбензолы с использованием реагентов на основе меди. Из-за высокой стоимости солей диазония этот метод предназначен только для специальных бромидов.
Арилйодиды
[ редактировать ]Синтетические арилйодиды используются в качестве рентгеноконтрастных веществ , но в остальном эти соединения не производятся в больших масштабах. Арилиодиды являются «легкими» субстратами для многих реакций, таких как реакции кросс-сочетания и превращения в реагенты Гриньяра , но они намного дороже, чем более легкие и менее реакционноспособные арилхлориды и бромиды.
Арилиодиды можно получить обработкой солей диазония йодидными солями. [ 7 ] Арены, богатые электронами, такие как анилин и диметоксипроизводные, непосредственно реагируют с йодом. [ 8 ]
ариллития и арил Реактивы Гриньяра реагируют с йодом с образованием арилгалогенида:
- АрЛи + И 2 → АрИ + ЛиИ
Этот метод применим для получения всех арилгалогенидов. Одним из ограничений является то, что большинство, но не все, [ 9 ] ариллитий и реактивы Гриньяра производят из арилгалогенидов.
Классификация по арильной группе
[ редактировать ]Галогенбензолы и производные галогенбензолов
[ редактировать ]Хотя термин «арилгалогенид» включает галогенированные производные любого ароматического соединения, он обычно относится к галогенбензолам, которые представляют собой конкретно галогенированные производные бензола . Группы галогенбензолов включают фторбензолы , хлорбензолы , бромбензолы и йодбензолы , а также смешанные галогенбензолы, содержащие по крайней мере два разных типа галогенов, связанных с одним и тем же бензольным кольцом. Существует также множество производных галогенбензола .
Галопиридины
[ редактировать ]Галоперидины основаны на ароматическом соединении пиридине . [ 10 ] Сюда входят хлорпиридины и бромпиридины . Хлорпиридины являются важными промежуточными продуктами фармацевтических и агрохимических препаратов .
Галогенированные нафталины
[ редактировать ]Галогенированные нафталины созданы на основе нафталина . Полихлорированные нафталины широко использовались с 1930-х по 1950-е годы в производстве кабелей и конденсаторов из-за их изоляционных, гидрофобных и огнезащитных свойств, но с тех пор их использование для этого было прекращено из-за токсичности, устойчивости к воздействию окружающей среды и внедрения новых материалов. . [ 3 ]
Арилгалогениды в природе
[ редактировать ]Гормоны щитовидной железы трийодтиронин (Т 3 ) и тироксин (Т 4 ) представляют собой арилйодиды. Тетраиодид Т 4 биосинтезируется электрофильным йодированием производного тирозина. [ 11 ] Синтетический Т 4 — одно из наиболее часто назначаемых лекарств в США. [ 12 ]
Многие хлорированные и бромированные ароматические соединения производятся морскими организмами. Источником галогенов являются хлориды и бромиды океанских вод. различные пероксидазы ферменты (например, бромпероксидаза Реакции катализируют ). Многочисленны производные богатых электронами колец, обнаруженных в тирозине, триптофане и различных пирролах. Некоторые из этих природных арилгалогенидов проявляют полезные лечебные свойства. [ 13 ] [ 14 ]


Структурные тенденции
[ редактировать ]Расстояния CX для арилгалогенидов следуют ожидаемой тенденции. Эти расстояния для фторбензола, хлорбензола, бромбензола и метил-4-иодбензоата составляют 135,6(4), 173,90(23), 189,8(1) и 209,9 пм соответственно. [ 15 ]
Реакции
[ редактировать ]Замена
[ редактировать ]В отличие от типичных алкилгалогенидов, арилгалогениды обычно не участвуют в обычных реакциях замещения. Арилгалогениды с электроноакцепторными группами в орто- и пара -положениях могут вступать в реакции S N Ar . Например, 2,4-динитрохлорбензол реагирует в щелочном растворе с образованием фенола.
В отличие от большинства других реакций замещения, фторид является лучшей уходящей группой, а йодид - худшей. [ 16 ] В статье 2018 года указывается, что эта ситуация на самом деле может быть довольно распространенной и возникать в системах, которые, как ранее предполагалось, действуют через механизмы SNAr . [ 17 ]
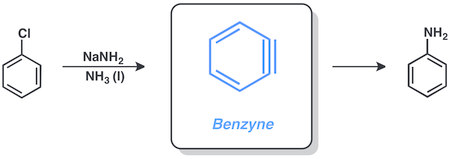
Бензин
[ редактировать ]Арилгалогениды часто реагируют через посредничество бензолов . Хлорбензол и амид натрия реагируют в жидком аммиаке с образованием анилина по этому пути.
Образование металлоорганических реагентов
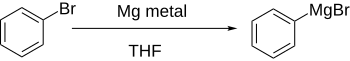
[ редактировать ]Арилгалогениды реагируют с металлами, обычно литием или магнием , с образованием металлоорганических производных, которые действуют как источники ариланионов. В результате реакции обмена металл-галоген арилгалогениды превращаются в ариллитиевые соединения. Показательным является получение фениллития из бромбензола с использованием н -бутиллития ( n -BuLi):
- C 6 H 5 Br + BuLi → C 6 H 5 Li + BuBr
Прямое образование реагентов Гриньяра путем добавления магния к арилгалогениду в эфирном растворе работает хорошо, если ароматическое кольцо не подвергается значительной дезактивации электроноакцепторными группами.
Другие реакции
[ редактировать ]Галогениды могут быть вытеснены сильными нуклеофилами посредством реакций с участием анион-радикалов. Альтернативно арилгалогениды, особенно бромиды и йодиды, подвергаются окислительному присоединению и, таким образом, подвергаются реакциям типа аминирования Бухвальда-Хартвига .
Хлорбензол когда-то был предшественником фенола , который теперь получается путем окисления кумола . При высоких температурах арильные группы реагируют с аммиаком с образованием анилинов. [ 3 ]
Биодеградация
[ редактировать ]Rhodococcusphenolicus — это бактерия, которая разлагает дихлорбензол как единственный источник углерода. [ 18 ]
Приложения
[ редактировать ]Арилгалогениды, производимые в крупнейших масштабах, представляют собой хлорбензол и изомеры дихлорбензола. Одним из основных, но прекращенных применений было использование хлорбензола в качестве растворителя для диспергирования гербицида Лассо. В целом, производство арилхлоридов (также производных нафтила) снижается с 1980-х годов, отчасти из-за экологических проблем. [ 3 ] Трифенилфосфин получают из хлорбензола:
- 3 C 6 H 5 Cl + PCl 3 + 6 Na → P(C 6 H 5 ) 3 + 6 NaCl
Арилбромиды широко используются в качестве антипиренов. Наиболее известным представителем является тетрабромбисфенол-А , который получают прямым бромированием дифенола. [ 19 ]
Ссылки
[ редактировать ]- ^ Симидзу, Масаки; Хияма, Тамеджиро (2005). «Современные методы синтеза фторзамещенных целевых молекул». Angewandte Chemie, международное издание . 44 (2): 214–231. дои : 10.1002/anie.200460441 . ПМИД 15614922 .
- ^ Зигемунд, Гюнтер; Швертфегер, Вернер; Фейринг, Эндрю; Умный, Брюс; Бер, Фред; Фогель, Гервард; МакКьюсик, Блейн (2002). «Соединения фтора органические». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a11_349 . ISBN 978-3527306732 . .
- ^ Перейти обратно: а б с д и ж Бек, Ю.; Лёзер, Э. (2011). «Хлорированные бензолы и другие хлорированные ароматические углеводороды». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.o06_o03 . ISBN 978-3527306732 .
- ^ Питер Бернар, Дэвид Де ла Маре (1976). Пути реакции электрофильного галогенирования, включающие атаку электрофильных галогенов на ненасыщенные соединения . Издательство Кембриджского университета. ISBN 9780521290142 .
- ^ Аткинсон, Эдвард Р.; Мерфи, Дональд М.; Лафкин, Джеймс Э. (1951). « dl -4,4',6,6'-Тетрахлордифеновая кислота». Органические синтезы . 31 : 96. дои : 10.15227/orgsyn.031.0096 .
- ^ Бойд, Роберт В.; Моррисон, Роберт (1992). Органическая химия . Энглвуд Клиффс, Нью-Джерси: Прентис Холл. п. 947. ИСБН 978-0-13-643669-0 .
- ^ Лидей, Филлис А.; Кайхо, Тацуо (2015). «Йод и соединения йода». Энциклопедия промышленной химии Ульмана . стр. 1–13. дои : 10.1002/14356007.a14_381.pub2 . ISBN 9783527306732 .
- ^ Янссен, Дональд Э.; Уилсон, CV (1956). «4-Йодовератрол». Органические синтезы . 36 : 46. дои : 10.15227/orgsyn.036.0046 .
- ^ Снекус, Виктор (1990). «Направленное орто-металлирование. Руководители третичных амидов и О-карбаматов в стратегиях синтеза полизамещенных ароматических соединений». Химические обзоры . 90 (6): 879–933. дои : 10.1021/cr00104a001 .
- ^ Зигемунд, Гюнтер; Швертфегер, Вернер; Фейринг, Эндрю; Умный, Брюс; Бер, Фред; Фогель, Гервард; МакКьюсик, Блейн (2000). «Пиридины и производные пиридина». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a22_399 . ISBN 978-3527306732 .
- ^ Мондал, Сантану; Раджа, Каруппусами; Швейцер, Ульрих; Мугеш, Говиндасами (2016). «Химия и биология в биосинтезе и действии гормонов щитовидной железы». Angewandte Chemie, международное издание . 55 (27): 7606–7630. дои : 10.1002/anie.201601116 . ПМИД 27226395 .
- ^ Брито, Джон П.; Росс, Джозеф С.; Эль Кокги, Омар М.; Марака, Спиридула; Дэн, Ихонг; Шах, Нилай Д.; Липска, Касия Дж. (2021). «Использование левотироксина в США, 2008-2018 гг.» . JAMA Внутренняя медицина . 181 (10): 1402–1405. doi : 10.1001/jamainternmed.2021.2686 . ПМЦ 8218227 . ПМИД 34152370 .
- ^ Фухимори, Даника Галонич ; Уолш, Кристофер Т. (2007). «Что нового в ферментативном галогенировании» . Современное мнение в области химической биологии . 11 (5): 553–60. дои : 10.1016/j.cbpa.2007.08.002 . ПМК 2151916 . ПМИД 17881282 .
- ^ Гриббл, Гордон В. (2004). «Природные органогалогены: новый рубеж для лекарственных средств?». Журнал химического образования . 81 (10): 1441. Бибкод : 2004JChEd..81.1441G . дои : 10.1021/ed081p1441 .
- ^ Оберхаммер, Хайнц (2009). «Структурная химия углерод-галогенных связей». Химия функциональных групп PATai . дои : 10.1002/9780470682531.pat0002 . ISBN 978-0-470-68253-1 .
- ^ Риттер, Тобиас; Хукер, Джейкоб М.; Нойманн, Констанция Н. (июнь 2016 г.). «Согласованное нуклеофильное ароматическое замещение на 19F- и 18F-» . Природа . 534 (7607): 369–373. Бибкод : 2016Natur.534..369N . дои : 10.1038/nature17667 . ISSN 1476-4687 . ПМЦ 4911285 . ПМИД 27281221 .
- ^ Якобсен, Эрик Н.; Харрисон А. Бессер; Цзэн, Ювэнь; Кван, Юджин Э. (сентябрь 2018 г.). «Согласованные нуклеофильные ароматические замещения» . Природная химия . 10 (9): 917–923. Бибкод : 2018НатЧ..10..917К . дои : 10.1038/s41557-018-0079-7 . ISSN 1755-4349 . ПМК 6105541 . ПМИД 30013193 .
- ^ Рефусс, Марк; Урбан, Джеймс (2005). « Rhodococcusphenolicus sp. nov., новый биопроцессор, выделенный актиномицет со способностью разлагать хлорбензол, дихлорбензол и фенол как единственные источники углерода». Систематическая и прикладная микробиология . 28 (8): 695–701. дои : 10.1016/j.syapm.2005.05.011 . ПМИД 16261859 .
- ^ Иоффе, Д.; Кампф, А. (2002). «Бром, органические соединения». Энциклопедия химической технологии Кирка-Отмера . дои : 10.1002/0471238961.0218151325150606.a01 . ISBN 978-0471238966 .