Адсорбция

Адсорбция – это адгезия [ 1 ] атомов на , ионов или молекул из газа, жидкости или растворенного твердого тела поверхность . [ 2 ] Этот процесс создает пленку адсорбата на поверхности адсорбента . Этот процесс отличается от абсорбции , при котором жидкость ( абсорбат ) растворяется или проникает в жидкость или твердое вещество ( абсорбент ). [ 3 ] Хотя адсорбция часто предшествует абсорбции, которая включает перенос абсорбата в объем абсорбирующего материала, альтернативно, адсорбция представляет собой явно поверхностное явление, при котором адсорбат не проникает через поверхность материала в объем адсорбента. [ 4 ] Термин «сорбция» включает в себя как адсорбцию, так и абсорбцию, а десорбция — это процесс, обратный сорбции.
Адсорбция : Увеличение концентрации растворенного вещества на границе раздела конденсированной и жидкой фаз за счет действия поверхностных сил. Адсорбция может происходить и на границе раздела конденсированной и газовой фаз. [ 5 ]
Подобно поверхностному натяжению , адсорбция является следствием поверхностной энергии . В объемном материале все требования к связи (будь то ионные , ковалентные или металлические ) составляющих атомов материала выполняются другими атомами в материале. Однако атомы на поверхности адсорбента не полностью окружены другими атомами адсорбента и поэтому могут притягивать адсорбаты. Точный характер связи зависит от особенностей участвующих веществ, но процесс адсорбции обычно классифицируется как физисорбция (характерная для слабых сил Ван-дер-Ваальса ) или хемосорбция (характерная для ковалентной связи). Это также может произойти из-за электростатического притяжения. [ 6 ] [ 7 ] Характер адсорбции может влиять на структуру адсорбированных частиц. Например, физическая адсорбция полимера из раствора может привести к сплющиванию структур на поверхности. [ 8 ]
Адсорбция присутствует во многих природных, физических, биологических и химических системах и широко используется в промышленных целях, таких как гетерогенные катализаторы , [ 9 ] [ 10 ] активированный уголь , улавливание и использование отходящего тепла для обеспечения холодной водой для кондиционирования воздуха и других технологических нужд ( адсорбционные охладители ), синтетические смолы , увеличение емкости хранения углерода, полученного из карбидов , и очистка воды . Адсорбция, ионный обмен и хроматография — это сорбционные процессы, при которых определенные адсорбаты избирательно переносятся из жидкой фазы на поверхность нерастворимых, жестких частиц, суспендированных в сосуде или упакованных в колонке. Применение в фармацевтической промышленности, в котором адсорбция используется как средство продления неврологического воздействия конкретных лекарств или их частей. [ нужна ссылка ] менее известны.
Слово «адсорбция» было введено в оборот в 1881 году немецким физиком Генрихом Кайзером (1853–1940). [ 11 ]
Изотермы
[ редактировать ]Адсорбцию газов и растворенных веществ обычно описывают с помощью изотерм, то есть количества адсорбата на адсорбенте в зависимости от его давления (если газ) или концентрации (для растворенных веществ в жидкой фазе) при постоянной температуре. Адсорбированное количество почти всегда нормируется по массе адсорбента, чтобы можно было сравнивать различные материалы. На сегодняшний день разработано 15 различных моделей изотерм. [ 12 ]
Дружелюбно
[ редактировать ]Первая математическая аппроксимация изотермы была опубликована Фрейндлихом и Кустером (1906) и представляет собой чисто эмпирическую формулу для газообразных адсорбатов:
где – масса адсорбированного адсорбата, – масса адсорбента, - давление адсорбата (его можно изменить на концентрацию, если исследуется раствор, а не газ), и и – эмпирические константы для каждой пары адсорбент–адсорбат при данной температуре. Эта функция неадекватна при очень высоком давлении, поскольку на самом деле имеет асимптотический максимум при неограниченном увеличении давления. С ростом температуры константы и Изменение отражает эмпирическое наблюдение о том, что адсорбированное количество увеличивается медленнее и для насыщения поверхности требуется более высокое давление.
Ленгмюр
[ редактировать ]Ирвинг Ленгмюр был первым, кто вывел научно обоснованную изотерму адсорбции в 1918 году. [ 13 ] Модель применима к газам, адсорбированным на твердых поверхностях. Это полуэмпирическая изотерма, имеющая кинетическую основу и полученная на основе статистической термодинамики. Это наиболее распространенное уравнение изотермы из-за его простоты и способности соответствовать различным данным по адсорбции. Он основан на четырех предположениях:
- Все центры адсорбции эквивалентны, и каждый сайт может вместить только одну молекулу.
- Поверхность энергетически однородна, адсорбированные молекулы не взаимодействуют.
- нет Фазовых переходов .
- При максимальной адсорбции образуется только монослой. Адсорбция происходит только на локализованных участках поверхности, а не на других адсорбатах.
Эти четыре предположения редко бывают верными: на поверхности всегда есть дефекты, адсорбированные молекулы не обязательно инертны, и механизм адсорбции первых молекул на поверхность явно не один и тот же, что и для последних. Четвертое условие является наиболее неприятным, поскольку зачастую на монослое адсорбируется больше молекул; эта проблема решается с помощью изотермы БЭТ для относительно плоских (немикропористых ) поверхностей. Тем не менее, изотерма Ленгмюра является первым выбором для большинства моделей адсорбции и имеет множество применений в поверхностной кинетике (обычно называемой кинетикой Ленгмюра-Хиншелвуда ) и термодинамике .
Ленгмюр предположил, что адсорбция происходит по такому механизму: , где A — молекула газа, а S — центр адсорбции. Прямая и обратная константы скорости равны k и k −1 . Если мы определим покрытие поверхности, , как доля занятых мест адсорбции, в равновесии имеем:
или
где — парциальное давление газа или молярная концентрация раствора. Для очень низкого давления , и для высоких давлений .
Стоимость трудно измерить экспериментально; обычно адсорбат представляет собой газ, а адсорбированное количество указывается в молях, граммах или объемах газа при стандартной температуре и давлении (STP) на грамм адсорбента. Если назвать v mon СТП-объемом адсорбата, необходимым для образования монослоя на адсорбенте (на грамм адсорбента), то , и получим выражение для прямой:
его наклон и точку пересечения y мы можем получить vmon Через и K , которые являются константами для каждой пары адсорбент-адсорбат при данной температуре. v mon связан с количеством мест адсорбции по закону идеального газа . Если предположить, что количество центров — это просто вся площадь твердого тела, разделенная на поперечное сечение молекул адсорбата, мы легко вычислим площадь поверхности адсорбента. Площадь поверхности адсорбента зависит от его структуры: чем больше в нем пор, тем больше площадь, что оказывает большое влияние на реакции на поверхности .
Если на поверхности адсорбируется более одного газа, определим как доля пустых сайтов, и мы имеем:
Также мы можем определить как доля узлов, занятых j -м газом:
где i — каждый из адсорбируемых газов.
Примечание:
1) Чтобы сделать выбор между уравнениями Ленгмюра и Фрейндлиха, необходимо исследовать энтальпии адсорбции. [ 14 ] В то время как модель Ленгмюра предполагает, что энергия адсорбции остается постоянной в зависимости от занятости поверхности, уравнение Фрейндлиха выводится с предположением, что теплота адсорбции постоянно уменьшается по мере заполнения мест связывания. [ 15 ] Выбор модели, основанной на наилучшем приближении данных, является распространенным заблуждением. [ 14 ]
2) Использование линеаризованной формы модели Ленгмюра больше не является общепринятой практикой. Достижения в вычислительной мощности позволили выполнять нелинейную регрессию быстро и с большей уверенностью, поскольку преобразование данных не требуется.
НО
[ редактировать ]Часто молекулы образуют многослойные слои, то есть некоторые из них адсорбируются на уже адсорбированных молекулах, и изотерма Ленгмюра недействительна. В 1938 году Стивен Брунауэр , Пол Эммет и Эдвард Теллер разработали модель изотермы, учитывающую эту возможность. Их теория называется теорией БЭТ , по инициалам их фамилий. Они модифицировали механизм Ленгмюра следующим образом:
- А (ж) +С ⇌ АС,
- А (г) + АС ⇌ А 2 S,
- А ) +А2С ⇌А3С и ( г так далее.

Вывод формулы сложнее, чем у Ленгмюра (полный вывод см. по ссылкам). Мы получаем:
где x — давление, разделенное на давление паров адсорбата при этой температуре (обычно обозначаемое ), v — объем STP адсорбированного адсорбата, v mon — объем STP количества адсорбата, необходимого для образования монослоя, а c — константа равновесия K, которую мы использовали в изотерме Ленгмюра, умноженная на давление паров адсорбата. Ключевое предположение, использованное при выводе уравнения БЭТ, состоит в том, что последовательные теплоты адсорбции для всех слоев, кроме первого, равны теплоте конденсации адсорбата.
Изотерма Ленгмюра обычно лучше подходит для хемосорбции, а изотерма БЭТ лучше подходит для физической адсорбции на немикропористых поверхностях.
Кислюк
[ редактировать ]
В других случаях молекулярные взаимодействия между молекулами газа, ранее адсорбированными на твердой поверхности, образуют значительные взаимодействия с молекулами газа в газовых фазах. Следовательно, адсорбция молекул газа на поверхности с большей вероятностью будет происходить вокруг молекул газа, которые уже присутствуют на твердой поверхности, что делает изотерму адсорбции Ленгмюра неэффективной для целей моделирования. Этот эффект был изучен в системе, где адсорбатом был азот, а адсорбентом вольфрам, Павел Кислюк (1922–2008) в 1957 году. [ 16 ] Чтобы компенсировать повышенную вероятность адсорбции вокруг молекул, присутствующих на поверхности подложки, Кислюк разработал теорию состояния-предшественника, согласно которой молекулы переходят в состояние-предшественник на границе между твердым адсорбентом и адсорбатом в газовой фазе. Отсюда молекулы адсорбата либо адсорбируются на адсорбенте, либо десорбируются в газовую фазу. Вероятность адсорбции, происходящей из состояния предшественника, зависит от близости адсорбата к другим молекулам адсорбата, которые уже адсорбировались. Если молекула адсорбата в состоянии-предшественнике находится в непосредственной близости от молекулы адсорбата, которая уже образовалась на поверхности, она имеет вероятность прилипания, отражаемую размером константы S E , и либо будет адсорбироваться из состояния-предшественника со скоростью k или будет EC десорбироваться в газовую фазу со скоростью k ES . Если молекула адсорбата переходит в состояние предшественника в месте, удаленном от любых других ранее адсорбированных молекул адсорбата, вероятность прилипания отражается размером S Д постоянная.
Эти факторы были включены как часть единой константы, называемой «коэффициентом прилипания», k E , описанной ниже:
Поскольку SD определяется факторами, которые учитываются в модели Ленгмюра, SD можно принять за константу скорости адсорбции. Однако константа скорости модели Кислюка ( R ') отличается от константы скорости модели Ленгмюра, поскольку R ' используется для представления влияния диффузии на образование монослоя и пропорциональна квадратному корню из коэффициента диффузии системы. Изотерма адсорбции Кислюка записывается следующим образом, где θ ( t ) — фракционное покрытие адсорбента адсорбатом, а t — время погружения:
Решение для θ ( t ) дает:
Энтальпия адсорбции
[ редактировать ]Константы адсорбции являются константами равновесия , поэтому подчиняются уравнению Ван'т-Гоффа :
Как видно из формулы, изменение K должно быть изостерическим, то есть при постоянном покрытии. Если мы начнем с изотермы БЭТ и предположим, что изменение энтропии одинаково при сжижении и адсорбции, мы получим
иными словами, адсорбция более экзотермична, чем сжижение.
Одномолекулярное объяснение
[ редактировать ]Адсорбцию ансамбля молекул на поверхности или границе раздела можно разделить на два процесса: адсорбцию и десорбцию. Если скорость адсорбции превосходит скорость десорбции, молекулы будут накапливаться с течением времени, образуя кривую адсорбции с течением времени. Если скорость десорбции больше, количество молекул на поверхности со временем будет уменьшаться. Скорость адсорбции зависит от температуры, скорости диффузии растворенного вещества (относительной длины свободного пробега для чистого газа) и энергетического барьера между молекулой и поверхностью. Диффузию и ключевые элементы скорости адсорбции можно рассчитать с использованием законов диффузии Фика и соотношения Эйнштейна (кинетическая теория) . В идеальных условиях, когда нет энергетического барьера и все молекулы, которые диффундируют и сталкиваются с поверхностью, адсорбируются, количество адсорбированных молекул на поверхности площади на поверхности бесконечной площади можно напрямую проинтегрировать из дифференциального уравнения второго закона Фика следующим образом: [ 17 ]
где - площадь поверхности (единица м 2 ), - числовая концентрация молекулы в объемном растворе (ед. #/м 3 ), – константа диффузии (единицы м 2 /песок время (единицы с). Дальнейшее моделирование и анализ этого уравнения [ 18 ] показывают, что корневая зависимость от времени обусловлена уменьшением концентрации вблизи поверхности в идеальных условиях адсорбции. Кроме того, это уравнение работает только для начала адсорбции, когда вблизи поверхности формируется устойчивый градиент концентрации. Поправку на уменьшение площади адсорбции и замедление развития градиента концентрации необходимо учитывать в течение более длительного времени. [ 19 ] В реальных экспериментальных условиях поток и небольшая площадь адсорбции всегда увеличивают скорость адсорбции, чем предсказывает это уравнение, а энергетический барьер либо ускоряет эту скорость за счет поверхностного притяжения, либо замедляет ее за счет поверхностного отталкивания. Таким образом, предсказание этого уравнения часто на несколько порядков отличается от экспериментальных результатов. В особых случаях, таких как очень маленькая площадь адсорбции на большой поверхности, а также при химическом равновесии , когда вблизи поверхности нет градиента концентрации, это уравнение становится полезным для прогнозирования скорости адсорбции с дискуссионной особой тщательностью для определения конкретного значения в конкретном измерении. [ 18 ]
Десорбция молекулы с поверхности зависит от энергии связи молекулы с поверхностью и температуры. Таким образом, типичная общая скорость адсорбции часто представляет собой совокупный результат адсорбции и десорбции.
Квантово-механическое – термодинамическое моделирование площади поверхности и пористости
[ редактировать ]С 1980 года разрабатывались две теории, объясняющие адсорбцию и получающие работающие уравнения. Эти два называются гипотезой хи, квантовомеханическим выводом и избыточной поверхностной работой (ESW). [ 20 ] Обе эти теории приводят к одному и тому же уравнению для плоских поверхностей:
где U — единичная ступенчатая функция. Определения остальных символов следующие:
где «ads» означает «адсорбированный», «m» означает «эквивалентность монослоя», а «vap» относится к давлению паров жидкого адсорбента при той же температуре, что и твердый образец. Единичная функция определяет молярную энергию адсорбции первой адсорбированной молекулы следующим образом:
Сюжет адсорбированный по сравнению с называется сюжетом ци. Для плоских поверхностей наклон графика хи дает площадь поверхности. заметил, что этот график очень хорошо соответствует изотерме. Эмпирически Майкл Поланьи [ 21 ] [ 22 ] [ 23 ] а также Ян Хендрик де Бур и Корнелис Цвиккер. [ 24 ] но не преследуется. Это произошло из-за критики в первом случае со стороны Альберта Эйнштейна , а во втором - со стороны Брунауэра. Это уравнение плоской поверхности можно использовать в качестве «стандартной кривой» в обычной традиции кривых сравнения, за исключением того, что ранняя часть графика пористого образца против выступает в качестве эталона. С помощью этого метода можно анализировать ультрамикропористые, микропористые и мезопористые состояния. Типичные стандартные отклонения для подгонки полной изотермы, включая пористые образцы, составляют менее 2%.
Обратите внимание, что в этом описании физической адсорбции энтропия адсорбции соответствует термодинамическому критерию Дубинина, то есть энтропия адсорбции из жидкого состояния в адсорбированное состояние примерно равна нулю.
Адсорбенты
[ редактировать ]Характеристики и общие требования
[ редактировать ]
Адсорбенты применяют обычно в виде сферических таблеток, стержней, формованных изделий или монолитов с гидродинамическим радиусом от 0,25 до 5 мм. Они должны иметь высокую стойкость к истиранию , высокую термическую стабильность и малый диаметр пор, что приводит к увеличению площади открытой поверхности и, следовательно, к высокой адсорбционной способности. Адсорбенты также должны иметь четкую пористую структуру, обеспечивающую быстрый перенос газообразных паров. [ 25 ] Большинство промышленных адсорбентов относятся к одному из трех классов:
- Кислородсодержащие соединения – обычно гидрофильны и полярны, включая такие материалы, как силикагель , известняк (карбонат кальция). [ 26 ] и цеолиты .
- Соединения на основе углерода. Обычно они гидрофобны и неполярны, включая такие материалы, как активированный уголь и графит .
- Соединения на полимерной основе. Являются полярными или неполярными, в зависимости от функциональных групп в полимерной матрице.
Силикагель
[ редактировать ]
Силикагель представляет собой химически инертную, нетоксичную, полярную и стабильную по размерам (< 400 °C или 750 °F) аморфную форму SiO 2 . Его получают в результате реакции между силикатом натрия и уксусной кислотой, за которой следует ряд процессов последующей обработки, таких как старение, травление и т. д. Эти методы последующей обработки приводят к различному распределению пор по размерам.
Кремнезем используется для осушки технологического воздуха (например, кислорода, природного газа) и адсорбции тяжелых (полярных) углеводородов из природного газа.
Цеолиты
[ редактировать ]Цеолиты представляют собой природные или синтетические кристаллические алюмосиликаты , которые имеют повторяющуюся сеть пор и выделяют воду при высокой температуре. Цеолиты полярны по своей природе.
Их производят гидротермальным синтезом алюмосиликата натрия или другого источника кремнезема в автоклаве с последующим ионным обменом с определенными катионами (Na + , Что + , Как 2+ , К + , НХ 4 + ). Диаметр каналов цеолитовых каркасов обычно составляет от 2 до 9 Å . После процесса ионного обмена происходит сушка кристаллов, которые можно гранулировать со связующим для получения макропористых таблеток.
Цеолиты применяются для осушки технологического воздуха, удаления CO 2 из природного газа, удаления CO из газа риформинга, разделения воздуха, каталитического крекинга , а также каталитического синтеза и риформинга.
Неполярные (кремнистые) цеолиты синтезируют из безалюминиевых источников кремнезема или деалюминированием алюминийсодержащих цеолитов. Процесс деалюминирования осуществляется путем обработки цеолита паром при повышенных температурах, обычно превышающих 500 ° C (930 ° F). Эта высокотемпературная термообработка разрывает связи алюминий-кислород, и атом алюминия выталкивается из каркаса цеолита.
Активированный уголь
[ редактировать ]Сам термин «адсорбция» был введен Генрихом Кайзером в 1881 году в контексте поглощения газов углеродами. [ 27 ]
Активированный уголь представляет собой высокопористое аморфное твердое вещество, состоящее из микрокристаллитов с графитовой решеткой, обычно приготовленное в виде небольших таблеток или порошка. Он неполярный и дешевый. Одним из его основных недостатков является то, что он реагирует с кислородом при умеренных температурах (более 300 °С).

Активированный уголь может быть изготовлен из углеродистого материала, включая уголь (битуминозный, суббитуминозный и бурый уголь), торф, древесину или скорлупу орехов (например, кокосового ореха). Производственный процесс состоит из двух этапов: карбонизации и активации. [ 28 ] [ 29 ] Процесс карбонизации включает сушку, а затем нагрев для отделения побочных продуктов, включая смолы и другие углеводороды, от сырья, а также для удаления образующихся газов. Процесс завершается нагреванием материала до температуры выше 400 °C (750 °F) в бескислородной атмосфере, которая не может поддерживать горение. Карбонизированные частицы затем «активируются», подвергаясь воздействию окислителя, обычно пара или диоксида углерода, при высокой температуре. Этот агент сжигает структуры, блокирующие поры, созданные во время фазы карбонизации, и таким образом образуется пористая трехмерная графитовая решетчатая структура. Размер пор, образующихся во время активации, зависит от времени, которое они проводят на этой стадии. Более длительное время воздействия приводит к увеличению размера пор. Наиболее популярные углероды в водной фазе имеют битумную основу из-за их твердости, устойчивости к истиранию, распределения пор по размерам и низкой стоимости, но их эффективность необходимо проверять в каждом применении, чтобы определить оптимальный продукт.
Активированный уголь используется для адсорбции органических веществ. [ 30 ] и неполярные адсорбаты, а также обычно используются для очистки отходящих газов (и сточных вод). Это наиболее широко используемый адсорбент, поскольку большинство его химических (например, поверхностных групп) и физических свойств (например, распределения пор по размерам и площади поверхности) можно регулировать в соответствии с потребностями. [ 31 ] Его полезность также обусловлена его большим объемом микропор (а иногда и мезопор) и, как следствие, большой площадью поверхности. В недавних исследовательских работах сообщалось, что активированный уголь является эффективным агентом для адсорбции катионных разновидностей токсичных металлов из систем с множеством загрязнителей, а также были предложены возможные механизмы адсорбции с подтверждающими доказательствами. [ 32 ]
Адсорбция воды
[ редактировать ]Адсорбция воды на поверхности имеет широкое значение в химической технологии , материаловедении и катализе . Присутствие физически или химически адсорбированной воды на поверхности твердых тел, также называемое поверхностной гидратацией, играет важную роль в управлении свойствами интерфейса, путями химических реакций и каталитическими характеристиками в широком диапазоне систем. В случае физически адсорбированной воды поверхностную гидратацию можно устранить просто путем сушки при температуре и давлении, обеспечивающих полное испарение воды. Для химически адсорбированной воды гидратация может протекать либо в форме диссоциативной адсорбции , при которой молекулы H 2 O диссоциируют на адсорбированные на поверхности -H и -OH, либо в форме молекулярной адсорбции (ассоциативной адсорбции), при которой отдельные молекулы воды остаются неповрежденными. [ 33 ]
Адсорбционное солнечное отопление и хранение
[ редактировать ]Низкая стоимость (200 долларов США за тонну) и высокая скорость цикла (2000 ×) синтетических цеолитов, таких как Linde 13X с водным адсорбатом, в последнее время вызвали большой академический и коммерческий интерес в связи с использованием для хранения тепловой энергии (TES), особенно низкопотенциальной солнечной энергии. и отходящее тепло. С 2000 года по настоящее время (2020 год) в ЕС было профинансировано несколько пилотных проектов. [ нужна ссылка ] Основная концепция заключается в сохранении солнечной тепловой энергии в виде скрытой химической энергии в цеолите. Обычно горячий сухой воздух из плоских солнечных коллекторов пропускается через слой цеолита, так что любой присутствующий водный адсорбат удаляется. Хранение может быть дневным, еженедельным, ежемесячным или даже сезонным в зависимости от объема цеолита и площади солнечных тепловых панелей. Когда требуется тепло ночью, в пасмурные часы или зимой, через цеолит проходит увлажненный воздух. Поскольку влага адсорбируется цеолитом, тепло выделяется в воздух, а затем и в пространство здания. Эту форму TES со специфическим использованием цеолитов впервые преподавал Джон Герра в 1978 году. [ 34 ]
Улавливание и хранение углерода
[ редактировать ]Типичными адсорбентами, предлагаемыми для улавливания и хранения углерода, являются цеолиты и МОК . [ 35 ] Адаптация адсорбентов делает их потенциально привлекательной альтернативой абсорбции. Поскольку адсорбенты можно регенерировать за счет колебаний температуры или давления, этот этап может быть менее энергоемким, чем методы абсорбционной регенерации. [ 36 ] Основными проблемами, связанными со стоимостью адсорбции при улавливании углерода, являются: регенерация адсорбента, массовое соотношение, растворитель/MOF, стоимость адсорбента, производство адсорбента, срок службы адсорбента. [ 37 ]
В технологии конверсии водяного газа с усиленной сорбцией (SEWGS) процесс улавливания углерода перед сжиганием, основанный на адсорбции твердых веществ, сочетается с реакцией конверсии водяного газа (WGS) для получения потока водорода под высоким давлением. [ 38 ] Полученный поток CO 2 можно хранить или использовать для других промышленных процессов. [ 39 ]
Адсорбция белков и поверхностно-активных веществ
[ редактировать ]Адсорбция белка — это процесс, который играет фундаментальную роль в области биоматериалов . Действительно, поверхности биоматериалов, контактирующие с биологическими средами, такими как кровь или сыворотка, немедленно покрываются белками. Следовательно, живые клетки взаимодействуют не непосредственно с поверхностью биоматериала, а со слоем адсорбированных белков. Этот белковый слой опосредует взаимодействие между биоматериалами и клетками, переводя физические и химические свойства биоматериала на «биологический язык». [ 40 ] Фактически, клеточной мембраны рецепторы связываются с биоактивными участками белкового слоя, и эти события связывания рецептор-белок передаются через клеточную мембрану таким образом, что стимулируют специфические внутриклеточные процессы, которые затем определяют клеточную адгезию, форму, рост и дифференцировку. На адсорбцию белка влияют многие свойства поверхности, такие как смачиваемость поверхности , химический состав поверхности. [ 41 ] и морфология поверхности в нанометровом масштабе. [ 42 ] Адсорбция поверхностно-активных веществ - аналогичное явление, но с использованием молекул поверхностно-активных веществ вместо белков. [ 43 ]
Адсорбционные охладители
[ редактировать ]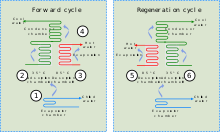
, сочетающие адсорбент с хладагентом, Адсорбционные охладители используют тепло для обеспечения охлаждающего эффекта. Это тепло в виде горячей воды может поступать из любого количества промышленных источников, включая отходящее тепло промышленных процессов, основное тепло солнечных тепловых установок или тепло выхлопных газов или водяной рубашки поршневого двигателя или турбины.
есть сходство Хотя между адсорбционными охладителями и абсорбционным охлаждением , первое основано на взаимодействии газов и твердых веществ. Адсорбционная камера чиллера заполнена твердым материалом (например, цеолитом, силикагелем, оксидом алюминия, активированным углем или некоторыми типами солей металлов), который в нейтральном состоянии адсорбировал хладагент. При нагревании твердое вещество десорбирует (выделяет) пары хладагента, которые впоследствии охлаждаются и сжижаются. Этот жидкий хладагент затем обеспечивает охлаждающий эффект в испарителе за счет своей энтальпии испарения . На заключительном этапе пары хладагента (ре)адсорбируются твердым веществом. [ 44 ] Поскольку адсорбционный охладитель не требует компрессора, он относительно тихий.
Адсорбция, опосредованная портальным сайтом
[ редактировать ]Адсорбция, опосредованная портальными сайтами, представляет собой модель сайт-селективной адсорбции активированного газа в металлических каталитических системах, которые содержат множество различных центров адсорбции. В таких системах низкокоординационные участки, подобные дефектам «край и угол», могут демонстрировать значительно более низкие энтальпии адсорбции, чем высококоординационные ( базальная плоскость ). В результате эти участки могут служить «порталами» для очень быстрой адсорбции на остальную поверхность. Это явление основано на обычном эффекте «побочного эффекта» (описанном ниже), когда определенные адсорбированные частицы проявляют высокую подвижность на некоторых поверхностях. Модель объясняет, казалось бы, противоречивые наблюдения термодинамики и кинетики адсорбции газа в каталитических системах, где поверхности могут существовать в диапазоне координационных структур, и она была успешно применена к биметаллическим каталитическим системам, где наблюдается синергетическая активность.
В отличие от чистого перелива, адсорбция в портальном центре относится к поверхностной диффузии к соседним местам адсорбции, а не к неадсорбирующим опорным поверхностям.
Модель, по-видимому, была впервые предложена для монооксида углерода на платине, нанесенной на кремнезем, Брандтом и др. (1993). [ 45 ] Похожая, но независимая модель была разработана Кингом и его коллегами. [ 46 ] [ 47 ] [ 48 ] для описания адсорбции водорода на щелочно-промотированных рутениевым, серебро-рутениевым и медно-рутениевым катализаторах на носителе из кремнезема. Та же группа применила эту модель к гидрированию CO ( синтез Фишера-Тропша ). [ 49 ] Зупанк и др. (2002) впоследствии подтвердили ту же модель адсорбции водорода на биметаллических катализаторах цезия-рутения на носителе магнезии. [ 50 ] Тренс и др. (2009) аналогичным образом описали поверхностную диффузию CO на частицах Pt различной морфологии на углеродном носителе. [ 51 ]
Адсорбционный перелив
[ редактировать ]В случае каталитических или адсорбентных систем, где частицы металла диспергированы на материале носителя (или носителе) (часто квазиинертные оксиды, такие как оксид алюминия или кремнезем), адсорбирующие вещества могут косвенно адсорбироваться на поверхности носителя под действием условия, когда такая адсорбция термодинамически невыгодна. Присутствие металла служит низкоэнергетическим путем для газообразных частиц, которые сначала адсорбируются на металле, а затем диффундируют на поверхность носителя. Это возможно, поскольку адсорбированные частицы достигают более низкого энергетического состояния после адсорбции на металле, тем самым снижая активационный барьер между частицами газовой фазы и частицами, адсорбированными на носителе.
Перелив водорода является наиболее распространенным примером адсорбционного перелива. В случае водорода адсорбция чаще всего сопровождается диссоциацией молекулярного водорода (H 2 ) на атомарный водород (H) с последующим перетоком присутствующих атомов водорода.
Спилловер-эффект использовался для объяснения многих наблюдений в области гетерогенного катализа и адсорбции. [ 52 ]
Адсорбция полимеров
[ редактировать ]Адсорбция молекул на полимерных поверхностях играет центральную роль в ряде применений, включая разработку антипригарных покрытий и различных биомедицинских устройств. Полимеры также могут адсорбироваться на поверхностях посредством адсорбции полиэлектролита .
В вирусах
[ редактировать ]Адсорбция является первым шагом в жизненном цикле вируса . Следующие шаги — проникновение, снятие покрытия, синтез (при необходимости транскрипция и трансляция) и высвобождение. Цикл репликации вируса в этом отношении одинаков для всех типов вирусов. Такие факторы, как транскрипция, могут быть необходимы, а могут и не потребоваться, если вирус способен интегрировать свою геномную информацию в ядро клетки или если вирус может реплицировать себя непосредственно в цитоплазме клетки.
В популярной культуре
[ редактировать ]Тетрис — это игра-головоломка, в которой блоки по 4 штуки прикрепляются к поверхности во время игры. Ученые использовали блоки Тетриса «как аналог молекул сложной формы» и их «адсорбцию на плоской поверхности» для термодинамики наночастиц изучения . [ 53 ] [ 54 ]
См. также
[ редактировать ]- Адатом
- Криоадсорбция
- Двухполяризационная интерферометрия
- Концентратор с псевдоожиженным слоем
- Силовой микроскоп с зондом Кельвина
- Микромеритика
- Молекулярное сито
- Адсорбция Поланьи
- Адсорбция при переменном давлении
- Случайная последовательная адсорбция
- Органический каркас с водородными связями
Ссылки
[ редактировать ]- ^ Гугурге, Амила Руван (17 февраля 2021 г.). «Абсорбция против адсорбции» . Химическая и технологическая инженерия . Проверено 26 ноября 2023 г.
- ^ «Глоссарий» . Центр поддержки технологий восстановления заброшенных земель и земель. Архивировано из оригинала 18 февраля 2008 г. Проверено 21 декабря 2009 г.
- ^ «поглощение (химия)» . Словарь/тезаурус Memidex (WordNet) . Архивировано из оригинала 05 октября 2018 г. Проверено 2 ноября 2010 г.
- ^ Аткинс, П.В.; Де Паула, Хулио; Килер, Джеймс (2018). Физическая химия Аткинса (Одиннадцатое изд.). Оксфорд, Великобритания. ISBN 978-0-19-876986-6 . OCLC 1020028162 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) [ нужна страница ] - ^ «адсорбция» . Золотая книга . ИЮПАК. 2014. doi : 10.1351/goldbook.A00155 . Проверено 1 апреля 2024 г.
- ^ Феррари, Л.; Кауфманн Дж.; Виннефельд, Ф.; Планк, Дж. (2010). «Взаимодействие модельных систем цемента с суперпластификаторами, исследованное методами атомно-силовой микроскопии, дзета-потенциала и адсорбционных измерений». J. Наука о коллоидном интерфейсе. 347 (1): 15–24. Бибкод : 2010JCIS..347...15F . дои : 10.1016/j.jcis.2010.03.005 . ПМИД 20356605 .
- ^ Хосровшахи, Мобин Сафарзаде; Абдол, Мохаммед Али; Мешхадимуслем, Хосейн; Хакпур, Эльназ; Эмруз, Хосейн Банна Мотехаддед; Садегзаде, Садег; Гаеми, Ахад (26 мая 2022 г.). «Роль химии поверхности в адсорбции CO2 пористым углем, полученным из биомассы, по экспериментальным результатам и молекулярно-динамическому моделированию» . Научные отчеты . 12 (1): 8917. Бибкод : 2022NatSR..12.8917K . дои : 10.1038/s41598-022-12596-5 . ПМЦ 9135713 . ПМИД 35618757 . S2CID 249096513 .
- ^ Кэрролл, Грегори Т.; Йонгежан, генеральный директор Махтильд; Пайпер, Дирк; Феринга, Бен Л. (2010). «Спонтанная генерация и формирование рисунка тороидов с хиральной полимерной поверхностью» . Химическая наука . 1 (4): 469. doi : 10.1039/c0sc00159g . ISSN 2041-6520 . S2CID 96957407 .
- ^ Челей, К.; Цвика, К.; Куржидловски, К.Дж. (май 2016 г.). «Стабильность CO 2 на поверхностях Ni с низким индексом: анализ DFT с поправкой Ван дер Ваальса». Катализные коммуникации . 80 (5): 33–38. дои : 10.1016/j.catcom.2016.03.017 .
- ^ Челей, К.; Цвика, К.; Кольменарес, Х.К.; Куржидловски, К.Дж. (2016). «Взгляд на взаимодействие промежуточных продуктов селективного окисления метанола с Au- или/и Pd-содержащими монометаллическими и биметаллическими катализаторами Core@Shell». Ленгмюр . 32 (30): 7493–7502. doi : 10.1021/acs.langmuir.6b01906 . ПМИД 27373791 .
- ^ Кайзер, Генрих (1881). «О сжатии газов на поверхностях в зависимости от давления и температуры» . Анналы физики и химии . 248 (4): 526–537. Бибкод : 1881АнП...248..526К . дои : 10.1002/andp.18812480404 . . В этом исследовании адсорбции газов углем слово «адсорбция» впервые употребляется на стр. 527: «Соссюр уже знал два фактора, определяющие величину адсорбции, — давление и температуру, поскольку они понижают давления или повышения температуры, чтобы освободить пористые тела от газов». («Соссюр уже знал два фактора, определяющие величину адсорбции, — [а именно] давление и температуру, — поскольку он использовал понижение давления или повышение температуры для освобождения пористых веществ от газов».)
- ^ Фу, Кентукки; Хамид, Б.Х. (2010). «Взгляд на моделирование систем изотерм адсорбции». Химико-технологический журнал . 156 (1): 2–10. дои : 10.1016/j.cej.2009.09.013 . ISSN 1385-8947 . S2CID 11760738 .
- ^ Чепирский, Л.; Балис, г-н; Коморовска-Чепирска, Э. (2000). «Некоторые обобщения изотермы адсорбции Ленгмюра» . Интернет-журнал химии . 3 (14). ISSN 1099-8292 . Архивировано из оригинала 13 января 2017 г. Проверено 19 ноября 2013 г.
- ^ Перейти обратно: а б Берк Г.М., Вурстер Д.Э., Бурафачип В., Берг М.Дж., Венг-Педерсен П., Шоттелиус Д.Д. Выбор модели адсорбции фенобарбитала активированным углем. Фарм Рез. 1991;8(2):228-231. дои:10.1023/а:1015800322286
- ^ Физическая химия поверхностей. Артур В. Адамсон. Interscience (Wiley), Нью-Йорк, 6-е изд.
- ^ Кислюк П. (январь 1957 г.). «Вероятности прилипания газов, хемосорбированных на поверхности твердых тел». Журнал физики и химии твердого тела . 3 (1–2): 95–101. Бибкод : 1957JPCS....3...95K . дои : 10.1016/0022-3697(57)90054-9 .
- ^ Ленгмюр, И.; Шефер, VJ (1937). «Влияние растворенных солей на нерастворимые монослои». Журнал Американского химического общества . 29 (11): 24:00–24:14. дои : 10.1021/ja01290a091 .
- ^ Перейти обратно: а б Чен, Цзисинь (2020). «Стохастическая адсорбция молекул разбавленных растворенных веществ на границах раздела фаз». ChemRxiv . doi : 10.26434/chemrxiv.12402404 . S2CID 242860958 .
- ^ Уорд, AFH; Тордай, Л. (1946). «Зависимость граничных натяжений решений от времени. I. Роль диффузии во временных эффектах». Журнал химической физики . 14 (7): 453–461. Бибкод : 1946JChPh..14..453W . дои : 10.1063/1.1724167 .
- ^ Кондон, Джеймс (2020). Определение площади поверхности и пористости методами физисорбции, измерения, классической теории и квантовой теории, 2-е издание . Амстердам.НЛ: Эльзевир. стр. Главы 3, 4 и 5. ISBN. 978-0-12-818785-2 .
- ^ Поланьи, М. (1914). «Об адсорбции с точки зрения третьего закона теплопроводности». Переговоры Немецкого физического общества (на немецком языке). 16 :1012.
- ^ Поланьи, М. (1920). «Новости об адсорбции и причине адсорбционных сил». Журнал электрохимии . 26 :370-374.
- ^ Поланьи, М. (1929). «Основы потенциальной теории адсорбции». Журнал электрохимии (на немецком языке). 35 : 431-432.
- ^ деБоер, Дж. Х.; Цвиккер, К. (1929). «Адсорбция как следствие поляризации». Журнал физической химии (на немецком языке). Б3 : 407-420.
- ^ Йи, Хунхун (апрель 2015 г.). «Влияние пористой структуры адсорбента на разделение газовых смесей углекислого газа и метана» . Журнал химических и инженерных данных . 60 (5): 1388–1395. дои : 10.1021/je501109q . Проверено 21 апреля 2023 г.
- ^ Вишвамбари Деви, Р.; Наир, Виджай В.; Сатьямурти, П; Добле, Мукеш (2022). «Смесь полиморфов CaCO 3 служит лучшим адсорбентом тяжелых металлов в четверной системе». Журнал опасных, токсичных и радиоактивных отходов . 26 (1). doi : 10.1061/(ASCE)HZ.2153-5515.0000651 . S2CID 240454883 .
- ^ Чечен, Ферхан (7 июля 2011 г.). «Очистка воды и сточных вод: историческая перспектива адсорбции активированным углем и ее интеграции в биологические процессы» (PDF) . application.wiley-vch.de . Проверено 23 августа 2024 г.
- ^ Спессато, Л. и др. КОН-суперактивированный уголь из отходов биомассы: понимание механизма адсорбции парацетамола и циклов термической регенерации. Журнал опасных материалов, Vol. 371, страницы 499–505, 2019.
- ^ Спессато, Л. и др. Оптимизация препарата активированного угля Сибипируна путем создания смеси симплекс-центроид для одновременной адсорбции родамина Б и метформина. Журнал опасных материалов, Vol. 411, стр. 125166, 2021.
- ^ Мальхотра, Милан; Суреш, Сумати; Гарг, Анураг (2018). «Активированный уголь, полученный из чайных отходов, для адсорбции диклофенака натрия из сточных вод: характеристики адсорбента, изотермы адсорбции, кинетика и термодинамика». Наука об окружающей среде и исследования загрязнения . 25 (32): 32210–32220. Бибкод : 2018ESPR...2532210M . дои : 10.1007/s11356-018-3148-y . ПМИД 30221322 . S2CID 52280860 .
- ^ Бланкеншип, Л. Скотт; Мокая, Роберт (21 февраля 2022 г.). «Модуляция пористости углей для улучшения адсорбции водорода, углекислого газа и метана: обзор» . Достижения в области материалов . 3 (4): 1905–1930. дои : 10.1039/D1MA00911G . ISSN 2633-5409 . S2CID 245927099 .
- ^ Мохан, С; Наир, Виджай V (2020). «Сравнительное исследование отделения тяжелых металлов из фильтрата с использованием активированного угля и топливной золы». Журнал опасных, токсичных и радиоактивных отходов . 24 (4): 473–491. doi : 10.1061/(ASCE)HZ.2153-5515.0000520 . ПМИД 04020031 . S2CID 219747988 .
- ^ Ассади, М. Хусейн Н.; Ханаор, Дориан А.Х. (июнь 2016 г.). «Влияние легирования медью на фотокаталитическую активность в плоскостях (101) анатаза TiO2: теоретическое исследование». Прикладная наука о поверхности . 387 (387): 682–689. arXiv : 1811.09157 . Бибкод : 2016ApSS..387..682A . дои : 10.1016/j.apsusc.2016.06.178 . S2CID 99834042 .
- ^ Патент США. №4269170 «Адсорбционное солнечное отопление и хранение»; Изобретатель: Джон М. Герра; Выдано 26 мая 1981 г.
- ^ Беренд, Смит; Реймер, Джеффри А; Ольденбург, Кертис М; Бург, Ян С. (2014). Введение в улавливание и секвестрацию углерода . Издательство Имперского колледжа. ISBN 9781306496834 .
- ^ Д'Алессандро, Дина М.; Смит, Беренд; Лонг, Джеффри Р. (16 августа 2010 г.). «Улавливание углекислого газа: перспективы новых материалов» . Angewandte Chemie, международное издание . 49 (35): 6058–6082. дои : 10.1002/anie.201000431 . ПМИД 20652916 .
- ^ Сатре, Роджер; Масанет, Эрик (18 марта 2013 г.). «Перспективное моделирование жизненного цикла системы улавливания и хранения углерода с использованием металлоорганических каркасов для улавливания CO2». РСК Прогресс . 3 (15): 4964. Бибкод : 2013RSCAd...3.4964S . дои : 10.1039/C3RA40265G . ISSN 2046-2069 .
- ^ Янсен, Дэниел; ван Селоу, Эдвард; Кобден, Пол; Манзолини, Джампаоло; Макки, Эннио; Газзани, Маттео; Блом, Ричард; Хенриксен, Партов Пакдел; Бивис, Рич; Райт, Эндрю (2013). «Технология SEWGS теперь готова к масштабированию!» . Энергетическая процедура . 37 : 2265–2273. Бибкод : 2013EnPro..37.2265J . дои : 10.1016/j.egypro.2013.06.107 .
- ^ (Эрик) ван Дейк, HAJ; Кобден, Пол Д.; Лукашук, Лилиана; де Уотер, Леон ван; Лундквист, Магнус; Манзолини, Джампаоло; Кормос, Калин-Кристиан; ван Дейк, Камиэль; Манкузо, Лука; Джонс, Джереми; Беллквист, Дэвид (1 октября 2018 г.). «Проект STEPWISE: технология конверсии воды и газа с усиленной сорбцией для снижения углеродного следа в черной металлургии». Обзор технологий Джонсона Матти . 62 (4): 395–402. дои : 10.1595/205651318X15268923666410 . hdl : 11311/1079169 . S2CID 139928989 .
- ^ Уилсон, CJ; Клегг, Р.Э.; Ливсли, ДИ; Пирси, MJ (2005). «Опосредование взаимодействий биоматериала и клетки с помощью адсорбированных белков: обзор». Тканевая инженерия . 11 (1): 1–18. дои : 10.1089/ten.2005.11.1 . ПМИД 15738657 . S2CID 19306269 .
- ^ Сивараман Б.; Боится КП; Латур РА (2009). «Исследование влияния химии поверхности и концентрации раствора на конформацию адсорбированных белков с использованием усовершенствованного метода кругового дихроизма» . Ленгмюр . 25 (5): 3050–6. дои : 10.1021/la8036814 . ПМЦ 2891683 . ПМИД 19437712 .
- ^ Скопеллити, Паскуале Эмануэле; Боргоново, Антонио; Индриери, Марко; Джорджетти, Лука; Доброе утро, Геро; Карбоне, Роберта; Подеста, Алессандро; Милани, Паоло (2010). Чжан, Шугуан (ред.). «Влияние морфологии поверхности в нанометровом масштабе на адсорбцию белка» . ПЛОС ОДИН . 5 (7): e11862. Бибкод : 2010PLoSO...511862S . дои : 10.1371/journal.pone.0011862 . ПМЦ 2912332 . ПМИД 20686681 .
- ^ Черагян, Гоштасп (2017). «Оценка наночастиц глины и дымящего кремнезема на адсорбцию полимера поверхностно-активного вещества при повышении нефтеотдачи» . Журнал Японского института нефти . 60 (2): 85–94. дои : 10.1627/jpi.60.85 .
- ^ Пилатовский И.; Ромеро, Р.Дж.; Исаза, Калифорния; Гамбоа, ЮАР; Себастьян, ПиДжей; Ривера, В. (2011). «Сорбционные холодильные системы». Системы кондиционирования воздуха с когенерацией и сорбцией на топливных элементах . Зеленая энергия и технологии. Спрингер. стр. 99, 100. doi : 10.1007/978-1-84996-028-1_5 . ISBN 978-1-84996-027-4 .
- ^ Брандт, Роберт К.; Хьюз, MR; Бурже, LP; Трушковская, К.; Гринлер, Роберт Г. (апрель 1993 г.). «Интерпретация CO, адсорбированного на Pt/SiO2, с двумя различными распределениями частиц по размерам». Поверхностная наука . 286 (1–2): 15–25. Бибкод : 1993SurSc.286...15B . дои : 10.1016/0039-6028(93)90552-У .
- ^ Унер, ДО; Саваргоанкар, Н.; Пруски, М.; Кинг, Т.С. (1997). «Влияние щелочных промоторов на динамику хемосорбции водорода и кинетику реакций синтез-газа на поверхностях Ru/SiO2». Динамика поверхностей и кинетика реакций в гетерогенном катализе, Материалы международного симпозиума . Исследования в области науки о поверхности и катализа. Том. 109. С. 315–324. дои : 10.1016/s0167-2991(97)80418-1 . ISBN 9780444826091 .
- ^ Нараян, РЛ; Кинг, Т.С. (март 1998 г.). «Состояния адсорбции водорода на биметаллических катализаторах Ru-Ag и Ru-Cu на кремнеземе, исследованные методом микрокалориметрии». Термохимика Акта . 312 (1–2): 105–114. Бибкод : 1998TcAc..312..105N . дои : 10.1016/S0040-6031(97)00444-9 .
- ^ ВандерВил, Дэвид П.; Пруски, Марек; Кинг, Терри С. (ноябрь 1999 г.). «Кинетическое исследование адсорбции и реакции водорода на рутениевых и серебряно-рутениевых катализаторах, нанесенных на кремнезем, во время гидрирования монооксида углерода» . Журнал катализа . 188 (1): 186–202. дои : 10.1006/jcat.1999.2646 .
- ^ Унер, DO (1 июня 1998 г.). «Разумный механизм продвижения щелочи в синтезе Фишера-Тропша: подвижность адсорбатов». Исследования в области промышленной и инженерной химии . 37 (6): 2239–2245. дои : 10.1021/ie970696d .
- ^ Зупанк, К.; Хорнунг, А.; Хинрихсен, О.; Мюлер, М. (июль 2002 г.). «Взаимодействие водорода с катализаторами Ru/MgO». Журнал катализа . 209 (2): 501–514. дои : 10.1006/jcat.2002.3647 .
- ^ Тренс, Филипп; Дюран, Роберт; Кок, Бернар; Кутансо, Кристоф; Руссо, Северин; Лами, Клод (ноябрь 2009 г.). «Отравление Pt/C-катализаторов CO и его последствия для кинетики хемосорбции водорода». Прикладной катализ Б: Экология . 92 (3–4): 280–284. Бибкод : 2009AppCB..92..280T . дои : 10.1016/j.apcatb.2009.08.004 .
- ^ Розанов Валерий Владимирович; Крылов, Олег В. (28 февраля 1997 г.). «Спилловер водорода в гетерогенном катализе». Российское химическое обозрение . 66 (2): 107–119. Бибкод : 1997RuCRv..66..107R . дои : 10.1070/rc1997v066n02abeh000308 . S2CID 250890123 .
- ^ Форд, Мэтт (6 мая 2009 г.). «Термодинамика Тетриса» . Арс Техника .
- ^ Барнс, Брайан С.; Сидериус, Дэниел В.; Гельб, Лев Д. (2009). «Структура, термодинамика и растворимость в тетромино жидкостях» . Ленгмюр . 25 (12): 6702–16. дои : 10.1021/la900196b . ПМИД 19397254 .
Дальнейшее чтение
[ редактировать ]- Касслер, Э.Л. (1997). Диффузия: массообмен в жидкостных системах (2-е изд.). Нью-Йорк: Издательство Кембриджского университета. стр. 308–330. ISBN 978-0-521-45078-2 .
Внешние ссылки
[ редактировать ]- Вывод изотерм Ленгмюра и БЭТ на JHU.edu
- Адсорбция углерода , на MEGTEC.com




































