Производство водорода
Водородной газ производится несколькими промышленными методами. [ 1 ] Почти все текущие запасы в мире водорода создаются из ископаемого топлива. [ 2 ] [ 3 ] : 1 Большая часть водорода представляет собой серой водород, изготовленный через реформирование метана пара . В этом процессе водород производится из химической реакции между парами и метаном , основным компонентом природного газа. Производство одной тонны водорода в рамках этого процесса излучает 6,6–9,3 тонны углекислого газа. [ 4 ] Когда захват углерода используется для удаления большой доли этих выбросов, продукт известен как синий водород . [ 5 ]
Обычно понимается, что зеленый водород производится из возобновляемого электричества посредством электролиза воды. [ 6 ] [ 7 ] Реже, определения зеленого водорода включают водород, вырабатываемый из других источников с низким уровнем эмиссии, таких как биомасса . [ 8 ] Производство зеленого водорода в настоящее время дороже, чем производство серого водорода, а эффективность преобразования энергии по своей природе низкая. [ 9 ] Другие методы выработки водорода включают биомассы газификацию , пиролиз метана и экстракцию подземного водорода . [ 10 ] [ 11 ]
По состоянию на 2023 год менее 1% выделенного производства водорода составляет низкоуглеродистый, то есть синий водород, зеленый водород и водород, продуцируемый из биомассы. [ 12 ]
В 2020 году было получено примерно 87 миллионов тонн водорода [ 13 ] Во всем мире для различных применений, таких как переработка нефти , в производстве аммиака посредством процесса Haber и при производстве метанола посредством снижения угарного газа . Глобальный рынок генерации водорода был справедливо оценен в 155 миллиардов долларов США в 2022 году и, как ожидается, будет расти с совокупным годовым темпом роста 9,3% с 2023 по 2030 год. [14]
Overview
[edit]Molecular hydrogen was discovered in the Kola Superdeep Borehole. It is unclear how much molecular hydrogen is available in natural reservoirs, but at least one company[15] specializes in drilling wells to extract hydrogen. Most hydrogen in the lithosphere is bonded to oxygen in water. Manufacturing elemental hydrogen requires the consumption of a hydrogen carrier such as a fossil fuel or water. The former carrier consumes the fossil resource and in the steam methane reforming (SMR) process produces greenhouse gas carbon dioxide. However, in the newer methane pyrolysis process no greenhouse gas carbon dioxide is produced. These processes typically require no further energy input beyond the fossil fuel.
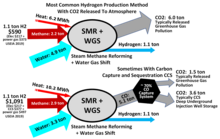
Decomposing water, the latter carrier, requires electrical or heat input, generated from some primary energy source (fossil fuel, nuclear power or a renewable energy). Hydrogen produced by electrolysis of water using renewable energy sources such as wind and solar power, referred to as green hydrogen.[16] When derived from natural gas by zero greenhouse emission methane pyrolysis, it is referred to as turquoise hydrogen.[17]
When fossil fuel derived with greenhouse gas emissions, is generally referred to as grey hydrogen. If most of the carbon dioxide emission is captured, it is referred to as blue hydrogen.[18] Hydrogen produced from coal may be referred to as brown or black hydrogen.[19]
Classification based on production method
[edit]Hydrogen is often referred to by various colors to indicate its origin (perhaps because gray symbolizes "dirty hydrogen"[20]).[21][22][11]
| Color | Production source | Notes | References | |
|---|---|---|---|---|
| Green | In most definitions, renewable electricity via electrolysis of water. Less frequently, definitions of green hydrogen include hydrogen produced from other low-emission sources such as biomass. | [7] | ||
| Turquoise | Thermal splitting of methane | Methane pyrolysis | [24]: 28 [25]: 2 | |
| Blue | Hydrocarbons with carbon capture and storage | CCS networks required | [24]: 28 | |
| Gray | Fossil hydrocarbons, mainly steam reforming of natural gas | [24]: 28 [26]: 10 [25]: 2 | ||
| Brown or black | Fossil hydrocarbons: brown (lignite) or black coal | Via coal gasification or in a suitable reactor[clarification needed] | [27]: 91 | |
| Red, pink or purple | Nuclear power | Thermochemical water splitting, electrolysis of water, or contributing steam to natural gas reforming | [25]: 2 [20] | |
| Yellow | Sometimes understood to mean solar photovoltaics | Photovoltaic | [22] | |
| Gold or white | Hydrogen that occurs naturally deep within the Earth's crust | Obtained by mining; also referred to as white | [28][29] | |
Current production methods
[edit]Steam reforming – gray or blue
[edit]Hydrogen is industrially produced from steam reforming (SMR), which uses natural gas.[30] The energy content of the produced hydrogen is around 74% of the energy content of the original fuel,[31] as some energy is lost as excess heat during production. In general, steam reforming emits carbon dioxide, a greenhouse gas, and is known as gray hydrogen. If the carbon dioxide is captured and stored, the hydrogen produced is known as blue hydrogen.
Steam methane reforming (SMR) produces hydrogen from natural gas, mostly methane (CH4), and water. It is the cheapest source of industrial hydrogen, being the source of nearly 50% of the world's hydrogen.[32] The process consists of heating the gas to 700–1,100 °C (1,300–2,000 °F) in the presence of steam over a nickel catalyst. The resulting endothermic reaction forms carbon monoxide and molecular hydrogen (H2).[33]
In the water-gas shift reaction, the carbon monoxide reacts with steam to obtain further quantities of H2. The WGSR also requires a catalyst, typically over iron oxide or other oxides. The byproduct is CO2.[33] Depending on the quality of the feedstock (natural gas, naphtha, etc.), one ton of hydrogen produced will also produce 9 to 12 tons of CO2, a greenhouse gas that may be captured.[34]
For this process, high temperature steam (H2O) reacts with methane (CH4) in an endothermic reaction to yield syngas.[35]
- CH4 + H2O → CO + 3 H2
In a second stage, additional hydrogen is generated through the lower-temperature, exothermic, water-gas shift reaction, performed at about 360 °C (680 °F):
- CO + H2O → CO2 + H2
Essentially, the oxygen (O) atom is stripped from the additional water (steam) to oxidize CO to CO2. This oxidation also provides energy to maintain the reaction. Additional heat required to drive the process is generally supplied by burning some portion of the methane.
From water
[edit]Methods to produce hydrogen without the use of fossil fuels involve the process of water splitting, or splitting the water molecule (H2O) into its components oxygen and hydrogen. When the source of energy for water splitting is renewable or low-carbon, the hydrogen produced is sometimes referred to as green hydrogen. The conversion can be accomplished in several ways, but all methods are currently considered more expensive than fossil-fuel based production methods.
Electrolysis of water – green, pink or yellow
[edit]Hydrogen can be made via high pressure electrolysis, low pressure electrolysis of water, or a range of other emerging electrochemical processes such as high temperature electrolysis or carbon assisted electrolysis.[36] However, current best processes for water electrolysis have an effective electrical efficiency of 70-80%,[37][38][39] so that producing 1 kg of hydrogen (which has a specific energy of 143 MJ/kg or about 40 kWh/kg) requires 50–55 kWh of electricity.
In parts of the world, steam methane reforming is between $1–3/kg on average excluding hydrogen gas pressurization cost. This makes production of hydrogen via electrolysis cost competitive in many regions already, as outlined by Nel Hydrogen[40] and others, including an article by the IEA[41] examining the conditions which could lead to a competitive advantage for electrolysis.
A small part (2% in 2019[42]) is produced by electrolysis using electricity and water, consuming approximately 50 to 55 kilowatt-hours of electricity per kilogram of hydrogen produced.[43]

Water electrolysis is using electricity to split water into hydrogen and oxygen. As of 2020, less than 0.1% of hydrogen production comes from water electrolysis.[44] Electrolysis of water is 70–80% efficient (a 20–30% conversion loss)[45][46] while steam reforming of natural gas has a thermal efficiency between 70 and 85%.[47] The electrical efficiency of electrolysis is expected to reach 82–86%[48] before 2030, while also maintaining durability as progress in this area continues apace.[49]
Water electrolysis can operate at 50–80 °C (120–180 °F), while steam methane reforming requires temperatures at 700–1,100 °C (1,300–2,000 °F).[50] The difference between the two methods is the primary energy used; either electricity (for electrolysis) or natural gas (for steam methane reforming). Due to their use of water, a readily available resource, electrolysis and similar water-splitting methods have attracted the interest of the scientific community. With the objective of reducing the cost of hydrogen production, renewable sources of energy have been targeted to allow electrolysis.[51]
There are three main types of electrolytic cells, solid oxide electrolyser cells (SOECs), polymer electrolyte membrane cells (PEM) and alkaline electrolysis cells (AECs).[52] Traditionally, alkaline electrolysers are cheaper in terms of investment (they generally use nickel catalysts), but less-efficient; PEM electrolysers, conversely, are more expensive (they generally use expensive platinum group metal catalysts) but are more efficient and can operate at higher current densities, and can therefore be possibly cheaper if the hydrogen production is large enough.[53]
SOECs operate at high temperatures, typically around 800 °C (1,500 °F). At these high temperatures, a significant amount of the energy required can be provided as thermal energy (heat), and as such is termed high-temperature electrolysis. The heat energy can be provided from a number of different sources, including waste industrial heat, nuclear power stations or concentrated solar thermal plants. This has the potential to reduce the overall cost of the hydrogen produced by reducing the amount of electrical energy required for electrolysis.[54][55][56][57]
PEM electrolysis cells typically operate below 100 °C (212 °F).[54] These cells have the advantage of being comparatively simple and can be designed to accept widely varying voltage inputs, which makes them ideal for use with renewable sources of energy such as photovoltaic solar panels.[58] AECs optimally operate at high concentrations of electrolyte (KOH or potassium carbonate) and at high temperatures, often near 200 °C (392 °F).
Industrial output and efficiency
[edit]Efficiency of modern hydrogen generators is measured by energy consumed per standard volume of hydrogen (MJ/m3), assuming standard temperature and pressure of the H2. The lower the energy used by a generator, the higher would be its efficiency; a 100%-efficient electrolyser would consume 39.4 kilowatt-hours per kilogram (142 MJ/kg) of hydrogen,[59] 12,749 joules per litre (12.75 MJ/m3). Practical electrolysis typically uses a rotating electrolyser, where centrifugal force helps separate gas bubbles from water.[60] Such an electrolyser at 15 bar pressure may consume 50 kilowatt-hours per kilogram (180 MJ/kg), and a further 15 kilowatt-hours (54 MJ) if the hydrogen is compressed for use in hydrogen cars.[61]
Conventional alkaline electrolysis has an efficiency of about 70%,[62] however advanced alkaline water electrolysers with efficiency of up to 82% are available.[63] Accounting for the use of the higher heat value (because inefficiency via heat can be redirected back into the system to create the steam required by the catalyst), average working efficiencies for PEM electrolysis are around 80%, or 82% using the most modern alkaline electrolysers.[64]
PEM efficiency is expected to increase to approximately 86%[65] before 2030. Theoretical efficiency for PEM electrolysers is predicted up to 94%.[66]

As of 2020, the cost of hydrogen by electrolysis is around $3–8/kg.[67] Considering the industrial production of hydrogen, and using current best processes for water electrolysis (PEM or alkaline electrolysis) which have an effective electrical efficiency of 70–82%,[68][69][70] producing 1 kg of hydrogen (which has a specific energy of 143 MJ/kg or about 40 kWh/kg) requires 50–55 kWh of electricity. At an electricity cost of $0.06/kWh, as set out in the Department of Energy hydrogen production targets for 2015,[71] the hydrogen cost is $3/kg.
The US DOE target price for hydrogen in 2020 is $2.30/kg, requiring an electricity cost of $0.037/kWh, which is achievable given recent PPA tenders for wind and solar in many regions.[72] The report by IRENA.ORG is an extensive factual report of present-day industrial hydrogen production consuming about 53 to 70 kWh per kg could go down to about 45 kWh/kg H
2.[73] The thermodynamic energy required for hydrogen by electrolysis translates to 33 kWh/kg, which is higher than steam reforming with carbon capture and higher than methane pyrolysis.
One of the advantages of electrolysis over hydrogen from steam methane reforming (SMR) is that the hydrogen can be produced on-site, meaning that the costly process of delivery via truck or pipeline is avoided.
Chemically assisted electrolysis
[edit]In addition to reduce the voltage required for electrolysis via the increasing of the temperature of the electrolysis cell it is also possible to electrochemically consume the oxygen produced in an electrolyser by introducing a fuel (such as carbon/coal,[74] methanol,[75][76] ethanol,[77] formic acid,[78] glycerol,[78] etc.) into the oxygen side of the reactor. This reduces the required electrical energy and has the potential to reduce the cost of hydrogen to less than 40~60% with the remaining energy provided in this manner.[79]
Carbon/hydrocarbon assisted water electrolysis (CAWE) has the potential to offer a less energy intensive, cleaner method of using chemical energy in various sources of carbon, such as low-rank and high sulfur coals, biomass, alcohols and methane (Natural Gas), where pure CO2 produced can be easily sequestered without the need for separation.[80][81]
Hydrogen from biomass – green
[edit]Biomass is converted into syngas by gasification and syngas is further converted into hydrogen by water-gas shift reaction (WGSR).[82]
Hydrogen as a byproduct of other chemical processes
[edit]The industrial production of chlorine and caustic soda by electrolysis generates a sizable amount of Hydrogen as a byproduct. In the port of Antwerp a 1MW demonstration fuel cell power plant is powered by such byproduct. This unit has been operational since late 2011.[83] The excess hydrogen is often managed with a hydrogen pinch analysis.
Gas generated from coke ovens in steel production is similar to Syngas with 60% hydrogen by volume.[84] The hydrogen can be extracted from the coke oven gas economically.[85]
Other fossil fuel methods
[edit]Partial oxidation
[edit]Hydrogen production from natural gas and heavier hydrocarbons is achieved by partial oxidation. A fuel-air or fuel-oxygen mixture is partially combusted, resulting in a hydrogen- and carbon monoxide-rich syngas. More hydrogen and carbon dioxide are then obtained from carbon monoxide (and water) via the water-gas shift reaction.[33] Carbon dioxide can be co-fed to lower the hydrogen to carbon monoxide ratio.
The partial oxidation reaction occurs when a substoichiometric fuel-air mixture or fuel-oxygen is partially combusted in a reformer or partial oxidation reactor. A distinction is made between thermal partial oxidation (TPOX) and catalytic partial oxidation (CPOX). The chemical reaction takes the general form:
- 2 CnHm + nO2 → 2n CO + mH2
Idealized examples for heating oil and coal, assuming compositions C12H24 and C24H12 respectively, are as follows:
- C12H24 + 6 O2 → 12 CO + 12 H2
- C24H12 + 12 O2 → 24 CO + 6 H2
Plasma pyrolysis
[edit]The Kværner process or Kvaerner carbon black and hydrogen process (CB&H)[86] is a plasma pyrolysis method, developed in the 1980s by a Norwegian company of the same name, for the production of hydrogen and carbon black from liquid hydrocarbons (CnHm). Of the available energy of the feed, approximately 48% is contained in the hydrogen, 40% is contained in activated carbon and 10% in superheated steam.[87] CO2 is not produced in the process.
A variation of this process was presented in 2009 using plasma arc waste disposal technology for the production of hydrogen, heat and carbon from methane and natural gas in a plasma converter.[88]
Coal
[edit]For the production of hydrogen from coal, coal gasification is used. The process of coal gasification uses steam and oxygen to break molecular bonds in coal and form a gaseous mixture of hydrogen and carbon monoxide.[51] Carbon dioxide and pollutants may be more easily removed from gas obtained from coal gasification versus coal combustion.[89][90] Another method for conversion is low-temperature and high-temperature coal carbonization.[91]
Coke oven gas made from pyrolysis (oxygen free heating) of coal has about 60% hydrogen, the rest being methane, carbon monoxide, carbon dioxide, ammonia, molecular nitrogen, and hydrogen sulfide (H2S). Hydrogen can be separated from other impurities by the pressure swing adsorption process. Japanese steel companies have carried out production of hydrogen by this method.
Petroleum coke
[edit]Petroleum coke can also be converted to hydrogen-rich syngas via coal gasification. The produced syngas consists mainly of hydrogen, carbon monoxide and H2S from the sulfur in the coke feed. Gasification is an option for producing hydrogen from almost any carbon source.[92]
Depleted oil wells
[edit]Injecting appropriate microbes into depleted oil wells allows them to extract hydrogen from the remaining, unrecoverable oil. Since the only inputs are the microbes, production costs are low. The method also produces concentrated CO
2 that could in principle be captured.[93]
Radiolysis
[edit]Nuclear radiation can break water bonds through radiolysis.[94][95] In the Mponeng gold mine, South Africa, researchers found bacteria in a naturally occurring high radiation zone. The bacterial community which was dominated by a new phylotype of Desulfotomaculum, was feeding on primarily radiolytically produced hydrogen.[96]
Thermolysis
[edit]Water spontaneously dissociates at around 2500 °C, but this thermolysis occurs at temperatures too high for usual process piping and equipment resulting in a rather low commercialization potential.[97]
Pyrolysis on biomass
[edit]Pyrolysis can be divided into different types based on the pyrolysis temperature, namely low-temperature slow pyrolysis, medium-temperature rapid pyrolysis, and high-temperature flash pyrolysis.[98] The source energy is mainly solar energy, with help of photosynthetic microorganisms to decompose water or biomass to produce hydrogen. However, this process has relatively low hydrogen yields and high operating cost. It is not a feasible method for industry.
Nuclear-assisted thermolysis
[edit]The high-temperature gas-cooled reactor (HTGR) is one of the most promising CO2-free nuclear technique to produce hydrogen by splitting water in a large scale. In this method, iodine-sulfur (IS) thermo-chemical cycle for splitting water and high-temperature steam electrolysis (HTSE) were selected as the main processes for nuclear hydrogen production. The S-I cycle follows three chemical reactions:[99]
Bunsen reaction: I2+SO2+2H2O→H2SO4+2HI
HI decomposition: 2HI→H2+I2
Sulfuric acid decomposition: H2SO4→SO2+1/2O2+H2O
The hydrogen production rate of HTGR with IS cycle is approximately 0.68 kg/s, and the capital cost to build a unit of power plant is $100 million.
Thermochemical cycle
[edit]Thermochemical cycles combine solely heat sources (thermo) with chemical reactions to split water into its hydrogen and oxygen components.[100] The term cycle is used because aside from water, hydrogen and oxygen, the chemical compounds used in these processes are continuously recycled. If electricity is partially used as an input, the resulting thermochemical cycle is defined as a hybrid one.
The sulfur-iodine cycle (S-I cycle) is a thermochemical cycle processes which generates hydrogen from water with an efficiency of approximately 50%. The sulfur and iodine used in the process are recovered and reused, and not consumed by the process. The cycle can be performed with any source of very high temperatures, approximately 950 °C, such as by Concentrating solar power systems (CSP) and is regarded as being well suited to the production of hydrogen by high-temperature nuclear reactors,[101] and as such, is being studied in the High-temperature engineering test reactor in Japan.[102][103][104][105] There are other hybrid cycles that use both high temperatures and some electricity, such as the Copper–chlorine cycle, it is classified as a hybrid thermochemical cycle because it uses an electrochemical reaction in one of the reaction steps, it operates at 530 °C and has an efficiency of 43 percent.[106]
Ferrosilicon method
[edit]Ferrosilicon is used by the military to quickly produce hydrogen for balloons. The chemical reaction uses sodium hydroxide, ferrosilicon, and water. The generator is small enough to fit a truck and requires only a small amount of electric power, the materials are stable and not combustible, and they do not generate hydrogen until mixed.[107] The method has been in use since World War I. A heavy steel pressure vessel is filled with sodium hydroxide and ferrosilicon, closed, and a controlled amount of water is added; the dissolving of the hydroxide heats the mixture to about 93 °C and starts the reaction; sodium silicate, hydrogen and steam are produced.[108]
Photobiological water splitting
[edit]
Biological hydrogen can be produced in an algae bioreactor.[109] In the late 1990s it was discovered that if the algae are deprived of sulfur it will switch from the production of oxygen, i.e. normal photosynthesis, to the production of hydrogen. It seems that the production is now economically feasible by surpassing the 7–10 percent energy efficiency (the conversion of sunlight into hydrogen) barrier.[110] with a hydrogen production rate of 10–12 ml per liter culture per hour.[111]
Photocatalytic water splitting
[edit]The conversion of solar energy to hydrogen by means of water splitting process is one of the most interesting ways to achieve clean and renewable energy systems. However, if this process is assisted by photocatalysts suspended directly in water instead of using photovoltaic and an electrolytic system the reaction is in just one step, it can be made more efficient.[112][113][114] Current systems, however have low performance for commercial implementation.[115][116]
Biohydrogen routes
[edit]Biomass and waste streams can in principle be converted into biohydrogen with biomass gasification, steam reforming, or biological conversion like biocatalysed electrolysis[79] or fermentative hydrogen production.[117]
Among hydrogen production methods biological routes are potentially less energy intensive. In addition, a wide variety of waste and low-value materials such as agricultural biomass as renewable sources can be utilized to produce hydrogen via biochemical or thermochemical pathways.[82] Nevertheless, at present hydrogen is produced mainly from fossil fuels, in particular, natural gas which are non-renewable sources. Hydrogen is not only the cleanest fuel but also widely used in a number of industries, especially fertilizer, petrochemical and food ones.[118]
Biochemical routes to hydrogen are classified as dark and photo fermentation processes. In dark fermentation, carbohydrates are converted to hydrogen by fermentative microorganisms including strict anaerobe and facultative anaerobic bacteria. A theoretical maximum of 4 mol H2/mol glucose can be produced.[citation needed] Sugars are convertible to volatile fatty acids (VFAs) and alcohols as by-products during this process. Photo fermentative bacteria are able to generate hydrogen from VFAs. Hence, metabolites formed in dark fermentation can be used as feedstock in photo fermentation to enhance the overall yield of hydrogen.[118]
Fermentative hydrogen production
[edit]Fermentative hydrogen production converts organic substrates to hydrogen. A diverse group of bacteria promote this transformation. Photofermentation differs from dark fermentation because it only proceeds in the presence of light. For example, photo-fermentation with Rhodobacter sphaeroides SH2C can be employed to convert some fatty acids into hydrogen.[119]
Ферментативная продукция водорода может быть выполнена с использованием прямого биофотолиза с помощью зеленых водорослей, косвенного биофотолиза цианобактериями, фотосферы с помощью анаэробных фотосинтетических бактерий и темной ферментации с помощью анаэробных ферментативных бактерий. Например, исследования по производству водорода с использованием H. salinarium , анаэробных фотосинтетических бактерий, в сочетании с донором гидрогеназы, таким как E. coli , сообщаются в литературе. [ 120 ] Enterobacter Aerogenes является еще одним производителем водорода. [ 121 ]
Ферментативное образование водорода
[ редактировать ]Разнообразные ферментативные пути были разработаны для получения водорода из сахара. [ 122 ]
Биокатализированный электролиз
[ редактировать ]
Помимо темной ферментации, электрогидгенез (электролиз с использованием микробов) является еще одной возможностью. Использование микробных топливных элементов , сточные воды или растения могут использоваться для генерации энергии. Биокатализированный электролиз не следует путать с биологическим производством водорода , так как последние используют только водоросли, а с последними сами водоросли мгновенно генерируют водород, где с биокатализированным электролизом это происходит после бега по микробным топливным элементам и разнообразию водных растений. [ 123 ] можно использовать. К ним относятся тростниковая сладкая трасса , шнуркасс, рис, помидоры, люпины и водоросли. [ 124 ]

Наногалвановый алюминиевый сплав порошок
[ редактировать ]Порошок алюминиевого сплава реагирует с водой с образованием газа водорода при контакте с водой. По сообщениям, он генерирует водород на 100 процентов от теоретического урожая. [ 125 ] [ 126 ] Экономические маршруты для создания алюминиевого сплава остаются неуловимыми.
CC-ход
[ редактировать ]CC-HOD (каталитический углерод-водород по спросу)-это низкотемпературный процесс, при котором углерод и алюминий погружаются и нагревают примерно до 80 ° C (176 ° F), вызывая химическую реакцию, которая производит водород.
Натуральный водород
[ редактировать ]
Водород также присутствует естественным образом под землей. Этот натуральный водород , также называемый белым водородом или золотым водородом, может быть извлечен из скважин аналогично ископаемому топливу, таким как нефть и природный газ. [ 127 ] [ 128 ] [ 11 ]
Белый водород может быть найден или произведен в средне-континентальной системе RIFT в масштабе для возобновляемой водородной экономики . Вода может быть перекачена в горячую богатую железом порода для извлечения водорода. [ 129 ]
Экспериментальные методы производства
[ редактировать ]Метатан пиролиз - бирюзовый
[ редактировать ]
Пиролиз метана (природного газа) с одноэтапным процессом [ 130 ] Бурный метатан через катализатор с расплавленным металлом является подходом «без парниковых газов» для производства водорода, который был продемонстрирован в лабораторных условиях в 2017 году и в настоящее время тестируется в больших масштабах. [ 131 ] [ 132 ] Процесс проводится при высоких температурах (1065 ° C). [ 133 ] [ 134 ] [ 135 ] [ 136 ] Производство 1 кг водорода требует около 18 кВт -ч электроэнергии для тепла процесса. [ 137 ] Пиролиз метана может быть выражен следующим уравнением реакции. [ 138 ]
- Гнездо
4 (g) → c (s) + 2 ч
2 (г) ΔH ° = 74,8 кДж/моль
Твердый углерод промышленного качества может быть продан в качестве производственного сырья или заполнено на свалке.
Технологии метана пиролиза находятся на ранних этапах развития по состоянию на 2023 год. У них есть многочисленные препятствия для преодоления до коммерциализации. [ 139 ]
Биологическое производство
[ редактировать ]Ферментативное производство водорода представляет собой ферментативное превращение органического субстрата в биогидроген, проявляемый разнообразной группой бактерий с использованием нескольких ферментных систем, включающих три этапа, аналогичные анаэробной конверсии . Реакции темной ферментации не требуют световой энергии, поэтому они способны постоянно производить водород из органических соединений в течение дня и ночи. Фотоферация отличается от темной ферментации , потому что она продолжается только в присутствии света . Например, фотосференция с Rhodobacter sphaeroides SH2C может быть использована для преобразования мелких молекулярных жирных кислот в водород. [ 140 ] Электрогидрогенез используется в микробных топливных элементах , где водород производится из органического вещества (например, из сточных вод или твердого вещества [ 141 ] ) в то время как применяется 0,2 - 0,8 В.
Биологический водород может быть получен в водорослей биореакторе . В конце 1990 -х годов было обнаружено, что если водоросли лишены серы, они переключатся от производства кислорода , то есть нормальный фотосинтез , на производство водорода. [ 142 ]
Биологический водород может быть получен в биореакторах, в которых используются сырья, отличные от водорослей, наиболее распространенным сырью является потоки отходов. Процесс включает в себя бактерии, питающиеся углеводородами и выделяющий водород и CO 2 . CO 2 может быть успешно изолирован несколькими методами, оставляя водородной газ. В 2006–2007 годах Nanologix впервые продемонстрировал прототип водородного биореактора с использованием отходов в качестве сырья на фабрике виноградного сока Уэлча на северо -востоке, штат Пенсильвания (США). [ 143 ]
Биокатализированный электролиз
[ редактировать ]Помимо регулярного электролиза, электролиз с использованием микробов является еще одной возможностью. различные водные растения, архивирующие 2010-05-17 на машине Wayback При биокатализированном электролизе водород генерируется после прохождения через микробные топливные элементы, и можно использовать . К ним относятся тростниковая сладкая трасса , корпус, рис, помидоры, люпины и водоросли [ 144 ]
Электролиз высокого давления
[ редактировать ]Электролиз высокого давления представляет собой электролиз воды путем разложения воды (H 2 O) в кислород (O 2 ) и газ водорода (H 2 ) с помощью электрического тока, проходящего через воду. Разница со стандартным электролицером является сжатый выход водорода около 120–200 бар (1740–2900 фунтов на квадратный дюйм , 12–20 МПа ). [ 145 ] Давивая водород в электролизере посредством процесса, известного как химическая сжатие, необходимость в внешнем водородном компрессоре устранена, [ 146 ] Среднее потребление энергии для внутреннего сжатия составляет около 3%. [ 147 ] Крупнейший в Европе (1 400 000 кг/А, электролиз высокого давления воды, щелочная технология), производство водорода работает в Кокколе, Финляндия. [ 148 ]
Высокотемпературный электролиз
[ редактировать ]Водород может генерироваться из энергии, поставляемой в форме тепла и электричества посредством высокотемпературного электролиза (HTE). Поскольку часть энергии в HTE поставляется в форме тепла, меньше энергии должно быть дважды преобразовано из тепла в электричество, а затем в водород. Следовательно, потенциально меньше энергии требуется для получения водорода. Ядерное тепло может быть использовано для разделения водорода от воды. Высокая температура (950–1000 ° C) газовые охлажденные ядерные реакторы могут разделить водород из воды с помощью термохимических средств с использованием ядерного тепла. Высокотемпературный электролиз был продемонстрирован в лаборатории, при 108 мДж (термический) на килограмм полученного водорода, [ 149 ] но не в коммерческом масштабе. Кроме того, это более низкий качественный «коммерческий» водород, не подходящий для использования в топливных элементах. [ 150 ]
Фотоэлектрохимическое расщепление воды
[ редактировать ]Использование электроэнергии, произведенных фотоэлектрическими системами, предлагает самый чистый способ производства водорода. Вода разбивается на водород и кислород путем электролиза - процесс фотоэлектрохимических клеток (PEC), который также называется искусственным фотосинтезом . [ 151 ] Уильям Айерс в устройствах по преобразованию энергии продемонстрировал и запатентовал первую фотоэлектрохимическую систему с высокой эффективностью многофункциональной системы для прямого расщепления воды в 1983 году. [ 152 ] Эта группа продемонстрировала прямое расщепление воды, которое теперь называется «искусственным листом» или «беспроводным солнечным расщеплением» с недорогим тонким пленком аморфного уровня кремния, погруженного непосредственно в воду. [ 153 ] [ 154 ]
Водород развивался на передней аморфной кремниевой поверхности, украшенной различными катализаторами, в то время как кислород эволюционировал с подложки из задней металлической. Мембрана Nafion над мультипрофюнкной ячейкой обеспечила путь для переноса ионов. Их патент также перечисляет множество других полупроводниковых многофункциональных материалов для прямого расщепления воды в дополнение к аморфным кремниевым и кремниевым сплавам Германия. Исследования продолжаются в направлении разработки высокоэффективных технологий мульти-соединений в университетах и фотоэлектрической промышленности. Если этот процесс помогает фотокатализаторы, подвешенные непосредственно в воде вместо использования фотоэлектрической и электролитической системы, реакция находится всего в одном этапе, что может повысить эффективность. [ 153 ] [ 154 ]
Фотоэлектрокаталитическая продукция
[ редактировать ]Метод, изученный Томасом Нанном и его командой в Университете Восточной Англии, состоит из золотого электрода, покрытого слоями наночастиц индий -фосфида (INP). Они ввели комплекс железа-сульфура в слоистую расположение, которое при погружении в воду и облучение светом под небольшим электрическим током, производил водород с эффективностью 60%. [ 155 ]
В 2015 году сообщалось, что Panasonic Corp. разработала фотокатализатор на основе нитрида ниобия , который может поглощать 57% солнечного света для поддержки разложения воды с образованием газа водорода. [ 156 ] Компания планирует получить коммерческое приложение «как можно раньше», а не до 2020 года.
Концентрируя солнечную тепловую
[ редактировать ]Очень высокие температуры необходимы для отделения воды на водород и кислород. Катализатор требуется, чтобы процесс работал при выполнимых температурах. Нагревание воды может быть достигнуто с помощью солнечной энергии, концентрирующей воду . Гидрозоль-2 -это 100-киловатт пилотная установка в Solar De Almería Plataforma в Испании , которая использует солнечный свет для получения необходимого от 800 до 1200 ° C для нагрева воды. Hydrosol II работает с 2008 года. Конструкция этой 100-киловаттной пилотной установки основана на модульной концепции. В результате может быть возможно, что эта технология может быть легко увеличена до диапазона мегаватта путем умножения доступных единиц реактора и соединения растения с полями гелиостата (поля зеркал солнечного отслеживания) подходящего размера. [ 157 ]
Термохимическое производство
[ редактировать ]Их более 352 [ 158 ] термохимические циклы, которые можно использовать для расщепления воды , [ 159 ] Около дюжины этих циклов, таких как цикл оксида железа , оксидный цинк оксида железа , цинко-оксид оксид , серый цикл-цикл , медно-хлорский цикл и гибридный цикл серы , алюминий алюминий-оксид Цикл , находится под исследованиями и в фазе тестирования для получения водорода и кислорода из воды и тепла без использования электроэнергии. [ 160 ] Эти процессы могут быть более эффективными, чем высокотемпературный электролиз, типичный в диапазоне от 35% до 49% LHV эффективности . Термохимическое производство водорода с использованием химической энергии из угля или природного газа обычно не рассматривается, поскольку прямой химический путь является более эффективным.
Ни один из процессов производства термохимического водорода не был продемонстрирован на уровнях производства, хотя некоторые из них были продемонстрированы в лабораториях.
Процесс шлифования
[ редактировать ]Процесс Kværner или процесс углерода и водородного процесса Kvaerner (CB & H) [ 161 ] является методом, разработанным в 1980 -х годах норвежской компанией с таким же названием , для производства водорода из углеводородов (C N H M ), таких как метатан , природный газ и биогаз . Из доступной энергии корма примерно 48% содержится в водороде, 40% содержится в активированном углероде и 10% в перегрете пар. [ 162 ]
Экстракция естественного водорода-белый водород
[ редактировать ]По состоянию на 2019 год [update]Водород в основном используется в качестве промышленного сырья, в основном для производства аммиака и метанола , а также в нефтепрочном нефте. Хотя изначально считалось, что газ водорода не встречается естественным образом в удобных резервуарах, теперь продемонстрировано, что это не так; В настоящее время водородная система эксплуатируется недалеко от Бурукбугу, региона Куликоро в Мали, производя электроэнергию для окружающих деревень. [ 163 ] В последние годы было сделано больше открытий природного водорода в континентальной геологической среде, геологической среде на берегу [ 164 ] и открыть путь к новой области естественного или нативного водорода, поддерживая усилия по переходу на энергетический переход . [ 165 ] [ 166 ]

Белый водород может быть найден или произведен в средне-континентальной системе RIFT в масштабе для возобновляемой водородной экономики. Вода может быть перекачена в горячую богатую железом порода для получения водорода, а водород может быть извлечен. [ 167 ]
Воздействие на окружающую среду
[ редактировать ]Большая часть водорода производится из ископаемого топлива , что приводит к выбросам углекислого газа . [ 168 ] Водород, продуцируемый этой технологией, был описан как серый водород , когда выбросы высвобождаются в атмосферу, а синий водород , когда выбросы захватываются за счет захвата углерода и хранения (CCS). [ 169 ] [ 170 ] Предполагается, что голубой водород имеет следов парниковых газов вверх и в среднем потоке , который на 20% больше, чем сжигание газа или угля для тепла, и на 60% больше по сравнению с горящим дизельным топливом для тепла, предполагая, что утечки метана и производство через пар. Метановые реформаторы (SMR), модифицированные с захватом углекислого газа. [ 171 ]
Использование аутотермических реформаторов (ATR) с интегрированным захватом углекислого газа позволяет более высокие показатели захвата при удовлетворительной энергоэффективности, а оценки жизненного цикла показали более низкие выбросы парниковых газов для таких растений по сравнению с SMR с захватом углекислого газа. [ 172 ] Применение технологии ATR с интегрированным захватом углекислого газа в Европе имела более низкий трасса парниковых газов, чем сжигание природного газа, например, для проекта H21 с сообщенным сокращением на 68% из -за снижения интенсивности углекислого газа природного газа вместе с более подходящим типом реактора для захвата углекислого газа. [ 173 ]
Водород, полученный из возобновляемых источников энергии , часто называют зеленым водородом . Утверждается, что два способа производства водорода из возобновляемых источников энергии являются практичными. Одним из них является использование энергии для газа , в которой электроэнергию используется для производства водорода из электролиза воды , а другая - использовать газ свал для производства водорода в паровом реформаторе. Водородное топливо, полученное возобновляемым источником энергии, такими как ветер или солнечная энергия, является возобновляемым топливом . [ 174 ] [ 175 ] Водород, полученный из ядерной энергии с помощью электролиза, иногда рассматривается как подмножество зеленого водорода , но также может быть назван розовым водородом . в Атомная электростанция Оскаршамна январе 2022 года заключила соглашение о предоставлении коммерческого розового водорода в порядке килограммов в день. [ 176 ]
По состоянию на 2020 год [update], оценочные затраты на производство составляют 1–1,80/кг для серого водорода и синего водорода, [ 177 ] и $ 2,50–6,80 за зеленый водород. [ 177 ]
94 миллиона тонн серого водорода производятся во всем мире с использованием ископаемого топлива по состоянию на 2022 год, в основном природного газа, и, следовательно, являются значительным источником выбросов парниковых газов. [ 178 ] [ 179 ] [ 180 ] [ 181 ]
Водород использует
[ редактировать ]Водород используется для преобразования тяжелых нефтяных фракций в более легкие посредством гидрокроки . Он также используется в других процессах, включая процесс ароматизации , гидродесульфуризация и производство аммиака посредством процесса Haber , основного промышленного метода производства синтетических азотных удобрений для выращивания 47 процентов продуктов питания во всем мире. [ 182 ]
Водород может использоваться в топливных элементах для локальной выработки электроэнергии или потенциально в качестве транспортного топлива.
Водород производится как побочный продукт производства промышленного хлора путем электролиза. Несмотря на то, что требует дорогостоящих технологий, водород может быть охлажден, сжат и очищен для использования в других процессах на месте или продается клиенту с помощью трубопровода, цилиндров или грузовиков. Обнаружение и разработка менее дорогих методов производства объемного водорода имеет отношение к созданию водородной экономики . [ 117 ]
Смотрите также
[ редактировать ]- Производство аммиака
- Искусственный фотосинтез
- Биогидроген
- Анализатор водорода
- Водородный компрессор
- Водородная экономика § Цветовые коды [ Сломан якорь ]
- Водородное охррение
- Испытание на утечку водорода
- Транспорт водородного трубопровода
- Очиститель водорода
- Безопасность водорода
- Датчик водорода
- Хранение водорода
- Водородная станция
- Водород
- Мысли о водороде
- Водородные технологии
- Водородный клапан
- Промышленное газ
- Жидкий водород
- Атомная станция следующего поколения (частично для производства водорода)
- Hy4heat
- Производитель водорода Lane
- Линде -Франк -Каро процесс
- Подземное хранение водорода
Ссылки
[ редактировать ]- ^ Фанат, Ликсин; Ту, Чжэнкай; Чан, Siew HWA (2021). «Недавняя разработка технологий водорода и топливных элементов: обзор» . Энергетические отчеты . 7 : 8421–8446. doi : 10.1016/j.egyr.2021.08.003 .
- ^ Рид, Стэнли; Юинг, Джек (13 июля 2021 года). «Водород - один из ответов на изменение климата. Получение его - это сложная часть» . New York Times .
- ^ Розенов, Ян (27 сентября 2022 года). «Нагревающие дома с водородом - это все, кроме трубной мечты? Обзор доказательств» . Джоул . 6 (10): 2225–2228. Bibcode : 2022Joule ... 6.2225R . doi : 10.1016/j.joule.2022.08.015 . S2CID 252584593 . Статья в прессе.
- ^ Бонхер, Майк; Vandewalle, Laurien A.; Марин, Гай Б.; Ван Гем, Кевин М. (март 2021 г.). «Мечта или реальность? Электрификация отраслей химических процессов» . Журнал CEP . Американский институт химических инженеров . Архивировано из оригинала 17 июля 2021 года . Получено 6 июля 2021 года .
- ^ Гриффитс, Стив; Sovacool, Benjamin K.; Ким, Jinsoo; Базильский, Морган; Уратани, Хоао М. (октябрь 2021 г.). «Промышленная декарбонизация с помощью водорода: критический и систематический обзор разработок, социально-технических систем и вариантов политики» . Энергетические исследования и социальные науки . 80 : 102208. Bibcode : 2021erss ... 8002208G . doi : 10.1016/j.ers.2021.102208 .
- ^ Эскадрито, Гаэтано; Май, Гаэтано; Никита, Агатино (ноябрь 2023 г.). «Зеленая водородная революция» . Возобновляемая энергия . 216 : 119041. Bibcode : 2023rene..21619041S . Doi : 10.1016/j.renene.2023.119041 .
- ^ Jump up to: а беременный Дейн, Джейсон (2020-06-29). "Итак, что такое зеленый водород?" Полем Greentechmedia . Архивировано из оригинала 2022-03-23 . Получено 2022-02-11 .
- ^ Эскадрито, Гаэтано; Май, Гаэтано; Никита, Агатино (ноябрь 2023 г.). «Зеленая водородная революция» . Возобновляемая энергия . 216 : 119041. Bibcode : 2023rene..21619041S . Doi : 10.1016/j.renene.2023.119041 .
- ^ Эванс, Саймон; Габбатисс, Джош (30 ноября 2020 г.). «Глубокие вопросы и ответы: нужен ли миру водород для решения изменения климата?» Полем Углеродная бригада . Архивировано из оригинала 1 декабря 2020 года . Получено 1 декабря 2020 года .
- ^ «Естественный водород: потенциальный источник чистой энергии под нашими ногами» . Йельский университет E360 . Получено 2024-03-23 .
- ^ Jump up to: а беременный в Hassanpouryouzband, Aliakbar; Уилкинсон, Марк; Haszeldine, R Stuart (2024). "Фьючерсы на водородную энергию - кормление или сельское хозяйство?" Полем Обзоры химического общества . 53 (5): 2258–2263. doi : 10.1039/d3cs00723e . HDL : 20.500.11820/B23E204C-744E-44F6-8CF5-B6761775260D . PMID 38323342 .
- ^ «Водород» . IEA . 10 июля 2023 года . Получено 2023-09-21 .
- ^ Коллинз, Ли (2021-05-18). «Чисто-нулевой мир» потребует 306 миллионов тонн зеленого водорода в год к 2050 году »: IEA | Recharge» . Перезарядка | Последние новости о возобновляемых источниках энергии . Архивировано из оригинала 2021-05-21.
- ^ «Отчет о рынке глобального водорода, 2030 год» .
- ^ «Natural Hydrogen Energy LLC» . Архивировано из оригинала 2020-10-25 . Получено 2020-09-29 .
- ^ «Определение зеленого водорода» (PDF) . Партнерство чистой энергии . Получено 2014-09-06 . [ Постоянная мертвая ссылка ]
- ^ Шнайдер, Стефан; Баджор, Зигфрид; Граф, Фрэнк; Колб, Томас (октябрь 2020 г.). «Состояние искусства производства водорода посредством пиролиза природного газа» . Chembioeng Reviews . 7 (5): 150–158. doi : 10.1002/cben.202000014 .
- ^ Sampson2019-02-11T10: 48: 00+00: 00, Джоанна (11 февраля 2019 г.). «Синий водород для зеленого будущего» . Gasworld . Архивировано с оригинала 2019-05-09 . Получено 2019-06-03 .
{{cite web}}: CS1 Maint: числовые имена: список авторов ( ссылка ) - ^ «Коричневый уголь экономика водорода ступенька | ect» . Архивировано с оригинала 2019-04-08 . Получено 2019-06-03 .
- ^ Jump up to: а беременный "Может ли жизнеспособная отрасль появиться из встряски водорода?" Полем Экономист . Получено 2023-09-26 .
- ^ «Цвет водорода объяснил» . Sensonic . Получено 2023-11-22 .
- ^ Jump up to: а беременный Национальная сетка. «Спектр цвета водорода» . Национальная группа сетки . Лондон, Великобритания . Получено 2022-09-29 .
- ^ "Какой потенциал для естественного водорода?" Полем Энергетический наблюдатель . Получено 2023-07-03 .
- ^ Jump up to: а беременный в BMWI (июнь 2020 г.). Национальная водородная стратегия (PDF) . Берлин, Германия: Федеральное министерство по экономическим делам и энергии (BMWI). Архивировано (PDF) из оригинала 2020-12-13 . Получено 2020-11-27 .
- ^ Jump up to: а беременный в Ван де Грааф, Тиджс; Overland, Индра; Шолтен, Даниэль; Вестфаль, Кирстен (декабрь 2020 г.). «Новая нефть? Геополитика и международное управление водородом» . Энергетические исследования и социальные науки . 70 : 101667. Bibcode : 2020erss ... 7001667V . doi : 10.1016/j.ers.2020.101667 . PMC 7326412 . PMID 32835007 .
- ^ Сансом, Роберт; Бакстер, Дженифер; Браун, Энди; Хоксворт, Стюарт; McCluskey, Ian (2020). Переход к водороду: оценка инженерных рисков и неопределенности (PDF) . Лондон, Великобритания: институт инженерии и технологий (IET). Архивировано (PDF) из оригинала 2020-05-08 . Получено 2020-03-22 .
- ^ Брюс, S; Теммингхофф, м; Хейворд, J; Шмидт, E; Munnings, c; Palfreyman, D; Хартли П. (2018). Национальная дорожная карта водорода: пути к экономически устойчивой водородной промышленности в Австралии (PDF) . Австралия: CSIRO. Архивировано (PDF) из оригинала на 2020-12-08 . Получено 2020-11-28 .
- ^ Департамент наук о Земле (12 сентября 2022 г.). "Золотой водород" . Кафедра наук о Земле, Оксфордский университет . Оксфорд, Великобритания . Получено 2022-09-29 .
- ^ Hassanpouryouzband, Aliakbar; Уилкинсон, Марк; Haszeldine, R Stuart (2024). "Фьючерсы на водородную энергию - кормление или сельское хозяйство?" Полем Обзоры химического общества . 53 (5): 2258–2263. doi : 10.1039/d3cs00723e . HDL : 20.500.11820/B23E204C-744E-44F6-8CF5-B6761775260D . PMID 38323342 .
- ^ «Фактическая мировая производство водорода от ...» Арно Эверс. Декабрь 2008 года. Архивировано с оригинала 2015-02-02 . Получено 2008-05-09 .
- ^ Веласкес Абад, а.; Dodds, PE (2017). «Производство водорода». Энциклопедия устойчивых технологий . С. 293–304. doi : 10.1016/b978-0-12-409548-9.10117-4 . ISBN 978-0-12-804792-7 .
- ^ Динсер, Ибрагим; Акар, Канан (сентябрь 2015 г.). «Обзор и оценка методов производства водорода для лучшей устойчивости». Международный журнал водородной энергии . 40 (34): 11094–11111. Bibcode : 2015ijhe ... 4011094d . doi : 10.1016/j.ijhydene.2014.12.035 .
- ^ Jump up to: а беременный в Пресса, Роман Дж.; Сантанам, KSV; Miri, Massoud J.; Бейли, Алла В.; Такач, Джеральд А. (2008). Введение в водородную технологию . Джон Уайли и сыновья. п. 249. ISBN 978-0-471-77985-8 .
- ^ Collodi, Guido (2010-03-11). «Производство водорода с помощью парового реформирования с захватом CO 2 » (PDF) . CISAP4 4 -я Международная конференция по безопасности и окружающей среде в индустрии процессов . Получено 2015-11-28 .
- ^ «Производство водорода HFCIT: реформирование природного газа» . Министерство энергетики США. 2008-12-15.
- ^ Badwal, Sukhvinder PS; Giddey, Sarbjit S.; Маннингс, Кристофер; Бхатт, Ананд I.; Холленкамп, Энтони Ф. (24 сентября 2014 г.). «Новые электрохимические технологии преобразования и хранения энергии» . Границы в химии . 2 : 79. Bibcode : 2014frch .... 2 ... 79b . doi : 10.3389/fchem.2014.00079 . PMC 4174133 . PMID 25309898 .
- ^ Вернер Циттель; Рейнхольд Вурстер (1996-07-08). «Глава 3: Производство водорода. Часть 4: Производство электричества посредством электролиза» . Hyweb: Знание - водород в энергетическом секторе . Ludwig-Bölkow-Systemtechnik Gmbh. Архивировано из оригинала 2007-02-07 . Получено 2010-10-01 .
- ^ Бьёрнар Крузе; Сондр Гринна; Cato Buch (2002-02-13). «Водород - статус и возможности» . Фонд Беллона. Архивировано из оригинала (PDF) 2011-07-02.
Предсказаны факторы эффективности для электролизеров PEM до 94%, но в настоящее время это только теоретически.
- ^ «Высокий и высокоэффективный 3D-электролиз воды» . Grid-Shift.com. Архивировано из оригинала 2012-03-22 . Получено 2011-12-13 .
- ^ «Широкий распространенный адаптация конкурентного водородного раствора» (PDF) . nelhydrogen.com . Нел Аса. Архивировано (PDF) из оригинала 2018-04-22 . Получено 22 апреля 2018 года .
- ^ Филиберт, Седрик. «Комментарий: производство промышленного водорода из возобновляемой энергии» . iea.org . Международное энергетическое агентство. Архивировано с оригинала 22 апреля 2018 года . Получено 22 апреля 2018 года .
- ^ IEA H2 2019 , с. 37
- ^ «Сколько электричества/воды необходимо для производства 1 кг H2 путем электролиза?» Полем Архивировано из оригинала 17 июня 2020 года . Получено 17 июня 2020 года .
- ^ Петрова, Магдалена (2020-12-04). «Зеленый водород набирает обороты, но все еще имеет огромные препятствия для преодоления» . CNBC . Получено 2021-06-20 .
- ^ «ITM - инфраструктура заправки водорода - февраль 2017 года» (PDF) . level-network.com . Получено 17 апреля 2018 года .
- ^ «Снижение затрат и повышение производительности электролизеров PEM» (PDF) . fch.europa.eu . Топливные элементы и водородные суставные предприятия . Получено 17 апреля 2018 года .
- ^ Каламарас, Кристос М.; Efstathiou, Angelos M. (2013). «Технологии производства водорода: текущее состояние и будущие разработки» . Конференции по энергетике . 2013 : 1–9. doi : 10.1155/2013/690627 .
- ^ «Снижение затрат и повышение производительности электролизеров PEM» (PDF) . fch.europa.eu . Топливные и водородные суставные предприятия . Получено 17 апреля 2018 года .
- ^ «Отчет и финансовая отчетность 30 апреля 2016 года» (PDF) . itm-power.com . Получено 17 апреля 2018 года .
- ^ «Производство водорода: реформирование природного газа» . Energy.gov . Министерство энергетики США . Получено 17 апреля 2018 года .
- ^ Jump up to: а беременный Ordeski, MF Альтернативные виды топлива: будущее водорода. 171–199 (The Fairmont Press, Inc., 2007).
- ^ Badwal, Sukhvinder PS; Гидди, Сарбжит; Маннингс, Кристофер (2013). «Производство водорода через твердые электролитические маршруты». Wiley Междисциплинарные обзоры: энергия и окружающая среда . 2 (5): 473–487. Bibcode : 2013wiree ... 2..473b . doi : 10.1002/wene.50 . S2CID 135539661 .
- ^ Себбахи, Седдик; Набил, Нухайла; Alaoui-belghiiti, амин; Ласри сказал; Рахиди, Самир; Хаджаджи, Абдельвахид (2022). «Оценка трех наиболее развитых технологий электролиза воды: электролиз щелочной воды, протонная мембрана и электролиз с твердым оксидом» Материалы сегодня: Труды 66 : 140–145. Doi : 10.1016/ j.matpr.2022.04.2
- ^ Jump up to: а беременный Огден, Дж. М. (1999). «Перспективы построения инфраструктуры энергетики водорода». Ежегодный обзор энергии и окружающей среды . 24 : 227–279. doi : 10.1146/annurev.energy.24.1.227 .
- ^ Хейч, Энн; Ebbesen, Sune Dalgaard; Дженсен, Сёрен Хойгаард; Могенсен, Могенс (2008). «Высокоэффективный электролиз высокого температуры». Журнал материалов Химия . 18 (20): 2331–40. Doi : 10.1039/b718822f .
- ^ В лаборатории можно сделать электролиз воды с таким простым аппаратом, как вольтаметт Hofmann : «Электролиз воды и концепция заряда» . Архивировано из оригинала 2010-06-13.
- ^ «Атомные электростанции могут производить водород для питания« экономики водорода » (пресс -релиз). Американское химическое общество . 25 марта 2012 года. Архивировано с оригинала 10 декабря 2019 года . Получено 9 марта 2013 года .
- ^ Кларк, Re; Giddey, S.; Ciacchi, ft; Badwal, Sps; Пол, Б.; Эндрюс, Дж. (2009). «Прямая связь электролизера с солнечной фотоэлектрической системой для генерации водорода». Международный журнал водородной энергии . 34 (6): 2531–42. doi : 10.1016/j.ijhydene.2009.01.053 .
- ^ Лука Бертуччиоли; и др. (7 февраля 2014 г.). «Разработка электролиза в Европейском Союзе» (PDF) . Клиентские топливные элементы и предприятие водородного сустава . Архивировано из оригинала (PDF) 31 марта 2015 года . Получено 2 мая 2018 года .
- ^ Л. Лао; C. Ramshaw; H. Yeung (2011). «Интенсификация процесса: электролиз воды в центробежном поле ускорения» . Журнал прикладной электрохимии . 41 (6): 645–656. doi : 10.1007/s10800-011-0275-2 . HDL : 1826/6464 . S2CID 53760672 . Получено 12 июня 2011 года .
- ^ Stensvold, Tore (26 января 2016 г.). «Рецепт Coca-Cola» может сделать водород новым норвежским промышленным приключением . Технический еженедельный журнал .
- ^ Столтен, Детлеф (4 января 2016 г.). Водородная наука и инженерия: материалы, процессы, системы и технологии . Джон Уайли и сыновья. п. 898. ISBN 9783527674299 Полем Получено 22 апреля 2018 года .
- ^ Thyssenkrupp. «Водород из электролиза воды - растворы для устойчивости» . thyssenkrupp-uhde-chlorine-engineers.com . Архивировано из оригинала 19 июля 2018 года . Получено 28 июля 2018 года .
- ^ «ITM - инфраструктура заправки водорода - февраль 2017 года» (PDF) . level-network.com . Получено 17 апреля 2018 года .
- ^ «Снижение затрат и повышение производительности электролизеров PEM» (PDF) . fch.europa.eu . Топливные элементы и водородные суставные предприятия . Получено 17 апреля 2018 года .
- ^ Бьёрнар Крузе; Сондр Гринна; Като -Бух (13 февраля 2002 г.). «Водород - статус и возможности» (PDF) . Фонд Беллона. п. 20. Архивировано из оригинала 16 сентября 2013 года.
{{cite web}}: Cs1 maint: непредвзятый URL ( ссылка ) - ^ Фиклинг, Дэвид (2 декабря 2020 года). «Водород - это ставка на триллион долларов на будущее» . Bloomberg.com . Архивировано из оригинала 2 декабря 2020 года.
Зеленый водород. Цена тока от 3 до 8 долларов за килограмм .. серый водород, который стоит всего 1 доллар США.
- ^ Вернер Циттель; Рейнхольд Вурстер (1996-07-08). «Глава 3: Производство водорода. Часть 4: Производство электричества посредством электролиза» . Hyweb: Знание - водород в энергетическом секторе . Ludwig-Bölkow-Systemtechnik Gmbh.
- ^ Бьёрнар Крузе; Сондр Гринна; Cato Buch (2002-02-13). «Водород - статус и возможности» . Фонд Беллона. Архивировано из оригинала (PDF) 2011-07-02.
Предсказаны факторы эффективности для электролизеров PEM до 94%, но в настоящее время это только теоретически.
- ^ «Высокий и высокоэффективный 3D-электролиз воды» . Grid-Shift.com. Архивировано из оригинала 2012-03-22 . Получено 2011-12-13 .
- ^ «Технические цели DOE для производства водорода из электролиза» . Energy.gov . Министерство энергетики США . Получено 22 апреля 2018 года .
- ^ Оставьте, Джейсон. «Xcel привлекает беспрецедентные» низкие цены на солнечную энергию и ветер в паре с хранением » . greentechmedia.com . Вуд Макензи . Получено 22 апреля 2018 года .
- ^ Доступ 22 июня 2021 года
- ^ Giddey, S; Кулкарни, а; Badwal, SPS (2015). «Низкое выбросы генерации водорода с помощью углеродного электролиза». Международный журнал водородной энергии . 40 (1): 70–4. Bibcode : 2015ijhe ... 40 ... 70g . doi : 10.1016/j.ijhydene.2014.11.033 .
- ^ Мм, Сангён; Чон, Хонгра; Ким, Тэ Джин; Lee, Jaeyoung (2012). «Чистое производство водорода из растворов метанол-вода посредством электролитического процесса реформирования, вызванного электролитическим реформированием». Журнал источников питания . 198 : 218–22. doi : 10.1016/j.jpowsour.2011.09.083 .
- ^ Ju, Hyungkuk; Гидди, Сарбжит; Badwal, Sukhvinder PS (2017). «Роль наноразмерного SNO 2 в электрокатализаторах на основе PT для выработки водорода в электролизе с помощью метанола, помогающей воде». Электрохимика Акта . 229 : 39–47. doi : 10.1016/j.electacta.2017.01.106 .
- ^ Ju, Hyongk; Гидди, Сарбжит; Baddal, Sukvinder PS; Малдер, Роджер Дж. (2016). Электро-каттитическое преобразование. Electorchimiic Acta . 212 : 744–57. doi : 10.1016/j.election .
- ^ Jump up to: а беременный Лами, Клод; Девадас, Абирами; Симос, Марио; Coutanceau, Christophe (2012). «Чистая генерация водорода посредством электрокаталитического окисления муравьиной кислоты в ячейке электролиза протонной обменной мембраны (PEMEC)». Электрохимика Акта . 60 : 112–20. doi : 10.1016/j.electacta.2011.11.006 .
- ^ Jump up to: а беременный Badwal, Sukhvinder P. S; Giddey, Sarbjit S; Маннингс, Кристофер; Бхатт, Ананд я; Холленкамп, Энтони Ф. (2014). «Новые электрохимические технологии преобразования и хранения энергии» . Границы в химии . 2 : 79. Bibcode : 2014frch .... 2 ... 79b . doi : 10.3389/fchem.2014.00079 . PMC 4174133 . PMID 25309898 .
- ^ Ju, h; Badwal, Sps; Giddey, S (2018). «Комплексный обзор углеродного и углеводородочного электролиза для производства водорода». Прикладная энергия . 231 : 502–533. Bibcode : 2018apen..231..502J . doi : 10.1016/j.apenergy.2018.09.125 . S2CID 117669840 .
- ^ Ju, Hyungkuk; Бадвал, Сухвиндер; Giddey, Sarbjit (2018). «Комплексный обзор углеродного и углеводородочного электролиза для производства водорода». Прикладная энергия . 231 : 502–533. Bibcode : 2018apen..231..502J . doi : 10.1016/j.apenergy.2018.09.125 . S2CID 117669840 .
- ^ Jump up to: а беременный Сасидхар, Наллапанени (30 ноября 2023 г.). «Углеродистое топливо и химические вещества из автоночных нефтеперерабатывающих заводов биомассы» . Индийский журнал по инженерии окружающей среды . 3 (2): 1–8. doi : 10.54105/ijee.b1845.113223 .
- ^ http://www.nedstack.com/images/stories/news/documents/20120202_Press%20Release%20Solvay%20PEM%20Power%20Plant%20Start%20Up.pdf Архивировано 2014-12-08 на машине Wayback% 20Start%20UP.PDF 2014-12-08
- ^ «Различные газы из производства стали» . Архивировано с оригинала 27 марта 2016 года . Получено 5 июля 2020 года .
- ^ «Производство сжиженного водорода, полученного COG» (PDF) . Архивировано (PDF) из оригинала 8 февраля 2021 года . Получено 8 июля 2020 года .
- ^ «Водородные технологии» . www.interstateTraveler.us .
- ^ [1] [ Постоянная мертвая ссылка ] [ Полная цитата необходима ]
- ^ «Кварнер-процесс с технологией утилизации отходов в плазменных дугах» . Архивировано из оригинала 2014-03-13 . Получено 2009-10-13 .
- ^ «Преимущества выбросов газификации» . Национальная лаборатория энергетических технологий . Министерство энергетики США.
- ^ «Выбросы от горящего угля» . США EIA . Администрация энергетической информации США.
- ^ Ли, Вун-дже; Ли, Юн-Кук (2001). «Внутренние характеристики давления газа, генерируемые во время карбонизации угля в коксе». Энергия и топливо . 15 (3): 618–23. doi : 10.1021/ef990178a .
- ^ Gemayel, Jimmy El; Макки, Артуро; Хьюз, Робин; Энтони, Эдвард Джон (2014). «Моделирование интеграции объекта модернизации битума и процесса IGCC с захватом углерода». Топливо . 117 : 1288–97. Bibcode : 2014fuel..117.1288g . doi : 10.1016/j.fuel.2013.06.045 .
- ^ Блейн, Лоз (2022-10-04). «Микробы, питающиеся нефтью, выделяют самый дешевый в мире« чистый «водород» . Новый Атлас . Получено 2022-10-06 .
- ^ Введение в радиационную химию Глава 7
- ^ Справочник по производству ядерного водорода Глава 8
- ^ Ли-гунг Лин; Пей-Линг Ван; Дуглас Румбл; Йоханна Липпманн-Пипке; Эрик Бойс; Лиза М. Пратт; Барбара Шервуд Лоллар ; Eoin L. Brodie; Терри С. Хазен; Гари Л. Андерсен; Тодд З. Десантис; Дуэйн П. Мозер; Дэйв Кершоу; TC Onstott (2006). «Долгосрочная устойчивость высокоэнергетической, низкоразбитивной коры биома» . Наука . 314 (5798): 479–82. Bibcode : 2006sci ... 314..479L . doi : 10.1126/science.1127376 . PMID 17053150 . S2CID 22420345 .
- ^ «Мечта или реальность? Электрификация отраслей химических процессов» . www.aiche-cep.com . Получено 2021-08-22 .
- ^ Гусин, Ху; Хао, Хуан (май 2009 г.). «Производство топливного газа богатого водородом путем газификации влажной биомассы с использованием сорбента CO2». Биомасса и биоэнергетика . 33 (5): 899–906. doi : 10.1016/j.biombioe.2009.02.006 .
- ^ Пинг, Чжан; Лайджун, Ван; Songzhe, Chen; Джингминг, Сюй (январь 2018 г.). «Прогресс производства ядерного водорода посредством процесса йода -мульчасти в Китае». Возобновляемые и устойчивые обзоры энергии . 81 : 1802–1812. Bibcode : 2018rserv..81.1802p . doi : 10.1016/j.rser.2017.05.275 .
- ^ Производство водорода: термохимические циклы
- ^ IEA Energy Technology Essentials- Архивирование производства и распределения водорода 2011-11-03 в The Wayback Machine , апрель 2007 г.
- ^ «HTTR высокотемпературная тестовый испытательный реактор» . Httr.jaea.go.jp. Архивировано из оригинала 2014-02-03 . Получено 2014-01-23 .
- ^ https://smr.inl.gov/document.ashx?path=docs%2fgcr-int%2fnhddelder.pdf Архивировал 2016-12-21 на машине Wayback . Прогресс в ядерной энергии Ядерная тепло для производства водорода: сочетание очень высокой/высокой температуры реактор на завод, производство водорода. 2009
- ^ «Отчет о состоянии 101 - Реактор с высокой температурой газовой турбины (GTHTR300C)» (PDF) .
- ^ «VHTR от JAEA для водорода и электричества когенерации: GTHTR300C» (PDF) . Архивировано из оригинала (PDF) 2017-08-10 . Получено 2013-12-04 .
- ^ Chukwu, C., Naterer, GF, Rosen, MA, «Процесс моделирование ядерного водорода с циклом Cu-Cl», 29-я конференция Канадского ядерного общества, Торонто, Онтарио, Канада, 1–4 июня 2008 г. Полем «Процесс моделирования ядерного термохимического производства водорода с медно-хлорным циклом» (PDF) . Архивировано из оригинала (PDF) 2012-02-20 . Получено 2013-12-04 .
- ^ Отчет № 40: процесс Ferrosilicon для генерации водорода
- ^ Откровенная наука: разговоры с известными химиками , István Hargittai, Magdolna Hargittai, p. 261, Imperial College Press (2000) ISBN 1-86094-228-8
- ^ Hemschemeier, Anja; Мелис, Анастасиос; Хаппе, Томас (2009). «Аналитические подходы к фотобиологической продукции водорода в одноклеточных зеленых водорослях» . Фотосинтез исследования . 102 (2–3): 523–40. Bibcode : 2009pher.102..523h . doi : 10.1007/s11120-009-9415-5 . PMC 2777220 . PMID 19291418 .
- ^ «DOE 2008 отчет 25 %» (PDF) . Архивировано из оригинала (PDF) 2017-06-17 . Получено 2009-03-06 .
- ^ Jenvanitpanjakul, Peesamai (3–4 февраля 2010 г.). Технология возобновляемых источников энергии и перспектива исследования биогидрогена в Таиланде (PDF) . Заседание руководящего комитета и семинар Исследовательской сети APEC для передовой биогидрогенной технологии. Тайчунг : Университет Фэн Чиа . Архивировано из оригинала (PDF) 4 июля 2013 года.
- ^ Наварре Юга, Руфин М.; Альварес Гальван, М. Утешение; Долины, ф.; Villory of the Hand, Джозеф А.; Железо, Хосе Л.Г. (2009). Полу-кальцлеты. Chemsuschem 2 (6): 471–85. Bibcode : 2009chsch ... 2 два 10.1002/cssc.200900018: 19536754PMID
- ^ Наварро, RM; Del Valle, F.; Villoria de la Mano, Ja; Альварес-Галван, MC; Fierro, JLG (2009). «Фотокаталитическое расщепление воды под видимым светом: развитие концепции и катализаторов» . Фотокаталитические технологии . Достижения в области химического машиностроения. Тол. 36. С. 111–43. doi : 10.1016/s0065-2377 (09) 00404-9 . ISBN 978-0-12-374763-1 .
- ^ Ropero-Vega, JL; Pedraza-Avella, Ja; Ниньо-Гомес, я (сентябрь 2015 г.). «Производство водорода путем фотоэлектролиза водных растворов фенола с использованием смешанных оксидных полупроводниковых пленок Bi - Nb - M - O (m = al, fe, ga, in) в качестве фотоанодов». Катализ сегодня . 252 : 150–156. doi : 10.1016/j.cattod.2014.11.007 .
- ^ Низкий, джингксиан; Ты, Джаго; Jaronic, Metect; Wageh, Swalm; Аль-Гэмди, Ахмед А. (май 2017 г.). «Гетеропереходные фотокалисты». Продвинутые материалы . 29 (20). Bibcode : 2017Adm… .2901694L . doi : 10.1002/adma.201601694 . PMID 2820969 . S2CID 2126127 .
- ^ Джуришич, Александра Б.; Он, янлинг; Нг, Алан М.К. (март 2020 г.). «Видимые фотокатализаторы: перспективы и проблемы» . APL материалы . 8 (3): 030903. Bibcode : 2020aplm .... 8C0903d . doi : 10.1063/1,5140497 .
- ^ Jump up to: а беременный Хайссингер, Петр; Lohmüller, Reiner; Уотсон, Аллан М. (2011). «Водород, 1. Свойства и возникновение». Энциклопедия промышленной химии Уллмана . doi : 10.1002/14356007.a13_297.pub2 . ISBN 978-3-527-30673-2 .
- ^ Jump up to: а беременный Асади, Нушин; Карими Алавидже, Масих; Zilouei, Хамид (январь 2017 г.). «Разработка математической методологии для изучения производства биогидрогена из региональных и национальных остатков сельскохозяйственных культур: тематическое исследование Ирана». Международный журнал водородной энергии . 42 (4): 1989–2007. Bibcode : 2017ijhe ... 42.1989a . doi : 10.1016/j.ijhydene.2016.10.021 .
- ^ Дао, у; Чен, у; Wu, y; Привет; Zhou, Z (2007). «Высокий выход водорода из двухэтапного процесса темной и фотосессии сахарозы». Международный журнал водородной энергии . 32 (2): 200–6. Bibcode : 2007ijhe ... 32..200T . doi : 10.1016/j.ijhydene.2006.06.034 .
- ^ Раджанандам, Бриеш; Киран, Шива (2011). «Оптимизация производства водорода Halobacterium salinarium в сочетании с E coli с использованием молочной плазмы в качестве ферментативного субстрата» . Журнал биохимических технологий . 3 (2): 242–4. Архивировано из оригинала 2013-07-31 . Получено 2013-03-09 .
- ^ Асади, Нушин; Zilouei, Хамид (март 2017 г.). «Оптимизация предварительной обработки рисовой соломы органосольва для усиленной продукции биогидрогена с использованием энтеробактерных аэрогенов». Технология Bioresource . 227 : 335–344. Bibcode : 2017bitec.227..335a . doi : 10.1016/j.biortech.2016.12.073 . PMID 28042989 .
- ^ Персиваль Чжан, YH; Солнце, Джибин; Zhong, Jian-Jiang (2010). «Производство биотоплива с помощью биотрансформации синтетического ферментативного пути in vitro». Текущее мнение о биотехнологии . 21 (5): 663–9. doi : 10.1016/j.copbio.2010.05.005 . PMID 20566280 .
- ^ Стрик, Дэвид ПБТБ; Хэмелерс (Берт), HVM; Снел, Ян Ф.Х; Buisman, Cees JN (2008). «Производство зеленого электричества с живыми растениями и бактериями в топливном элементе». Международный журнал исследований энергетики . 32 (9): 870–6. Bibcode : 2008ijer ... 32..870s . doi : 10.1002/er.1397 . S2CID 96849691 .
- «Живые растения производят энергию» . Университет Вагенингена и исследовательский центр (пресс -релиз). Архивировано из оригинала 2010-05-17.
- ^ Timmers, Ruud (2012). Выработка электроэнергии живыми растениями в микробном топливном элементе завода (кандидатская диссертация). Университет Вагенингена. ISBN 978-94-6191-282-4 . [ страница необходима ]
- ^ «Наногалванические сплавы на основе алюминия для генерации водорода» . Исследовательская лаборатория боевых возможностей армии США . Получено 6 января 2020 года .
- ^ МакНалли, Дэвид (25 июля 2017 г.). «Обнаружение армии может предложить новый источник энергии» . Армия США . Получено 6 января 2020 года .
- ^ Гаухер, Эрик С. (февраль 2020 г.). «Новые перспективы в промышленном разведке для местного водорода» . Элементы: международный журнал минералогии, геохимии и петрологии . 16 (1): 8–9. Bibcode : 202010eleme..16 .... 8g . doi : 10.2138/gesselents.16.1.8 .
- ^ Рука, Эрик. «Скрытый водород» . Science.org . Наука . Получено 9 декабря 2023 года .
- ^ «Потенциал геологического водорода для энергии следующего поколения | Геологическая служба США» .
- ^ Фернандес, Соня. «Исследователи разрабатывают потенциально недорогую технологию с низким уровнем выбросов, которая может преобразовать метатан без формирования CO2» . Phys-Org . Американский институт физики. Архивировано из оригинала 19 октября 2020 года . Получено 19 октября 2020 года .
- ^ Басф. «Исследователи BASF, работающие над принципиально новыми, низкоуглеродистыми производственными процессами, пиролизом метана» . Устойчивость Соединенных Штатов . Басф. Архивировано из оригинала 19 октября 2020 года . Получено 19 октября 2020 года .
- ^ Шнайдер, Стефан; Баджор, Зигфрид; Граф, Фрэнк; Колб, Томас (октябрь 2020 г.). «Состояние искусства производства водорода посредством пиролиза природного газа» . Chembioeng Reviews . 7 (5): 150–158. doi : 10.1002/cben.202000014 .
- ^ Upham, D. Chester; Агарвал, Вишал; Хечфе, Александр; Snodgrass, Zachary R.; Гордон, Майкл Дж.; Metiu, Horia; McFarland, Eric W. (17 ноября 2017 г.). «Каталитические расплавленные металлы для прямого преобразования метана в водород и разделяемый углерод» . Наука . 358 (6365): 917–921. Bibcode : 2017sci ... 358..917U . doi : 10.1126/science.aao5023 . PMID 29146810 . S2CID 206663568 .
- ^ Палмер, Кларк; Upham, D. Chester; Умный, Саймон; Гордон, Майкл Дж.; Metiu, Horia; McFarland, Eric W. (январь 2020 г.). «Сухое реформирование метана, катализируемое сплавными сплавами с расплавленным металлом». Природный катализ . 3 (1): 83–89. doi : 10.1038/s41929-019-0416-2 . S2CID 210862772 .
- ^ Картрайт, Джон. «Реакция, которая даст нам чистое ископаемое топливо навсегда» . Newscientist . New Scientist Ltd. Архивировал из оригинала 26 октября 2020 года . Получено 30 октября 2020 года .
- ^ Институт технологии Карлсруэ. «Водород из метана без выбросов CO2» . Phys.org . Архивировано из оригинала 21 октября 2020 года . Получено 30 октября 2020 года .
- ^ Труды hcei.tsc.ru
- ^ Lumbers, Brock (2022). «Математическое моделирование и моделирование термо-каталитического разложения метана для экономически улучшенного производства водорода» . Международный журнал водородной энергии . 47 (7): 4265–4283. Bibcode : 2022ijhe ... 47.4265L . doi : 10.1016/j.ijhydene.2021.11.057 . S2CID 244814932 . Получено 16 марта 2022 года .
- ^ Патлолла, Шашанк Редди; Кацу, Кайл; Шарафиан, Амир; Вэй, Кевин; Эррера, Омар Э.; Мерида, Уолтер (июль 2023 г.). «Обзор технологий пиролиза метана для производства водорода». Возобновляемые и устойчивые обзоры энергии . 181 : 113323. Bibcode : 2023rserv.18113323p . doi : 10.1016/j.rser.2023.1133323 .
- ^ Дао, Юнчхен; Чен, Ян; Ву, Юнцян; Он, янлинг; Чжоу, Чжихуа (1 февраля 2007 г.). «Высокий выход водорода из двухэтапного процесса темной и фотосессии сахарозы». Международный журнал водородной энергии . 32 (2): 200–206. Bibcode : 2007ijhe ... 32..200T . doi : 10.1016/j.ijhydene.2006.06.034 . INIST 18477081 .
- ^ «Производство водорода из органического твердого вещества» . Biohydrogen.nl. Архивировано с оригинала 2011-07-20 . Получено 2010-07-05 .
- ^ Hemschemeier, Anja; Мелис, Анастасиос; Хаппе, Томас (декабрь 2009 г.). «Аналитические подходы к фотобиологической продукции водорода в одноклеточных зеленых водорослях» . Фотосинтез исследования . 102 (2–3): 523–540. Bibcode : 2009pher.102..523h . doi : 10.1007/s11120-009-9415-5 . PMC 2777220 . PMID 19291418 .
- ^ «Nanologix генерирует энергию на месте с помощью биореакторного водорода» . Твердое состояние технологии . 20 сентября 2007 года. Архивировано с оригинала 2018-05-15 . Получено 14 мая 2018 года .
- ^ «Мощность от растений с использованием микробных топливных элементов» (на голландском языке). Архивировано из оригинала 2021-02-08 . Получено 2010-07-05 .
- ^ Janssen, H.; Смоки, б.; Грон, Hg; Mai, H.; Рейхель, Р.; Столтен Д. (2001). Электролиз высокого давления, ключевая технология для эффективного H 2 производства . Гипотеза IV. Kluwer Academic. С. 172–177. ISBN 978-3-9807963-0-9 Полем OCLC 496234379 . Ости 20274275 .
- ^ Кармо, м; Фриц Д; Mergel J; Столтен Д. (2013). «Комплексный обзор электролиза PEM Water». Журнал водородной энергии . 38 (12): 4901–4934. Bibcode : 2013ijhe ... 38.4901c . doi : 10.1016/j.ijhydene.2013.01.151 .
- ^ «2003-Фебус-Паг.9» (PDF) . Архивировано из оригинала (PDF) на 2009-03-27 . Получено 2010-07-05 .
- ^ «Финляндия экспортирует десять топливных станций» . Декабрь 2015 года. Архивировано с оригинала 2016-08-28 . Получено 2016-08-22 .
- ^ «Паровая жара: исследователи готовится к полномасштабной водородной установке» (пресс-релиз). Наука ежедневно . 2008-09-18. Архивировано из оригинала 2008-09-21 . Получено 2008-09-19 .
- ^ «План исследований и разработок ядерного водорода» (PDF) . US Dept. of Energy . Март 2004 года. Архивировано из оригинала (PDF) 2008-05-18 . Получено 2008-05-09 .
- ^ Валенти, Джованни; Бони, Алессандро; Мельхионна, Мишель; Cargnello, Matteo; Наси, Люсия; Бертони, Джованни; Gorte, Raymond J.; Маркачо, Массимо; Рапино, Стефания; Бончио, Марселла; Fornasiero, Paolo; Прато, Маурицио; Паолуччи, Франческо (декабрь 2016 г.). «Коасиальные гетероструктуры Интукация диоксида палладия/титана с углеродными нанатубами для эффективной эволюции электрокалитического водорода» . Природная связь . 7 (1): 13549. Bibcode : 2016natco ... 713549v . Doi : 10.1038/ncomms13549 . PMC 5159813 . PMID 27941752 .
- ^ Уильям Айерс, Патент США 4 466 869 фотолитического производства водорода
- ^ Jump up to: а беременный Наварре Юга, Руфин М.; Альварес Гальван, М. Утешение; долины, ф.; Ручный злодей, Хосе А.; Железо, Хосе Л.Г. (22 июня 2009 г.). Полу-кальцлеты. Chemsuschem 2 (6): 471–485. Bibcode : 2009chsch ... 2 два 10.1002/cssc.200900018: 19536754PMID
- ^ Jump up to: а беременный Наварро, RM; Del Valle, F.; Villoria de la Mano, Ja; Альварес-Галван, MC; Fierro, JLG (2009). «Фотокаталитическое расщепление воды под видимым светом». Достижения в области химической инженерии - фотокаталитические технологии . Тол. 36. С. 111–143. doi : 10.1016/s0065-2377 (09) 00404-9 . ISBN 978-0-12-374763-1 .
- ^ Нанн, Томас; Ибрагим, Саад К.; Woi, Pei-Meng; Сюй, Шу; Зиглер, Ян; Пикетт, Кристофер Дж. (22 февраля 2010 г.). «Расщепление воды видимым светом: нанофотокатода для производства водорода» . Angewandte Chemie International Edition . 49 (9): 1574–1577. doi : 10.1002/anie.200906262 . PMID 20140925 .
- ^ Yamamura, Tetsushi (2 августа 2015 г.). «Panasonic приближается к самообеспеченности по энергии дома с топливными элементами» . Асахи Шимбун . Архивировано с оригинала 7 августа 2015 года . Получено 2015-08-02 .
- ^ «Портал DLR-ученые DLR достигают солнечного водорода на 100-киловаттной пилотной установке» . Dlr.de. 2008-11-25. Архивировано из оригинала 2013-06-22 . Получено 2009-09-19 .
- ^ «353 термохимические циклы» (PDF) . Архивировано (PDF) из оригинала на 2009-02-05 . Получено 2010-07-05 .
- ^ UNLV Термохимический цикл Автоматизированной базы данных оценивания (публичная) [ Постоянная мертвая ссылка ]
- ^ «Разработка солнечной термохимической продукции водорода из воды» (PDF) . Архивировано (PDF) из оригинала 2007-04-17 . Получено 2010-07-05 .
- ^ «Беллона-гидрогенрепорт» . InterstateTraveler.us. Архивировано с оригинала 2016-06-03 . Получено 2010-07-05 .
- ^ https://www.hfpeurope.org/infotools/energyinfos__e/hydrogen/main03.html [ Постоянная мертвая ссылка ]
- ^ Принцхофер, Ален; Тахара Сиссе, Чик Сиди; Диало, Алиу Бубакар (октябрь 2018 г.). «Открытие большого накопления естественного водорода в Бурукбугу (Мали)». Международный журнал водородной энергии . 43 (42): 19315–19326. Bibcode : 2018ijhe ... 4319315p . doi : 10.1016/j.ijhydene.2018.08.193 . S2CID 105839304 .
- ^ Ларин, Николай; Zgonnik, viacheslav; Родина, Светлана; Девиль, Эрик; Принцхофер, Ален; Ларин, Владимир Н. (сентябрь 2015 г.). «Природное молекулярное водородное просачивание, связанное с поверхностными, округленными депрессиями на европейском кратоне в России». Исследование природных ресурсов . 24 (3): 369–383. Bibcode : 2015nrr .... 24..369L . doi : 10.1007/s11053-014-9257-5 . S2CID 128762620 .
- ^ Гаухер, Эрик С. (1 февраля 2020 г.). «Новые перспективы в промышленном разведке для местного водорода» . Элементы . 16 (1): 8–9. Bibcode : 202010eleme..16 .... 8g . doi : 10.2138/gesselents.16.1.8 .
- ^ Truche, Laurent; Базаркина, Елена Ф. (2019). «Естественный водород. Топливо 21 века» . E3S Web of Conferences . 98 : 03006. BIBCODE : 2019E3SWC..9803006T . doi : 10.1051/e3sconf/20199803006 .
- ^ «Потенциал геологического водорода для энергии следующего поколения | Геологическая служба США» .
- ^ «Резюме исполнительной власти - Глобальный обзор водорода 2023 - Анализ» . IEA . Получено 2024-05-13 .
- ^ Хесслер, Уве (6 декабря 2020 г.). "Первый элемент в периодической таблице: почему все суета о водороде?" Полем DW.com . Deutsche Welle.
- ^ «Продукты воздуха для построения крупнейшего в Европе голубого водорода и укрепляют долгосрочное согласие» , пресс-релиз Air Products , 6 ноября 2023 года. Получено 2023-11-14.
- ^ Роберт В. Ховарт; Марк З. Джейкобсон (12 августа 2021 г.). «Насколько зеленый синий водород?». Энергетическая наука и инженерия . doi : 10.1002/ESE3.956 . ISSN 2050-0505 . Wikidata Q108067259 .
- ^ Антонини, Кристина; Трейер, Карин; Стреб, Энн; van der Spek, Mijndert; Бауэр, Кристиан; Маззотти, Марко (2020). «Производство водорода из природного газа и биометана с захватом и хранением углерода-техно-экологический анализ». Устойчивая энергия и топливо . 4 (6): 2967–2986. doi : 10.1039/d0se002222d . HDL : 20.500.11850/422246 .
- ^ «Факты о низкоуглеродном водороде-европейская перспектива» , Zep Oct 2021. Подтверждено 2023-12-12.
- ^ «Новые горизонты для водорода» (PDF) . Обзор исследований (2). Национальная лаборатория возобновляемой энергии : 2–9. Апрель 2004 г.
- ^ Дворак, Phred, "WSJ News Exclusive: Green Hydrode получает повышение в США с заводом за 4 миллиарда долларов : запланированная фабрика, совместное предприятие от Air Products и AES ..."], Wall Street Journal , 8 декабря 2022 года. Получено 2023-11-14. (требуется подписка)
- ^ Коллинз, Ли (25 января 2022 г.). «Первый мир для ядерного розового водорода в качестве коммерческой сделки, подписанной в Швеции | перезарядка» . Перезарядка | Последние новости о возобновляемых источниках энергии .
- ^ Jump up to: а беременный Коллинз, Ли (19 марта 2020 г.). «Пробуждение на зеленом водороде: количество необходимого ветра и солнечной энергии огромно | перезарядка» . Перезарядка | Последние новости о возобновляемых источниках энергии . Архивировано из оригинала 4 июня 2021 года.
- ^ «Как энергетический кризис влияет на переход к чистому нулю?» Полем Европейский инвестиционный банк . Получено 2022-12-23 .
- ^ «Водород - топливо и технологии» . IEA . Получено 2022-12-23 .
- ^ Castelvecchi, Davide (2022-11-16). «Как революция водорода может помочь спасти планету - и как она не может». Природа . 611 (7936): 440–443. Bibcode : 2022natur.611..440c . doi : 10.1038/d41586-022-03699-0 . PMID 36385542 . S2CID 253525130 .
- ^ «Водород» . Energy.ec.europa.eu . Получено 2022-12-23 .
- ^ Ричи, Ханна . "Сколько людей кормит синтетические удобрения?" Полем Наш мир в данных . Глобальная лаборатория данных . Получено 16 сентября 2021 года .
Источники
[ редактировать ]Дальнейшее чтение
[ редактировать ]- Франческо Кализ; и др., ред. (2019). Солнечное производство водорода . Академическая пресса. ISBN 978-0-12-814853-2 .