Полиаминоксидаза
Полиаминоксидаза ферментативный (PAO) представляет собой флавопротеин , который окисляет углерод-азот-связь во вторичной аминогруппе донора полиаминов , используя молекулярный кислород в качестве акцептора. Генерализованная реакция PAO превращает три субстрата (вода, кислород и полиамин с первичными и вторичными аминогрупп) в три продукта ( перекись водорода , амино-альдегид и первичный амин). Различные PAO с различными спецификами субстрата существуют в разных организмах. Филогенетический анализ предполагает, что PAOS, вероятно, развивался один раз у эукариот и диверсифицирован с помощью дивергентной эволюции и событий дупликации генов, хотя некоторые прокариоты приобрели PAO с помощью горизонтального переноса генов . [ 1 ]

| Субстрат | Амино-альдегидный продукт | Первичный продукт амина | Идентификатор EC | Кегг реакция |
| Спермина | 3-аминопропанал | Спермидин | EC 1.5.3.16 , EC 1.5.3.17 | R09076 |
| Спермидин | 3-аминопропанал | Путресцина | EC 1.5.3.17 | R09077 |
| 4-аминобутанал | 1,3-диаминопропан | EC 1.5.3.14 | R01914 | |
| N1-ацетилспермин | N- (3-ацетамидопропил) -4-аминобутанал | 1,3-диаминопропан | EC 1.5.3.15 | НА |
| 3-ацетамидопропанал | Спермидин | EC 1.5.3.13 , EC 1.5.3.17 | R03899 | |
| N1, n12-dicetylspermine | 3-ацетамидопропанал | N1-ацетилспермидин | EC 1.5.3.13 | НА |
| N1-ацетилспермидин | 3-ацетамидопропанал | Путресцина | EC 1.5.3.13, EC 1.5.3.17 | R09074 |
| N8-ацетилспермидин | 4-ацетамидобутанал | 1,3-диаминопропан | EC 1.5.3.15 | R09075 |
Структура и механизм
[ редактировать ]Структуры PAO из кукурузы, пивоваренных дрожжей и мышей содержат субстрат-связывающий домен и FAD-связывающий домен обеспечивает причудливый кофактор . , который не кофактор [ 2 ] [ 3 ] [ 4 ] Активный сайт расположен на интерфейсе этих доменов.

Активные сайты в PAO различаются, но некоторые функции необходимы. Наиболее строго консервированными аминокислотными кодонами активного участка в генах PAO являются остаток K в положении 300 и ароматический остаток ( F , Y или H ) в положении 403 (числа относятся к гомологичным положениям в последовательности ZMPAO1, найденное PAO. в кукурузе). [ 1 ] K300 водородные связки до молекулы воды, которая также водородные связки до каталитического атома азота N5. При кукурузе этот комплекс модулирует окислительно -восстановительный потенциал и скорость повторного окисления кофактора и может участвовать в стабилизации сниженного кофактора или гидролиза имина. [ 6 ] Электроновое ароматическое кольцо в положении 403 может взаимодействовать с аминогрупп в субстрате. [ 7 ] Слабые взаимодействия с другими более переменными остатками активного участка участвуют в позиционировании субстратов. [ 8 ]
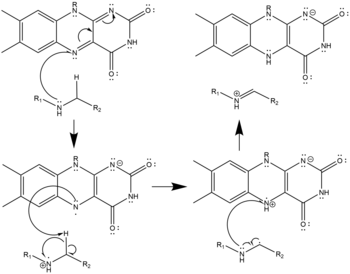
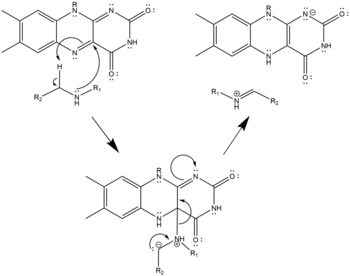
В активном участке причудливая окисление вторичного амина до имини , которое впоследствии вода гидролизует, давая амино-альдегид и первичный амин. Молекулярный кислород повторно окисляет причуд, генерируя перекись водорода.
- Три возможных механизмах окисления полиамин с причудением на основе структуры мышиной N1-ацетилсперминоксидазы; [ 9 ] Вторичное окисленное амин должно быть в нейтральном, депротонированном состоянии. Это окисление может проходить с помощью переноса гидрида (слева), радикальной абстракции (центра) или нуклеофильной атаки с ковалентно связанным промежуточным (справа). Все три одинаково правдоподобны, учитывая структуру, и ни один из них не был подтвержден как истинный механизм.
-
Механизм переноса гидрида приливания полиаминов
-
Радикальный механизм окисления полиаминов
-
Нуклеофильный механизм окисления полиаминов

Метаболизм
[ редактировать ]полиаминов PAO занимают центральное место в катаболизме . Различные продукты органической реакции приводят к различным метаболитам с разными судьбами. Поскольку все реакции PAO выделяют перекись водорода, PAO привязаны к метаболизму активных форм кислорода , что перекрывается с путями запрограммированной гибели клеток . [ 11 ]
Катаболизм полиамина часто активируется в опухолевых клетках млекопитающих. Молекулы ниже по течению от окисления полиаминов играют роли в пролиферации клеток. Спермидина является предшественником Supusine , который активирует изоформу 1а инициации эукариотического инициации 5A (EIF5A), которая позволяет трансляцию мРНК. Путезина оказывает влияние на комплекс MTOR 1 и эукариотический фактор инициации трансляции 4e (EIF4FE). Из -за этого множественные противоопухолевые препараты на различных стадиях клинических испытаний целевые PAO. [ 12 ]
У растений полиаминовый катаболизм тесно связан с реакциями на стресс и созреванием плодов. [ 13 ]
Ссылки
[ редактировать ]- ^ Подпрыгнуть до: а беременный Сальви, Даниэле; Тавладораки, Параскеви (2020-10-20). «Дерево жизни полиаминных оксидаз» . Научные отчеты . 10 (1): 17858. Bibcode : 202020natsr..1017858S . doi : 10.1038/s41598-020-74708-3 . ISSN 2045-2322 . PMC 7576179 . PMID 33082384 .
- ^ Бинда, Клаудия; Кода, Алессандро; Анджелини, Риккардо; Федерико, Родольфо; Ascenzi, Paolo; Mattevi, Andrea (1999-03-15). «U-образный каталитический туннель длиной 30 Å в кристаллической структуре полиаминоксидазы» . Структура 7 (3): 265–276. doi : 10.1016/s0969-2126 (99) 80037-9 . ISSN 0969-2126 . PMID 10368296 .
- ^ Хуан, Цинкиу; Лю, Кун; Хао, Куан (2005-05-13). «Кристаллические структуры FMS1 и его комплекс с спермином показывают специфичность субстрата» . Журнал молекулярной биологии . 348 (4): 951–959. doi : 10.1016/j.jmb.2005.03.008 . ISSN 0022-2836 . PMID 15843025 .
- ^ Шегрен, Тейв; Wassvik, Carola M.; Снайдер, Арджан; Агаард, Анна; Куманомиду, Тайчи; Барлинд, Луиза; Камински, Тим П.; Кашима, Акико; Йокота, Такехиро; Fjellström, Ola (2017-01-24). «Структура мышиной N1-ацетилсперминоксидазы выявляет молекулярные детали катаболизма полиаминового катаболизма позвоночных» . Биохимия . 56 (3): 458–467. doi : 10.1021/acs.biochem.6b01140 . ISSN 0006-2960 . PMID 28029774 .
- ^ Банк, данные белка RCSB. "3D View: 1H84" . Ковалентный аддукт между полиаминоксидазой и N1ethyln11 ((циклогептил) метил) 4,8diazaundecane при рН 4,6 .
- ^ Фиорильо, Аннарита; Федерико, Родольфо; Polticelli, Fabio; Боффи, Альберто; Маззеи, Франко; Fusco, Massimo di; Илари, Андреа; Тавладораки, Параскеви (2011). «Структура мутанта кукурузы полиаминоксидазы K300M в комплексе с природными субстратами обеспечивает снимок каталитического механизма окисления полиаминов» . Журнал FEBS . 278 (5): 809–821. doi : 10.1111/j.1742-4658.2010.08000.x . ISSN 1742-4658 . PMID 21205212 . S2CID 26000653 .
- ^ Binda, C.; Mattevi, A.; Эдмондсон, Де (2002-07-05). «Структурно-функциональные отношения у флавоэнзимзависимых окислений амина: сравнение полиаминоксидазы и моноаминоксидазы» . Журнал биологической химии . 277 (27): 23973–23976. doi : 10.1074/jbc.r200005200 . ISSN 0021-9258 . PMID 12015330 .
- ^ Бинда, Клаудия; Анджелини, Риккардо; Федерико, Родольфо; Ascenzi, Paolo; Mattevi, Andrea (2001-03-01). «Структурные основания для связывания ингибитора и катализа в полиаминоксидазе» . Биохимия . 40 (9): 2766–2776. doi : 10.1021/bi002751j . ISSN 0006-2960 . PMID 11258887 .
- ^ Шегрен, Тейв; Wassvik, Carola M.; Снайдер, Арджан; Агаард, Анна; Куманомиду, Тайчи; Барлинд, Луиза; Камински, Тим П.; Кашима, Акико; Йокота, Такехиро; Fjellström, Ola (2017-01-24). «Структура мышиной N1-ацетилсперминоксидазы выявляет молекулярные детали катаболизма полиаминового катаболизма позвоночных» . Биохимия . 56 (3): 458–467. doi : 10.1021/acs.biochem.6b01140 . ISSN 0006-2960 . PMID 28029774 .
- ^ Ромеро, Эльвира; Гомес Кастелланос, Дж. Рубен; Гадда, Джованни; Fraaije, Marco W.; Mattevi, Andrea (2018-02-28). «Тот же субстрат, многоереации: активация кислорода в флавоэнзимах» . Химические обзоры . 118 (4): 1742–1769. Doi : 10.1021/acs.chemrev.7b00650 . ISSN 0009-2665 . PMID 29323892 .
- ^ Moschou, Panagiotis n.; Рубелакис-Анжелакис, Каллиопи А. (2014-03-01). «Полиамины и запрограммированная гибель клеток» . Журнал экспериментальной ботаники . 65 (5): 1285–1296. doi : 10.1093/jxb/ert373 . ISSN 0022-0957 . PMID 24218329 .
- ^ Казеро, Роберт А.; Мюррей Стюарт, Трейси; Пегг, Энтони Э. (ноябрь 2018 г.). «Полиаминовый метаболизм и рак: лечение, проблемы и возможности» . Природные обзоры. Рак . 18 (11): 681–695. doi : 10.1038/s41568-018-0050-3 . ISSN 1474-1768 . PMC 6487480 . PMID 30181570 .
- ^ Ван, Вэй; Paschalidis, Konstantinos; Фенг, Цзянь-Кан; Песня, Цзе; Лю, Джи-Хонг (2019). «Катаболизм полиаминов у растений: универсальный процесс с разнообразными функциями» . Границы в науке о растениях . 10 : 561. DOI : 10.3389/fpls.2019.00561 . ISSN 1664-462x . PMC 6513885 . PMID 31134113 .