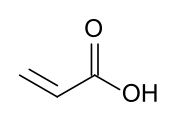
Акриловая кислота
| |
| |
| Имена | |
|---|---|
| Название ИЮПАК
Акриловая кислота [ 2 ]
| |
| Предпочтительное название ИЮПАК
Проп-2-еновая кислота [ 2 ] | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 635743 | |
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.001.071 |
| Номер ЕС |
|
| 1817 | |
| КЕГГ | |
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| C3H4OC3H4O2 | |
| Молярная масса | 72.063 g/mol |
| Появление | Прозрачная бесцветная жидкость |
| Запах | Едкий [ 3 ] |
| Плотность | 1,051 г/мл |
| Температура плавления | 14 ° C (57 ° F; 287 К) |
| Точка кипения | 141 ° С (286 ° F; 414 К) |
| смешивается | |
| войти P | 0.28 [ 4 ] |
| Давление пара | 3 мм рт. ст. [ 3 ] |
| Кислотность ( pKa ) | 4,25 (Н 2 О) [ 5 ] |
| Вязкость | 1,3 сП при 20 °C (68 °F) |
| Опасности | |
| СГС Маркировка : | |
    
| |
| Опасность | |
| Х226 , Х302 , Х312 , Х314 , Х332 , Х400 | |
| P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P273 , P280 , P301+P312 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+ , P312, P304+P340 P305 +P351+P338 , P310 , P312 , P321 , P322 , P330 , P363 , P370+P378 , P391 , P403+P235 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 49.4 [ 6 ] ° С (120,9 ° F; 322,5 К) |
| 429 ° С (804 ° F; 702 К) | |
| Взрывоопасные пределы | 2.4–8.02% [ 3 ] |
| NIOSH (пределы воздействия на здоровье в США): | |
ПЭЛ (допустимо)
|
Никто [ 3 ] |
РЕЛ (рекомендуется)
|
СВВ 2 ppm (6 мг/м 3 ) [кожа] [ 3 ] |
IDLH (Непосредственная опасность)
|
без даты [ 3 ] |
| Паспорт безопасности (SDS) | Паспорт безопасности |
| Родственные соединения | |
Другие анионы
|
акрилат |
Родственные карбоновые кислоты
|
уксусная кислота пропионовая кислота молочная кислота 3-гидроксипропионовая кислота малоновая кислота масляная кислота кротоновая кислота |
Родственные соединения
|
аллиловый спирт пропиональдегид акролеин метилакрилат |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Акриловая кислота ( ИЮПАК : проп-2-еновая кислота ) представляет собой органическое соединение с формулой CH 2 =CHCOOH. Это простейшая ненасыщенная карбоновая кислота , состоящая из винильной группы, соединенной непосредственно с концом карбоновой кислоты . Эта бесцветная жидкость имеет характерный едкий или терпкий запах. Смешивается с водой , спиртами , эфирами и хлороформом . Ежегодно производится более миллиона тонн. [ 7 ]
История
[ редактировать ]Слово «акрил» было придумано в 1843 году для химического производного акролеина , масла с едким запахом, полученного из глицерина .
Производство
[ редактировать ]Акриловую кислоту получают путем окисления пропилена : , который является побочным продуктом производства этилена и бензина
- 2 СН 2 =СНСН 3 + 3 О 2 → 2 СН 2 =СНСО 2 Н + 2 Н 2 О
Исторические методы
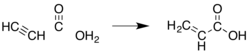
[ редактировать ]Поскольку акриловая кислота и ее эфиры уже давно коммерчески ценятся, было разработано множество других методов. Большинство из них были заброшены по экономическим или экологическим причинам. Ранним методом было гидрокарбоксилирование ацетилена (« химия Реппе »):
Этот метод требует карбонила никеля , высокого давления монооксида углерода и ацетилена, который относительно дорог по сравнению с пропиленом.
Акриловую кислоту когда-то производили путем гидролиза акрилонитрила путем аммоксидирования, но от этого способа отказались, поскольку при нем образуются побочные продукты аммония, от , материала, полученного из пропена которых необходимо избавляться. Другие ныне заброшенные предшественники акриловой кислоты включают этенон и этиленциангидрин. [ 7 ]
Исследовать
[ редактировать ]Карбоксилирование этилена в акриловую кислоту в сверхкритическом диоксиде углерода термодинамически возможно, но эффективные катализаторы не разработаны. [ 8 ] 3-Гидроксипропионовая кислота (3HP), предшественник акриловой кислоты путем дегидратации, может быть получена из сахаров, но этот процесс не является конкурентоспособным. [ 9 ] [ 10 ]
Реакции и использование
[ редактировать ]Акриловая кислота вступает в типичные реакции с карбоновой кислотой . При реакции со спиртом образует соответствующий эфир . Эфиры и соли акриловой кислоты известны под общим названием акрилаты (или пропеноаты). Наиболее распространенными алкиловыми эфирами акриловой кислоты являются метиловый , бутиловый, этиловый и 2-этилгексилакрилат.
Акриловая кислота и ее эфиры легко соединяются сами с собой (с образованием полиакриловой кислоты ) или другими мономерами (например , акриламидами , акрилонитрилом , виниловыми соединениями, стиролом и бутадиеном ) путем реакции по двойной связи, образуя гомополимеры или сополимеры , которые используются в производстве. различных пластмасс , покрытий , клеев , эластомеров , а также полиролей и красок для полов.
Акриловая кислота используется во многих отраслях промышленности, включая производство подгузников , водоочистку и текстильную промышленность. По прогнозам, к 2020 году ежегодное мировое потребление акриловой кислоты достигнет более 8000 килотонн. Ожидается, что это увеличение связано с ее использованием в новых областях применения, включая средства личной гигиены , моющие средства и продукты для лечения недержания у взрослых . [ 11 ]
Заместители
[ редактировать ]В качестве заместителя акриловой кислоты может использоваться ацильная группа или карбоксиалкильная группа, в зависимости от удаления группы из молекулы.
Более конкретно, это:
- Акрилоильная группа с удалением -OH от углерода-1.
- с 2-карбоксиэтенильная группа удалением -H от углерода-3. Эта группа заместителей содержится в хлорофилле .
Безопасность
[ редактировать ]Акриловая кислота сильно раздражает и разъедает кожу и дыхательные пути. Контакт с глазами может привести к серьезной и необратимой травме. Низкое воздействие окажет минимальное воздействие на здоровье или не приведет к его отсутствию, тогда как высокое воздействие может привести к отеку легких . LD составляет 293 мг/кг (перорально, крыса) , 50 составляет 340 мг/кг (крыса, перорально), при этом самая низкая зарегистрированная LD 50 что сопоставимо с этиленгликолем, что указывает на то, что он является сильным ядом. [ 12 ] Этилакрилат когда-то использовался в качестве синтетического пищевого ароматизатора и был отозван FDA, возможно, из-за канцерогенного эффекта, наблюдаемого у лабораторных животных. [ 13 ]
Исследования на животных показали, что высокие дозы акриловой кислоты снижают прибавку в весе. Акриловую кислоту можно превратить в нетоксичную молочную кислоту . [ 14 ]
Акриловая кислота входит в состав табачного дыма . [ 15 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Индекс Merck , 11-е издание, 124 .
- ^ Jump up to: а б Международный союз теоретической и прикладной химии (2014). Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 . Королевское химическое общество . п. 746. дои : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Jump up to: а б с д и ж Карманный справочник NIOSH по химическим опасностям. «#0013» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Акриловая кислота_msds» .
- ^ Диппи, JFJ; Хьюз, SRC; Розански, А. (1959). «Константы диссоциации некоторых симметрично дизамещенных янтарных кислот». Журнал Химического общества : 2492–2498. дои : 10.1039/JR9590002492 .
- ^ «АКРИЛОВАЯ КИСЛОТА СТАБИЛИЗИРОВАННАЯ» . Управление реагирования и восстановления . Проверено 19 августа 2024 г.
- ^ Jump up to: а б Охара, Такаши; Сато, Такахиса; Симидзу, Нобору; Прешер, Гюнтер; Швинд, Хельмут; Вайберг, Отто; Мартен, Клаус; Грейм, Хельмут (2003). «Акриловая кислота и ее производные». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a01_161.pub2 . ISBN 3527306730 .
- ^ Сакакура, Тошиясу; Чой, Джун-Чул; Ясуда, Хироюки (13 июня 2007 г.). «Превращение углекислого газа». Химические обзоры . 107 (6): 2365–2387. дои : 10.1021/cr068357u . ПМИД 17564481 .
- ^ Сладкая сделка: компания Dow и партнеры разработали план перехода от сахара к акрилу . Durabilityanddesign.com. Проверено 24 мая 2012 г.
- ^ Better Bugs to Make Plastics, Technology Review, 20 сентября 2010 г., получено 9 января 2012 г. . Technologyreview.com (20 сентября 2010 г.). Проверено 24 мая 2012 г.
- ^ «Рынок акриловой кислоты» . Проверено 30 мая 2018 г.
- ^ «Акриловая кислота Webwiser» .
- ^ «Обновление закона о синтетических пищевых ароматизаторах» .
- ^ «Предварительные проверенные экспертом значения токсичности акриловой кислоты» (PDF) . www.google.com . Проверено 29 апреля 2022 г.
- ^ Тальхаут, Рейнске; Шульц, Томас; Флорек, Ева; Ван Бентем, Джон; Вестер, Пит; Опперхейзен, Антон (2011). «Опасные соединения в табачном дыме» . Международный журнал экологических исследований и общественного здравоохранения . 8 (12): 613–628. дои : 10.3390/ijerph8020613 . ISSN 1660-4601 . ПМК 3084482 . ПМИД 21556207 .