Терапевтическая генная модуляция
Терапевтическая модуляция гена относится к практике изменения экспрессии гена на одной из различных стадий с целью облегчения той или иной формы заболевания. Она отличается от генной терапии тем, что генная модуляция направлена на изменение экспрессии эндогенного гена (возможно, путем введения гена, кодирующего новый модулирующий белок), тогда как генная терапия касается введения гена, продукт которого напрямую помогает реципиенту.
Модуляция экспрессии генов может быть опосредована на уровне транскрипции ДНК-связывающими агентами (которые могут быть искусственными факторами транскрипции ), небольшими молекулами или синтетическими олигонуклеотидами . Это также может быть опосредовано посттранскрипционно посредством РНК-интерференции .
Модуляция транскрипционных генов
[ редактировать ]В подходе к терапевтической модуляции используются агенты, которые модулируют эндогенную транскрипцию путем специфического воздействия на эти гены на уровне гДНК . Преимущество этого подхода перед модуляцией на уровне мРНК или белка состоит в том, что каждая клетка содержит только одну копию гДНК. Таким образом, целевое число копий значительно ниже, что теоретически позволяет вводить лекарства в гораздо меньших дозах. [ нужна ссылка ]
Этот подход также предлагает несколько преимуществ по сравнению с традиционной генной терапией . Непосредственное воздействие на эндогенную транскрипцию должно привести к правильной относительной экспрессии вариантов сплайсинга . Напротив, традиционная генная терапия обычно вводит ген, который может экспрессировать только один транскрипт, а не набор стехиометрически экспрессируемых вариантов сплайсированных транскриптов. Кроме того, введенные вирусом гены могут быть направлены на подавление генов путем метилирования, что может противодействовать эффекту традиционной генной терапии. [1] Ожидается, что это не станет проблемой для модуляции транскрипции, поскольку оно действует на эндогенную ДНК.
Существует три основные категории агентов, которые действуют как модуляторы транскрипционных генов: триплекс-образующие олигонуклеотиды (TFO), синтетические полиамиды (SPA) и ДНК-связывающие белки . [2]
Триплекс-образующие олигонуклеотиды
[ редактировать ]Кто они такие
[ редактировать ]Триплекс-образующие олигонуклеотиды (TFO) являются одним из потенциальных методов достижения терапевтической модуляции генов. TFO имеют длину примерно 10-40 пар оснований и могут связываться в большой бороздке дуплексной ДНК, образуя третью цепь или тройную спираль. [2] [3] Связывание происходит в полипуриновых или полипиримидиновых областях посредством водородных связей Хугстина с пуриновыми (A/G) основаниями двухцепочечной ДНК, которая уже находится в форме спирали Уотсона-Крика . [4]
Как они работают
[ редактировать ]TFO могут представлять собой молекулы полипурина или полипиримидина и связываться с одной из двух цепей двойной спирали либо в параллельной, либо в антипараллельной ориентации, нацеливаясь на полипуриновые или полипиримидиновые области. Поскольку коды распознавания ДНК различны для параллельного и антипараллельного способа связывания TFO, TFO, состоящие из пиримидинов (C/T), связываются с богатой пуринами цепью целевой двойной спирали посредством водородных связей Хугстина параллельным образом. . [3] TFO, состоящие из пуринов (A/G) или смешанных пуринов и пиримидинов, связываются с одной и той же цепью, богатой пуринами, посредством обратных связей Хугстина антипараллельным образом. TFO могут распознавать богатые пуринами целевые цепи дуплексной ДНК. [2]

Осложнения и ограничения
[ редактировать ]Чтобы мотивы TFO могли связываться параллельным образом и создавать водородные связи , атом азота в положении 3 остатка цитозина должен быть протонирован , но при физиологических уровнях pH это не так, что может препятствовать параллельному связыванию. [2]
Другим ограничением является то, что TFO могут связываться только с богатыми пуринами целевыми цепями, и это ограничивает выбор эндогенных генов-мишеней для полипурин-полипиримидиновых участков в дуплексной ДНК. Если бы был создан метод, позволяющий TFO связываться с пиримидиновыми основаниями, это позволило бы TFO воздействовать на любую часть генома . Кроме того, геном человека богат полипуриновыми и полипиримидиновыми последовательностями, которые могут влиять на специфичность связывания TFO с целевой областью ДНК. Подход к преодолению этого ограничения заключается в разработке TFO с модифицированными нуклеотидами, которые действуют как заблокированные нуклеиновые кислоты , увеличивая сродство TFO к конкретным целевым последовательностям. [5]
Другие ограничения включают проблемы, связанные с аффинностью и специфичностью связывания, стабильностью in vivo и проникновением в клетки. Исследователи пытаются преодолеть эти ограничения, улучшая характеристики TFO посредством химических модификаций , таких как модификация основной цепи TFO для уменьшения электростатического отталкивания между TFO и дуплексом ДНК. Также из-за их высокой молекулярной массы поглощение клетками ограничено, и некоторые стратегии преодоления этого включают агенты, конденсирующие ДНК , связывание ТФО с гидрофобными остатками, такими как холестерин , или агенты, повышающие проницаемость клеток. [2]
Что они могут сделать?
[ редактировать ]Ученые все еще совершенствуют технологию, позволяющую превратить ТФО в терапевтический продукт , и большая часть этой работы связана с их потенциальным применением в антигенной терапии. В частности, их использовали в качестве индукторов сайт-специфических мутаций , реагентов, избирательно и специфически расщепляющих ДНК-мишень, а также в качестве модуляторов экспрессии генов . [6] Одним из таких методов модификации последовательности генов является нацеливание на ДНК с помощью TFO для активации целевого гена . Если целевая последовательность расположена между двумя неактивными копиями гена, лиганды ДНК, такие как TFO, могут связываться с целевым сайтом и распознаваться как повреждения ДНК. Чтобы исправить эти повреждения, на целевой последовательности собираются комплексы репарации ДНК , ДНК восстанавливается. Повреждение субстрата внутримолекулярной рекомбинации затем можно восстановить и обнаружить, если резекция зайдет достаточно далеко, чтобы образовались совместимые концы по обе стороны от места расщепления, а затем лигируются 3'-выступы, что приводит к образованию единственной активной копии гена и потере всех последовательностей между двумя копиями гена. [4]
В модельных системах ТФО могут ингибировать экспрессию генов на уровне ДНК, а также вызывать целевой мутагенез в модели. [6] Ингибирование элонгации транскрипции эндогенных мишеней, индуцированное TFO, было успешно протестировано на клеточных культурах. [7] Однако, несмотря на большой успех in vitro , достижения в области сотовых приложений были ограниченными, возможно, из-за целевой доступности.
TFO обладают потенциалом подавлять молчание гена, воздействуя на инициацию или элонгацию транскрипции, арестовывая сайты связывания триплекса или внося постоянные изменения в целевую последовательность посредством стимуляции собственных путей восстановления клетки. Эти приложения могут быть актуальны при создании методов лечения рака , которые подавляют экспрессию генов на уровне ДНК. Поскольку аберрантная экспрессия генов является отличительной чертой рака, модуляция уровня экспрессии этих эндогенных генов потенциально может служить терапией для нескольких типов рака .
Синтетические полиамиды
[ редактировать ]Синтетические полиамиды представляют собой набор небольших молекул, которые образуют специфические водородные связи с малой бороздкой ДНК. Они могут оказывать эффект либо напрямую, связывая регуляторную область или транскрибируемую область гена для модификации транскрипции, либо косвенно, путем сконструированной конъюгации с другим агентом, который вносит изменения вокруг участка-мишени ДНК.
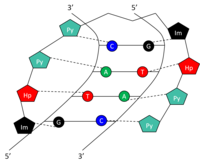
Структура
[ редактировать ]Специфические основания в малой бороздке ДНК могут распознаваться и связываться небольшими синтетическими полиамидами (SPA). ДНК-связывающие SPA были разработаны так, чтобы содержать три полиамидных аминокислотных компонента: гидроксипиррол (Hp), имидазол (Im) и пиррол (Py). [10] Цепи этих аминокислот закручиваются в шпильку. Аминокислоты по обе стороны от шпильки образуют пару, которая специфически распознает обе стороны пары оснований Уотсона-Крика . Это происходит за счет образования водородных связей внутри малой бороздки ДНК. Амидные пары Py/Im, Py/Hp, Hp/Py и Im/Py узнают пары оснований Уотсона-Крика CG, AT, TA и GC соответственно (табл. 1). На рисунке показано графическое представление распознавания 5'-GTAC-3' SPA. СПА обладают низкой токсичностью, но еще не использовались для модуляции генов человека.
| Амидная пара | Нуклеотидная пара |
|---|---|
| Пи/Я | компьютерная графика |
| Ру/Хп | В |
| HP/Py | ТА |
| Я/Пи | ГК |
Ограничения и обходные пути
[ редактировать ]Основным структурным недостатком немодифицированных SPA как модуляторов генов является то, что их последовательность распознавания не может быть расширена за пределы 5 пар оснований Уотсона-Крика. Естественная кривизна малой бороздки ДНК слишком крутая, чтобы соответствовать структуре шпильки. Есть несколько групп, предлагающих обходные пути этой проблемы. [8] [11] [12] [13] [14] SPA можно сделать так, чтобы они лучше повторяли кривизну малой бороздки, введя бета-аланин , который расслабляет структуру. [10] Другой подход к увеличению длины распознавания — последовательное использование нескольких коротких шпилек. [15] [16] Этот подход увеличил длину распознавания до одиннадцати пар оснований Уотсона-Крика.


Прямая модуляция
[ редактировать ]SPA могут ингибировать транскрипцию посредством связывания с транскрибируемой областью гена-мишени. Это ингибирование происходит за счет блокирования удлинения РНК-полимеразой.
SPA могут также модулировать транскрипцию, нацеливаясь на сайт связывания регулятора транскрипции. Если регулятор является активатором транскрипции, это приведет к снижению уровня транскрипции. Например, было продемонстрировано, что нацеливание SPA на сайт связывания активирующего транскрипционного фактора TFIIIA ингибирует транскрипцию нижестоящей 5S РНК. [17] Напротив, если регулятор является репрессором, это повысит уровень транскрипции. Например, SPA нацеливается на фактор хозяина LSF, который подавляет экспрессию длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ) 1-го типа, блокирует связывание LSF и, следовательно, де-репрессирует экспрессию LTR. [18] .

Сопряженная модуляция
[ редактировать ]Не было доказано, что SPA напрямую модифицируют ДНК или обладают иной активностью, кроме прямого блокирования других факторов или процессов. Однако модифицирующие агенты могут быть связаны с хвостовыми концами шпильки. Специфическое связывание SPA с ДНК обеспечивает сайт-специфическое нацеливание конъюгированного модифицирующего агента.
SPA были соединены с ДНК-алкилирующими фрагментами циклопропилпирроиндола. [19] и хлорамбуцил [20] которые смогли повредить и сшить ДНК SV40. Этот эффект ингибировал клеточный цикл и рост. Хлорамбуцил, химиотерапевтический агент, был более эффективен в сочетании с SPA, чем без него.
В 2012 году SPA были конъюгированы с SAHA, мощным ингибитором гистондеацетилазы (HDAC). [21] SPA с конъюгированными SAHA были нацелены на Oct-3/4 и Nanog, которые индуцировали эпигенетическое ремоделирование и, следовательно, увеличивали экспрессию множественных генов, связанных с плюрипотентностью, в эмбриональных фибробластах мыши.
Дизайнерские белки с цинковыми пальцами
[ редактировать ]Что это такое/структура
[ редактировать ]Дизайнерские белки «цинковых пальцев» — это сконструированные белки, используемые для воздействия на определенные области ДНК . Эти белки используют связываться с ДНК способность природных доменов цинковых пальцев для модуляции определенных целевых областей генома . [22] Как в дизайнерских, так и в натуральных мотивах цинковых пальцев белок состоит из двух β-листов и одной α-спирали . Два остатка гистидина на α-спирали и два остатка цистеина на β-листах связаны с атомом цинка , что служит для стабилизации белкового домена в целом. Эта стабилизация особенно полезна для α-спирали в ее функции как домена распознавания и связывания ДНК. Фактор транскрипции TFIIIA является примером встречающегося в природе белка с мотивом цинковых пальцев. [23]

Как они работают
[ редактировать ]Мотивы «цинковых пальцев» связываются с большой бороздкой спиральной ДНК. [23] где аминокислотных остатков последовательность на α-спирали придает мотиву специфичность к целевой последовательности. Домен связывается с семи нуклеотидов последовательностью ДНК из (положения с 1 по 6 на первичной цепи ДНК, а также положения 0 и 3 на комплементарной цепи ), тем самым обеспечивая высокую селективность белкового мотива в отношении своей мишени. [22] При разработке дизайнерского белка «цинковых пальцев» исследователи могут использовать такие методы, как сайт-направленный мутагенез с последующими рандомизированными исследованиями связывающей способности. [22] [24] или рекомбинация in vitro мотивов с известной целевой специфичностью для получения библиотеки конечных белков, специфичных для последовательности. [25]


Эффекты и влияние на модуляцию генов
[ редактировать ]Созданные белки «цинковых пальцев» могут модулировать экспрессию генома несколькими способами. В конечном счете, за результат экспрессии в первую очередь отвечают два фактора: является ли целевая последовательность регуляторной областью или кодирующей областью ДНК, и какие типы эффекторных доменов связаны с доменом цинкового пальца и если да, то какие. Если целевой последовательностью сконструированного дизайнерского белка является регуляторный домен, например, промотор или репрессор репликации , сайт связывания природных факторов транскрипции будет скрыт, что приведет к соответствующему снижению или увеличению транскрипции , соответственно, для ассоциированный ген . [26] Аналогичным образом, если целевой последовательностью является экзон , дизайнерский цинковый палец скроет последовательность от транскрипционных комплексов РНК-полимеразы , что приведет к усеченному или иным образом нефункциональному генному продукту. [22]
Эффекторные домены, связанные с цинковым пальцем, также могут иметь сопоставимые эффекты. Именно функция этих эффекторных доменов, возможно, является наиболее важной с точки зрения использования дизайнерских белков «цинковых пальцев» для терапевтической модуляции генов. Если домен метилазы увеличению состояния метилирования ДНК связан с дизайнерским белком цинкового пальца, то когда белок цинкового пальца связывается с целевой последовательностью ДНК , это впоследствии приведет к в этой области. Скорость транскрипции затронутых таким образом генов будет снижена. [27] Многие из эффекторных доменов модулируют либо ДНК напрямую, например, посредством метилирования, расщепления, [28] или рекомбинация целевой последовательности ДНК [29] - или путем модуляции скорости транскрипции - например, ингибирования транскрипции с помощью репрессорных доменов, которые блокируют транскрипционный аппарат, [30] стимулирование транскрипции с помощью доменов активации, которые рекрутируют транскрипционные механизмы на этот сайт, [31] или гистоновые или другие эпигенетической домены модификации, которые влияют на состояние хроматина и способность транскрипционного аппарата получать доступ к затронутым генам. [32] Эпигенетическая модификация является основной темой при определении различных уровней экспрессии генов, что объясняется идеей о том, что насколько туго закручена нить ДНК – от гистонов на локальном уровне до хроматина на хромосомном уровне – может влиять на доступность последовательностей ДНК. ДНК к транскрипционному аппарату, тем самым влияя на скорость, с которой она может транскрибироваться. [23] Если вместо непосредственного воздействия на цепь ДНК, как описано выше, дизайнерский белок «цинковые пальцы» вместо этого влияет на состояние эпигенетической модификации целевой области ДНК, модуляция экспрессии генов может быть достигнута аналогичным образом.
В первом случае, чтобы успешно продемонстрировать использование дизайнерских белков с цинковыми пальцами для модуляции экспрессии генов in vivo , Choo et al. [26] разработали белок, состоящий из трех доменов с цинковыми пальцами, которые нацелены на определенную последовательность BCR-ABL слитого онкогена . Этот специфический онкоген участвует в развитии острого лимфобластного лейкоза . Онкоген обычно позволяет клеткам лейкемии размножаться в отсутствие специфических факторов роста, что является отличительным признаком рака . Включив сигнал ядерной локализации в трехдоменный белок «цинковые пальцы», чтобы облегчить связывание белка с геномной ДНК в ядре, Choo et al. смогли продемонстрировать, что их сконструированный белок может блокировать транскрипцию онкогена in vivo. Клетки лейкемии стали зависеть от обычных факторов роста, возвращая клеточный цикл под контроль нормальной регуляции . [26]
Посттранскрипционная модуляция генов
[ редактировать ]Основным подходом к посттранскрипционной модуляции генов является использование РНК-интерференции (РНКи). Основная проблема использования РНКи для модуляции генов — доставка лекарств к клеткам-мишеням. [33] [34] Модуляция гена RNAi была успешно применена к мышам для лечения мышиной модели воспалительного заболевания кишечника. [35] В этом лечении использовались стабилизированные наночастицы на основе липосом, нацеленные на интегрин бета-7, захватывающие короткие интерферирующие РНК (миРНК). Существует несколько других форм доставки РНКи, в том числе: полиплексная доставка, конъюгаты лиганд-миРНК, голая доставка, доставка неорганическими частицами с использованием наночастиц золота и сайт-специфическая локальная доставка. [36]
Клиническое значение
[ редактировать ]С другой стороны, дизайнерские белки с цинковыми пальцами прошли некоторые клинические испытания . Эффективность и безопасность EW-A-401, сконструированного фактора транскрипции с цинковыми пальцами, в качестве фармакологического средства для лечения хромоты , сердечно-сосудистого заболевания, исследовали в клинических испытаниях. [37] Белок состоит из сконструированной плазмидной ДНК , которая побуждает пациента вырабатывать сконструированный фактор транскрипции, мишенью которого является ген фактора роста эндотелия сосудов-А (VEGF-A) , который положительно влияет на развитие кровеносных сосудов . Хотя он еще не одобрен Управлением по контролю за продуктами и лекарствами США (FDA), два клинических исследования фазы I были завершены , которые идентифицировали этот белок цинковых пальцев как многообещающее и безопасное потенциальное терапевтическое средство для лечения заболеваний периферических артерий у людей. [38]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Молодой ВБ, Линк СиДжей (2000). «Химерный ретровирусный хелперный вирус и последовательность IRES пикорнавируса для устранения метилирования ДНК для улучшения упаковки ретровирусных клеток» . Журнал вирусологии . 74 (11): 5242–5249. doi : 10.1128/JVI.74.11.5242-5249.2000 . ПМЦ 110878 . ПМИД 10799600 .
- ^ Jump up to: а б с д и Уил Т.Г., Хайсма Х.Дж., Ротс М.Г. (2003). «Терапевтическая модуляция функции эндогенных генов с помощью агентов с разработанной специфичностью последовательности ДНК» . Исследования нуклеиновых кислот . 31 (21): 6064–6078. дои : 10.1093/nar/gkg815 . ПМК 275457 . ПМИД 14576293 .
- ^ Jump up to: а б Сарджент, Р.Г.; Ким, С.; Грюнерт, округ Колумбия. (2011). «Модификация генов на основе олиго/полинуклеотидов: стратегии и терапевтический потенциал» . Олигонуклеотиды . 21 (2): 55–75. дои : 10.1089/oli.2010.0273 . ПМК 3078494 . ПМИД 21417933 .
- ^ Jump up to: а б Саймон, П.; Канната, Ф.; Конкорде, Япония; Джованнанджели, К. (август 2008 г.). «Нацеливание на ДНК триплекс-образующих олигонуклеотидов для модификации последовательности генов». Биохимия . 90 (8): 1109–16. дои : 10.1016/j.biochi.2008.04.004 . ПМИД 18460344 .
- ^ Чжоу, Ю.; Киржек, Э.; Лоо, ЗП.; Антонио, М.; Яу, Ю.Х.; Чуа, Ю.В.; Гейфман-Шочат, С.; Киржек Р.; Чен, Г. (июль 2013 г.). «Распознавание дуплексов РНК химически модифицированными триплекс-образующими олигонуклеотидами» . Нуклеиновые кислоты Рез . 41 (13): 6664–73. дои : 10.1093/нар/gkt352 . ПМЦ 3711454 . ПМИД 23658228 .
- ^ Jump up to: а б Гунтака, РВ.; Варма, БР.; Вебер, КТ. (январь 2003 г.). «Триплекс-образующие олигонуклеотиды как модуляторы экспрессии генов». Int J Biochem Cell Biol . 35 (1): 22–31. дои : 10.1016/s1357-2725(02)00165-6 . ПМИД 12467644 .
- ^ Фариа, М.; Вуд, CD .; Перруо, Л.; Нельсон, Дж.С.; Зима, А.; Уайт, г-н; Хелен, К.; Джованнанджели, К. (апрель 2000 г.). «Направленное ингибирование элонгации транскрипции в клетках, опосредованное триплекс-образующими олигонуклеотидами» . Proc Natl Acad Sci США . 97 (8): 3862–7. Бибкод : 2000PNAS...97.3862F . дои : 10.1073/pnas.97.8.3862 . ЧВК 18107 . ПМИД 10760257 .
- ^ Jump up to: а б Редди Б.С., Шарма С.К., Лоун Дж.В. (2001). «Последние разработки в области селективных последовательности эффекторов ДНК с малыми бороздками». Курс. Мед. Хим . 8 (5): 475–508. дои : 10.2174/0929867003373292 . ПМИД 11281837 .
- ^ Дерван П.Б. (2001). «Молекулярное распознавание ДНК малыми молекулами». Биоорг. Мед. Хим . 9 (9): 2215–2235. дои : 10.1016/s0968-0896(01)00262-0 . ПМИД 11553460 .
- ^ Jump up to: а б Уайт С., Шевчик Дж.В., Тернер Дж.М., Бэрд Э.Э., Дерван П.Б. (1998). «Распознавание четырех пар оснований Уотсона-Крика в малой бороздке ДНК синтетическими лигандами» (PDF) . Природа . 391 (6666): 468–471. Бибкод : 1998Natur.391..468W . дои : 10.1038/35106 . ПМИД 9461213 . S2CID 205023593 .
- ^ Дерван П.Б., Эдельсон Б.С. (2003). «Распознавание малой бороздки ДНК пирролимидазолполиамидами». Курс. Мнение. Структура. Биол . 13 (3): 284–299. дои : 10.1016/s0959-440x(03)00081-2 . ПМИД 12831879 .
- ^ Лоун Дж.В. (1988). «Лекситропсины: рациональный дизайн агентов для чтения последовательностей ДНК в качестве новых противораковых агентов и потенциальных клеточных зондов». Противораковый препарат . 3 (1): 25–40. ПМИД 2838035 .
- ^ Траугер Дж.В., Бэрд Э.Э., Дерван П.Б. (1996). «Распознавание ДНК разработанными лигандами в субнаномолярных концентрациях». Природа . 382 (6591): 559–561. Бибкод : 1996Natur.382..559T . дои : 10.1038/382559a0 . ПМИД 8700233 . S2CID 4335955 .
- ^ Веммер Д.Э. (2000). «Разработанные лиганды малой бороздки, специфичные для последовательности». Анну. Преподобный Биофиз. Биомол. Структурировать . 29 : 439–461. doi : 10.1146/annurev.biophys.29.1.439 . ПМИД 10940255 .
- ^ Керс I, Дерван П.Б. (2002). «Поиск оптимального линкера в тандемных шпильках полиамидов». Биоорг. Мед. Хим . 10 (10): 3339–3349. дои : 10.1016/s0968-0896(02)00221-3 . ПМИД 12150881 .
- ^ Вейерманн П., Дерван П.Б. (2002). «Распознавание десяти пар оснований ДНК димерами шпильки «голова к голове»» (PDF) . Дж. Ам. хим. Соц . 124 (24): 6872–6878. дои : 10.1021/ja020258k . ПМИД 12059208 .
- ^ Готтесфельд Дж. М., Нили Л., Траугер Дж. В., Бэрд Э. Э., Дерван П. Б. (1997). «Регуляция экспрессии генов с помощью малых молекул». Природа . 387 (6629): 202–205. Бибкод : 1997Natur.387..202G . дои : 10.1038/387202a0 . ПМИД 9144294 . S2CID 4358491 .
- ^ Кулл Дж.Дж., Хе Дж., Меландер С., Ракер В.К., Дерван П.Б., Марголис Д.М. (2002). «Направленная дерепрессия длинного концевого повтора вируса иммунодефицита человека типа 1 с помощью полиамидов пиррол-имидазола» . Дж. Вирол . 76 (23): 12349–12354. дои : 10.1128/jvi.76.23.12349-12354.2002 . ПМК 136904 . ПМИД 12414976 .
- ^ Ван Ю.Д., Дзигелевски Дж., Вурц Н.Р., Дзигелевска Б., Дерван П.Б., Бирман Т.А. (2003). «Сшивание ДНК и биологическая активность шпильочного конъюгата полиамида-хлорамбуцила» . Исследования нуклеиновых кислот . 31 (21): 1208–1215. дои : 10.1093/нар/gkg215 . ПМЦ 150233 . ПМИД 12582240 .
- ^ Ван Ю.Д., Дзигелевски Дж., Чанг А.Ю., Дерван П.Б., Бирман Т.А. (2002). «Бесклеточная и клеточная активность конъюгата полиамида-CBI, селективного по последовательностям ДНК» . Ж. Биол. Хим . 277 (45): 42431–42437. дои : 10.1074/jbc.M207179200 . ПМИД 12196541 .
- ^ Пандиан Н.Г., Накано Ю., Сато С., Моринага Х., Бандо Т., Нагасе Х., Сугияма Х. (2012). «Синтетическая небольшая молекула для быстрой индукции множественных генов плюрипотентности в эмбриональных фибробластах мыши» . Научные отчеты . 2 (544): 544. Бибкод : 2012НацСР...2Э.544П . дои : 10.1038/srep00544 . ПМК 3408130 . ПМИД 22848790 .
- ^ Jump up to: а б с д Папворт, М.; Коласинска, П.; Минчук, М. (январь 2006 г.). «Дизайнерские белки с цинковыми пальцами и их применение». Джин . 366 (1): 27–38. дои : 10.1016/j.gene.2005.09.011 . ПМИД 16298089 .
- ^ Jump up to: а б с Уотсон, Джеймс Д. (2008). Молекулярная биология гена . Сан-Франциско: Пирсон/Бенджамин Каммингс. п. 595. ИСБН 978-0-8053-9592-1 .
- ^ Дежарле-младший; Берг, Дж.М. (март 1993 г.). «Использование консенсусной структуры последовательностей цинковых пальцев и правил специфичности для разработки специфических ДНК-связывающих белков» . Proc Natl Acad Sci США . 90 (6): 2256–60. Бибкод : 1993PNAS...90.2256D . дои : 10.1073/pnas.90.6.2256 . ПМК 46065 . ПМИД 8460130 .
- ^ Исалан, М.; Клюг, А.; Чу, Ю. (июль 2001 г.). «Быстрый, общеприменимый метод создания цинковых пальцев, проиллюстрированный воздействием на промотор ВИЧ-1» . Нат Биотехнология . 19 (7): 656–60. дои : 10.1038/90264 . ПМЦ 2677679 . ПМИД 11433278 .
- ^ Jump up to: а б с Чу, Ю.; Санчес-Гарсия, И.; Клюг, А. (декабрь 1994 г.). «Репрессия in vivo с помощью сайт-специфического ДНК-связывающего белка, созданного против онкогенной последовательности» (PDF) . Природа . 372 (6507): 642–5. Бибкод : 1994Natur.372..642C . дои : 10.1038/372642a0 . hdl : 10261/6295 . ПМИД 7990954 . S2CID 12701336 .
- ^ Карвин, CD .; Парр, РД.; Кладде, депутат парламента. (ноябрь 2003 г.). «Сайт-селективное нацеливание in vivo на метилирование ДНК цитозина-5 белками цинковых пальцев» . Нуклеиновые кислоты Рез . 31 (22): 6493–501. дои : 10.1093/нар/gkg853 . ПМЦ 275549 . ПМИД 14602907 .
- ^ Ким, Ю.Г.; Ча, Дж.; Чандрасегаран, С. (февраль 1996 г.). «Гибридные рестриктазы: слияние цинковых пальцев с доменом расщепления Fok I» . Proc Natl Acad Sci США . 93 (3): 1156–60. Бибкод : 1996PNAS...93.1156K . дои : 10.1073/pnas.93.3.1156 . ПМК 40048 . ПМИД 8577732 .
- ^ Урнов, ФД.; Миллер, Дж. К.; Ли, ЮЛ; Босежур, СМ.; Рок, Дж. М.; Август, С.; Джеймисон, AC; Портеус, штат Миннесота; и др. (июнь 2005 г.). «Высокоэффективная коррекция эндогенных генов человека с использованием разработанных нуклеаз с цинковыми пальцами». Природа . 435 (7042): 646–51. Бибкод : 2005Natur.435..646U . дои : 10.1038/nature03556 . ПМИД 15806097 . S2CID 4390010 .
- ^ Берли, РР.; Драйер, Б.; Барбас, КФ. (февраль 2000 г.). «Позитивная и негативная регуляция эндогенных генов с помощью разработанных факторов транскрипции» . Proc Natl Acad Sci США . 97 (4): 1495–500. Бибкод : 2000PNAS...97.1495B . дои : 10.1073/pnas.040552697 . ПМК 26462 . ПМИД 10660690 .
- ^ Лара, Х.; Ван, Ю.; Бельтран, AS.; Хуарес-Морено, К.; Юань, X.; Като, С.; Лейзевиц, А.В.; Куэлло Фредес, М.; и др. (август 2012 г.). «Нацеливание на серозный эпителиальный рак яичников с помощью дизайнерских факторов транскрипции цинковых пальцев» . J Биол Хим . 287 (35): 29873–86. дои : 10.1074/jbc.M112.360768 . ПМЦ 3436144 . ПМИД 22782891 .
- ^ Сноуден, AW.; Чжан, Л.; Урнов Ф.; Дент, К.; Жувено, Ю.; Чжун, X.; Ребар, Э.Дж.; Джеймисон, AC; и др. (декабрь 2003 г.). «Репрессия фактора роста эндотелия сосудов А в клетках глиобластомы с использованием сконструированных факторов транскрипции цинковых пальцев». Рак Рез . 63 (24): 8968–76. ПМИД 14695215 .
- ^ Бельке, Массачусетс. (апрель 2006 г.). «Прогресс в использовании миРНК in vivo» . Мол Тер . 13 (4): 644–70. дои : 10.1016/j.ymthe.2006.01.001 . ПМК 7106286 . ПМИД 16481219 .
- ^ Дайксхорн, DM; Либерман, Дж. (2006). «Бегущее вмешательство: перспективы и препятствия к использованию малых интерферирующих РНК в качестве низкомолекулярных лекарств». Анну Рев Биомед Инж . 8 : 377–402. CiteSeerX 10.1.1.418.758 . doi : 10.1146/annurev.bioeng.8.061505.095848 . ПМИД 16834561 .
- ^ Пер, Д.; Парк, Э.Дж.; Моришита, Ю.; Карман, резюме; Симаока, М. (февраль 2008 г.). «Системная доставка миРНК, направленная на лейкоциты, раскрывающая циклин D1 как противовоспалительную мишень» . Наука . 319 (5863): 627–30. дои : 10.1126/science.1149859 . ПМК 2490797 . ПМИД 18239128 .
- ^ Реттиг, гр.; Бельке, Массачусетс. (март 2012 г.). «Прогресс в использовании миРНК-II in vivo» . Мол Тер . 20 (3): 483–512. дои : 10.1038/mt.2011.263 . ПМК 3293614 . ПМИД 22186795 .
- ^ «Идентификатор NCT00080392. Модуляция фактора роста эндотелия сосудов (VEGF) с использованием инженерного фактора транскрипции цинковых пальцев для лечения перемежающейся хромоты нижних конечностей» . ClinicalTrials.gov . Национальные институты здравоохранения США. 30 декабря 2011 года . Проверено 25 июля 2013 г.
- ^ Джакка, М.; Заккинья, С. (июнь 2012 г.). «Генная терапия VEGF: терапевтический ангиогенез в клинике и за ее пределами» . Джин Тер . 19 (6): 622–9. дои : 10.1038/gt.2012.17 . ПМИД 22378343 .