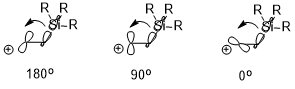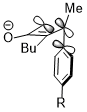Стереоэлектронный эффект
Эта статья требует внимания эксперта в области химии . Конкретная проблема: Многочисленные ошибки в примерах. ( декабрь 2019 г. ) |
В химии , прежде всего органической и вычислительной химии , стереоэлектронный эффект [1] Это влияние на молекулярную геометрию , реакционную способность или физические свойства из-за пространственных отношений в , молекул электронной структуре в частности взаимодействия между атомными и/или молекулярными орбиталями . [2] Другими словами, стереоэлектронные эффекты также можно определить как геометрические ограничения, налагаемые на основные и/или переходные состояния молекул, возникающие из соображений перекрытия орбиталей. [3] Таким образом, стереоэлектронный эффект объясняет определенное молекулярное свойство или реакционную способность, вызывая стабилизирующие или дестабилизирующие взаимодействия, которые зависят от относительной ориентации электронов (связывающих или несвязывающих) в пространстве. [4]
Стереоэлектронные эффекты проявляются и в других известных взаимодействиях. К ним относятся такие важные явления, как аномерный эффект и гиперконъюгация . Важно отметить, что стереоэлектронные эффекты не следует неправильно понимать как простую комбинацию стерических эффектов и электронных эффектов .
Стереоэлектронный эффект, основанный на нескольких общих принципах взаимодействия орбиталей, наряду со стерическим эффектом, индуктивным эффектом , эффектом растворителя , мезомерным эффектом и ароматичностью , является важным типом объяснения наблюдаемых закономерностей селективности, реакционной способности и стабильности. по органической химии . Несмотря на относительно простые предпосылки, стереоэлектронные эффекты часто дают объяснение парадоксальным или неожиданным наблюдениям. В результате стереоэлектронные факторы теперь широко учитываются и используются при разработке новой органической методологии и синтезе сложных мишеней. В последние годы изучение стереоэлектронных эффектов также вошло в сферу биохимии и фармацевтической химии .
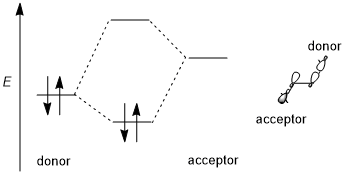
Стереоэлектронный эффект обычно включает стабилизирующее донорно-акцепторное взаимодействие (т.е. заполненная связь-пустая разрыхляющая связь, 2-электронное 2-орбитальное) взаимодействие. Донором обычно является более высокая связывающая или несвязывающая орбиталь , а акцептором часто является низколежащая разрыхляющая орбиталь, как показано на схеме ниже. Если это возможно, то для того, чтобы этот стереоэлектронный эффект был благоприятен, донорно-акцепторные орбитали должны иметь (1) небольшую энергетическую щель и (2) быть геометрически хорошо расположенными для взаимодействия. В частности, это означает, что формы донорных и акцепторных орбиталей (включая симметрию π или σ и размер взаимодействующих долей) должны быть хорошо согласованы для взаимодействия; ориентация антиперипланарная особенно благоприятна . Некоторые авторы требуют, чтобы стереоэлектронные эффекты были стабилизирующими. [1] Однако иногда возникают дестабилизирующие донор-донорные взаимодействия (т.е. заполненная связь-разрыхляющая связь, 4-электронная 2-орбиталь), которые также иногда называют стереоэлектронными эффектами, хотя такие эффекты трудно отличить от общего стерического отталкивания. [3] [5]
Тенденция различных орбиталей
[ редактировать ]возьмем простейшую систему CH 2 X–CH 3 В качестве примера ; донорной орбиталью является орбиталь σ(C–H), а акцепторной – σ*(C–X). При переходе от фтора к хлору , а затем к брому электроотрицательность галогена и энергетический уровень орбиталей σ*(C–X) уменьшаются. [6] Следовательно, общую тенденцию акцепторов можно резюмировать так: π*(C=O)>σ*(C–Hal)>σ*(C–O)>σ*(C–N)>σ*(C–C ), σ*(C–H). Для донорских орбиталей несвязывающие орбитали или неподеленные пары обычно более эффективны, чем связывающие орбитали, из-за высоких уровней энергии. Кроме того, в отличие от акцепторов, донорные орбитали требуют менее поляризованных связей. Таким образом, общие тенденции для донорных орбиталей будут следующими: n(N)>n(O)>σ(C–C), σ(C–H)>σ(C–N)>σ(C–O)>σ. (C–S)>σ(C–Hal). [5]
Стереоэлектронное воздействие в отдельных случаях может быть направленным. Радиус серы намного больше радиуса углерода и кислорода . Таким образом, различия в расстояниях связей C–S приводят к гораздо большей разнице в двух стереоэлектронных эффектах в 1,3- дитиане (σ(C–H) → σ*(C–S)), чем в 1,3- диоксане ( σ(C–H) → σ*(C–O)). [6] Показанные ниже различия между связями C–C и C–S вызывают значительную разницу в расстояниях между связями C–S и двумя связями C–H. Чем меньше разница, тем лучше взаимодействие и сильнее стереоэлектронный эффект. [6]
Влияние на стабильность
[ редактировать ]имеется электроположительный заместитель (например, –SiR 3 , –SnR 3 Если в β-положении карбокатиона , –HgR и т. д.) , положительный заряд может быть стабилизирован, что также во многом обусловлено стереоэлектронным эффектом (проиллюстрировано ниже с использованием – SiR3 в качестве примера). Ориентация двух взаимодействующих орбиталей может оказывать существенное влияние на эффект стабилизации (σ(C–Si) → пустая p-орбиталь), где антиперипланарно (180°) > перпендикулярно (90°) > син (0°). [7]
Влияние на телосложение
[ редактировать ]Левый эффект
[ редактировать ]Одним из структурных последствий ациклических систем из-за стереоэлектронного эффекта является эффект гоша . [8] В 1,2-дифторэтане , несмотря на стерическое столкновение, предпочтительной конформацией является гош, поскольку σ(C–H) является хорошим донором, а σ*(C–F) – хорошим акцептором, а стереоэлектронный эффект (σ(C–F) – хороший акцептор) –H) → σ*(C–F)) требует, чтобы минимум энергии был грубым, а не анти. [9]
Этот бестактный эффект и его влияние на конформацию важны в биохимии. Например, во фрагментах субъединицы HIF-α, содержащих ( 2S,4R )-4-гидроксипролин, гош-взаимодействие благоприятствует конформеру, который может связываться с активным сайтом pVHL. [10] pVHL опосредует протеасомную деградацию HIF1A и, тем самым, физиологический ответ на гипоксию.
Особые эффекты заместителя фтора
[ редактировать ]Стереоэлектронные эффекты могут оказать существенное влияние на фармацевтические исследования . В целом, замену водорода на фтор можно рассматривать как способ регулирования как гидрофобности , так и метаболической стабильности лекарственного средства-кандидата. Более того, он может оказывать глубокое влияние на конформации, часто из-за стереоэлектронных эффектов в дополнение к обычным стерическим эффектам, возникающим из-за большего размера атома фтора. Например, геометрия основного состояния анизола (метоксибензола) и (трифторметокси)бензола резко различается. В анизоле метильная группа предпочитает быть копланарной с фенильной группой , в то время как (трифторметокси)бензол предпочитает геометрию, в которой двугранный угол [C(арил)–C(арил)–O–C(F 3 )] составляет около 90°. °. Другими словами, связь O–CF 3 перпендикулярна плоскости фенильной группы. [11]
Дальнейшие исследования показывают, что даже при замене всего лишь одного или двух атомов водорода в метильной группе на атом фтора искажение структуры также может быть значительным: [C(арил)–C(арил)–O–C( H 2 F)] двугранный угол в структуре с минимизацией энергии составляет около 24°, а двугранный угол [C(арил)–C(арил)–O–C(HF 2 )] 33°. [11]
Влияние на селективность реакции
[ редактировать ]Редуктивная циклизация
[ редактировать ]Хотя разница в энергии между копланарным анизолом и его изомером довольно велика, вращение между связью O–CH 3 становится благоприятным, когда электронные свойства метоксигруппы ароматических колец необходимо изменить для стабилизации необычного промежуточного или переходного состояния. В следующей реакции региоселективность можно объяснить как вращение связи O–C вне плоскости, которое меняет метоксигруппу с донорной группы в плоскости на акцепторную группу вне плоскости. [12]
Промежуточным продуктом вышеуказанной реакции является дианион, и стереоэлектронный эффект, который стабилизирует этот промежуточный продукт по сравнению с другим, заключается в том, что анионный заряд в пара-положении может делокализоваться на атоме кислорода посредством орбитального взаимодействия: π (бензол) → σ. *(О–СН 3 ). [12]
гидрирование
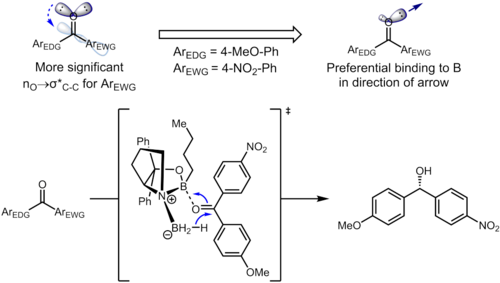
[ редактировать ]Даже отдаленные заместители бензольного кольца могут влиять на электронную плотность ароматического кольца и, в свою очередь, влиять на селективность. При гидрировании кетонов с использованием катализаторов CBS кетон координируется с атомом бора с неподеленной парой атома кислорода. В следующем примере индуктивное влияние заместителей может привести к дифференциации двух sp. 2 неподеленные пары атома кислорода. [13]
Соответствующим стереоэлектронным взаимодействием в исходном материале является взаимодействие n O → σ*(C карбонил – C арил ). Электроноакцепторный заместитель в бензольном кольце снижает электронную плотность ароматического кольца и, таким образом, делает орбиталь σ*(C карбонил –C арил(нитро) ) лучшим акцептором, чем σ*(C карбонил –C арил(метокси) ) . Эти два стереоэлектронных взаимодействия используют разные неподеленные пары на атоме кислорода (одну, которая антиперипланарна рассматриваемому σ* для каждого), что приводит к образованию неподеленных пар с разной электронной плотностью. В частности, повышенное истощение электронной плотности от неподеленной пары, антиперипланарной к 4-нитрофенильной группе, приводит к ослаблению способности этой неподеленной пары координировать себя с бором. Это, в свою очередь, приводит к тому, что неподеленная пара, антиперипланарная по отношению к 4-метоксифенилу, предпочтительно связывается с катализатором, что приводит к четко определенной лицевой селективности. В оптимизированных условиях продукт образуется с превосходным уровнем энантиоселективности (95% ee). [13]
Влияние на термодинамику
[ редактировать ]Влияние на равновесие
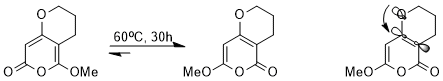
[ редактировать ]Стереоэлектронный эффект влияет на термодинамику равновесия. Например, следующее равновесие может быть достигнуто посредством каскада перициклических реакций.
Несмотря на очень схожие структуры, один из двух изомеров имеет явное преимущество перед другим из-за стереоэлектронного эффекта. Поскольку орбиталь σ* CC, соседняя с электроноакцепторной карбонильной группой, имеет меньшую энергию и, следовательно, является лучшим акцептором, чем орбиталь σ* CC, соседняя с метокси-группой, изомер, в котором n O (с) Неподеленная пара, способная передать эту разрыхляющую орбиталь с более низкой энергией, будет стабилизирована (показано орбитальное взаимодействие). [14]
Другой пример предпочтения равновесия в области перициклической реакции показан ниже. Стереоэлектронный эффект, влияющий на равновесие, — это взаимодействие делокализованных «банановых связей» с пустой p-орбиталью атома бора. [15]
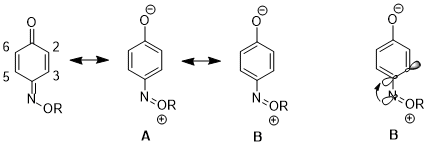
Влияние на резонансные структуры
[ редактировать ]В другом случае стереоэлектронный эффект может привести к увеличению вклада одной резонансной структуры над другой, что приводит к дальнейшим последствиям в реактивности . Для 1,4- бензохинонмоноксима существуют значительные различия в физических свойствах и реакционной способности между двойной связью C2-C3 и двойной связью C5-C6. Например, в 1 H ЯМР, 3 J 23 выше, чем 3 Дж 56. [16] Двойная связь C2-C3 также избирательно подвергается реакции Дильса-Альдера с циклопентадиеном , несмотря на повышенные стерические затруднения на этой стороне молекулы. [17] Эти данные иллюстрируют повышенный вклад резонансной структуры B со структурой A. по сравнению Авторы утверждают, что донорство от n N к σ* -орбитали C4-C3 удлиняет связь C4-C3 (C4 - углерод, несущий азотистый заместитель), что уменьшает pp-перекрытие между этими двумя атомами. Это, в свою очередь, снижает относительную важность структуры A , которая имеет двойную связь между C4 и C3. [18]
Применение в асимметричных реакциях Дильса – Альдера.
[ редактировать ]В асимметричных реакциях Дильса-Альдера вместо использования хиральных лигандов или хиральных вспомогательных веществ для дифференциации боковой селективности диенофилов о дифференциации лицевой селективности диенов (особенно для производных циклопентадиена ) с использованием стереоэлектронных эффектов. Вудворд с 1955 года сообщил [19] Было проведено систематическое исследование лицевой селективности с использованием производных замещенного циклопентадиена или перметилциклопентадиена, и результаты могут быть перечислены ниже. [20]
Стереоэлектронным эффектом, влияющим на результат лицевой селективности диена в реакции Дильса–Альдера, является взаимодействие между σ(C(sp 2 )–CH 3 ) (когда σ(C(sp 2 )–X) является лучшим акцептором, чем донор) или σ(C(sp 2 )–X) (когда σ(C(sp 2 )–X) является лучшим донором, чем акцептором) и σ*-орбиталью образующейся связи между диеном и диенофилом. [20]
Если оба геминальных заместителя представляют собой ароматические кольца с разными заместителями, настраивающими электронную плотность, дифференциация лицевой селективности также проста, когда диенофил приближается к диеновому анти-анти к более богатой электронами связи C–C, где и возникает стереоэлектронный эффект, в этом случае случай аналогичен предыдущему. [21]
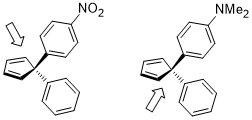
Раскрытие кольца циклобутена в условиях нагревания может иметь два продукта: вращение внутрь и наружу.
Переходное состояние вращения внутрь структуры, показанной ниже, относительно предпочтительно для акцепторных заместителей R (например, NO 2 ), но особенно нежелательно для донорных заместителей R (например, NMe 2 ). [22]
Стереоэлектронный эффект против стерического столкновения
[ редактировать ]Иногда стереоэлектронные эффекты могут победить крайнее стерическое столкновение. В аналогичной реакции раскрытия циклобутенового кольца триметилсилильная группа , которая очень объемна, по-прежнему благоприятствует вращению внутрь. Стереоэлектронный эффект, который представляет собой взаимодействие, показанное выше, когда акцепторной орбиталью является σ*(Si-CH 3 ), по-видимому, является более преобладающим фактором в определении селективности реакции против стерических препятствий и даже побеждает штраф за нарушение система конъюгации продукта из-за стерического столкновения. [23]
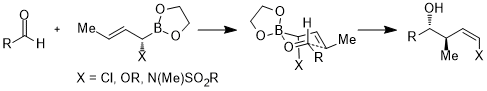
Более того, акцепторные орбитали не ограничиваются разрыхляющими орбиталями связей углерод-гетероатом или пустыми орбиталями; в следующем случае акцепторной орбиталью является орбиталь σ*(B–O). В переходном состоянии шестичленного кольца стереоэлектронное взаимодействие имеет вид σ(C–X) → σ*(B–O). [24]
Стереоэлектронные эффекты в биомолекулах
[ редактировать ]События молекулярного узнавания, опосредованные посредством орбитальных взаимодействий, имеют решающее значение в ряде биологических процессов, таких как ферментативный катализ. [25] Стабилизация взаимодействий между белками и углеводами в гликозилированных белках также иллюстрирует роль стереоэлектронных эффектов в биомолекулах. [26]
Ссылки
[ редактировать ]- ^ Jump up to: а б Алабугин И.В. Стереоэлектронные эффекты: мост между структурой и реактивностью. John Wiley & Sons Ltd, Чичестер, Великобритания, 2016 г. http://eu.wiley.com/WileyCDA/WileyTitle/productCd-1118906349.html
- ^ Крамер, Кристофер Дж. (1996). «Гиперконъюгация, как она влияет на конформационный анализ». Журнал молекулярной структуры: THEOCHEM . 370 (2–3): 135–146. дои : 10.1016/S0166-1280(96)04567-8 . ISSN 0166-1280 .
- ^ Jump up to: а б Эванс, Д.А. (2006). Химия 206 Конспект лекций . Кембридж, Массачусетс: Гарвардский университет (неопубликовано). стр. 1–2 (Лекция 1).
- ^ Пьер., Делонгшам (1983). Стереоэлектронные эффекты в органической химии (1-е изд.). Оксфорд [Оксфордшир]: Pergamon Press. ISBN 0080261841 . OCLC 9412829 .
- ^ Jump up to: а б Кирби, Эй Джей (1996). Стереоэлектронные эффекты . Оксфорд: Издательство Оксфордского университета. ISBN 9780198558934 .
- ^ Jump up to: а б с Алабугин Игорь Владимирович; Зейдан, Тарек А. (2002). «Стереоэлектронные эффекты и общие тенденции гиперконъюгативной акцепторной способности σ-связей». Журнал Американского химического общества . 124 (12): 3175–3185. дои : 10.1021/ja012633z . ISSN 0002-7863 . ПМИД 11902907 .
- ^ Кэри, ФА; Сундберг, Р.Дж. (2007). Продвинутая органическая химия, Часть A: Структура и механизм (5-е изд.). Нью-Йорк: Спрингер. ISBN 978-0387448978 .
- ^ Ханак, М. (1965). Конформационная теория . Нью-Йорк и Лондон: Академическая пресса.
- ^ Анслин, Э.В.; Догерти, Д.А. (2004). Современная физико-органическая химия . Саусалито, Калифорния: Университетские научные книги. ISBN 1891389319 .
- ^ Фухимори, генеральный директор (2009). «Ощущение гипоксии становится неуклюжим». Нат. хим. Биол . 5 (4): 202–203. дои : 10.1038/nchembio0409-202 . ПМИД 19295524 .
- ^ Jump up to: а б Мюллер, К.; Фаэ, К.; Дидерих, Ф. (2007). «Фтор в фармацевтике: взгляд за пределы интуиции». Наука . 317 (5846): 1881–1886. Бибкод : 2007Sci...317.1881M . дои : 10.1126/science.1131943 . ISSN 0036-8075 . ПМИД 17901324 . S2CID 8905635 .
- ^ Jump up to: а б Петерсон, Пол В.; Шевченко, Николай; Алабугин, Игорь В. (2013). « «Стереоэлектронный умполунг»: преобразование p-донора в σ-акцептор посредством инъекции электронов и конформационного изменения». Органические письма . 15 (9): 2238–2241. дои : 10.1021/ol400813d . ISSN 1523-7060 . ПМИД 23639080 .
- ^ Jump up to: а б Кори, Э.Дж.; Хелал, Кристофер Дж. (1995). «Новые электронные эффекты удаленных заместителей на катализируемое оксазаборолидином энантиоселективное восстановление кетонов». Буквы тетраэдра . 36 (50): 9153–9156. дои : 10.1016/0040-4039(95)01961-G . ISSN 0040-4039 .
- ^ Венкатараман, Хемалатха; Ча, Джин К. (1989). «Объем и механизм перегруппировки 4,6-диалкокси-2-пиронов». тетраэдра Буквы 30 (27): 3509–3512. дои : 10.1016/S0040-4039(00) 99426-7 ISSN 0040-4039 .
- ^ Гриднев Илья Дмитриевич; Ток Олег Л.; Гриднева Наталья Александровна; Бубнов Юрий Н.; Шрайнер, Питер Р. (1998). «Синтез и динамические свойства циклогептатриенил(дипропил)борана. Равновесие с 7-дипропилборилноркарадиеном». Журнал Американского химического общества . 120 (5): 1034–1043. дои : 10.1021/ja9724699 . ISSN 0002-7863 .
- ^ Норрис, РК; Стернхелл, С. (1969). «2-Замещенные и 2,6-дизамещенные 1,4-бензохинон-4-оксимы («п-нитрозофенолы»)». Ауст. Дж. Чем . 22 (5): 935–970. дои : 10.1071/CH9690935 .
- ^ Болдуин, Дж. Э.; Норрис, РК (1981). «Стереоэлектронный контроль в органической химии: реакции присоединения некоторых 1,4-бензохинона 4-(О-метилоксимов)». Дж. Орг. Хим . 46 (4): 697–703. дои : 10.1021/jo00317a011 .
- ^ Перрин, CL; Энглер, RE (1997). «Происхождение кажущихся стереоэлектронных эффектов в структуре и реакционной способности бензохинонмонооксимов». Дж. Орг. Хим . 62 (3): 687–692. дои : 10.1021/jo961386s . ПМИД 11671465 .
- ^ Уинштейн, С.; Шатавский, М.; Нортон, К.; Вудворд, РБ (1955). «7-норборненил и 7-норборнил катионы». Дж. Ам. хим. Соц . 77 (15): 4183–4184. дои : 10.1021/ja01620a078 .
- ^ Jump up to: а б Мехта, Говердхан; Ума, Р. (2000). «Стереоэлектронный контроль в реакции Дильса-Альдера диссимметричных 1,3-диенов». Отчеты о химических исследованиях . 33 (5): 278–286. дои : 10.1021/ar990123s . ISSN 0001-4842 . ПМИД 10813872 .
- ^ Холтерман, РЛ; Маккарти, бакалавр; МакЭвой, Массачусетс (1992). «Стереоэлектронный контроль лицевой селективности в циклоприсоединении Дильса-Альдера стерически несмещенных 5,5-диарилциклопентадиенов». Дж. Орг. Хим . 57 (21): 5585–5589. дои : 10.1021/jo00047a009 .
- ^ Шиндо, М.; Сато, Ю.; Шишидо, Дж. (1998). «Высокостереоселективный синтез три- и тетразамещенных олефинов через иноляты». Тетраэдр Летт . 39 (27): 4857–4860. дои : 10.1016/s0040-4039(98) 00921-6
- ^ Мураками, М.; Хасэгава, М. (2004). «Синтез и термическое раскрытие кольца транс-3,4-дисилилциклобутена». Энджью. хим. Межд. Эд . 43 (37): 4874–4876. дои : 10.1002/anie.200460144 . ПМИД 15372640 .
- ^ Шлапбах, А.; Хоффманн, RW (2001). «(E)-α-Сульфонамидокротилборонаты как реагенты для стереоселективного синтеза гомоальдолов». Дж. Орг. Хим . 66 (2): 323–328. doi : 10.1002/1099-0690(200101)2001:2<323::aid-ejoc323>3.0.co;2-a .
- ^ Горенштейн, Дэвид Г. (1 октября 1987 г.). «Стереоэлектронные эффекты в биомолекулах» . Химические обзоры . 87 (5): 1047–1077. дои : 10.1021/cr00081a009 . ISSN 0009-2665 .
- ^ Ардеяни, Мазиар С.; Нудлман, Луи; Пауэрс, Эван Т.; Келли, Джеффри В. (15 марта 2021 г.). «Стереоэлектронные эффекты в стабилизации взаимодействий белок-N-гликан, выявленные экспериментом и машинным обучением» . Природная химия . 13 (5): 480–487. Бибкод : 2021НатЧ..13..480А . дои : 10.1038/s41557-021-00646-w . ISSN 1755-4349 . ПМЦ 8102341 . ПМИД 33723379 .