Искусственный синтез генов
Синтез искусственных генов , или просто синтез генов , относится к группе методов, которые используются в синтетической биологии для конструирования и сборки генов из нуклеотидов de novo . В отличие от синтеза ДНК в живых клетках, синтез искусственных генов не требует матричной ДНК, что позволяет синтезировать практически любую последовательность ДНК в лаборатории. Он состоит из двух основных этапов, первым из которых является твердофазный синтез ДНК , иногда известный как печать ДНК . [1] В результате образуются олигонуклеотидные фрагменты, длина которых обычно составляет менее 200 пар оснований. Затем второй шаг включает соединение этих олигонуклеотидных фрагментов с использованием различных методов сборки ДНК. Поскольку синтез искусственных генов не требует матричной ДНК, теоретически возможно создать полностью синтетическую молекулу ДНК без ограничений по нуклеотидной последовательности или размеру.
Синтез первого полного гена, дрожжевой тРНК , был продемонстрирован Хар Гобиндом Хораной и его коллегами в 1972 году. [2] Синтез первых генов, кодирующих пептиды и белки , был выполнен в лабораториях Герберта Бойера и Александра Маркхэма соответственно. [3] [4] Совсем недавно были разработаны методы искусственного синтеза генов, которые позволят собирать целые хромосомы и геномы. Первая синтетическая дрожжевая хромосома была синтезирована в 2014 году, а целые функциональные бактериальные хромосомы. также синтезированы [5] Кроме того, в будущем в синтезе искусственных генов могут использоваться новые пары нуклеиновых оснований (неприродные пары оснований). [6] [7] [8]
Стандартные методы синтеза ДНК
[ редактировать ]Синтез олигонуклеотидов
[ редактировать ]Олигонуклеотиды химически синтезируются с использованием строительных блоков, называемых нуклеозидамифосфорамидитами . Это могут быть нормальные или модифицированные нуклеозиды, которые имеют защитные группы, предотвращающие неправильное взаимодействие их аминов, гидроксильных групп и фосфатных групп. Добавляют по одному фосфорамидиту, с 5'-гидроксильной группы снимают защиту и добавляют новое основание и так далее. Цепь растет в направлении от 3' к 5', что противоположно биосинтезу. В конце все защитные группы удаляются. Тем не менее, поскольку это химический процесс, происходит несколько неправильных взаимодействий, приводящих к образованию некоторых дефектных продуктов. Чем длиннее синтезируемая олигонуклеотидная последовательность, тем больше в ней дефектов, поэтому этот процесс практичен только для получения коротких последовательностей нуклеотидов . Текущий практический предел составляет около 200 пар оснований для олигонуклеотида достаточного качества, чтобы его можно было использовать непосредственно для биологического применения. ВЭЖХ можно использовать для выделения продуктов в правильной последовательности. Между тем, большое количество олигонуклеотидов можно синтезировать параллельно на генные чипы . Для оптимальной работы последующих процедур синтеза генов их следует готовить индивидуально и в больших масштабах.
Соединение олигонуклеотидов на основе отжига
[ редактировать ]Обычно набор индивидуально разработанных олигонуклеотидов изготавливают на автоматизированных твердофазных синтезаторах, очищают, а затем соединяют посредством специфического отжига и стандартного лигирования или полимеразных реакций. Чтобы улучшить специфичность отжига олигонуклеотидов, на этапе синтеза используется набор термостабильных ДНК- лигазы и полимеразы ферментов . На сегодняшний день описано несколько методов синтеза генов, таких как лигирование фосфорилированных перекрывающихся олигонуклеотидов, [2] [3] метод Фока I [4] и модифицированная форма лигазной цепной реакции для синтеза генов. несколько подходов к сборке ПЦР . Кроме того, было описано [9] Обычно они используют олигонуклеотиды длиной 40-50 нуклеотидов, которые перекрывают друг друга. Эти олигонуклеотиды предназначены для покрытия большей части последовательности обеих цепей, а полноразмерная молекула генерируется постепенно с помощью ПЦР с удлинением перекрытия (OE). [9] термодинамически сбалансированная ПЦР наизнанку (TBIO) [10] или комбинированные подходы. [11] Размер наиболее часто синтезируемых генов варьируется от 600 до 1200 п.н., хотя гены гораздо большей длины были получены путем соединения ранее собранных фрагментов размером менее 1000 п.н. В этом диапазоне размеров необходимо протестировать несколько клонов-кандидатов, подтвердив последовательность клонированного синтетического гена методами автоматического секвенирования.
Ограничения
[ редактировать ]Более того, поскольку сборка полноразмерного генного продукта зависит от эффективного и специфического выравнивания длинных одноцепочечных олигонуклеотидов, критические параметры успеха синтеза включают области расширенной последовательности, включающие вторичные структуры, вызванные инвертированными повторами, чрезвычайно высокое или низкое содержание GC, или повторяющиеся структуры. Обычно эти сегменты конкретного гена можно синтезировать только путем разделения процедуры на несколько последовательных этапов и окончательной сборки более коротких подпоследовательностей, что, в свою очередь, приводит к значительному увеличению времени и труда, необходимых для его производства.Результат эксперимента по синтезу генов сильно зависит от качества используемых олигонуклеотидов. Для этих протоколов синтеза генов, основанных на отжиге, качество продукта прямо и экспоненциально зависит от правильности используемых олигонуклеотидов. Альтернативно, после выполнения синтеза генов с олигонуклеотидами более низкого качества необходимо приложить больше усилий для последующего обеспечения качества во время анализа клонов, который обычно выполняется с помощью трудоемких стандартных процедур клонирования и секвенирования.Другой проблемой, связанной со всеми современными методами синтеза генов, является высокая частота ошибок последовательности из-за использования химически синтезированных олигонуклеотидов. Частота ошибок увеличивается с увеличением длины олигонуклеотидов, и, как следствие, процент правильного продукта резко снижается по мере использования большего количества олигонуклеотидов.Проблему мутаций можно было бы решить с помощью более коротких олигонуклеотидов, используемых для сборки гена. Однако все методы сборки, основанные на отжиге, требуют смешивания праймеров в одной пробирке. В этом случае более короткие перекрытия не всегда позволяют точно и специфично отжигать комплементарные праймеры, что приводит к ингибированию образования полноразмерного продукта.Ручной дизайн олигонуклеотидов является трудоемкой процедурой и не гарантирует успешного синтеза нужного гена. Для оптимальной работы почти всех методов, основанных на отжиге, температуры плавления перекрывающихся областей должны быть одинаковыми для всех олигонуклеотидов. Необходимую оптимизацию праймеров следует проводить с использованием специализированных программ дизайна олигонуклеотидов. На данный момент представлено несколько решений по автоматизированному созданию праймеров для синтеза генов. [12] [13] [14]
Процедуры исправления ошибок
[ редактировать ]Для преодоления проблем, связанных с качеством олигонуклеотидов, было разработано несколько сложных стратегий, в которых используются либо отдельно приготовленные рыболовные олигонуклеотиды, либо [15] несоответствие связывающих ферментов семейства mutS [16] или специфические эндонуклеазы бактерий или фагов. [17] Тем не менее, все эти стратегии увеличивают время и затраты на синтез генов, основанный на отжиге химически синтезированных олигонуклеотидов.
Массовое параллельное секвенирование также использовалось в качестве инструмента для скрининга сложных библиотек олигонуклеотидов и обеспечения поиска точных молекул. В одном подходе олигонуклеотиды секвенируют на платформе пиросеквенирования 454, а роботизированная система визуализирует и выбирает отдельные шарики, соответствующие точной последовательности. [18] В другом подходе сложная библиотека олигонуклеотидов модифицируется уникальными фланкирующими метками перед массовым параллельным секвенированием. Праймеры, ориентированные на теги, затем позволяют извлекать молекулы с желаемыми последовательностями с помощью ПЦР с телефонным доступом. [19]
Все чаще гены упорядочиваются в наборы, включающие функционально связанные гены или несколько вариантов последовательностей одного гена. Практически все разрабатываемые терапевтические белки, такие как моноклональные антитела, оптимизируются путем тестирования множества вариантов генов на предмет улучшения функции или экспрессии.
Неестественные пары оснований
[ редактировать ]В то время как традиционный синтез нуклеиновых кислот использует только 4 пары оснований — аденин, тимин, гуанин и цитозин, синтез олигонуклеотидов в будущем может включать использование неприродных пар оснований, которые представляют собой искусственно созданные и синтезированные нуклеиновые основания, не встречающиеся в природе.
В 2012 году группа американских учёных во главе с Флойдом Ромесбергом, химиком-биологом из Научно-исследовательского института Скриппса в Сан-Диего, Калифорния, опубликовала информацию о том, что его команда разработала неестественную пару оснований (UBP). Два новых искусственных нуклеотида или пары неестественных оснований (UBP) были названы d5SICS и dNaM . С технической точки зрения, эти искусственные нуклеотиды, несущие гидрофобные азотистые основания , имеют два слитых ароматических кольца , которые образуют комплекс (d5SICS – dNaM) или пару оснований в ДНК. В 2014 году та же команда из Научно-исследовательского института Скриппса сообщила, что они синтезировали участок кольцевой ДНК, известный как плазмида, содержащую природные пары оснований TA и CG, вместе с наиболее эффективной разработкой лаборатории UBP Ромесберга, и вставили ее в клетки обычного организма. бактерия E. coli , которая успешно реплицировала неприродные пары оснований в нескольких поколениях. Это первый известный пример передачи живым организмом расширенного генетического кода последующим поколениям. Частично это было достигнуто за счет добавления поддерживающего гена водоросли, который экспрессирует нуклеотид-трифосфатный переносчик, который эффективно импортирует трифосфаты d5SICSTP и dNaMTP в E. coli бактерии . Затем естественные пути репликации бактерий используют их для точной репликации плазмиды, содержащей d5SICS-dNaM.
Успешное включение третьей пары оснований является значительным прорывом на пути к значительному расширению числа аминокислот , которые могут кодироваться ДНК, с существующих 20 аминокислот до теоретически возможных 172, тем самым расширяя возможности живых организмов производить новые белки . [20] В будущем эти неприродные пары оснований можно будет синтезировать и включать в олигонуклеотиды с помощью методов печати ДНК.
сборка ДНК
[ редактировать ]Таким образом, печать ДНК может использоваться для создания частей ДНК, которые определяются как последовательности ДНК, кодирующие определенную биологическую функцию (например, промоторы , последовательности, регулирующие транскрипцию, или открытые рамки считывания ). [21] Однако, поскольку синтез олигонуклеотидов обычно не может точно производить последовательности олигонуклеотидов длиной более нескольких сотен пар оснований, необходимо использовать методы сборки ДНК для сборки этих частей вместе для создания функциональных генов, мультигенных цепей или даже целых синтетических хромосом или геномов. Некоторые методы сборки ДНК определяют только протоколы соединения частей ДНК, тогда как другие методы также определяют правила формата совместимых с ними частей ДНК. Эти процессы можно масштабировать, чтобы обеспечить сборку целых хромосом или геномов. В последние годы число различных стандартов сборки ДНК увеличилось: по состоянию на 2015 год было разработано 14 различных стандартов сборки, каждый из которых имеет свои плюсы и минусы. [22] В целом, разработка стандартов сборки ДНК значительно облегчила рабочий процесс в синтетической биологии, способствовала обмену материалом между исследовательскими группами, а также позволила создавать модульные и многоразовые части ДНК. [22]
Различные методы сборки ДНК можно разделить на три основные категории: сборка, опосредованная эндонуклеазами, сайт-специфическая рекомбинация и сборка на основе длительного перекрытия. [22] Каждая группа методов имеет свои особенности, преимущества и ограничения.
Сборка, опосредованная эндонуклеазой
[ редактировать ]Эндонуклеазы — это ферменты, которые распознают и расщепляют сегменты нуклеиновой кислоты, и их можно использовать для управления сборкой ДНК. Из различных типов рестриктаз рестриктазы типа II являются наиболее широко доступными и используемыми, поскольку их сайты расщепления расположены рядом с сайтами узнавания или внутри них. Следовательно, методы сборки, опосредованные эндонуклеазой, используют это свойство для определения частей ДНК и протоколов сборки.
Биокирпичи
[ редактировать ]
Стандарт сборки BioBricks был описан и представлен Томом Найтом в 2003 году и с тех пор постоянно обновляется. [23] В настоящее время наиболее часто используемым стандартом BioBricks является стандарт сборки 10, или BBF RFC 10. BioBricks определяет последовательности префиксов и суффиксов, необходимые для совместимости части ДНК с методом сборки BioBricks, что позволяет объединять все части ДНК, находящиеся в формат BioBricks.
Префикс содержит сайты рестрикции EcoRI, NotI и XBaI, а суффикс содержит сайты рестрикции SpeI, NotI и PstI. За пределами префиксной и суффиксной областей часть ДНК не должна содержать этих сайтов рестрикции. Чтобы соединить две части BioBrick вместе, одну из плазмид расщепляют EcoRI и SpeI, а вторую плазмиду расщепляют EcoRI и XbaI. Два выступа EcoRI дополняют друг друга и, таким образом, будут отжигаться вместе, в то время как SpeI и XbaI также образуют дополнительные выступы, которые также можно лигировать вместе. Поскольку полученная плазмида содержит исходные префиксные и суффиксные последовательности, ее можно использовать для соединения с другими частями BioBricks. [24] Из-за этого свойства стандарт сборки BioBricks считается идемпотентным по своей природе. Однако между двумя слитыми биокирпичиками также будет образоваться «рубцовая» последовательность (ТАКТАГ или ТАКТАГАГ). Это предотвращает использование BioBricks для создания слитых белков, поскольку рубцовая последовательность из 6 пар оснований кодирует тирозин и стоп-кодон, вызывая прекращение трансляции после экспрессии первого домена, в то время как рубцовая последовательность из 8 пар оснований вызывает сдвиг рамки считывания , предотвращая непрерывное считывание кодоны. Чтобы предложить альтернативные рубцовые последовательности, которые, например, образуют рубец длиной 6 пар оснований, или рубцовые последовательности, не содержащие стоп-кодоны, были разработаны другие стандарты сборки, такие как сборка BB-2, сборка BglBricks, сборка Silver и сборка Фрайбурга. [25] [26] [27] [28]
Хотя самый простой метод сборки деталей BioBrick описан выше, существует также несколько других широко используемых методов сборки, которые имеют ряд преимуществ по сравнению со стандартной сборкой. Сборка из 3 антибиотиков (3A) позволяет выбрать правильную сборку посредством выбора антибиотика, в то время как сборка амплифицированной вставки стремится преодолеть низкую эффективность трансформации, наблюдаемую в сборке 3A. [29] [30]
Стандарт сборки BioBrick также послужил источником вдохновения для использования других типов эндонуклеаз для сборки ДНК. Например, и стандарт iBrick, и стандарты сборки векторов HomeRun используют самонаводящиеся эндонуклеазы вместо ферментов рестрикции типа II. [31] [32]
Сборка эндонуклеазы рестрикции типа IIs
[ редактировать ]В некоторых методах сборки также используются эндонуклеазы рестрикции типа II. Они отличаются от других эндонуклеаз типа II, поскольку они отрезают несколько пар оснований от сайта узнавания. В результате выступающая последовательность может быть изменена так, чтобы она содержала желаемую последовательность. Это дает методам сборки типа II два преимущества: он обеспечивает сборку «без шрамов» и позволяет выполнять сборку из нескольких частей в один бак. Методы сборки, в которых используются эндонуклеазы типа II, включают Golden Gate и связанные с ним варианты.
Клонирование Золотых Ворот
[ редактировать ]
Протокол сборки Golden Gate был определен Engler et al. 2008, чтобы определить метод сборки ДНК, который позволил бы получить окончательную конструкцию без рубцовой последовательности, но при этом не иметь исходных сайтов рестрикции. Это позволяет белку экспрессироваться без содержания нежелательных белковых последовательностей, которые могут отрицательно повлиять на сворачивание или экспрессию белка. Используя фермент рестрикции BsaI, который образует выступающий конец из 4 пар оснований, для сборки можно использовать до 240 уникальных непалиндромных последовательностей. [33]
Плазмидный дизайн и сборка
При клонировании Golden Gate каждый собираемый фрагмент ДНК помещается в плазмиду, фланкированную обращенными внутрь сайтами рестрикции BsaI, содержащими запрограммированные выступающие последовательности. Для каждого фрагмента ДНК 3'-концевая последовательность комплементарна 5'-концу следующего нижестоящего фрагмента ДНК. Для первого фрагмента 5'-конец комплементарен 5'-концу целевой плазмиды, тогда как 3'-конец конечного фрагмента комплементарен 3'-концу целевой плазмиды. Такая конструкция позволяет собрать все фрагменты ДНК в реакции в одном котле (где все реагенты смешиваются вместе), при этом все фрагменты располагаются в правильной последовательности. Успешно собранные конструкции отбираются путем выявления потери функции скрининговой кассеты, которая изначально находилась в целевой плазмиде. [33]
MoClo и Золотая коса
Исходная сборка Golden Gate позволяет создавать только одну конструкцию в векторе назначения. Чтобы эту конструкцию можно было использовать в последующей реакции в качестве вектора входа, были разработаны стандарты MoClo и Golden Braid. [34]
Стандарт MoClo предполагает определение нескольких уровней сборки ДНК:
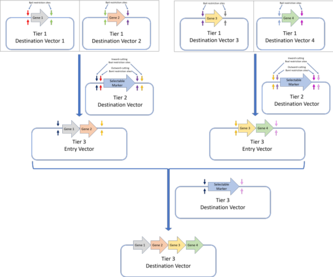
- Уровень 1: сборка уровня 1 представляет собой стандартную сборку «Золотых ворот», при которой гены собираются из частей их компонентов (частей ДНК, кодирующих генетические элементы, такие как UTR , промоторы, сайты связывания рибосом или последовательности терминаторов ). По бокам от сайта вставки векторов назначения уровня 1 находится пара сайтов рестрикции BpiI, разрезающих внутрь. Это позволяет использовать эти плазмиды в качестве входных векторов для векторов назначения второго уровня.Стандарт сборки MoClo позволяет собирать конструкции Golden Gate на последующих уровнях. В приведенном здесь примере четыре гена, собранные с помощью сборки Golden Gate уровня 1, собираются в мультигенную конструкцию на сборке уровня 2.Стандарт сборки Golden Braid также основан на первом уровне сборки Golden Gate и собирает дальнейшие уровни посредством парного протокола. Четыре вектора назначения первого уровня (собранные посредством сборки Golden Gate) собираются в два вектора назначения уровня 2, которые затем используются в качестве векторов входа уровня 3 для вектора назначения уровня 3. Используются чередующиеся ферменты рестрикции (BpiI для уровня 2 и BsaI для уровня 3).Стандарты сборки MoClo и Golden Braid являются производными от исходного стандарта сборки Golden Gate.
- Уровень 2: Сборка уровня 2 включает дальнейшую сборку генов, собранных на сборке уровня 1, в мультигенные конструкции. Если существует необходимость в дальнейшей сборке более высокого уровня, можно добавить разрезающие внутрь сайты рестрикции BsaI, чтобы фланкировать сайты вставки. Эти векторы затем можно использовать в качестве входных векторов для конструкций более высокого уровня.
На каждом уровне сборки попеременно используются сайты рестрикции BsaI и BpiI, чтобы минимизировать количество запрещенных сайтов, а последовательная сборка для каждого уровня достигается за счет следования конструкции плазмиды Golden Gate. В целом, стандарт MoClo позволяет собирать конструкцию, содержащую несколько единиц транскрипции, собранных из разных частей ДНК, с помощью серии реакций Golden Gate в одном горшке. Однако одним из недостатков стандарта MoClo является то, что он требует использования «фиктивных частей», не имеющих биологической функции, если для окончательной конструкции требуется менее четырех составных частей. [35] С другой стороны, стандарт Golden Braid представил стандарт парной сборки Golden Gate.
Стандарт Golden Braid использует ту же многоуровневую сборку, что и MoClo, но каждый уровень включает сборку только двух фрагментов ДНК, то есть парный подход. Следовательно, на каждом уровне пары генов клонируются в целевой фрагмент в желаемой последовательности, а затем собираются по два за раз на последовательных уровнях. Как и MoClo, стандарт Golden Braid чередует ферменты рестрикции BsaI и BpiI на каждом уровне.
Развитие методов сборки «Золотых ворот» и их вариантов позволило исследователям разработать наборы инструментов для ускорения рабочего процесса синтетической биологии. Например, EcoFlex был разработан как набор инструментов для E. Coli , в котором для частей ДНК используется стандарт MoClo, а аналогичный набор инструментов также был разработан для разработки микроводорослей Chlamydomonas Reinhardtii . [36] [37]
Сайт-специфическая рекомбинация
[ редактировать ]Сайт-специфическая рекомбинация использует фаговые интегразы вместо ферментов рестрикции, что устраняет необходимость наличия сайтов рестрикции во фрагментах ДНК. Вместо этого интегразы используют уникальные сайты присоединения (att) и катализируют перегруппировку ДНК между целевым фрагментом и вектором назначения. Система клонирования Invitrogen Gateway была изобретена в конце 1990-х годов и использует две запатентованные смеси ферментов: клоназу BP и клоназу LR. Смесь клоназ BP катализирует рекомбинацию между сайтами attB и attP, генерируя гибридные сайты attL и attR, тогда как смесь клоназ LR катализирует рекомбинацию сайтов attL и attR с образованием сайтов attB и attP. Поскольку каждая смесь ферментов распознает только определенные att-сайты, рекомбинация является высокоспецифичной, и фрагменты могут быть собраны в желаемой последовательности. [38]
Векторный дизайн и сборка
Поскольку клонирование шлюза является запатентованной технологией, все реакции шлюза необходимо выполнять с помощью набора шлюза, предоставленного производителем. Реакцию можно разделить на две стадии. Первый этап включает сборку входных клонов, содержащих интересующий фрагмент ДНК, а второй этап включает вставку этого интересующего фрагмента в целевой клон.
- Входные клоны должны быть созданы с использованием поставляемых «донорских» векторов, содержащих кассету шлюза, окруженную сайтами attP. Кассета Gateway содержит ген бактериального самоубийства (например, ccdB ), который позволит выжить и отобрать успешно рекомбинированные входные клоны. Пара сайтов attB добавляется для фланкирования интересующего фрагмента ДНК, и это позволит рекомбинировать с сайтами attP при добавлении смеси клоназ BP. Образуются входные клоны, и интересующий фрагмент фланкируется сайтами attL.
- Вектор назначения также поставляется с кассетой шлюза, но вместо этого окружен парой сайтов attR. Смешивание этой целевой плазмиды с входными клонами и смесью клоназ LR позволит осуществить рекомбинацию между сайтами attR и attL. Создается целевой клон с успешно вставленным интересующим фрагментом. Летальный ген вставляется в исходный вектор, и бактерии, трансформированные этой плазмидой, погибают. Таким образом, желаемый вектор может быть легко выбран.
Самые ранние версии метода клонирования шлюза позволяли использовать только один входной клон для каждого созданного целевого клона. Однако дальнейшие исследования показали, что можно создать еще четыре ортогональные последовательности att, позволяющие собирать до четырех различных фрагментов ДНК, и этот процесс теперь известен как технология Multisite Gateway. [39]
Помимо клонирования Gateway, также разработаны некоммерческие методы с использованием других интеграз. Например, в методе рекомбинационной сборки сериновой интегразы (SIRA) используется интеграза φC31, а в методе тандемной сборки на основе сайт-специфической рекомбинации (SSRTA) используется интеграза фага Streptomyces φBT1. [40] [41] Другие методы, такие как система сборки векторов HomeRun (HVAS), основаны на системе клонирования Gateway и дополнительно включают самонаводящиеся эндонуклеазы для разработки протокола, который потенциально может поддерживать промышленный синтез синтетических конструкций ДНК. [31]

Сборка с длинным перекрытием
[ редактировать ]В последние годы было разработано множество методов сборки с длинным перекрытием. Один из наиболее часто используемых методов, метод сборки Гибсона, был разработан в 2009 году и представляет собой метод сборки ДНК в одном горшке, который не требует использования ферментов рестрикции или интеграз. [42] Другие подобные методы сборки на основе перекрытия включают клонирование с расширением круговой полимеразы (CPEC), независимое от последовательности и лигазы клонирование (SLIC) и экстракт клонирования с бесшовным лигированием (SLiCE). [43] [44] [45] Несмотря на наличие множества способов сборки внахлест, метод сборки Гибсона по-прежнему остается самым популярным. [46] Помимо перечисленных выше методов, другие исследователи опирались на концепции, используемые в сборке Гибсона и других методах сборки, для разработки новых стратегий сборки, таких как стратегия модульной сборки с перекрытием и линкерами (MODAL) или стандарт сборки Biopart для идемпотентного клонирования (BASIC). ) метод. [47] [48]
Сборка Гибсона
[ редактировать ]Метод сборки Гибсона представляет собой относительно простой метод сборки ДНК, требующий лишь нескольких дополнительных реагентов: 5'- экзонуклеазы Т5 , ДНК-полимеразы Phusion и Taq ДНК-лигазы . Фрагменты ДНК, подлежащие сборке, синтезируются так, чтобы их 5'- и 3'-концы перекрывались в том порядке, в котором они должны быть собраны. Эти реагенты смешиваются вместе с фрагментами ДНК, подлежащими сборке, при 50 °C, и происходят следующие реакции:
- Экзонуклеаза Т5 откусывает ДНК с 5'-конца каждого фрагмента, обнажая 3'-выступы на каждом фрагменте ДНК.
- Комплементарные выступы соседних фрагментов ДНК отжигаются посредством комплементарного спаривания оснований.
- ДНК-полимераза Phusion заполняет любые пробелы в местах отжига фрагментов.
- ДНК-лигаза Taq восстанавливает разрывы на обеих цепях ДНК.
Поскольку экзонуклеаза Т5 термолабильна, она инактивируется при 50 °C после первоначального этапа жевания. Таким образом, продукт стабилен, а фрагменты собираются в желаемом порядке. Этот протокол в одном горшке позволяет точно собрать до 5 различных фрагментов, в то время как у нескольких коммерческих поставщиков есть наборы для точной сборки до 15 различных фрагментов в двухэтапной реакции. [49] Однако, хотя протокол сборки Гибсона быстрый и использует относительно мало реагентов, он требует индивидуального синтеза ДНК, поскольку каждый фрагмент должен быть спроектирован так, чтобы содержать перекрывающиеся последовательности с соседними фрагментами, и амплифицироваться с помощью ПЦР. Такая зависимость от ПЦР может также влиять на точность реакции при использовании длинных фрагментов, фрагментов с высоким содержанием GC или повторяющихся последовательностей. [48]

КАПИТАЛ
[ редактировать ]Стратегия MODAL определяет перекрывающиеся последовательности, известные как «линкеры», чтобы уменьшить объем настройки, которую необходимо выполнить с каждым фрагментом ДНК. Линкеры были разработаны с использованием программного обеспечения R2oDNA Designer , а области перекрытия были разработаны так, чтобы иметь длину 45 пар оснований, чтобы быть совместимыми со сборкой Гибсона и другими методами сборки с перекрытием. Чтобы прикрепить эти линкеры к частям, которые необходимо собрать, проводят ПЦР с использованием праймеров, специфичных для частей, содержащих префиксные и суффиксные адаптерные последовательности длиной 15 пар оснований. Линкеры затем присоединяются к адаптерным последовательностям посредством второй реакции ПЦР. Для позиционирования фрагментов ДНК один и тот же линкер будет присоединен к суффиксу желаемого вышестоящего фрагмента и префиксу желаемых нижележащих фрагментов. После прикрепления линкеров для сборки фрагментов ДНК в желаемом порядке можно использовать сборку Гибсона, CPEC или другие методы сборки с перекрытием.
БАЗОВЫЙ
[ редактировать ]Стратегия сборки BASIC была разработана в 2015 году и направлена на устранение ограничений предыдущих методов сборки, включая шесть ключевых концепций из них: стандартные детали многократного использования; одноярусный формат (все детали одного формата и собираются по одному и тому же процессу); идемпотентное клонирование; параллельная (многочастная) сборка ДНК; независимость от размера; автоматизация. [48]
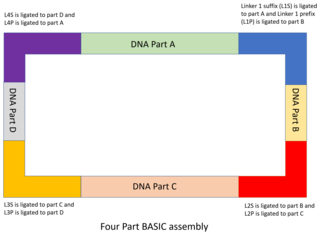
Части ДНК и дизайн линкера
Части ДНК конструируют и клонируют в запасающие плазмиды, при этом часть фланкируется интегрированной последовательностью префикса ( i P) и интегрированным суффиксом ( i S). Последовательности i P и i S содержат обращенные внутрь сайты рестрикции BsaI, которые содержат выступающие части, комплементарные линкерам BASIC. [48] Как и в MODAL, 7 стандартных линкеров, используемых в BASIC, были разработаны с помощью программного обеспечения R2oDNA Designer и проверены на предмет отсутствия последовательностей, гомологичных геномам шасси, а также нежелательных последовательностей, таких как последовательности вторичной структуры, сайты рестрикции. или сайты связывания рибосом. Каждая последовательность линкера разделена на две половины, каждая из которых имеет выступающий конец длиной 4 п.о., комплементарный сайту рестрикции BsaI, двухцепочечную последовательность длиной 12 п.н. и разделяющую перекрывающуюся последовательность длиной 21 п.н. с другой половиной. Половина, которая связывается с вышестоящей частью ДНК, известна как часть суффиксного линкера (например, L1S), а половина, которая связывается с нижестоящей частью, известна как часть префиксного линкера (например, L1P). Эти линкеры составляют основу сборки частей ДНК вместе.
Помимо указания порядка сборки, стандартные компоновщики BASIC также можно модифицировать для выполнения других функций. Чтобы обеспечить идемпотентную сборку, линкеры также были созданы с дополнительными метилированными последовательностями iP и iS , вставленными для защиты их от распознавания BsaI. Это метилирование теряется после трансформации и репликации плазмиды in vivo, и плазмиды можно экстрагировать, очищать и использовать для дальнейших реакций.
Поскольку последовательность линкера относительно длинная (45 пар оснований для стандартного линкера), существует возможность включения функциональных последовательностей ДНК для уменьшения количества частей ДНК, необходимых во время сборки. Стандарт сборки BASIC предоставляет несколько линкеров, встроенных в RBS разной силы. Аналогичным образом, чтобы облегчить конструирование слитых белков, содержащих несколько белковых доменов, было также разработано несколько слитых линкеров, обеспечивающих полное считывание конструкции ДНК. Эти слитые линкеры кодируют полипептид глицина и серина из 15 аминокислот, который является идеальным линкерным пептидом для слитых белков с несколькими доменами.
Сборка
Сборка окончательной конструкции состоит из трех основных этапов.
- Сначала части ДНК вырезаются из запасающей плазмиды, в результате чего образуется фрагмент ДНК с выступающими концами BsaI на 3'- и 5'-концах.
- Затем каждая часть линкера прикрепляется к соответствующей части ДНК путем инкубации с ДНК-лигазой Т4. Каждая часть ДНК будет иметь суффикс и префикс линкерной части из двух разных линкеров, чтобы определить порядок сборки. Например, первая часть последовательности будет иметь L1P и L2S, а вторая часть — L2P и L3S. Части линкера можно менять, чтобы изменить последовательность сборки.
- Наконец, части с прикрепленными линкерами собираются в плазмиду путем инкубации при 50 °C. Выступы P- и S-линкеров длиной 21 п.о. отжигаются, и конечная конструкция может быть трансформирована в бактериальные клетки для клонирования. Однонитевые разрывы восстанавливаются in vivo после трансформации, образуя стабильную конечную конструкцию, клонированную в плазмиды.
Приложения
[ редактировать ]Поскольку методы печати ДНК и сборки ДНК позволили за последние годы постепенно и экспоненциально удешевить коммерческий синтез генов, [50] Синтез искусственных генов представляет собой мощный и гибкий инженерный инструмент для создания и проектирования новых последовательностей ДНК и функций белков. Помимо синтетической биологии, различные области исследований, такие как экспрессия гетерологичных генов , разработка вакцин , генная терапия и молекулярная инженерия, значительно выиграют от наличия быстрых и дешевых методов синтеза ДНК для кодирования белков и пептидов. [51] Методы, используемые для печати и сборки ДНК, даже позволили использовать ДНК в качестве носителя информации .
Синтез бактериальных геномов
[ редактировать ]Синтии и Микоплазмы Лаборатория
[ редактировать ]28 июня 2007 года группа из Института Дж. Крейга Вентера статью опубликовала в журнале Science Express , в которой говорилось, что они успешно трансплантировали природную ДНК бактерии Mycoplasma mycoides в клетку Mycoplasma capricolum , создав бактерию, которая вела себя как М. . микоидес . [52]
6 октября 2007 года Крейг Вентер объявил в интервью британской газете The Guardian что та же команда искусственно синтезировала модифицированную версию единственной хромосомы Mycoplasmagentitalium , . Хромосома была модифицирована для устранения всех генов, которые, как показали тесты на живых бактериях, не нужны. Следующим запланированным шагом в этом проекте минимального генома является трансплантация синтезированного минимального генома в бактериальную клетку с удалением старой ДНК; Полученная бактерия будет называться Mycoplasma Laboratorium . На следующий день канадская по биоэтике группа ETC Group опубликовала заявление через своего представителя Пэта Муни , в котором говорилось, что «творение» Вентера было «шасси, на котором можно построить практически все». Синтезированный геном еще не был трансплантирован в рабочую клетку. [53]
21 мая 2010 года журнал Science сообщил, что группа Вентера успешно синтезировала геном бактерии Mycoplasma mycoides из компьютерной записи и трансплантировала синтезированный геном в существующую клетку бактерии Mycoplasma capricolum , у которой была удалена ДНК. «Синтетическая» бактерия оказалась жизнеспособной, т. е. способной размножаться миллиарды раз. Первоначально команда планировала использовать бактерию M.genitalium , с которой они работали ранее, но перешла на M.mycoides , поскольку последняя бактерия растет намного быстрее, что привело к более быстрым экспериментам. [54] Вентер описывает его как «первый вид… родителями которого были компьютеры». [55] Трансформированная бактерия получила название « Синтия от ETC ». Представитель Вентера отказался подтвердить какой-либо прорыв на момент написания этой статьи.
Синтетические дрожжи 2.0
[ редактировать ]В рамках проекта Synthetic Yeast 2.0 различные исследовательские группы по всему миру приняли участие в проекте по синтезу геномов синтетических дрожжей и посредством этого процесса оптимизации генома модельного организма Saccharomyces cerevisiae . [56] В проекте Yeast 2.0 применялись различные методы сборки ДНК, которые обсуждались выше, и в марте 2014 года Джеф Буке из Медицинского центра Лангоне при Нью-Йоркском университете обнаружил, что его команда синтезировала хромосому III S. cerevisiae . [57] [58] Процедура включала замену генов в исходной хромосоме синтетическими версиями, а готовую синтетическую хромосому затем интегрировали в дрожжевую клетку. Для этого потребовалось спроектировать и создать 273 871 пару оснований ДНК – меньше, чем 316 667 пар оснований в исходной хромосоме. В марте 2017 года синтез 6 из 16 хромосом был завершен, синтез остальных еще продолжается. [59]
См. также
[ редактировать ]Примечания
[ редактировать ]- ^ Штейн Р. (7 мая 2015 г.). «Печать ДНК — большое благо для исследований, но некоторые вызывают опасения» . Все учтено . Национальное общественное радио.
- ^ Jump up to: а б Хорана Х.Г., Агарвал К.Л., Бючи Х., Карутерс М.Х., Гупта Н.К., Клеппе К. и др. (декабрь 1972 г.). «Исследования полинуклеотидов. 103. Тотальный синтез структурного гена рибонуклеиновой кислоты, переносящей аланин, из дрожжей». Журнал молекулярной биологии . 72 (2): 209–17. дои : 10.1016/0022-2836(72)90146-5 . ПМИД 4571075 .
- ^ Jump up to: а б Итакура К., Хиросе Т., Креа Р., Риггс А.Д., Хейнекер Х.Л., Боливар Ф., Бойер Х.В. (декабрь 1977 г.). «Экспрессия в Escherichia coli химически синтезированного гена гормона соматостатина». Наука 198 (4321): 1056–63. Бибкод : 1977Научный... 198.1056I дои : 10.1126/science.412251 . ПМИД 412251 .
- ^ Jump up to: а б Edge MD, Green AR, Heathcliffe GR, Meacock PA, Schuch W, Scanlon DB и др. (август 1981 г.). «Полный синтез гена человеческого лейкоцитарного интерферона». Природа . 292 (5825): 756–62. Бибкод : 1981Natur.292..756E . дои : 10.1038/292756a0 . ПМИД 6167861 . S2CID 4330168 .
- ^ Шукман Д (27 марта 2014 г.). «Прогресс в области синтетической ДНК приветствуется» . Новости Би-би-си . Проверено 11 апреля 2020 г.
- ^ Кимото М., Ямасигэ Р., Мацунага К., Ёкояма С., Хирао И. (май 2013 г.). «Поколение аптамеров ДНК с высоким сродством с использованием расширенного генетического алфавита». Природная биотехнология . 31 (5): 453–7. дои : 10.1038/nbt.2556 . ПМИД 23563318 . S2CID 23329867 .
- ^ Малышев Д.А., Дхами К., Куах Х.Т., Лавернь Т., Ордуханян П., Торкамани А., Ромесберг Ф.Е. (июль 2012 г.). «Эффективная и независимая от последовательности репликация ДНК, содержащей третью пару оснований, создает функциональный шестибуквенный генетический алфавит» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (30): 12005–10. Бибкод : 2012PNAS..10912005M . дои : 10.1073/pnas.1205176109 . ПМК 3409741 . ПМИД 22773812 .
- ^ Малышев Д.А., Дхами К., Лавернь Т., Чен Т., Дай Н., Фостер Дж.М. и др. (май 2014 г.). «Полусинтетический организм с расширенным генетическим алфавитом» . Природа . 509 (7500): 385–8. Бибкод : 2014Natur.509..385M . дои : 10.1038/nature13314 . ПМК 4058825 . ПМИД 24805238 .
- ^ Jump up to: а б Фурманн М., Эртель В., Хегеманн П. (август 1999 г.). «Синтетический ген, кодирующий зеленый флуоресцентный белок (GFP), является универсальным репортером у Chlamydomonas Reinhardtii» . Заводской журнал . 19 (3): 353–61. дои : 10.1046/j.1365-313X.1999.00526.x . ПМИД 10476082 .
- ^ Мандеки В., Боллинг Т.Дж. (август 1988 г.). «Метод синтеза генов FokI». Джин . 68 (1): 101–7. дои : 10.1016/0378-1119(88)90603-8 . ПМИД 3265397 .
- ^ Стеммер В.П., Крамери А., Ха К.Д., Бреннан Т.М., Хейнекер Х.Л. (октябрь 1995 г.). «Одноэтапная сборка гена и всей плазмиды из большого количества олигодезоксирибонуклеотидов». Джин . 164 (1): 49–53. дои : 10.1016/0378-1119(95)00511-4 . ПМИД 7590320 .
- ^ Гао Икс, Йо П, Кейт А, Рэган Т.Дж., Харрис Т.К. (ноябрь 2003 г.). «Синтез генов на основе термодинамически сбалансированной ПЦР наизнанку (TBIO): новый метод разработки праймеров для высокоточной сборки более длинных последовательностей генов» . Исследования нуклеиновых кислот . 31 (22): 143д–143. дои : 10.1093/нар/gng143 . ПМК 275580 . ПМИД 14602936 .
- ^ Янг Л., Донг Кью (апрель 2004 г.). «Двухэтапный метод тотального синтеза генов» . Исследования нуклеиновых кислот . 32 (7): е59. дои : 10.1093/нар/gnh058 . ПМК 407838 . ПМИД 15087491 .
- ^ Хиллсон, Нью-Джерси, Розенгартен Р.Д., Кислинг Дж.Д. (январь 2012 г.). «Программное обеспечение для автоматизации проектирования сборок j5 DNA» . ACS Синтетическая биология . 1 (1): 14–21. дои : 10.1021/sb2000116 . ПМИД 23651006 .
- ^ Гувер Д.М., Лубковски Дж. (май 2002 г.). «DNAWorks: автоматизированный метод создания олигонуклеотидов для синтеза генов на основе ПЦР» . Исследования нуклеиновых кислот . 30 (10): 43д–43. дои : 10.1093/нар/30.10.e43 . ПМЦ 115297 . ПМИД 12000848 .
- ^ Вильялобос А., Несс Дж. Э., Густафссон С., Миншалл Дж., Говиндараджан С. (июнь 2006 г.). «Генный дизайнер: инструмент синтетической биологии для конструирования искусственных сегментов ДНК» . БМК Биоинформатика . 7 : 285. дои : 10.1186/1471-2105-7-285 . ПМЦ 1523223 . ПМИД 16756672 .
- ^ Тянь Дж., Гун Х., Шэн Н., Чжоу Х., Гулари Э., Гао Х., Чёрч Дж. (декабрь 2004 г.). «Точный мультиплексный синтез генов из программируемых ДНК-микрочипов» (PDF) . Природа . 432 (7020): 1050–4. Бибкод : 2004Natur.432.1050T . дои : 10.1038/nature03151 . hdl : 2027.42/62677 . ПМИД 15616567 . S2CID 4373350 .
- ^ Мацас М., Сталер П.Ф., Кефер Н., Зибельт Н., Буагерен В., Леонард Дж.Т. и др. (декабрь 2010 г.). «Высокоточный синтез генов путем извлечения ДНК с проверенной последовательностью, идентифицированной с помощью высокопроизводительного пиросеквенирования» . Природная биотехнология . 28 (12): 1291–4. дои : 10.1038/nbt.1710 . ПМЦ 3579223 . ПМИД 21113166 .
- ^ Шварц Джей-Джей, Ли С., Шендюр Дж. (сентябрь 2012 г.). «Точный синтез генов с помощью меточного поиска молекул ДНК с проверенной последовательностью» . Природные методы . 9 (9): 913–5. дои : 10.1038/nmeth.2137 . ПМЦ 3433648 . ПМИД 22886093 .
- ^ Вайдман С (06 декабря 2017 г.). «Расширение генетического алфавита» . Блог . Гарвардский университет . Проверено 17 апреля 2020 г.
- ^ «Справка: Синтетическая биология — parts.igem.org» . www.parts.igem.org . Проверено 11 апреля 2020 г.
- ^ Jump up to: а б с Казини А., Сторч М., Болдуин Г.С., Эллис Т. (сентябрь 2015 г.). «Кирпичики и чертежи: методы и стандарты сборки ДНК» . Обзоры природы. Молекулярно-клеточная биология . 16 (9): 568–76. дои : 10.1038/nrm4014 . hdl : 10044/1/31281 . ПМИД 26081612 . S2CID 3502437 .
- ^ Найт Т. (2003). «Идемпотентный векторный дизайн для стандартной сборки биокирпичей». Рабочая группа Массачусетского технологического института по синтетической биологии . hdl : 1721.1/21168 .
- ^ Рёкке Г., Корвальд Э., Пар Дж., Ойос О., Лале Р. (2014). «Стандарты и методы сборки BioBrick и сопутствующие программные инструменты». В Валла С., Лале Р. (ред.). Методы клонирования и сборки ДНК . Методы молекулярной биологии. Том. 1116. Клифтон, Нью-Джерси, стр. 1–24. дои : 10.1007/978-1-62703-764-8_1 . ISBN 978-1-62703-763-1 . ПМИД 24395353 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Найт Т (19 ноября 2008 г.). «Проект стандарта на биологические детали Biobrick BB-2». ББФ РФЦ . 12 . hdl : 1721.1/45139 .
- ^ Андерсон Дж.К., Дюбер Дж.Э., Легия М., Ву Г.К., Голер Дж.А., Аркин А.П., Кислинг Дж.Д. (январь 2010 г.). «BglBricks: гибкий стандарт сборки биологических деталей» . Журнал биологической инженерии . 4 (1): 1. дои : 10.1186/1754-1611-4-1 . ПМК 2822740 . ПМИД 20205762 .
- ^ Филлипс I, Сильвер П (20 апреля 2006 г.). «Новая стратегия сборки биокирпичиков, разработанная для упрощенной белковой инженерии» . hdl : 1721.1/32535 .
- ^ Грюнберг Р., Арндт К., Мюллер К. (18 апреля 2009 г.). «Стандарт сборки биокирпича Fusion Protein (Фрайбург)». ББФ РФЦ . 25 . hdl : 1721.1/45140 .
- ^ Шетти Р., Лизаразо М., Реттберг Р., Найт Т.Ф. (2011). «Сборка стандартных биологических частей BioBrick с использованием сборки из трех антибиотиков». Синтетическая биология, Часть B — Компьютерный дизайн и сборка ДНК . Методы энзимологии. Том. 498. стр. 311–26. дои : 10.1016/B978-0-12-385120-8.00013-9 . hdl : 1721.1/65066 . ISBN 9780123851208 . ПМИД 21601683 .
- ^ Спир М.А., Ричард Т.Л. (декабрь 2011 г.). «Сборка амплифицированных вставок: оптимизированный подход к стандартной сборке генетических цепей BioBrickTM» . Журнал биологической инженерии . 5 (1): 17. дои : 10.1186/1754-1611-5-17 . ПМК 3287150 . ПМИД 22176971 .
- ^ Jump up to: а б Ли М.В., Шукла Д., Роудс Б.Х., Лалл А., Шу Дж., Мориарити Б.С., Ларгаэспада Д.А. (24 июня 2014 г.). «Система сборки векторов HomeRun: гибкая и стандартизированная система клонирования для сборки многомодульных конструкций ДНК» . ПЛОС ОДИН . 9 (6): e100948. Бибкод : 2014PLoSO...9j0948L . дои : 10.1371/journal.pone.0100948 . ПМК 4069157 . ПМИД 24959875 .
- ^ Лю Дж.К., Чен В.Х., Рен С.С., Чжао Г.П., Ван Дж. (20 октября 2014 г.). «iBrick: новый стандарт итеративной сборки биологических частей с помощью самонаводящихся эндонуклеаз» . ПЛОС ОДИН . 9 (10): е110852. Бибкод : 2014PLoSO...9k0852L . дои : 10.1371/journal.pone.0110852 . ПМК 4203835 . ПМИД 25329380 .
- ^ Jump up to: а б Энглер С., Кандзия Р., Марилоннет С. (05.11.2008). «Один горшок, один шаг, прецизионный метод клонирования с высокой производительностью» . ПЛОС ОДИН . 3 (11): е3647. Бибкод : 2008PLoSO...3.3647E . дои : 10.1371/journal.pone.0003647 . ПМК 2574415 . ПМИД 18985154 .
- ^ Вебер Э., Энглер С., Грюцнер Р., Вернер С., Марилоннет С. (февраль 2011 г.). «Модульная система клонирования для стандартизированной сборки мультигенных конструкций» . ПЛОС ОДИН . 6 (2): e16765. Бибкод : 2011PLoSO...616765W . дои : 10.1371/journal.pone.0016765 . ПМК 3041749 . ПМИД 21364738 .
- ^ Кляйн К.А., Эмде Л., Куйперс А., Собецко П. (17 октября 2019 г.). «MoCloFlex: модульная, но гибкая система клонирования» . Границы биоинженерии и биотехнологии . 7 : 271. дои : 10.3389/fbioe.2019.00271 . ПМК 6843054 . ПМИД 31750294 .
- ^ Мур С.Дж., Лай Х.Э., Келвик Р.Дж., Чи С.М., Белл DJ, Полицци К.М., Фримонт PS (октябрь 2016 г.). «EcoFlex: многофункциональный набор MoClo для синтетической биологии E. coli» . ACS Синтетическая биология . 5 (10): 1059–1069. doi : 10.1021/acsynbio.6b00031 . hdl : 10044/1/31290 . ПМИД 27096716 .
- ^ Крозе П., Наварро Ф.Дж., Уиллмунд Ф., Мехршахи П., Баковски К., Лауэрсен К.Дж. и др. (сентябрь 2018 г.). «Рождение фотосинтетического шасси: набор инструментов MoClo, обеспечивающий синтетическую биологию микроводорослей Chlamydomonas Reinhardtii» . ACS Синтетическая биология . 7 (9): 2074–2086. дои : 10.1021/acsynbio.8b00251 . ПМИД 30165733 . S2CID 52131500 .
- ^ Рис-Хойс Дж.С., Уолхаут А.Дж. (январь 2018 г.). «Шлюзовое рекомбинационное клонирование» . Протоколы Колд-Спринг-Харбора . 2018 (1): pdb.top094912. дои : 10.1101/pdb.top094912 . ПМК 5935001 . ПМИД 29295908 .
- ^ Сасаки Ю., Соне Т., Ёсида С., Яхата К., Хотта Дж., Чеснат Дж.Д. и др. (февраль 2004 г.). «Доказательства высокой специфичности и эффективности сигналов множественной рекомбинации при клонировании смешанной ДНК с помощью системы Multisite Gateway» . Журнал биотехнологии . 107 (3): 233–43. doi : 10.1016/j.jbiotec.2003.10.001 . ПМИД 14736459 .
- ^ Колломс С.Д., Меррик К.А., Олорунниджи Ф.Дж., Старк В.М., Смит М.С., Осборн А. и др. (февраль 2014 г.). «Сборка и модификация быстрого метаболического пути с использованием сайт-специфической рекомбинации серининтегразы» . Исследования нуклеиновых кислот . 42 (4): е23. дои : 10.1093/нар/gkt1101 . ПМЦ 3936721 . ПМИД 24225316 .
- ^ Чжан Л., Чжао Г., Дин Икс (3 ноября 2011 г.). «Тандемная сборка кластера генов биосинтеза эпотилона путем сайт-специфической рекомбинации in vitro» . Научные отчеты . 1 (1): 141. Бибкод : 2011NatSR...1E.141Z . дои : 10.1038/srep00141 . ПМК 3216622 . ПМИД 22355658 .
- ^ Гибсон Д.Г., Янг Л., Чуанг Р.Ю., Вентер Дж.К., Хатчисон К.А., Смит Х.О. (май 2009 г.). «Ферментативная сборка молекул ДНК размером до нескольких сотен килобаз» . Природные методы . 6 (5): 343–5. дои : 10.1038/nmeth.1318 . ПМИД 19363495 . S2CID 1351008 .
- ^ Цюань Дж, Тянь Дж (июль 2009 г.). «Круговое клонирование полимеразным расширением сложных генных библиотек и путей» . ПЛОС ОДИН . 4 (7): е6441. Бибкод : 2009PLoSO...4.6441Q . дои : 10.1371/journal.pone.0006441 . ПМЦ 2713398 . ПМИД 19649325 .
- ^ Ли М.З., Элледж С.Дж. (март 2007 г.). «Использование гомологичной рекомбинации in vitro для создания рекомбинантной ДНК с помощью SLIC» . Природные методы . 4 (3): 251–6. дои : 10.1038/nmeth1010 . ПМИД 17293868 . S2CID 30893882 .
- ^ Чжан Ю, Верлинг Ю, Эдельманн В (апрель 2012 г.). «SLiCE: новый метод клонирования ДНК на основе экстракта бактериальных клеток» . Исследования нуклеиновых кислот . 40 (8): е55. дои : 10.1093/nar/gkr1288 . ПМЦ 3333860 . ПМИД 22241772 .
- ^ «Как Gibson Assembly® меняет синтетическую биологию» . Биолаборатории Новой Англии . Проверено 14 апреля 2020 г.
- ^ Казини А., Макдональд Дж.Т., Де Йонге Дж., Христодулу Дж., Фримонт П.С., Болдуин Г.С., Эллис Т. (январь 2014 г.). «Конструирование ДНК в одном горшке для синтетической биологии: стратегия модульной сборки с перекрытием и линкерами (MODAL)» . Исследования нуклеиновых кислот . 42 (1): e7. дои : 10.1093/нар/gkt915 . ПМЦ 3874208 . ПМИД 24153110 .
- ^ Jump up to: а б с д Сторч М., Казини А., Макроу Б., Флеминг Т., Трюитт Х., Эллис Т., Болдуин Г.С. (июль 2015 г.). «BASIC: новый стандарт сборки Biopart для идемпотентного клонирования обеспечивает точную одноуровневую сборку ДНК для синтетической биологии» . ACS Синтетическая биология . 4 (7): 781–7. дои : 10.1021/sb500356d . hdl : 10044/1/29939 . ПМИД 25746445 .
- ^ «Протокол Ассамблеи Гибсона» . Аддген . Проверено 14 апреля 2020 г.
- ^ Эль Каруи М., Ойос-Флайт М., Флетчер Л. (2019). «Будущие тенденции в синтетической биологии – отчет» . Границы биоинженерии и биотехнологии . 7 : 175. дои : 10.3389/fbioe.2019.00175 . ПМК 6692427 . ПМИД 31448268 .
- ^ Косури С., генеральный директор Церкви (май 2014 г.). «Крупномасштабный синтез ДНК de novo: технологии и приложения» (PDF) . Природные методы . 11 (5): 499–507. дои : 10.1038/nmeth.2918 . ПМК 7098426 . ПМИД 24781323 .
- ^ Лартиг С., Гласс Дж.И., Альперович Н., Пипер Р., Пармар П.П., Хатчисон К.А. и др. (август 2007 г.). «Трансплантация генома бактерий: замена одного вида на другой». Наука . 317 (5838): 632–8. Бибкод : 2007Sci...317..632L . CiteSeerX 10.1.1.395.4374 . дои : 10.1126/science.1144622 . ПМИД 17600181 . S2CID 83956478 .
- ^ Пилкингтон Э (6 октября 2009 г.). «Я создаю искусственную жизнь, — заявляет генный пионер США» . Хранитель . Лондон. Архивировано из оригинала 28 мая 2010 года . Проверено 22 мая 2010 г.
- ^ Пенниси, Э. (21 мая 2010 г.). «Синтетический геном приносит новую жизнь бактериям» (PDF) . Наука . 328 (5981): 958–9. дои : 10.1126/science.328.5981.958 . ПМИД 20488994 . Архивировано (PDF) из оригинала 25 мая 2010 года . Проверено 21 мая 2010 г.
- ^ «Как ученые создали «искусственную жизнь» » . Новости Би-би-си . 20 мая 2010 г. Архивировано из оригинала 1 июня 2013 года . Проверено 21 мая 2010 г.
- ^ «Дрожжи 2.0» . Коллекция природных коммуникаций . Спрингер Натюр Лимитед. 22 мая 2018 года . Проверено 17 апреля 2020 г.
- ^ Шукман Д. (27 марта 2014 г.). «Ученые приветствуют прогресс синтетических хромосом» . Новости Би-би-си . Проверено 28 марта 2014 г.
- ^ Анналуру Н., Мюллер Х., Митчелл Л.А., Рамалингам С., Стракваданио Г., Ричардсон С.М. и др. (апрель 2014 г.). «Полный синтез функционального конструктора эукариотической хромосомы» . Наука 344 (6179): 55–8. Бибкод : 2014Наука...344... 55А дои : 10.1126/science.1249252 . ПМЦ 4033833 . ПМИД 24674868 .
- ↑ Специальный выпуск «СИНТЕТИЧЕСКИЙ ГЕНОМ ДРОЖЖЕЙ» Science, 10 марта 2017 г.Том 355, Выпуск 6329