Диметиламин
| |

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
N -Метилметанамин | |
| Другие имена
(Диметил)амин
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| 3DMeet | |
| 605257 | |
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.004.272 |
| Номер ЕС |
|
| 849 | |
| КЕГГ | |
| МеШ | диметиламин |
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1032 |
Панель управления CompTox ( EPA )
|
|
| Характеристики [ 1 ] [ 2 ] | |
| (СН 3 ) 2 NH | |
| Молярная масса | 45.085 g·mol −1 |
| Появление | Бесцветный газ |
| Запах | Рыбный, аммиачный |
| Плотность | 649,6 кг м −3 (при 25 °С) |
| Температура плавления | −93,00 °С; −135,40 ° F; 180,15 К |
| Точка кипения | от 7 до 9 °С; от 44 до 48 °F; от 280 до 282 К |
| 1.540 кг л −1 | |
| войти P | −0.362 |
| Давление пара | 170,3 кПа (при 20 °С) |
Закон Генри
постоянная ( k H ) |
310 мкмоль Па −1 кг −1 |
| Основность (p K b ) | 3.29 |
| Термохимия | |
Стандартная энтальпия
образование (Δ f H ⦵ 298 ) |
от −21 до −17 кДж моль −1 |
| Опасности | |
| СГС Маркировка : | |
  
| |
| Опасность | |
| Х220 , Х302 , Х315 , Х318 , Х332 , Х335 | |
| П210 , П261 , П280 , П305+П351+П338 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | -6 ° C (21 ° F; 267 К) (жидкость) |
| 401 ° С (754 ° F; 674 К) | |
| Взрывоопасные пределы | 2.8–14.4% |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза )
|
698 мг/кг (крыса, перорально) 316 мг/кг (мыши, перорально) 240 мг/кг (кролик, перорально) 240 мг/кг (морская свинка, перорально) [ 4 ] |
ЛК 50 ( средняя концентрация )
|
4700 частей на миллион (крыса, 4 часа) 4540 частей на миллион (крыса, 6 часов) 7650 частей на миллион (мышь, 2 часа) [ 4 ] |
| NIOSH (пределы воздействия на здоровье в США): | |
ПЭЛ (допустимо)
|
СВВ 10 частей на миллион (18 мг/м 3 ) [ 3 ] |
РЕЛ (рекомендуется)
|
СВВ 10 частей на миллион (18 мг/м 3 ) [ 3 ] |
IDLH (Непосредственная опасность)
|
500 частей на миллион [ 3 ] |
| Родственные соединения | |
Родственные амины
|
|
Родственные соединения
|
|
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Диметиламин представляет собой органическое соединение формулы (CH 3 ) 2 NH. Этот вторичный амин представляет собой бесцветный горючий газ с аммиака запахом . Диметиламин обычно встречается в продаже в виде раствора в воде в концентрации примерно до 40%. По оценкам, в 2005 году было произведено 270 000 тонн. [ 5 ]
Структура и синтез
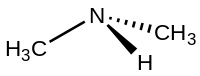
[ редактировать ]Молекула состоит из азота атома с двумя метильными заместителями и одним водородом . Диметиламин является слабым и рКа аммония - CH 3 основанием NH +
2 -CH 3 составляет 10,73, что выше метиламина (10,64) и триметиламина (9,79).
Диметиламин реагирует с кислотами с образованием солей, таких как гидрохлорид диметиламина, белое твердое вещество без запаха с температурой плавления 171,5 °C. Диметиламин получают каталитической реакцией метанола и аммиака при повышенных температурах и высоком давлении: [ 6 ]
- 2 СН 3 ОН + NH 3 → (СН 3 ) 2 NH + 2 H 2 O
Естественное явление
[ редактировать ]Диметиламин довольно широко распространен в животных и растениях и присутствует во многих продуктах питания на уровне нескольких мг/кг. [ 7 ]
Использование
[ редактировать ]Диметиламин является предшественником нескольких промышленно значимых соединений. [ 5 ] [ 8 ] Он реагирует с сероуглеродом с образованием диметилдитиокарбамата , предшественника бис(диметилдитиокарбамата) цинка и других химических веществ, используемых при вулканизации каучука серной . Диметиламиноэтоксиэтанол получают путем реакции диметиламина и оксида этилена . [ 9 ] Также доступны другие методы получения потоков, богатых этим веществом, которые затем необходимо дополнительно очистить. [ 10 ] Растворители диметилформамид и диметилацетамид являются производными диметиламина. Это сырье для производства многих агрохимикатов и фармацевтических препаратов , таких как димефокс и димедрол соответственно. Табун химического оружия . получают из диметиламина Поверхностно -активное вещество лаурилдиметиламиноксид содержится в мыле и чистящих средствах. Несимметричный диметилгидразин — ракетное топливо, получают из диметиламина. [ 11 ]
- (CH 3 ) 2 NH + NH 2 Cl → (CH 3 ) 2 NNH 2 ⋅ HCl
Это аттрактант для долгоносиков . [ 12 ]
Реакции
[ редактировать ]Это основное, как в Льюисе, так и в [ 13 ] [ 14 ] и чувства Бренстеда . легко образует соли диметиламмония При обработке кислотами . Депротонирование диметиламина можно осуществлять литийорганическими соединениями . Образующийся LiNMe 2 , имеющий кластерную структуру, служит источником Me 2 N. − . Этот амид лития использовался для получения летучих комплексов металлов, таких как тетракис(диметиламидо)титан и пентакис(диметиламидо)тантал .
Реагирует со многими карбонильными соединениями. Альдегиды дают аминали. Например, реакция диметиламина и формальдегида дает бис(диметиламино)метан : [ 15 ]
- 2 (СН 3 ) 2 NH + СН 2 О → [(СН 3 ) 2 N] 2 СН 2 + Н 2 О
Он превращает сложные эфиры в диметиламиды.
Безопасность
[ редактировать ]Диметиламин не очень токсичен и имеет следующие значения ЛД 50 : 736 мг/кг (мышь, внутрибрюшинно); 316 мг/кг (мыши, перорально); 698 мг/кг (крыса, перорально); 3900 мг/кг (крыса, кожно); 240 мг/кг (морская свинка или кролик, перорально). [ 16 ]
Хотя диметиламин не является остро токсичным, он подвергается нитрозированию с образованием диметилнитрозамина , канцерогена.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Диметиламин» . Интернет-книга NIST по химии . США: Национальный институт стандартов и технологий . Проверено 15 февраля 2022 г.
- ^ «Диметиламин 38931 – ≥99,0%» . Олдрич . Компания Сигма-Олдрич . Проверено 15 февраля 2022 г.
- ^ Перейти обратно: а б с Карманный справочник NIOSH по химическим опасностям. «#0219» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Перейти обратно: а б «Диметиламин» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Перейти обратно: а б Ван Гайзель, Август Б.; Мусин, Вилли (2000). «Метиламины». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a16_535 . ISBN 978-3527306732 .
- ^ Корбин ДР; Шварц С.; Зоннихсен Г.К. (1997). «Синтез метиламинов: обзор». Катализ сегодня . 37 (2): 71–102. дои : 10.1016/S0920-5861(97)00003-5 .
- ^ Нейрат, Великобритания; и др. (1977). «Первичные и вторичные амины в среде обитания человека». Пищевая и косметическая токсикология . 15 (4): 275–282. дои : 10.1016/s0015-6264(77)80197-1 . ПМИД 590888 .
- ^ Словарь промышленных химикатов Эшфорда , 3-е издание, 2011 г., страницы 3284-3286.
- ^ Франк, Х., 2007. Получение N, N-диметиламиноэтоксиэтанола путем взаимодействия диметиламина с оксидом этилена. Патент США.
- ^ US8907084B2 - Способ получения 2-(2-аминоэтокси) этанола (2AEE) и морфолина с 2AEE: морфолин >3 - Google Patents
- ^ Ширманн, Жан-Пьер; Бурдодук, Поль (2001). «Гидразин». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a13_177 . ISBN 3-527-30673-0 .
- ^ Индекс Merck, 10-е изд. (1983), стр.470, Рэуэй: Merck & Co.
- ^ Лоуренс, Кристиан; Ле Галль, Жан-Франсуа (2010). Шкалы основности и сродства Льюиса: данные и измерения . Оксфорд: Уайли-Блэквелл. стр. 50–51. ISBN 978-0-470-74957-9 .
- ^ Крамер, Р.Э.; Бопп, Т.Т. (1977). «Графическое отображение энтальпий образования аддуктов кислот и оснований Льюиса». Журнал химического образования . 54 : 612–613. дои : 10.1021/ed054p612 . На графиках, показанных в этой статье, использовались более старые параметры. Улучшенные параметры E&C перечислены в модели ECW .
- ^ Годри, Мишель; Жасор, Ив; Хак, Трунг Буи (1979). «Региоселективная конденсация Манниха с трифторацетатом диметил(метилен)аммония: 1-(диметиламино)-4-метил-3-пентанон». Орг. Синтез . 59 : 153. дои : 10.15227/orgsyn.059.0153 .
- ^ Профиль химической информации о диметиламиноборане, Национальная программа токсикологии, NIEHS, NIH (2008), стр. 4: http://ntp.niehs.nih.gov/ntp/htdocs/Chem_Background/ExSumPdf/DimethylamineBorane508.pdf
Внешние ссылки
[ редактировать ]- Международная карта химической безопасности 0260 (газ)
- Международная карта химической безопасности 1485 (водный раствор)
- Карманный справочник NIOSH по химическим опасностям. «#0219» . Национальный институт охраны труда и здоровья (NIOSH).
- Свойства от Air Liquide
- Паспорт безопасности на сайте airliquide.com
