Тройная точка

В термодинамике тройная точка вещества - это температура и давление , при которых три фазы ( газ , жидкость и твердость ) этого вещества сосуществуют в термодинамическом равновесии . [ 1 ] Это та температура и давление, при которых встречаются кривые сублимации , слияния и испарения . Например, тройная точка ртути происходит при температуре -38,8 ° C (-37,8 ° F) и давлении 0,165 м PA .
В дополнение к тройной точке для твердых, жидких и газовых фаз, тройная точка может включать более чем одну твердую фазу для веществ с несколькими полиморфами . Helium-4 необычен в том смысле, что он не имеет кривой сублимации/осаждения и, следовательно, нет тройных точек, где его твердая фаза соответствует своей газовой фазе. точку паровой жидкости Вместо этого он имеет суперфлюдную , точку с твердое жидкостью-суперфлюидом, точка с твердое солидным жидкостью и точку с твердым солидным суперфлюидом. Ни один из них не должен быть запутан с точкой лямбды , которая не является какой -либо тройной точкой.
Термин «тройная точка» был придуман в 1873 году Джеймсом Томсоном , братом лорда Кельвина . [ 2 ] Тройные точки нескольких веществ используются для определения точек в международной температурной шкале IT-90 , начиная от тройной точки водорода (13,8033 К) до тройной точки воды (273,16 К, 0,01 ° C или 32,018 ° F) Полем
До 2019 года тройная точка воды была использована для определения Кельвина , базовой единицы термодинамической температуры в международной системе единиц (SI). [ 3 ] Кельвин был определен таким образом, чтобы тройная точка воды составляла ровно 273,16 К, но это изменилось с пересмотром SI 2019 года , где Кельвин был переосмыслен, так что константа Больцмана - точно 1,380 649 × 10 −23 J⋅K −1 и тройная точка воды стала экспериментально измеренной постоянной.
Тройная точка воды
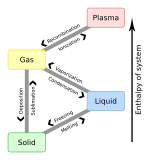
[ редактировать ]Газо -ликид -ссолидная тройная точка
[ редактировать ]
После пересмотра SI 2019 года значение тройной точки воды больше не используется в качестве определяющей точки. Однако его эмпирическое значение остается важным: уникальная комбинация давления и температуры, при которой сосуществует жидкая вода , твердый лед и водяной пары в стабильном равновесии, составляет приблизительно 273,16 ± 0,0001 [ 4 ] и давление паров 611,657 паскалей (6,11657 мбар; 0,00603659 атм). [ 5 ] [ 6 ]
Жидкая вода может существовать только при давлениях, равных или превышающей тройную точку. Ниже, в вакууме внешнего пространства , сплошной лед, сублимизируя , переходит непосредственно в водяной пары при нагревании при постоянном давлении. И наоборот, над тройной точкой, твердый лед сначала тает в жидкую воду при нагревании при постоянном давлении, а затем испаряется или кипит, образуя пара при более высокой температуре.
Для большинства веществ тройная точка газа -ликидна -твердая - минимальная температура, при которой жидкость может существовать. Для воды это не так. Точка плавления обычного льда уменьшается с давлением, как показано на пунктирной зеленой линии фазовой диаграммы . Чуть ниже тройной точки, сжатие при постоянной температуре трансформирует водяной пары сначала в твердый, а затем в жидкость.
Исторически, во время миссии Mariner 9 до Марса давление воды в тройной точке использовалось для определения «уровня моря». Теперь лазерная альтиметрия и гравитационные измерения предпочитают определить марсианскую высоту. [ 7 ]
Фазы высокого давления
[ редактировать ]При высоких давлениях вода имеет сложную фазовую диаграмму с 15 известными фазами льда и несколькими тройными точками, в том числе 10 координат которых показаны на диаграмме. Например, тройная точка при 251 К (-22 ° C) и 210 МПа (2070 атм) соответствует условиям для сосуществования льда IH (обычного льда), ICE III и жидкой воды, все в равновесии. Существуют также тройные точки для сосуществования трех твердых фаз, например , ICE II , ICE V и ICE VI при 218 К (-55 ° C) и 620 МПа (6120 атм).
Для тех форм льда высокого давления, которые могут существовать в равновесии с жидкостью, диаграмма показывает, что точки плавления увеличиваются с давлением. При температуре выше 273 К (0 ° C) увеличение давления на водяном паре сначала приводит к жидкой воде, а затем в форме льда высокого давления. В диапазоне 251–273 К , сначала образуется ICE I, затем жидкая вода, а затем ICE III или ICE V, за которыми следуют другие все еще более плотные формы высокого давления.

| Фазы в стабильном равновесии | Давление | Температура |
|---|---|---|
| Жидкая вода, лед пары и водяной | 611.657 [ 8 ] | 273,16 К (0,01 ° С) |
| Жидкая вода, лед и ice iii | 209,9 МПа | 251 К (-22 ° С) |
| Жидкая вода, ICE III и ICE V | 350,1 МПа | −17,0 ° C. |
| Жидкая вода, лед и лед | 632,4 МПа | 0,16 ° C. |
| Ice I H , Ice II и ICE III | 213 МПа | −35 ° C. |
| ICE II, ICE III и ICE V | 344 МПа | −24 ° C. |
| ICE II, ICE V и ICE VI | 626 МПа | −70 ° C. |
Клетки с тройной точкой
[ редактировать ]с тройной точкой используются в калибровке термометров . Клетки Для строгих работ клетки с тройной точкой обычно заполняются очень чистым химическим веществом, таким как водород, аргон, ртуть или вода (в зависимости от желаемой температуры). Чистота этих веществ может быть такова, что только одна часть в миллионе является загрязняющим веществом, называемой «шесть девян», потому что она на 99,9999% чисто. специфическая изотопная композиция (для воды, VSMow Используется ), потому что изменения в изотопном составе вызывают небольшие изменения в тройной точке. Клетки с тройными точками настолько эффективны в достижении высоко точных, воспроизводимых температур, что международный стандарт калибровочной системы для термометров, называемый его-90, зависит от трехточечных клеток водорода , неонового , кислорода , аргона , ртути и воды для разграничения шести его определенные температурные точки.
Таблица тройных точек
[ редактировать ]В этой таблице перечислены газо -лик -ликидные тройные точки нескольких веществ. Если не указано иное, данные поступают из Национального бюро стандартов США (теперь NIST , Национальный институт стандартов и технологий). [ 9 ]
| Вещество | T [ k ] ( ° C ) | P [ KPA ]* ( ATM ) |
|---|---|---|
| Ацетилен | 192,4 К (-80,7 ° C) | 120 кПа (1,2 атм) |
| Аммиак | 195,40 К (-77,75 ° C) | 6,060 кПа (0,05981 атм) |
| Аргон | 83,8058 K (-189,3442 ° C) | 68,9 кПа (0,680 атм) |
| Мышьяк | 1 090 К (820 ° С) | 3628 кПа (35,81 атм) |
| Бутан [ 10 ] | 134,6 К (-138,6 ° C) | 7 × 10 −4 KPA (6,9 × 10 −6 банкомат) |
| Углерод ( графит ) | 4765 К (4492 ° C) | 10 132 кПа (100,00 атм) |
| Углекислый газ | 216,55 К (-56,60 ° С) | 517 кПа (5,10 атм) |
| Угарный угарный газ | 68,10 К (-205 ° C) | 15,37 кПа (0,1517 атм) |
| Хлороформ [ 11 ] [ 12 ] | 209,61 К (-63,54 ° C) | ? |
| Дейтерий | 18,63 К (-254,52 ° C) | 17,1 кПа (0,169 атм) |
| Этан | 89,89 К (-183,26 ° C) | 1.1 × 10 −3 KPA (1,1 × 10 −5 банкомат) |
| Этанол [ 13 ] | 150 К (-123 ° C) | 4.3 × 10 −7 KPA (4,2 × 10 −9 банкомат) |
| Этилен | 104,0 К (-169,2 ° C) | 0,12 кПа (0,0012 атм) |
| Муравьиная кислота [ 14 ] | 281,40 К (8,25 ° С) | 2,2 кПа (0,022 атм) |
| Гелий-4 (пара [ 15 ] | 2.1768 K (-270,9732 ° C) | 5,048 кПа (0,04982 атм) |
| Гелий-4 ( HCP - BCC -HE-II) [ 16 ] | 1,463 К (-271,687 ° С) | 26,036 кПа (0,25696 атм) |
| Гелий-4 (BCC-HE-I-HE-II) [ 16 ] | 1,762 К (-271,388 ° C) | 29,725 кПа (0,29336 атм) |
| Гелий-4 (HCP-BCC-HE-I) [ 16 ] | 1,772 К (-271,378 ° С) | 30,016 кПа (0,29623 атм) |
| Гексафторуэтан [ 17 ] | 173,08 К (-100,07 ° C) | 26,60 кПа (0,2625 атм) |
| Водород | 13,8033 K (-259,3467 ° C) | 7,04 кПа (0,0695 атм) |
| Wydrogen-1 (профиль) [ 18 ] | 13,96 К (-259,19 ° С) | 7,18 кПа (0,0709 атм) |
| Хлорид водорода | 158,96 К (-114,19 ° C) | 13,9 кПа (0,137 атм) |
| Йод [ 19 ] | 386,65 К (113,50 ° C) | 12,07 кПа (0,1191 атм) |
| Изобутан [ 20 ] | 113,55 К (-159,60 ° C) | 1.9481 × 10 −5 KPA (1,9226 × 10 −7 банкомат) |
| Криптон | 115,76 К (-157,39 ° С) | 74,12 кПа (0,7315 атм) |
| Меркурий | 234.3156 K (-38,8344 ° C) | 1.65 × 10 −7 KPA (1,63 × 10 −9 банкомат) |
| Метан | 90,68 К (-182,47 ° C) | 11,7 кПа (0,115 атм) |
| Неон | 24.5561 K (-248,5939 ° C) | 43,332 кПа (0,42765 атм) |
| Оксид азота | 109,50 К (-163,65 ° C) | 21,92 кПа (0,2163 атм) |
| Азот | 63,18 К (-209,97 ° C) | 12,6 кПа (0,124 атм) |
| Оксид азота | 182,34 К (-90,81 ° C) | 87,85 кПа (0,8670 атм) |
| Кислород | 54,3584 K (-218,7916 ° C) | 0,14625 кПа (0,0014434 атм) |
| Палладий | 1825 К (1552 ° C) | 3.5 × 10 −3 KPA (3,5 × 10 −5 банкомат) |
| Платина | 2 045 К (1772 ° C) | 2 × 10 −4 KPA (2,0 × 10 −6 банкомат) |
| Радон | 202 К (-71 ° С) | 70 кПа (0,69 атм) |
| (моно) Силан [ 21 ] | 88,48 К (-184,67 ° С) | 0,019644 кПа (0,00019387 атм) |
| Диоксид серы | 197,69 К (-75,46 ° C) | 1,67 кПа (0,0165 атм) |
| Титан | 1 941 К (1668 ° C) | 5.3 × 10 −3 KPA (5,2 × 10 −5 банкомат) |
| Урановый гексафторид | 337,17 K (64,02 ° C) | 151,7 кПа (1,497 атм) |
| Вода [ 5 ] [ 6 ] | 273,16 К (0,01 ° С) | 0,611657 кПа (0,00603659 атм) |
| Ксенон | 161,3 К (-111,8 ° C) | 81,5 кПа (0,804 атм) |
| Цинк | 692,65 К (419,50 ° C) | 0,065 кПа (0,00064 атм) |
Примечания:
- Для сравнения типичное атмосферное давление составляет 101,325 кПа (1 атм).
- Перед новым определением единиц SI тройная точка Water, 273.16 K, было точным числом.
Смотрите также
[ редактировать ]Ссылки
[ редактировать ]- ^ Iupac , сборник химической терминологии , 2 -е изд. («Золотая книга») (1997). Онлайн -исправленная версия: (1994) « Тройная точка ». doi : 10.1351/goldbook.t06502 .
- ^ Джеймс Томсон (1873) «Количественное исследование определенных отношений между газообразной, жидкостью и твердыми состояниями водного составления» , Труды Королевского общества , 22 : 27–36. Из сноски на стр. 28: «... три кривых встретятся или пересекают друг друга в одной точке, которую я назвал тройной точкой ».
- ^ Определение Кельвина в BIPM.
- ^ «Брошюра SI: Международная система единиц (SI) - 9 -е издание» . BIPM . Получено 21 февраля 2022 года .
- ^ Jump up to: а беременный Международные уравнения для давления вдоль плавления и вдоль кривой сублимации обычного водного вещества . W. Wagner, A. Saul and A. Pruss (1994), J. Phys. Химический Рефери Данные, 23 , 515.
- ^ Jump up to: а беременный Мерфи, Д.М. (2005). «Обзор давления в паре льда и воду из переохлаждения для атмосферных применений» . Ежеквартальный журнал Королевского метеорологического общества . 131 (608): 1539–1565. Bibcode : 2005qjrms.131.1539m . doi : 10.1256/QJ.04.94 . S2CID 122365938 .
- ^ Карр, Майкл Х. (2007). Поверхность Марса . Издательство Кембриджского университета. п. 5 ISBN 978-0-521-87201-0 .
- ^ Мерфи, Д.М. (2005). «Обзор давления в паре льда и воду из переохлаждения для атмосферных применений» . Ежеквартальный журнал Королевского метеорологического общества . 131 (608): 1539–1565. Bibcode : 2005qjrms.131.1539m . doi : 10.1256/QJ.04.94 . S2CID 122365938 .
- ^ Сенгель, Юнус А.; Тернер, Роберт Х. (2004). Основы тепловых наук . Бостон: МакГроу-Хилл. п. 78. ISBN 0-07-297675-6 .
- ^ См. Бутан (страница данных)
- ^ См . Хлороформ (страница данных)
- ^ «Трихлорметан» . Nist Chemistry Webbook, SRD 69 . NIST (Национальный институт науки и техники) . Получено 11 мая 2024 года .
- ^ См . Этанол (страница данных)
- ^ См. Commin Acid (страница данных)
- ^ Доннелли, Рассел Дж.; Баренги, Карло Ф. (1998). «Наблюдаемые свойства жидкого гелия при насыщенном давлении паров». Журнал физических и химических справочных данных . 27 (6): 1217–1274. Bibcode : 1998jpcrd..27.1217d . doi : 10.1063/1,556028 .
- ^ Jump up to: а беременный в Hoffer, JK; Гарднер, WR; Waterfield, CG; Филлипс, NE (апрель 1976 г.). "Термодинамические свойства 4 Он. II Фаза BCC и фазы PT и VT ниже 2 K ». Журнал физики низкой температуры . 23 (1): 63–102. Bibcode : 1976jltp ... 23 ... 63h . DOI : 10.1007/bf00117245 . S2CID 120473493 Полем
- ^ См. Hexafluoroethane (страница данных)
- ^ «Протиум | Изотоп | Британская» . 27 января 2024 года.
- ^ Валас, С.М. (1990). Химический процесс оборудование - выбор и дизайн . Амстердам: Elsevier. п. 639. ISBN 0-7506-7510-1 .
- ^ См. Isobutane (страница данных)
- ^ «Энциклопедия силанового газа» . Газовая энциклопедия . Воздушная жидкость.
Внешние ссылки
[ редактировать ] СМИ, связанные с Triple Point в Wikimedia Commons
СМИ, связанные с Triple Point в Wikimedia Commons