Ртуть (ii) тиоцианат
| |

| |
| Имена | |
|---|---|
| Другие имена
Меркурический тиоцианат
Меркурический сульфоцианат | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Echa Infocard | 100.008.886 |
| ЕС номер |
|
PubChem CID
|
|
| НЕКОТОРЫЙ | |
Comptox Dashboard ( EPA )
|
|
| Характеристики | |
| HG (SCN) 2 | |
| Молярная масса | 316.755 g/mol |
| Появление | Белый моноклинный порошок |
| Запах | без запаха |
| Плотность | 3,71 г/см 3 , твердый |
| Точка плавления | 165 ° C (329 ° F; 438 K) (разлагается) |
| 0,069 г/100 мл | |
| Растворимость | Растворимый в разбавленной соляной кислоте , KCN , аммиак Слегка растворим в алкоголе , эфир |
| −96.5·10 −6 см 3 /мол | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности
|
Высокомеренный |
| GHS Маркировка : [ 1 ] | |
  
| |
| Опасность | |
| H300 , H310 , H330 , H373 , H410 | |
| P260 , P262 , P270 , P271 , P273 , P280 , P284 , P301+P316 , P302+P352 , P304+P340 , P316 , P319 , P320 , P321 , P330 , P364 P361 , , P391, P4033333333333333333333333, p361 , P391 P364 , P33333333333 , , P391, P33333333333333, P361, P364 , стр. , P361 | |
| NFPA 704 (Огненная бриллиант) | |
| Смертельная доза или концентрация (LD, LC): | |
Ld 50 ( средняя доза )
|
46 мг/кг (крыса, устное) |
За исключением случаев, когда отмечены, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа).
| |
Ртуть (ii) тиоцианат (Hg (SCN) 2 ) является неорганическим химическим соединением , координационный комплекс HG 2+ и тиоцианатный анион . Это белый порошок. При воспламенении он будет производить большую, извилистую «змею», эффект, известный как змея фараона . [ 2 ]
Синтез и структура
[ редактировать ]Первый синтез миоцианата ртути был, вероятно, был завершен в 1821 году Йенсом Джейкобом Берзелиусом :
- HGO + 2 HSCN → HG (SCN) 2 + H 2 O
Доказательства первого чистого образца были представлены в 1866 году, приготовленное химиком по имени Отто Хермес. [ 2 ] Он готовится лечением решений, содержащих ионы ртути (II) и тиоцианата. Низкая растворимость продукта тиоцианата ртути заставляет его осаждать из раствора. [ 3 ] Большинство синтезов достигаются путем осадков:
- HG (№ 3 ) 2 + 2 KSCN → HG (SCN) 2 + 2Kno 3
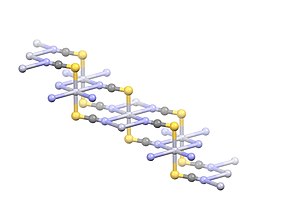
Соединение принимает полимерную структуру с HG 2+ Центры линейно координировались с двумя атомами S с расстоянием 2,381 Å. Четыре слабых Hg 2+ --N взаимодействия обозначены расстояниями 2,81 Å. [ 4 ]
Использование
[ редактировать ]Меркурий тиоцианат имеет несколько применений в химическом синтезе. Это предшественник других тиоцианатных комплексов , таких как калий Трис (тиоцианато) ртуть (II) (k [Hg (SCN) 3 ]) и цезий -трис (тиоцианато) ртуть (II) (CS [HG (SCN) 3 ]). HG (SCN) 3 − Ион также может существовать независимо и легко генерируется из приведенных выше соединений. [ 5 ]
Его реакции с органическими галогениками дают два продукта, один с серной, связанной с органическим соединением, и один с азотом, связанным с органическим соединением. [ 6 ]
Использование в анализе хлорида
[ редактировать ]Было обнаружено, что ртутный тиоцианат может улучшить пределы обнаружения при определении ионов хлорида в воде с помощью УФ-видимой спектроскопии . Этот метод был впервые предложен в 1952 году и был стандартным методом определения хлоридных ионов в лабораториях по всему миру с тех пор. Автоматизированная система была изобретена в 1964 году, а затем коммерческий цветовой анализатор был доступен в 1974 году Technicon ( Tarrytown, NY , USA). Основной механизм включает добавление миоцианата ртути к раствору с неизвестной концентрацией хлоридных ионов и железа в качестве реагента . Ионы хлорида вызывают литую тиоцианату -миоцианата ртути, а ион тиоцианата связываю Fe (III), что интенсивно поглощается при 450 нм. Это поглощение позволяет измерять концентрацию комплекса железа. Это значение позволяет рассчитать концентрацию хлорида. [ 7 ]
Это может определить концентрацию хлоридных ионов в водном растворе. Тиоцианат ртуть без железа (III) добавляется в раствор с неизвестной концентрацией хлоридных ионов, образуя комплекс тиоцианата ртути и иона хлорида, который поглощает свет при 254 нм, что позволяет более точные измерения внимания, чем вышеупомянутый метод, используя железо. [ 7 ]
Змей фараона
[ редактировать ]
Меркурий тиоцианат ранее использовался в пиротехнике, вызывая эффект, известный как змея фараона или змея фараона. Когда соединение находится в присутствии достаточно сильного источника тепла, быстрое, экзотермическое реакцию , которая производит большую массу намоточки, запускается твердое твердое твердое вещество. Неясное пламя, которое часто синее, но также может быть желтым/оранжевым, сопровождает сгорание. Полученная сплошная может варьироваться от темного графита до серого до светлого цвета в цвете, а внутренняя часть, как правило, намного темнее, чем снаружи. [ 2 ]
Реакция имеет несколько этапов следующим образом: [ 8 ] Зажигание миоцианата ртуть заставляет его образовывать нерастворимую коричневую массу, которая в основном является нитридом углерода , C 3 N 4 . Ртуть сульфид и дисульфид углерода также производятся.
Ссылки
[ редактировать ]- ^ «Меркурический тиоцианат (соединение)» . pubchem.ncbi.nlm.nih.gov . Получено 31 мая 2023 года .
- ^ Jump up to: а беременный в Дэвис, TL (1940). «Пиротехнические змеи». Журнал химического образования . 17 (6): 268–270. doi : 10.1021/ed017p268 .
- ^ Sekine, T.; Исии Т. (1970). «Исследования систем перегородки жидкости. VIII. Извлечение растворителя хлорида ртути (II), бромида, йодида и тиоцианата с некоторыми органическими растворителями» . Бюллетень химического общества Японии . 43 (8): 2422–2429. doi : 10.1246/bcsj.43.2422 .
- ^ Beauchamp, Al; Goutier, D. «Структура Cristalline et moleculaire du Тиоцианат Mercuric» Канадский журнал химии 1972, том 50, p977-p981. Два : 10.1139/V72-153
- ^ Bowmaker, GA; Churakov, Av; Харрис, RK; Говард, Джейк; Apperley, DC (1998). "Твердовое состояние 199 HG MAS ЯМР исследования комплексов тиоцианата ртути (II) и связанных с ними соединений. Кристаллическая структура Hg (Secn) 2 ". Неорганическая химия . 37 (8): 1734–1743. DOI : 10.1021/IC9700112 .
- ^ Китамура, Т.; Kobayashi, S.; Танигучи, Х. (1990). «Фотолиз виниловых галогенидов. Реакция фотогенерированных виниловых катионов с циановым и тиоцианатным ионами». Журнал органической химии . 55 (6): 1801–1805. doi : 10.1021/jo00293a025 .
- ^ Jump up to: а беременный Cirello-egamino, J.; Brindle, Id (1995). «Определение хлоридных ионов путем реакции с тиоцианатом ртути в отсутствие железа (III) с использованием УФ-фотометрического метода инъекции потока». Аналитик 120 (1): 183–186. doi : 10.1039/an9952000183 .
- ^ «Сделайте фейерверк змеи фараона» . О образовании . Архивировано из оригинала 2012-02-01 . Получено 2016-02-08 .
Внешние ссылки
[ редактировать ]- «Змея фараона» . YouTube . 2 сентября 2008 г.
- «Как сделать змей фараона (ртуть (ii) тиоцианат)» . YouTube . 24 марта 2014 года
