Электрокортикография
| Электрокортикография | |
|---|---|
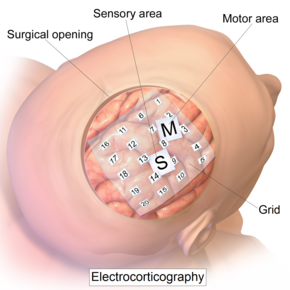 Внутричерепная электродная сетка для электрокортикографии. | |
| Синонимы | Внутричерепная электроэнцефалография |
| Цель | запись электрической активности коры головного мозга (инвазивный метод). |
Электрокортикография ( ЭКоГ ), разновидность внутричерепной электроэнцефалографии ( иЭЭГ ), представляет собой тип электрофизиологического мониторинга, при котором используются электроды, помещаемые непосредственно на открытую поверхность мозга для регистрации электрической активности коры головного мозга . Напротив, обычные электроды электроэнцефалографии (ЭЭГ) контролируют эту активность снаружи черепа. ЭКоГ может проводиться как в операционной во время операции (интраоперационная ЭКоГ), так и вне операции (экстраоперационная ЭКоГ). Поскольку для имплантации электродной сетки требуется краниотомия (хирургический разрез черепа), ЭКоГ является инвазивной процедурой.
История
[ редактировать ]ECoG была впервые разработана в начале 1950-х годов Уайлдером Пенфилдом и Гербертом Джаспером , нейрохирургами из Монреальского неврологического института . [1] Они разработали ECoG в рамках своей новаторской монреальской процедуры — хирургического протокола, используемого для лечения пациентов с тяжелой эпилепсией . Корковые потенциалы, зарегистрированные с помощью ЭКоГ, использовались для выявления эпилептогенных зон — участков коры, генерирующих эпилептические припадки . Эти зоны затем будут хирургически удалены из коры во время резекции, тем самым разрушая ткань мозга, в которой возникли эпилептические припадки. Пенфилд и Джаспер также использовали электростимуляцию во время записи ЭКоГ у пациентов, перенесших операцию по поводу эпилепсии под местной анестезией . [2] Эта процедура использовалась для изучения функциональной анатомии головного мозга, картирования речевых областей и определения соматосенсорных и соматомоторных областей коры, которые необходимо исключить из хирургического удаления.Доктор по имени Роберт Гэлбрейт Хит также был одним из первых исследователей мозга в Медицинской школе Университета Тулейна . [3] [4]
Электрофизиологические основы
[ редактировать ]Сигналы ЭКоГ состоят из синхронизированных постсинаптических потенциалов ( потенциалов локального поля ), регистрируемых непосредственно с открытой поверхности коры. Потенциалы возникают в основном в кортикальных пирамидных клетках и поэтому должны пройти через несколько слоев коры головного мозга, спинномозговой жидкости (СМЖ), мягкой мозговой оболочки и паутинной оболочки , прежде чем достичь субдуральных записывающих электродов, расположенных чуть ниже твердой мозговой оболочки (наружной черепной мембраны). . Однако, чтобы достичь скальповых электродов обычной электроэнцефалограммы (ЭЭГ), электрические сигналы также должны проходить через череп , где потенциалы быстро затухают из-за низкой проводимости костей . По этой причине пространственное разрешение ЭКоГ намного выше, чем ЭЭГ, что является важным преимуществом визуализации для дооперационного планирования. [5] ECoG обеспечивает временное разрешение примерно 5 мс и пространственное разрешение всего 1–100 мкм. [6]
При использовании глубинных электродов потенциал локального поля дает меру нейронной популяции в сфере радиусом 0,5–3 мм вокруг кончика электрода. [7] При достаточно высокой частоте дискретизации (более примерно 10 кГц) глубинные электроды также позволяют измерять потенциалы действия . [8] При этом пространственное разрешение зависит от отдельных нейронов, а поле зрения отдельного электрода составляет примерно 0,05–0,35 мм. [7]
Процедура
[ редактировать ]Запись ЭКоГ осуществляется с электродов, помещенных на обнаженную кору. Чтобы получить доступ к коре головного мозга, хирург должен сначала выполнить краниотомию, удалив часть черепа, чтобы обнажить поверхность мозга. Эта процедура может выполняться либо под общей анестезией , либо под местной анестезией, если для функционального картирования коры требуется взаимодействие с пациентом. Затем на поверхность коры головного мозга хирургическим путем имплантируют электроды, размещение которых определяется результатами предоперационной ЭЭГ и магнитно-резонансной томографии (МРТ). Электроды могут располагаться либо за пределами твердой мозговой оболочки (эпидуральная анестезия), либо под твердой мозговой оболочкой (субдуральная анестезия). Матрицы электродов ECoG обычно состоят из шестнадцати стерильных одноразовых электродов из нержавеющей стали с углеродистыми наконечниками, платины, платино-иридиевого сплава или золотых шариковых электродов, каждый из которых установлен на шаровом шарнире для облегчения позиционирования. Эти электроды прикреплены к вышележащей рамке в конфигурации «корона» или «ореол». [9] Субдуральные ленточные и сетчатые электроды также широко используются в различных размерах: от 4 до 256. [10] контакты электродов. Сетки прозрачные, гибкие и пронумерованы на каждом контакте электродов. Стандартное расстояние между сеточными электродами составляет 1 см; отдельные электроды обычно имеют диаметр 5 мм. Электроды легко прилегают к поверхности коры головного мозга и имеют достаточную гибкость, чтобы гарантировать, что нормальные движения мозга не причинят травм. Ключевое преимущество ленточных и сетчатых электродов заключается в том, что их можно вводить под твердую мозговую оболочку в кортикальные области, не обнажаемые при краниотомии. Ленточные электроды и массивы коронок можно использовать в любой желаемой комбинации. Глубинные электроды также можно использовать для регистрации активности более глубоких структур, таких как гиппокамп .
DCES
[ редактировать ]Прямая кортикальная электрическая стимуляция (DCES), также известная как картирование кортикальной стимуляции , часто выполняется одновременно с записью ЭКоГ для функционального картирования коры и идентификации критических корковых структур. [9] При использовании конфигурации коронки ручной биполярный стимулятор с палочкой можно использовать в любом месте электродной решетки. Однако при использовании субдуральной полоски стимуляция должна применяться между парами соседних электродов из-за непроводящего материала, соединяющего электроды на сетке. Электрические стимулирующие токи, подаваемые на кору, относительно низкие: от 2 до 4 мА для соматосенсорной стимуляции и около 15 мА для когнитивной стимуляции. [9] Частота стимуляции обычно составляет 60 Гц в Северной Америке и 50 Гц в Европе, а любая плотность заряда более 150 мкКл/см2 вызывает повреждение тканей. [11] [12]
Функции, наиболее часто отображаемые с помощью DCES, — это первичная двигательная, первичная сенсорная и языковая функции. Пациент должен быть внимательным и интерактивным при проведении картографических процедур, хотя участие пациента варьируется в зависимости от каждой процедуры картирования. Картирование языка может включать в себя называние, чтение вслух, повторение и устное понимание; Соматосенсорное картирование требует, чтобы пациент описал ощущения, возникающие на лице и конечностях, когда хирург стимулирует различные области коры. [9]
Клинические применения
[ редактировать ]С момента своего развития в 1950-х годах ЭКоГ использовалась для локализации эпилептогенных зон во время предоперационного планирования, картирования корковых функций и прогнозирования успеха эпилептической хирургической резекции. ЭКоГ предлагает несколько преимуществ перед альтернативными методами диагностики:
- Гибкое размещение записывающих и стимулирующих электродов. [2]
- Может выполняться на любом этапе до, во время и после операции.
- Позволяет проводить прямую электрическую стимуляцию мозга, определяя критические области коры, которых следует избегать во время операции.
- Более высокая точность и чувствительность, чем при записи ЭЭГ скальпа – пространственное разрешение выше, а соотношение сигнал/шум лучше благодаря более близкому расположению к нейронной активности.
Ограничения ECoG включают в себя:
- Ограниченное время выборки – судороги ( иктальные события) не могут быть зарегистрированы в течение периода записи ЭКоГ.
- Ограниченное поле зрения – размещение электродов ограничено площадью обнаженной коры и временем операции, могут возникнуть ошибки отбора проб.
- Запись подлежит влиянию анестетиков, наркотических анальгетиков и самой операции. [2]
Трудноизлечимая эпилепсия
[ редактировать ]Эпилепсия в настоящее время считается третьим наиболее часто диагностируемым неврологическим расстройством, от которого страдают примерно 2,5 миллиона человек только в Соединенных Штатах. [13] Эпилептические припадки являются хроническими и не связаны с какими-либо причинами, поддающимися немедленному лечению, такими как токсины или инфекционные заболевания, и могут широко варьироваться в зависимости от этиологии, клинических симптомов и места возникновения в мозге. Для пациентов с трудноизлечимой эпилепсией – эпилепсией, которая не реагирует на противосудорожные препараты – хирургическое лечение может быть жизнеспособным вариантом лечения. Парциальная эпилепсия [14] Это распространенная трудноизлечимая эпилепсия, и парциальный припадок трудно обнаружить. Лечение такой эпилепсии ограничивается установкой стимулятора блуждающего нерва. Хирургическое лечение эпилепсии — это лечение парциальной эпилепсии при условии, что область мозга, вызывающая приступы, аккуратно и аккуратно удалена.
- Экстраоперационная ЭКоГ
Прежде чем пациента можно будет идентифицировать как кандидата на резекционную операцию, необходимо провести МРТ, чтобы продемонстрировать наличие структурного поражения в коре головного мозга, что подтверждается данными ЭЭГ об эпилептогенной ткани. [2] После выявления поражения можно провести ЭКоГ, чтобы определить местоположение и степень поражения, а также окружающую область раздражения. ЭЭГ кожи головы, хотя и является ценным диагностическим инструментом, не обладает точностью, необходимой для локализации эпилептогенной области. ЭКоГ считается золотым стандартом оценки активности нейронов у пациентов с эпилепсией и широко используется для предоперационного планирования при хирургической резекции поражения и эпилептогенной зоны. [15] [16] Успех операции зависит от точной локализации и удаления эпилептогенной зоны. Данные ЭКоГ оцениваются с учетом иктальной спайковой активности – «диффузной быстрой волновой активности», регистрируемой во время припадка, – и интериктальной эпилептиформной активности (ИЭА), коротких всплесков активности нейронов, регистрируемых между эпилептическими событиями. ЭКоГ также проводится после резекционной операции, чтобы обнаружить оставшуюся эпилептиформную активность и определить успех операции. Остаточные пики ЭКоГ, не измененные резекцией, указывают на плохой контроль приступов и неполную нейтрализацию эпилептогенной кортикальной зоны. Для полного устранения судорожной активности может потребоваться дополнительная операция. Внеоперационная ЭКоГ также используется для локализации функционально важных областей (также известных как красноречивая кора), которые необходимо сохранить во время хирургического вмешательства по поводу эпилепсии. [17] Сообщается, что двигательные, сенсорные, когнитивные задачи во время внеоперационной ЭКоГ приводят к увеличению амплитуды высокочастотной активности 70–110 Гц в областях, участвующих в выполнении заданных задач. [17] [18] [19] Высокочастотная активность, связанная с задачей, может анимировать, «когда» и «где» кора головного мозга активируется и тормозится в 4D-режиме с временным разрешением 10 миллисекунд или ниже и пространственным разрешением 10 мм или ниже. [18] [19]
- Интраоперационная ЭКоГ
Целью резекционной операции является удаление эпилептогенной ткани без возникновения неприемлемых неврологических последствий. Помимо идентификации и локализации эпилептогенных зон, ЭКоГ, используемая в сочетании с DCES, также является ценным инструментом для функционального картирования коры . Крайне важно точно локализовать критические структуры головного мозга, определив, какие области хирург должен сохранить во время резекции (« красноречивая кора »), чтобы сохранить обработку сенсорной информации, координацию движений и речь. Функциональное картирование требует, чтобы пациент имел возможность взаимодействовать с хирургом, и поэтому выполняется под местной, а не общей анестезией. Электрическая стимуляция с использованием корковых и острых глубинных электродов используется для исследования отдельных областей коры с целью выявления центров речи, соматосенсорной интеграции и соматомоторной обработки. Во время резекционной операции также может быть проведена интраоперационная ЭКоГ для мониторинга эпилептической активности тканей и обеспечения резекции всей эпилептогенной зоны.
Хотя использование экстраоперационной и интраоперационной ЭКоГ в резекционной хирургии является общепринятой клинической практикой на протяжении нескольких десятилетий, недавние исследования показали, что полезность этого метода может варьироваться в зависимости от типа эпилепсии, проявляемой у пациента. Курувилла и Флинк сообщили, что, хотя интраоперационная ЭКоГ играет решающую роль при индивидуальной височной лобэктомии, множественных субпиальных трансекциях (MST) и удалении пороков развития коры (MCD), она оказалась непрактичной при стандартной резекции медиальной височной доли. эпилепсия (ВЛЭ) с МРТ-признаками мезиального височного склероза (МТС). [2] Исследование, проведенное Веннбергом, Квесни и Расмуссеном, продемонстрировало дооперационное значение ЭКоГ в случаях лобной эпилепсии (FLE). [20]
Исследовательские приложения
[ редактировать ]ECoG недавно стал многообещающим методом записи для использования в интерфейсах мозг-компьютер (BCI). [21] BCI — это прямые нейронные интерфейсы, которые обеспечивают управление протезами, электронными или коммуникационными устройствами посредством прямого использования сигналов мозга человека. Сигналы мозга могут быть записаны либо инвазивно, с помощью записывающих устройств, имплантированных непосредственно в кору головного мозга, либо неинвазивно, с использованием скальповых электродов ЭЭГ. ЭКоГ служит частично инвазивным компромиссом между двумя модальностями: хотя ЭКоГ не проникает через гематоэнцефалический барьер , как инвазивные записывающие устройства, он имеет более высокое пространственное разрешение и более высокое соотношение сигнал/шум, чем ЭЭГ. [21] ECoG недавно привлекла внимание к декодированию воображаемой речи или музыки, что может привести к «буквальным» BCI. [22] в котором пользователи просто воображают слова, предложения или музыку, которые BCI может напрямую интерпретировать. [23] [24]
Помимо клинических применений для локализации функциональных областей для поддержки нейрохирургии, функциональное картирование мозга в реальном времени с помощью ECoG привлекло внимание для поддержки исследований по фундаментальным вопросам нейробиологии. Например, в исследовании 2017 года были изучены области обработки лица и цвета и обнаружено, что эти субрегионы вносят весьма специфический вклад в различные аспекты зрения. [25] Другое исследование показало, что высокочастотная активность от 70 до 200 Гц отражает процессы, связанные как с кратковременным, так и с устойчивым принятием решений. [26] Другая работа, основанная на ECoG, представила новый подход к интерпретации активности мозга, предполагая, что и мощность, и фаза совместно влияют на мгновенный потенциал напряжения, который напрямую регулирует возбудимость коры. [27] Подобно работе по расшифровке воображаемой речи и музыки, эти направления исследований, включающие функциональное картирование мозга в реальном времени, также имеют значение для клинической практики, включая как нейрохирургию, так и системы BCI. Система, которая использовалась в большинстве этих публикаций по функциональному картированию в реальном времени, «Кортикью» . использовался как в исследовательских, так и в клинических целях.
Последние достижения
[ редактировать ]Эта статья нуждается в дополнительных цитатах для проверки . ( сентябрь 2022 г. ) |
Электрокортикограмма до сих пор считается « золотым стандартом » определения эпилептогенных зон; однако эта процедура является рискованной и высокоинвазивной. Недавние исследования изучали разработку неинвазивного метода визуализации коры головного мозга для предоперационного планирования, который может предоставить информацию и разрешение, аналогичные инвазивной ЭКоГ.
В одном новом подходе Lei Ding et al. [28] стремиться объединить информацию, предоставляемую структурной МРТ и ЭЭГ кожи головы, чтобы обеспечить неинвазивную альтернативу ЭКоГ. В этом исследовании изучался подход подпространственной локализации источника с высоким разрешением, FINE (первопринципные векторы), для изображения местоположений и оценки протяженности источников тока по ЭЭГ кожи головы. К полученной томографии значений подпространственной корреляции был применен метод пороговой обработки с целью идентификации эпилептогенных источников. Этот метод был протестирован на трех педиатрических пациентах с трудноизлечимой эпилепсией и дал обнадеживающие клинические результаты. Состояние каждого пациента оценивалось с помощью структурной МРТ, длительного видео-ЭЭГ-мониторинга с помощью скальповых электродов, а затем и субдуральных электродов. Затем данные ЭКоГ записывались с имплантированных субдуральных электродных сеток, помещенных непосредственно на поверхность коры. Для каждого субъекта также были получены изображения МРТ и компьютерной томографии.
Эпилептогенные зоны, выявленные по предоперационным данным ЭЭГ, были подтверждены наблюдениями по послеоперационным данным ЭКоГ у всех трех пациентов. Эти предварительные результаты позволяют предположить, что с помощью описанных методов визуализации и интеграции можно управлять хирургическим планированием и определять местонахождение эпилептогенных зон неинвазивно. Результаты ЭЭГ были дополнительно подтверждены хирургическими результатами всех трех пациентов. После хирургической резекции у двух пациентов приступы прекратились, а у третьего наблюдалось значительное уменьшение приступов. Благодаря своему клиническому успеху FINE предлагает многообещающую альтернативу предоперационной ЭКоГ, предоставляя информацию как о местоположении, так и о степени эпилептогенных источников с помощью неинвазивной процедуры визуализации.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Пальмини, А (2006). «Концепция эпилептогенной зоны: современный взгляд на взгляды Пенфилда и Джаспера на роль межприступных спайков» . Эпилептические расстройства . 8 (Приложение 2): С10–5. дои : 10.1684/j.1950-6945.2006.tb00205.x . hdl : 10923/21709 . ПМИД 17012068 .
- ^ Jump up to: а б с д и Курувилла, А; Флинк, Р. (2003). «Интраоперационная электрокортикография в хирургии эпилепсии: полезна или нет?» . Захват . 12 (8): 577–84. дои : 10.1016/S1059-1311(03)00095-5 . ПМИД 14630497 . S2CID 15643130 .
- ^ Баумайстер А.А. (2000). «Программа электрической стимуляции мозга Тулейна - исторический пример медицинской этики». J Hist Neurosci . 9 (3): 262–78. дои : 10.1076/jhin.9.3.262.1787 . ПМИД 11232368 . S2CID 38336466 .
- ^ Марван Хариз; Патрик Бломстедт; Людвик Зринзо (2016). «Глубокая стимуляция мозга между 1947 и 1987 годами: нерассказанная история» . Нейрохирургический фокус . 29 (2). e1 – через Medscape.
- ^ Хасигути, К; Мориока, Т; Ёсида, Ф; Мияги, Ю; и др. (2007). «Корреляция между электроэнцефалографической и электрокортикографической активностью, регистрируемой скальпом во время иктального периода» . Захват . 16 (3): 238–247. дои : 10.1016/j.seizure.2006.12.010 . ПМИД 17236792 . S2CID 1728557 .
- ^ Фаллеггер, Флориан; Скьявоне, Джузеппе; Пирондини, Эльвира; Вагнер, Фабьен Б.; Вашикурас, Николас; Серекс, Людовик; Зегарек, Грегори; Мэй, Адриан; Константин, Пол; Пальма, Мари; Хошневис, Мехрдад; Ван Руст, Дирк; Ивер, Блез; Куртин, Грегуар; Шаллер, Карл (март 2021 г.). «МРТ-совместимые и конформные электрокортикографические сетки для трансляционных исследований» . Передовая наука . 8 (9). дои : 10.1002/advs.202003761 . ISSN 2198-3844 . ПМЦ 8097365 . ПМИД 33977054 .
- ^ Jump up to: а б Логотетис, НК (2003). «Основа сигнала функциональной магнитно-резонансной томографии BOLD» . Журнал неврологии . 23 (10): 3963–71. doi : 10.1523/JNEUROSCI.23-10-03963.2003 . ПМК 6741096 . ПМИД 12764080 .
- ^ Ульберт, я; Халгрен, Э; Хейт, Г; Кармос, Г (2001). «Множественная микроэлектродная система записи для внутрикортикальных применений у человека». Журнал методов нейробиологии . 106 (1): 69–79. дои : 10.1016/S0165-0270(01)00330-2 . ПМИД 11248342 . S2CID 12203755 .
- ^ Jump up to: а б с д Шух, Л; Друри, я (1996). «Интраоперационная электрокортикография и прямая корковая электростимуляция». Семинары по анестезиологии . 16 : 46–55. дои : 10.1016/s0277-0326(97)80007-4 .
- ^ Месгарани, Н; Чанг, Э.Ф. (2012). «Избирательное корковое представление присутствующего говорящего при восприятии речи нескольких говорящих» . Природа . 485 (7397): 233–6. Бибкод : 2012Natur.485..233M . дои : 10.1038/nature11020 . ПМК 3870007 . ПМИД 22522927 .
- ^ Бойер А., Даффо Х., Винсент М., Рамдани С., Мандонне Э., Гиро Д., Боннетблан Ф. (2018). «Электрофизиологическая активность, вызванная прямой электрической стимуляцией мозга человека: интерес к компоненту P0» (PDF) . 2018 40-я ежегодная международная конференция Общества инженерии в медицине и биологии IEEE (EMBC) . Том. 2018. С. 2210–2213. дои : 10.1109/EMBC.2018.8512733 . ISBN 978-1-5386-3646-6 . ПМИД 30440844 . S2CID 53097668 .
- ^ Ритаччо, Энтони Л.; Бруннер, Питер; Шалк, Гервин (март 2018 г.). «Картирование электрической стимуляции мозга: основные принципы и новые альтернативы» . Журнал клинической нейрофизиологии . 35 (2): 86–97. дои : 10.1097/WNP.0000000000000440 . ISSN 0736-0258 . ПМЦ 5836484 . ПМИД 29499015 . «частота» на стр. 6, «повреждения» на стр. 3 PDF-файла
- ^ Корман, М. (2007). «Что такое эпилепсия? Клинические перспективы диагностики и лечения». Журнал клинической нейрофизиологии . 24 (2): 87–95. дои : 10.1097/WNP.0b013e3180415b51 . ПМИД 17414964 . S2CID 35146214 .
- ^ Ветжен, Николас М.; Марш, В. Ричард; Мейер, Фредрик Б.; Кашино, Грегори Д.; Итак, Элсон; Бриттон, Джеффри В.; Стед, С. Мэтью; Уоррелл, Грегори А. (июнь 2009 г.). «Модель начала приступов при внутричерепной электроэнцефалографии и хирургические результаты при неочаговой экстратемпоральной эпилепсии: Клиническая статья» . Журнал нейрохирургии . 110 (6): 1147–1152. дои : 10.3171/2008.8.JNS17643 . ISSN 0022-3085 . ПМК 2841508 . ПМИД 19072306 .
- ^ Сугано, Х; Симидзу, Х; Сунага, С (2007). «Эффективность интраоперационной электрокортикографии для оценки исходов приступов у пациентов с трудноизлечимой эпилепсией и массовыми поражениями височных долей» . Захват . 16 (2): 120–127. дои : 10.1016/j.seizure.2006.10.010 . ПМИД 17158074 .
- ^ Миллер, К.Дж.; денНийс, М; Шеной, П; Миллер, Дж.В.; и др. (2007). «Функциональное картирование мозга в реальном времени с использованием электрокортикографии». НейроИмидж . 37 (2): 504–507. doi : 10.1016/j.neuroimage.2007.05.029 . ПМИД 17604183 . S2CID 3362496 .
- ^ Jump up to: а б Кроун, Северная Каролина; Мильоретти, ДЛ ; Гордон, Б; Лессер, Р.П. (1998). «Функциональное картирование сенсомоторной коры головного мозга человека с помощью электрокортикографического спектрального анализа. II. Событийная синхронизация в гамма-диапазоне» . Мозг . 121 (12): 2301–15. дои : 10.1093/brain/121.12.2301 . ПМИД 9874481 .
- ^ Jump up to: а б Накаи, Ю; Чон, JW; Браун, ЕС; Ротермель, Р; Кодзима, К; Камбара, Т; Шах, А; Миттал, С; Суд, С; Асано, Э (2017). «Трех- и четырехмерное картирование речи и языка у больных эпилепсией» . Мозг . 140 (5): 1351–1370. дои : 10.1093/brain/awx051 . ПМК 5405238 . ПМИД 28334963 .
- ^ Jump up to: а б Накаи, Я; Нагашима, А; Хаякава, А; Осуки, Т; Чон, JW; Сугиура, А; Браун, ЕС; Асано, Э (2018). «Четырёхмерная карта ранней зрительной системы человека» . Клин Нейрофизиол . 129 (1): 188–197. дои : 10.1016/j.clinph.2017.10.019 . ПМЦ 5743586 . ПМИД 29190524 .
- ^ Веннберг, Р; Кени, Ф; Оливье, А; Расмуссен, Т. (1998). «Электрокортикография и исход эпилепсии лобной доли». Электроэнцефалография и клиническая нейрофизиология . 106 (4): 357–68. дои : 10.1016/S0013-4694(97)00148-X . ПМИД 9741764 .
- ^ Jump up to: а б Шеной, П; Миллер, К.Дж.; Ойеманн, Дж.Г.; Рао, РПН (2007). «Общие характеристики электрокортикографических ИМК» (PDF) . Транзакции IEEE по биомедицинской инженерии . 55 (1): 273–80. CiteSeerX 10.1.1.208.7298 . дои : 10.1109/TBME.2007.903528 . ПМИД 18232371 . S2CID 3034381 . Архивировано (PDF) из оригинала 14 декабря 2014 г.
- ^ Эллисон, Брендан З. (2009). «Глава 2: На пути к повсеместному распространению BCI». Интерфейсы «мозг-компьютер» . Спрингер. стр. 357–387. ISBN 978-3-642-02091-9 .
- ^ Свифт, Джеймс; Кун, Уильям; Гугер, Кристоф; Бруннер, Питер; Банч, М; Линч, Т; Фроули, Т; Ритаччо, Энтони; Шалк, Гервин (2018). «Пассивное функциональное картирование рецептивных областей языка с помощью электрокортикографических сигналов» . Клиническая нейрофизиология . 6 (12): 2517–2524. дои : 10.1016/j.clinph.2018.09.007 . ПМК 6414063 . ПМИД 30342252 .
- ^ Мартин, Стефани; Итуррате, Иньяки; Миллан, Хосе дель Р.; Найт, Роберт; Пэсли, Брайан Н. (2018). «Декодирование внутренней речи с помощью электрокортикографии: прогресс и проблемы на пути к речевому протезу» . Границы в неврологии . 12 : 422. дои : 10.3389/fnins.2018.00422 . ПМК 6021529 . ПМИД 29977189 .
- ^ Шалк, Гервин; Капеллер, Кристоф; Гугер, Кристоф; Огава, Х; Хиросима, С; Лафер-Соуза, Р.; Сайгин, Зеньип М.; Камада, Кёске; Канвишер, Нэнси (2017). «Фафены и радуги: причинно-следственные доказательства функциональной и анатомической специфики лица и обработки цвета в человеческом мозге» . Proc Natl Acad Sci США . 114 (46): 12285–12290. Бибкод : 2017PNAS..11412285S . дои : 10.1073/pnas.1713447114 . ПМК 5699078 . ПМИД 29087337 .
- ^ Саез, я; Лин, Дж; Столк, А; Изменять; Парвизи, Дж; Шалк, Гервин; Найт, Роберт Т.; Сюй, М. (2018). «Кодирование множественных вычислений, связанных с вознаграждением, в переходной и устойчивой высокочастотной активности в OFC человека» . Современная биология . 28 (18): 2889–2899.е3. дои : 10.1016/j.cub.2018.07.045 . ПМК 6590063 . ПМИД 30220499 .
- ^ Шалк, Гервин; Марпл, Дж.; Найт, Роберт Т.; Кун, Уильям Г. (2017). «Мгновенное напряжение как альтернатива энергетической и фазовой интерпретации колебательной активности мозга» . НейроИмидж . 157 : 545–554. doi : 10.1016/j.neuroimage.2017.06.014 . ПМК 5600843 . ПМИД 28624646 .
- ^ Дин, Л; Вилке, К; Сюй, Б; Сюй, Х; и др. (2007). «Визуализация источника ЭЭГ: корреляция местоположения и протяженности источника с электрокортикографией и хирургическими резекциями у пациентов с эпилепсией» . Журнал клинической нейрофизиологии . 24 (2): 130–136. дои : 10.1097/WNP.0b013e318038fd52 . ПМЦ 2758789 . ПМИД 17414968 .
