Роданский
| Роданский домен | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Символ | Роданский | ||
| Пфам | PF00581 | ||
| ИнтерПро | ИПР001763 | ||
| PROSITE | PDOC00322 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 2ора / СКОПе / СУПФАМ | ||
| Суперсемейство OPM | 413 | ||
| белок OPM | 2 млн человек в сутки | ||
| CDD | cd00158 | ||
| Мембраном | 571 | ||
| |||
| тиосульфатсертрансфераза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 2.8.1.1 | ||
| Номер CAS. | 9026-04-4 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
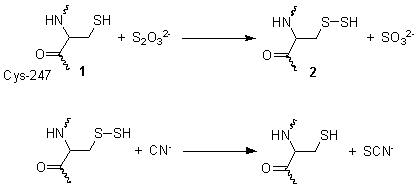
Роданец - это митохондриальный фермент , который детоксицирует цианид (CN − ), превращая его в тиоцианат (SCN − , также известный как «роданат»). [ 1 ] В энзиматологии общее название указано как тиосульфатсертрансфераза ( EC 2.8.1.1 ). [ 2 ] На диаграмме справа показана кристаллографически определенная структура роданеза.
Он катализирует следующую реакцию:
- тиосульфат + цианид сульфит + тиоцианат
Структура и механизм
[ редактировать ]Эта реакция протекает в две стадии. На первом этапе тиосульфат восстанавливается по тиоловой группе цистеина -247 1 с образованием персульфида и сульфита 2 . На втором этапе персульфид реагирует с цианидом с образованием тиоцианата, регенерируя тиол цистеина 1 . [ 3 ]
Роданец разделяет эволюционное родство с большим семейством белков, в том числе:
- Каталитический домен фосфатазы Cdc25
- некаталитические домены эукариотических МАПК-фосфатаз двойной специфичности
- некаталитические домены МАРК-фосфатаз дрожжей ПТР-типа
- некаталитические домены дрожжей Ubp4, Ubp5, Ubp7
- некаталитические домены Ubp-Y млекопитающих
- Белок теплового шока дрозофилы HSP-67BB
- несколько белков бактериального холодового шока и фагового шока
- белки, связанные со старением растений
- каталитические и некаталитические домены роданезы [ 4 ]
Роданец имеет внутреннее дублирование. Этот домен обнаружен в виде единственной копии в других белках, включая фосфатазы и С-концевые гидролазы убиквитина. [ 5 ]
Клиническая значимость
[ редактировать ]Эта реакция важна для лечения воздействия цианида, поскольку образующийся тиоцианат примерно в 1/200 токсичен. [ 6 ] :с. 15938 Применение раствора тиосульфата в качестве антидота при отравлении цианидами основано на активации этого ферментативного цикла.
Белки человека
[ редактировать ]Митохондриальный ген роданезы человека — TST .
Следующие другие человеческие гены соответствуют «роданоподобному» домену в InterPro, но не являются роданазой с ее каталитической активностью (см. также список родственных семейств в #Структура и механизм ):
- Индуктор М-фазы фосфатазы: CDC25A ; CDC25B ; CDC25C ;
- Протеинфосфатаза двойной специфичности: DUSP ; ДУСП1 ; ДУСП2 ; ДУСП4 ; ДУСП5 ; ДУСП6 ; ДУСП7 ; ДУСП10 ; DUSP16 , он же MKP7;
- Тиосульфат:глутатионсертрансфераза: KAT , теперь известная как « TSTD1 »;
- Аденилилтрансфераза и серотрансфераза: MOCS3 ;
- 3-меркаптопируватсертрансфераза: MPST , также известная как «TSTD2».
- Не фермент: TBCK ; ТСГА14 ;
- Убиквитинкарбоксиконцевая гидролаза: USP8 ;
- Неизвестная активность: TSTD3
Номенклатура
[ редактировать ]Хотя стандартные правила номенклатуры ферментов указывают, что их названия должны заканчиваться буквами «-аза», роданез впервые был описан в 1933 году. [ 7 ] до создания в 1955 г. Комиссии по ферментам; как таковое, старое название уже получило широкое распространение.
Систематическое название этого класса ферментов — «тиосульфат: цианидсертрансфераза». Другие широко используемые названия включают «тиосульфатцианидтранссульфуразу», «тиосульфаттиотрансферазу», «роданец» и «роданазу».
Ссылки
[ редактировать ]- ^ Чиполлоне Р., Асенци П., Томао П., Империи Ф., Виска П. (2008). «Ферментативная детоксикация цианида: подсказки от Pseudomonas aeruginosa Rhodanese». Журнал молекулярной микробиологии и биотехнологии . 15 (2–3): 199–211. дои : 10.1159/000121331 . ПМИД 18685272 . S2CID 25431686 .
- ^ EC 2.8.1.1 , в Международном союзе биохимии и молекулярной биологии.
- ^ Чиполлоне Р., Асенци П., Томао П., Империи Ф., Виска П. (2008). «Ферментативная детоксикация цианида: подсказки от Pseudomonas aeruginosa Rhodanese». Журнал молекулярной микробиологии и биотехнологии . 15 (2–3): 199–211. дои : 10.1159/000121331 . ПМИД 18685272 . S2CID 25431686 .
- ^ «Тиосульфатсертрансфераза, консервативный сайт (IPR001307)» . ЭМБЛ-ЭБИ . ИнтерПро.
- ^ Глюбич Ф, Газерро М, Занотти Г, Дельбоно С, Бомбьери Г, Берни Р (август 1996 г.). «Особенности структуры активного центра химически модифицированных форм роданеза» . Журнал биологической химии . 271 (35): 21054–61. дои : 10.1074/jbc.271.35.21054 . ПМИД 8702871 .
- ^ Ящак Э., Полковска Ж., Наркович С., Наместник Ю. (июль 2017 г.). «Цианиды в окружающей среде-Анализ-Проблемы и задачи» . Международное исследование наук об окружающей среде и загрязнении окружающей среды . 24 (19): 15929–15948. дои : 10.1007/s11356-017-9081-7 . ПМК 5506515 . ПМИД 28512706 .
- ^ Чиполлоне Р., Асенци П., Виска П. (февраль 2007 г.). «Общие темы и вариации в роданском суперсемействе» . ИУБМБ Жизнь . 59 (2): 51–9. дои : 10.1080/15216540701206859 . ПМИД 17454295 .
Внешние ссылки
[ редактировать ]- Роданский язык в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)