Пиридоксин-5'-фосфатоксидаза
| Пиридоксаль-5'-фосфатсинтаза | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 1.4.3.5 | ||
| Номер CAS. | 9029-21-4 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Пиридоксин-5'-фосфатоксидаза — фермент , кодируемый PNPO геном . [ 1 ] [ 2 ] [ 3 ] который катализирует несколько реакций на пути метаболизма витамина B6 . Пиридоксин-5'-фосфатоксидаза катализирует заключительную, лимитирующую стадию метаболизма витамина B6 , биосинтез пиридоксаль-5'-фосфата, биологически активной формы витамина B6, которая действует как незаменимый кофактор. [ 4 ] Пиридоксин-5'-фосфатоксидаза является членом ферментного класса оксидаз или, более конкретно, оксидоредуктаз . Эти ферменты катализируют одновременную окислительно-восстановительную реакцию. Ферменты-субстраты оксидазы гидроксилируются одним атомом кислорода молекулярного кислорода. [ 5 ] Одновременно другой атом кислорода восстанавливается до воды . Хотя молекулярный кислород является акцептором электронов в реакциях этих ферментов, они уникальны, поскольку кислород не появляется в окисленном продукте.
Активная форма витамина B 6 , пиридоксаль-5'-фосфат (PLP), имеет решающее значение для нормальной клеточной функции. Некоторые раковые клетки имеют заметные различия в метаболизме витамина B6 по сравнению с их нормальными аналогами. Ферментом, лимитирующим скорость синтеза витамина B6 , является пиридоксин-5'-фосфатоксидаза (PNPO; EC 1.4.3.5). [предоставлено OMIM] [ 3 ]
Структура
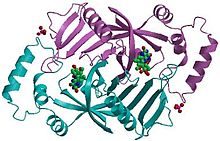
[ редактировать ]Пиридоксин-5'-фосфатоксидаза представляет собой гомодимер или молекулу, состоящую из двух идентичных полипептидных субъединиц. Предполагается, что два мономера удерживаются вместе дисульфидными связями . Между двумя мономерами также существуют взаимодействия солевых мостиков. Каждая субъединица прочно связывает одну молекулу пиридоксаль-5'-фосфата с каждой субъединицей. как альфа-спирали , так и бета-листы В белковом мотиве присутствуют , который лучше всего описать как структуру с разделенным стволом. Эта структура частично обусловлена дисульфидными связями, присутствующими во вторичной структуре белка этого фермента. Множественные тиоловые группы (–SH) указывают на наличие дисульфидных связей в структуре молекулы. Этот фермент требует присутствия кофактора FMN ( флавинмононуклеотид ). [ 6 ] Кофакторы — это ионы или коферменты, необходимые для активности фермента. FMN расположен в глубокой щели (образованной двумя субъединицами полипептида) и удерживается на месте за счет обширных взаимодействий водородных связей с белком. В этом конкретном случае FMN помогает ферменту связывать субстраты. В отсутствие пиридоксаль-5'-фосфата (PLP) активный центр фермента находится в «открытой» конформации. Как только субстрат связывается и превращается в PLP, активный центр фермента оказывается в частично «закрытой» конформации. Определенные аминокислотные остатки могут образовывать водородные связи с PLP, образуя, таким образом, крышку, которая физически закрывает активный центр, создавая «закрытую» конформацию. [ 7 ]

Путь
[ редактировать ]Пиридоксин-5'-фосфатоксидаза представляет собой фермент, который катализирует ограниченную по скорости стадию пути метаболизма B 6 . Витамин B6 , также известный как пиридоксин , является важнейшим питательным веществом для человеческого организма, поскольку он отвечает за большее количество функций организма, чем любой другой витамин. Витамин В6 является коферментом в обмене углеводов, жиров и белков. Это означает, что ферменты, которые расщепляют эти вещества для использования в организме, не могут функционировать, если не присутствует витамин B6, вызывающий конформационные изменения фермента, тем самым активируя его. Витамин B6 также играет роль в синтезе гормонов , эритроцитов, нейротрансмиттеров и ферментов. Человек с дефицитом витамина B6 может страдать бессонницей, а также пострадать от поражения центральной нервной системы. [ 4 ]
Реакции
[ редактировать ]Пиридоксин-5'-фосфатоксидаза катализирует несколько реакций; двумя наиболее важными являются дезаминирование пиридоксамина 5'-фосфата и дезаминирование пиридоксина 5-фосфата, оба из которых являются ключевыми промежуточными продуктами метаболизма B 6 . [ 8 ] Число ЕС пиридоксин-5'-фосфатоксидазы составляет 1.4.3.5. [ 6 ]

- пиридоксина фосфат + O 2 ⇌ H 2 O 2 + пиридоксальфосфат

Пиридоксин-5'-фосфатоксидаза также играет роль в азотистом обмене, превращая амины в альдегиды и NH 3 по реакции:
- амин + H 2 O + O 2 ⇌ альдегид + NH 3 + H 2 O 2

Кинетика
[ редактировать ]У человека фермент пиридоксин-5'-фосфатоксидаза демонстрирует низкую каталитическую константу скорости - 0,2 с. −1 , с низкими значениями K m как для пиридоксина-5'-фосфата, так и для пиридоксамина-5'-фосфата. Фермент также имеет низкую скорость оборота, что означает, что он относительно медленно преобразует субстрат в продукт. Пиридоксаль-5'-фосфат является эффективным ингибитором продукта. Поскольку пиридоксаль-5'-фосфат, активная форма витамина B6 , является продуктом метаболического пути, если он существует в избытке, то этот путь не обязательно должен продолжать производить продукт. Однако, если он существует в низких концентрациях, это сигнал для того, чтобы путь синтезировал больше. Это пример торможения обратной связи . [ 9 ]
Пиридоксин-5'-фосфатоксидаза у разных организмов
[ редактировать ]Пиридоксин-5'-фосфатоксидаза оказалась высококонсервативной с течением времени, поскольку существует много сходства между ферментом, обнаруженным у человека, и Escherichia coli . Хотя аминокислотная последовательность от версии фермента E. coli до человеческой версии сохраняется только на 39%, последовательности сайта связывания FMN и активных сайтов субстрата относятся к числу очень высококонсервативных частей. Одним из ключевых отличий является то, что пиридоксин-5'-фосфатоксидаза человека обладает более высокой специфичностью к пиридоксамин-5'-фосфатному субстрату, тогда как пиридоксин-5'-фосфатоксидаза в E. coli имеет более высокую специфичность к пиридоксаль-5'-фосфатному субстрату. . [ 9 ]
Клиническое значение
[ редактировать ]Мутации гена PNPO могут привести к развитию дефицита пиридоксамино-5'-фосфатоксидазы — заболевания, которое проявляется вскоре после рождения судорогами и последующей энцефалопатией.
Ссылки
[ редактировать ]- ^ Нго Э.О., ЛеПейдж Г.Р., Танасси Дж.В., Мейслер Н., Наттер Л.М. (июнь 1998 г.). «Отсутствие активности пиридоксин-5'-фосфатоксидазы (PNPO) в неопластических клетках: выделение, характеристика и экспрессия кДНК PNPO». Биохимия . 37 (21): 7741–8. дои : 10.1021/bi972983r . ПМИД 9601034 .
- ^ Кан Дж.Х., Хонг М.Л., Ким Д.В., Пак Дж., Кан Т.К., Вон М.Х., Пэк Н.И., Мун Б.Дж., Чой С.Ю., Квон О.С. (июнь 2004 г.). «Геномная организация, распределение в тканях и делеционная мутация пиридоксин-5'-фосфатоксидазы человека». Eur J Biochem . 271 (12): 2452–61. дои : 10.1111/j.1432-1033.2004.04175.x . ПМИД 15182361 .
- ^ Перейти обратно: а б «Ген Энтрез: ПНПО пиридоксамин-5'-фосфатоксидаза» .
- ^ Перейти обратно: а б «Витамин В 6 » . Проверено 3 июня 2007 г.
- ^ Нельсон Д.Л., Кокс М.М. (2005). Ленингерские принципы биохимии, четвертое издание . Нью-Йорк: WH Freeman and Company. ISBN 0-7167-4339-6 .
- ^ Перейти обратно: а б Онлайн-менделевское наследование у человека (OMIM): пиридоксамин-5-прайм-фосфатоксидаза; ПНПО - 603287
- ^ ВВП : 1jnw ; ди Сальво МЛ, Ко ТП, Мусаев ФН, Рабони С, Ширх В, Сафо МК (январь 2002 г.). «Структура активного центра и стереоспецифичность пиридоксин-5'-фосфатоксидазы Escherichia coli». Журнал молекулярной биологии . 315 (3): 385–97. дои : 10.1006/jmbi.2001.5254 . ПМИД 11786019 .
- ^ «Обмен витамина В6» . Референтный путь . KEGG: Киотская энциклопедия генов и геномов.
- ^ Перейти обратно: а б Мусаев Ф.Н., Ди Сальво М.Л., Ко Т.П., Ширх В., Сафо М.К. (июль 2003 г.). «Структура и свойства рекомбинантной пиридоксин-5'-фосфатоксидазы человека» . Белковая наука . 12 (7): 1455–63. дои : 10.1110/ps.0356203 . ПМЦ 2323923 . ПМИД 12824491 .
Дальнейшее чтение
[ редактировать ]- Маруяма К., Сугано С. (1994). «Олиго-кэпирование: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Джин . 138 (1–2): 171–4. дои : 10.1016/0378-1119(94)90802-8 . ПМИД 8125298 .
- Сузуки И., Ёситомо-Накагава К., Маруяма К. и др. (1997). «Создание и характеристика библиотеки кДНК, обогащенной по полной длине и по 5'-концу». Джин . 200 (1–2): 149–56. дои : 10.1016/S0378-1119(97)00411-3 . ПМИД 9373149 .
- Штраусберг Р.Л., Фейнгольд Е.А., Граус Л.Х. и др. (2003). «Получение и первоначальный анализ более 15 000 полноразмерных последовательностей кДНК человека и мыши» . Учеб. Натл. акад. наук. США . 99 (26): 16899–903. Бибкод : 2002PNAS...9916899M . дои : 10.1073/pnas.242603899 . ПМК 139241 . ПМИД 12477932 .
- Мусаев Ф.Н., Ди Сальво М.Л., Ко Т.П. и др. (2004). «Структура и свойства рекомбинантной пиридоксин-5'-фосфатоксидазы человека» . Белковая наука . 12 (7): 1455–63. дои : 10.1110/ps.0356203 . ПМЦ 2323923 . ПМИД 12824491 .
- Ота Т., Сузуки Ю., Нисикава Т. и др. (2004). «Полное секвенирование и характеристика 21 243 полноразмерных кДНК человека» . Нат. Жене . 36 (1): 40–5. дои : 10.1038/ng1285 . ПМИД 14702039 .
- Герхард Д.С., Вагнер Л., Фейнгольд Е.А. и др. (2004). «Статус, качество и расширение проекта полноразмерной кДНК Национального института здравоохранения: Коллекция генов млекопитающих (MGC)» . Геном Рез . 14 (10Б): 2121–7. дои : 10.1101/гр.2596504 . ПМК 528928 . ПМИД 15489334 .
- Миллс П.Б., Сёртиз Р.А., член парламента Чемпиона и др. (2005). «Неонатальная эпилептическая энцефалопатия, вызванная мутациями гена PNPO, кодирующего пиридокс(ам)ин-5'-фосфатоксидазу» . Хм. Мол. Жене . 14 (8): 1077–86. дои : 10.1093/hmg/ddi120 . ПМИД 15772097 .
- Кимура К., Вакамацу А., Судзуки Ю. и др. (2006). «Диверсификация транскрипционной модуляции: крупномасштабная идентификация и характеристика предполагаемых альтернативных промоторов генов человека» . Геном Рез . 16 (1): 55–65. дои : 10.1101/гр.4039406 . ПМК 1356129 . ПМИД 16344560 .
Внешние ссылки
[ редактировать ] СМИ, связанные с пиридоксин-5'-фосфатоксидазой, на Викискладе?
СМИ, связанные с пиридоксин-5'-фосфатоксидазой, на Викискладе?