Глутаматдегидрогеназа 1
| ГЛУХОЙ1 | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | GLUD1 , GDH, GDH1, GLUD, глутаматдегидрогеназа 1, hGDH1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 138130 ; МГИ : 95753 ; Гомологен : 55885 ; Генные карты : GLUD1 ; ОМА : GLUD1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
GLUD1 ( глутаматдегидрогеназа 1 ) представляет собой митохондриального матрикса фермент , один из семейства глутаматдегидрогеназ , которые широко распространены в жизни и играют ключевую роль в азота и глутамата (Glu) метаболизме и энергетическом гомеостазе . Эта дегидрогеназа экспрессируется на высоких уровнях в печени , головном мозге , поджелудочной железе и почках , но не в мышцах . Считается, что в клетках поджелудочной железы GLUD1 участвует в инсулина секреции механизмах . В нервной ткани, где глутамат присутствует в концентрациях выше, чем в других тканях, GLUD1, по-видимому, участвует как в синтезе , так и в катаболизме глутамата и, возможно, в детоксикации аммиака .
Структура
[ редактировать ]Ген
[ редактировать ]
человека GLUD1 содержит 13 экзонов и расположен на 10-й хромосоме .
Есть свидетельства того, что GLUD1 и естественного отбора возник безинтронный GLUD2 был ретропозирован на Х-хромосому, где в результате случайных мутаций . GLUD2 адаптировался к конкретным потребностям нервной системы, где он особенно выражен. [ 5 ]
Белок
[ редактировать ]
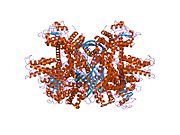
Каждый домен окрашен по-разному — Glu-BD , NAD(P)-BD , антенна , ось вращения спирали . Аллостерические регуляторы показаны в виде сферных моделей. Эта конкретная структура GLUD1 представляет собой комбинацию двух рентгеновских структур — одной со связанным GTP ( 1HWZ ) и второй со связанным ADP ( 1NQT , 8AR8 ). Хотя эта структура и ненастоящая, она показывает относительное положение аллостерических эффекторов при связывании с GLUD1. Также показаны НАДФН и Глю.
GLUD1 представляет собой гексамер. Мономерная единица имеет:
- N-концевой Glu-BD (связывающий домен), состоящий в основном из β-нитей.
- НАД-BD - может связывать любой НАД + или НАДФ + .
- Антенноподобный выступ из 48 остатков, идущий от вершины каждого NAD-BD. Антенна состоит из восходящей спирали и нисходящей случайной спиральной цепи, которая содержит небольшую α-спираль по направлению к С-концевому концу цепи.
НАД-BD находится поверх Glu-BD. НАД-BD и Glu-BD образуют каталитическую щель. Во время связывания субстрата НАД-BD значительно перемещается. Это движение состоит из двух компонентов: вращение вдоль длинной оси спирали в задней части NAD-BD, называемой «поворотной спиралью», и закручивание вокруг антенны по часовой стрелке. Сравнение открытой и закрытой конформаций GLUD1 выявляет изменения в маленькой спирали нисходящей нити антенны, которая, по-видимому, отскакивает при открытии каталитической щели. [ 6 ] Замыкание одной субъединицы связано с искривлением небольшой спирали нисходящего тяжа, которая вдавливается в антенну соседней субъединицы. На этой маленькой спирали расположен R496 (см. Мутации).
Основная структура гексамера представляет собой сложенный димер тримеров. Glu-BD мономеров в основном ответственны за формирование ядра. Относительное положение мономеров таково, что вращение вокруг основной спирали каждого мономера не ограничено. Усики трех субъединиц внутри тримеров обвивают друг друга и претерпевают конформационные изменения по мере открытия и закрытия каталитической щели. Антенна служит каналом межсубъединичной связи во время отрицательной кооперативности и аллостерической регуляции.
Сопоставление GLUD1 из различных источников показывает, что антенна, вероятно, развилась у протиста до образования пуриновых регуляторных сайтов . Это предполагает, что существует некоторое селективное преимущество самой антенны и что животные развили новые функции для GLUD1 за счет добавления аллостерической регуляции . [ 7 ]
GLUD1 может образовывать длинные волокна путем соединения гексамеров «конец в конец». Полимеризация не связана с каталитической активностью, но, вероятно, играет важную роль, например, в образовании мультиферментных комплексов.
GLUD1 имеет два сайта связывания коферментов: один в НАД-BD, который способен связывать эфир НАД+ или НАДФ. + и непосредственно участвует в каталитическом процессе, а второй, обладающий регуляторной функцией, лежит непосредственно под стержневой спиралью, способной связывать АДФ, НАД + , или НАДН, но плохо связывает НАДФ. [ 8 ]
Функция
[ редактировать ]GLUD1 катализирует окислительное дезаминирование Glu до 2-оксоглутарата и свободного NH 4 . + используя либо НАД + или НАДФ + в качестве сопутствующего фактора. Реакция протекает с переносом гидрид-иона от Cα Глу к НАД(Ф). + , образуя при этом 2-иминоглутарат, который гидролизуется до 2-оксоглутарата и NH 4 + . Равновесие реакции в стандартных условиях в значительной степени благоприятствует образованию Glu по сравнению с NH 4. + (Go' ~ 30 кДж.моль-1). По этой причине считалось, что этот фермент играет важную роль в детоксикации аммиака, поскольку высокий уровень [NH 4 + ] токсичны, такое положение равновесия будет физиологически важным; это поможет поддерживать низкий уровень [NH 4 + ]. Однако у людей с определенной формой гипераммониемии, возникшей в результате формы гиперинсулинизма , активность фермента повышается из-за снижения чувствительности ГТФ, отрицательного регулятора. У этих людей уровень аммиака в крови значительно повышается, чего нельзя было бы ожидать, если бы фермент действительно работал в равновесии.
Взаимодействия
[ редактировать ]Обязательные партнеры
[ редактировать ]АДП
[ редактировать ]АДФ связывается позади НАД-BD, сразу под поворотной спиралью – в специальном аллостерическом сайте АДФ. Аденозиновый фрагмент связывается с гидрофобным карманом, при этом группы рибозофосфата направлены наружу, к аллостерическому сайту GTP. [ 9 ]
НАДН также может связываться с сайтом АДФ в высоких концентрациях, что обычно приводит к ингибированию фермента. [ 10 ]
ГТП
[ редактировать ]Связыванию GTP противодействуют Pi и ADP, но он синергичен с НАДН, связанным в некаталитическом аллостерическом сайте. Большинство контактов между GTP и ферментом осуществляется через трифосфатный фрагмент. Сайт связывания GTP считается «сенсором», который отключает фермент, когда клетка находится в состоянии высокой энергии. GTP связывается на стыке NAD-BD и антенны. [ 8 ] [ 11 ]
Хотя большая часть взаимодействий GLUD1-GTP осуществляется через взаимодействия β- и γ-фосфатов, существуют специфические взаимодействия с E346 и K343, которые отдают предпочтение гуанозину по сравнению с аденозином.
В открытой конформации сайт связывания GTP искажен так, что он больше не может связывать GTP. [ 6 ]
Регулирование
[ редактировать ]Когда GLUD1 сильно насыщен лигандами (субстратами) активного центра, в активном центре образуется ингибирующий абортивный комплекс: НАД(Ф)H.Glu в реакции окислительного дезаминирования при высоком pH и НАД(Ф) + .2-оксоглутарат в реакции восстановительного аминирования при низком pH. GLUD1 принимает конфигурацию базального состояния в отсутствие аллостерических эффекторов, независимо от того, функциональны ли аллостерические сайты. Аллостерические регуляторы GLUD1 - ADP, GTP, Leu, NAD. + и НАДН - оказывают свое действие путем изменения энергии, необходимой для открытия и закрытия каталитической щели во время ферментативного оборота, иными словами, дестабилизируя или стабилизируя соответственно абортивные комплексы. Активаторы не необходимы для каталитической функции GLUD1, поскольку он активен в отсутствие этих соединений (базальное состояние). Было высказано предположение, что GLUD1 в своем базальном состоянии принимает конфигурацию (открытая каталитическая щель), которая обеспечивает каталитическую активность независимо от того, функциональны ли аллостерические сайты. Регуляция GLUD имеет особое биологическое значение, о чем свидетельствуют наблюдения, показывающие, что регуляторные мутации GLUD1 связаны с клиническими проявлениями у детей.
АДП
[ редактировать ]АДФ является одним из двух основных активаторов (НАД + будучи другим), действует путем дестабилизации абортивных комплексов и отмены негативного сотрудничества. В отсутствие субстратов и при наличии связанного АДФ каталитическая щель находится в открытой конформации, и гексамеры GLUD1 образуют в кристаллической ячейке длинные полимеры с большим количеством взаимодействий, чем обнаружено в кристаллах абортивного комплекса ( 8AR8 [ 9 ] ). Это согласуется с тем фактом, что ADP способствует агрегации в растворе. Когда каталитическая щель открывается, R516 поворачивается вниз к фосфатам АДФ. [ 8 ] Открытие каталитической щели примерно коррелирует с расстоянием между R516 и фосфатами АДФ. Таким образом, ADP активирует GLUD1, способствуя открытию каталитической щели, что снижает сродство продукта и облегчает его высвобождение. [ 6 ] [ 12 ] таким образом позволяя GLUD1 согласовать некаталитические абортивные комплексы. [ 11 ]
Ранее предполагалось, что ингибирование высоким содержанием [АДФ] происходит из-за конкуренции между АДФ и аденозиновым фрагментом кофермента в активном сайте1. По крайней мере, известно, что на этот эффект относительно не влияют ни H507Y, ни R516A.
СПС
[ редактировать ]АТФ оказывает сложное влияние, зависящее от концентрации, на активность GLUD1:
- Низкий [АТФ] – ингибирование, опосредованное через сайт связывания ГТФ, поскольку оно устраняется H507Y. Сродство АТФ к сайту GTP оказывается в 1000 раз ниже, чем к GTP, поскольку взаимодействия β- и γ-фосфатов являются основным фактором, определяющим связывание в сайте GTP.
- Промежуточная [АТФ] - активация, опосредованная через эффекторный участок АДФ, поскольку практически полностью элиминируется R516A. В этом сайте нуклеотидная группа является основным детерминантом связывания.
- Высокое [АТФ] - ингибирование, опосредованное слабым связыванием в третьем сайте, относительно специфичном для адениновых нуклеотидов. На этот эффект относительно не влияют ни H507Y, ни R516A. Как предполагается для АДФ, это может быть связано с конкуренцией между АТФ и аденозиновым фрагментом кофермента в активном центре. [ 13 ]
ГТП
[ редактировать ]GTP ингибирует обмен ферментов в широком диапазоне условий за счет увеличения сродства GLUD1 к продукту реакции, что ограничивает скорость высвобождения продукта при всех условиях в присутствии GTP. GTP действует, сохраняя каталитическую щель в закрытой конформации, тем самым стабилизируя абортивные комплексы. Эффекты GTP на GLUD1 не локализованы исключительно на субъединице, с которой он связывается, и что антенна играет важную роль в передаче этого ингибирования другим субъединицам.
Лео
[ редактировать ]Leu активирует GLUD1 независимо от ADP, обладая специальным аллостерическим сайтом в области интерфейса субъединиц 8AR7 . [ 9 ] Усиленные ответы пациентов с HI/HA (см. синдром HI/HA) на стимуляцию высвобождения INS Leu3, возникающие в результате нарушения чувствительности к ингибированию GTP, подчеркивают физиологическую важность ингибирующего контроля GLUD1. [ 13 ]
ОНИ +
[ редактировать ]НАД(Ф)(Н) может связываться со вторым сайтом на каждой субъединице. Этот сайт связывает НАД(Н) примерно в 10 раз лучше, чем НАДФ(Н), причем восстановленные формы лучше, чем окисленные. [ 10 ] Хотя было высказано предположение, что связывание восстановленного кофермента в этом сайте ингибирует реакцию, тогда как связывание окисленного кофермента вызывает активацию, эффект до сих пор неясен.
НАДН
[ редактировать ]НАДН — еще один крупный аллостерический ингибитор GLUD1.
Фосфат
[ редактировать ]Фосфат и другие двухвалентные анионы стабилизируют GLUD1. Недавние структурные исследования показали, что молекулы фосфата связываются с сайтом GTP. [ 8 ]
Клиническое значение
[ редактировать ]Семейный гиперинсулинизм, связанный с мутациями в GLUD1, характеризуется гипогликемией, которая варьируется от тяжелой неонатальной, трудно поддающейся лечению болезни до детской болезни с легкими симптомами и трудно диагностируемой гипогликемией . Заболевание, возникающее в неонатальном периоде, проявляется в течение нескольких часов-двух дней после рождения. Заболевание, возникающее в детском возрасте, проявляется в течение первых месяцев или лет жизни. В период новорожденности симптомы могут быть неспецифическими, включая судороги, гипотонию, плохое питание и апноэ. В тяжелых случаях концентрация глюкозы в сыворотке обычно чрезвычайно низка и поэтому легко распознается, тогда как в более легких случаях вариабельная и легкая гипогликемия может затруднить диагностику. Даже в пределах одной семьи проявления заболевания могут варьироваться от легких до тяжелых. Лица с аутосомно-рецессивным семейным гиперинсулинизмом, вызванным мутациями в ABCC8 или KCNJ11 (FHI-KATP), обычно имеют крупные размеры для гестационного возраста и обычно имеют тяжелую рефрактерную гипогликемию в первые 48 часов жизни; пострадавшие младенцы обычно лишь частично реагируют на диету или медикаментозное лечение (например, терапию диазоксидом), и поэтому может потребоваться резекция поджелудочной железы. Лица с аутосомно-доминантным FHI- КАТФ , как правило, соответствует гестационному возрасту при рождении, проявляется примерно в возрасте одного года (диапазон: от 2 дней до 30 лет) и реагирует на диету и терапию диазоксидом. Сообщалось об исключениях из обоих этих общих правил. FHI-GCK, вызванный мутациями GCK , может быть намного мягче, чем FHI-KATP; однако у некоторых людей наблюдается тяжелая гипогликемия, не поддающаяся лечению диазоксидом. FHI-HADH, вызванный мутациями HADH, имеет тенденцию быть относительно легким, хотя сообщалось о тяжелых случаях. Лица с FHI-HNF4A, вызванным мутациями в HNF4A, обычно рождаются крупными для гестационного возраста и имеют легкие особенности, которые поддаются лечению диазоксидом . FHI-UCP2, вызванный мутациями в UCP2, является редкой причиной диазоксид-зависимой FH1. Гипераммониемия/гиперинсулинизм (ГА/ГИ) связан с легкой и умеренной гипераммониемией и относительно легкой, поздней гипогликемией; у большинства, но не у всех больных людей имеются мутации в GLUD1. [ 14 ]
Клинические характеристики
[ редактировать ]FHI характеризуется гипогликемией, которая варьируется от тяжелой неонатальной, трудно поддающейся лечению болезни до детской болезни с легкими симптомами и трудно диагностируемой гипогликемией. Заболевание, возникающее в неонатальном периоде, проявляется в течение нескольких часов-двух дней после рождения. Заболевание, возникающее в детском возрасте, проявляется в течение первых месяцев или лет жизни. [ 15 ] В период новорожденности симптомы могут быть неспецифическими, включая судороги, гипотонию, плохое питание и апноэ. В тяжелых случаях концентрация глюкозы в сыворотке обычно чрезвычайно низка и поэтому легко распознается, тогда как в более легких случаях вариабельная и легкая гипогликемия может затруднить диагностику. Даже в пределах одной семьи проявления заболевания могут варьироваться от легких до тяжелых. [ 16 ]
Диагностика/тестирование
[ редактировать ]Примерно у 45% больных имеются мутации либо в ABCC8, который кодирует белок SUR1, либо в KCNJ11, который кодирует белок Kir6.2. В еврейском населении ашкенази две мутации-основателя ABCC8 ответственны примерно за 97% FHI. Другие мутации-основатели ABCC8 присутствуют в финской популяции (p. Val187Asp и p.Asp1506Lys). Мутации в GLUD1 и HNF4A встречаются примерно у 5% людей с FHI. [ 17 ] [ 18 ] Активирующие мутации GCK или инактивирующие мутации HADH встречаются менее чем у 1% людей с FHI. На сегодняшний день мутации UCP2 зарегистрированы только в двух семьях. Примерно 40% людей с FHI не имеют идентифицируемой мутации ни в одном из генов, которые, как известно, связаны с FHI.
Управление
[ редактировать ]При первоначальном диагнозе гипогликемию корректируют внутривенным введением глюкозы для нормализации концентрации глюкозы в плазме и предотвращения повреждения головного мозга. [ 19 ] Долгосрочное медикаментозное лечение включает использование диазоксида, аналогов соматостатина, нифедипина, глюкагона, рекомбинантного IGF-I, глюкокортикоидов, гормона роста человека, диетического вмешательства или комбинации этих методов лечения. [ 20 ] У лиц, у которых агрессивное медикаментозное лечение не позволяет поддерживать концентрацию глюкозы в плазме в безопасных пределах или у которых такая терапия не может безопасно поддерживаться в течение длительного времени, рассматривается резекция поджелудочной железы. [ 21 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000148672 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000021794 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Шашидхаран П., Михаэлидис Т.М., Робакис Н.К., Кресовали А., Папаматеакис Дж., Плайтакис А. (июнь 1994 г.). «Новая человеческая глутаматдегидрогеназа, экспрессирующаяся в нервных и тестикулярных тканях и кодируемая Х-связанным безинтронным геном» . Ж. Биол. Хим . 269 (24): 16971–6. дои : 10.1016/S0021-9258(19)89484-X . ПМИД 8207021 .
- ^ Jump up to: а б с Смит Т.Дж., Шмидт Т., Фанг Дж., Ву Дж., Сюздак Дж. , Стэнли Калифорния (май 2002 г.). «Структура апо глутаматдегидрогеназы человека детализирует взаимодействие субъединиц и аллостерию». Дж. Мол. Биол . 318 (3): 765–77. дои : 10.1016/S0022-2836(02)00161-4 . ПМИД 12054821 .
- ^ Банерджи С., Шмидт Т., Фанг Дж., Стэнли К.А., Смит Т.Дж. (апрель 2003 г.). «Структурные исследования активации АДФ глутаматдегидрогеназы млекопитающих и эволюции регуляции». Биохимия . 42 (12): 3446–56. дои : 10.1021/bi0206917 . ПМИД 12653548 .
- ^ Jump up to: а б с д Смит Т.Дж., Петерсон П.Е., Шмидт Т., Фанг Дж., Стэнли Калифорния (март 2001 г.). «Структуры бычьих комплексов глутаматдегидрогеназы объясняют механизм пуриновой регуляции». Дж. Мол. Биол . 307 (2): 707–20. дои : 10.1006/jmbi.2001.4499 . ПМИД 11254391 .
- ^ Jump up to: а б с Алешин В.А., Буник В.И., Брух Е.М., Беллинцони М. (2022). «Структурная основа связывания аллостерических активаторов лейцина и АДФ с глутаматдегидрогеназой млекопитающих» . Int J Mol Sci . 23 (19): 11306. doi : 10.3390/ijms231911306 . ПМК 9570180 . ПМИД 36232607 .
- ^ Jump up to: а б Буник В, Артюхов А, Алешин В, Мкртчян Г (2016). «Множественные формы глутаматдегидрогеназы у животных: структурные детерминанты и физиологические последствия» . Биология . 5 (4): 53. doi : 10.3390/biology5040053 . ПМК 5192433 . ПМИД 27983623 .
- ^ Jump up to: а б Петерсон П.Е., Смит Т.Дж. (июль 1999 г.). «Структура бычьей глутаматдегидрогеназы дает представление о механизме аллостерии» . Структура . 7 (7): 769–82. дои : 10.1016/S0969-2126(99)80101-4 . ПМИД 10425679 .
- ^ Джордж А., Белл Дж. Э. (декабрь 1980 г.). «Влияние аденозин-5'-дифосфата на бычью глутаматдегидрогеназу: модификация диэтилпирокарбоната». Биохимия . 19 (26): 6057–61. дои : 10.1021/bi00567a017 . ПМИД 7470450 .
- ^ Jump up to: а б Фанг, Дж; Сюй, BY; МакМаллен, CM; Понц, М; Смит, Ти Джей; Стэнли, Калифорния (2002). «Экспрессия, очистка и характеристика аллостерических регуляторных мутаций GLUD1» . Биохим. Дж . 363 (Часть 1): 81–7. дои : 10.1042/0264-6021:3630081 . ПМК 1222454 . ПМИД 11903050 .
- ^ «Ген Энтрез: глутаматдегидрогеназа 1» .
- ^ Вон JG, Ценг Х.С., Ян А.Х., Тан К.Т., Яп Т.С., Ли Ч., Лин Х.Д., Буркус Н., Питтенгер Г., Виник А. (ноябрь 2006 г.). «Клинические особенности и морфологическая характеристика 10 больных с синдромом неинсулиномной панкреатогенной гипогликемии (НИПСГ)». Клиническая эндокринология . 65 (5): 566–78. дои : 10.1111/j.1365-2265.2006.02629.x . ПМИД 17054456 . S2CID 19076202 .
- ^ Пинни С.Е., МакМаллен С., Беккер С., Лин Ю.В., Ханна С., Торнтон П., Гангули А., Шинг С.Л., Стэнли Калифорния (август 2008 г.). «Клинические характеристики и биохимические механизмы врожденного гиперинсулинизма, связанного с мутациями доминантного KATP-канала» . Журнал клинических исследований . 118 (8): 2877–86. дои : 10.1172/JCI35414 . ПМК 2441858 . ПМИД 18596924 .
- ^ Глейзер Б., Блех И., Кракиновский Ю., Экстайн Дж., Гиллис Д., Мазор-Аронович К., Ландау Х., Абелиович Д. (октябрь 2011 г.). «Частота аллеля мутации ABCC8 в еврейском населении ашкенази и риск фокальной гиперинсулинемической гипогликемии». Генетика в медицине . 13 (10): 891–4. дои : 10.1097/GIM.0b013e31821fea33 . ПМИД 21716120 . S2CID 11352891 .
- ^ Хёйлунд К., Хансен Т., Лайер М., Хенриксен Дж.Э., Левин К., Линдхольм Дж., Педерсен О., Бек-Нильсен Х. (июнь 2004 г.). «Новый синдром аутосомно-доминантной гиперинсулинемической гипогликемии, связанный с мутацией гена инсулинового рецептора человека» . Диабет . 53 (6): 1592–8. дои : 10.2337/диабет.53.6.1592 . ПМИД 15161766 .
- ^ Мазор-Аронович К., Ландау Х., Гиллис Д. (март 2009 г.). «Хирургическое и нехирургическое лечение врожденного гиперинсулинизма». Обзоры детской эндокринологии . 6 (3): 424–30. ПМИД 19396028 .
- ^ Мазор-Аронович К., Гиллис Д., Лобель Д., Хирш Х.Дж., Пинхас-Хамиэль О., Модан-Мозес Д., Глейзер Б., Ландау Х. (октябрь 2007 г.). «Долгосрочные результаты развития нервной системы при консервативном лечении врожденного гиперинсулинизма» . Европейский журнал эндокринологии . 157 (4): 491–7. doi : 10.1530/EJE-07-0445 . ПМИД 17893264 .
- ^ Стэнли К.А., Торнтон П.С., Гангули А., МакМаллен С., Андервуд П., Бхатиа П., Стейнкраусс Л., Ваннер Л., Кэй Р., Ручелли Э., Сучи М., Адзик Н.С. (январь 2004 г.). «Предоперационная оценка детей с очаговым или диффузным врожденным гиперинсулинизмом с помощью внутривенных тестов на острый инсулиновый ответ и селективной стимуляции артерий поджелудочной железы кальцием» . Журнал клинической эндокринологии и метаболизма . 89 (1): 288–96. дои : 10.1210/jc.2003-030965 . ПМИД 14715863 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW о семейном гиперинсулинизме
- Глутамат + дегидрогеназа Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Обзор всей структурной информации, доступной в PDB для UniProt : P00367 (глутаматдегидрогеназа 1, митохондриальная) в PDBe-KB .
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .