Тройная точка
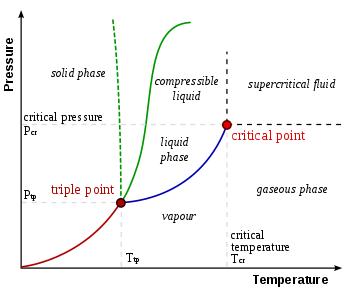
В термодинамике тройная точка вещества — это температура и давление , при которых три фазы ( газ , жидкость и твердое вещество ) этого вещества сосуществуют в термодинамическом равновесии . [1] Это температура и давление, при которых сублимации , плавления и испарения сходятся кривые . Например, тройная точка ртути ) и давлении 0,165 мПа возникает при температуре -38,8 °C (-37,8 ° F .
Помимо тройной точки для твердой, жидкой и газовой фаз, тройная точка может включать более одной твердой фазы для веществ с несколькими полиморфными модификациями . Гелий-4 необычен тем, что у него нет кривой сублимации/осаждения и, следовательно, нет тройных точек, где его твердая фаза встречается с газовой фазой. Вместо этого он имеет точку пар-жидкость-сверхтекучесть, точку твердое-жидкость-сверхтекучесть, точку твердое-твердое-жидкость и точку твердое-твердое-сверхтекучесть. Ничто из этого не следует путать с лямбда-точкой , которая не является тройной точкой.
Термин «тройная точка» был придуман в 1873 году Джеймсом Томсоном , братом лорда Кельвина . [2] Тройные точки некоторых веществ используются для определения точек в международной температурной шкале ITS-90 , от тройной точки водорода (13,8033 К) до тройной точки воды (273,16 К, 0,01 ° C или 32,018 ° F). .
До 2019 года тройная точка воды использовалась для определения кельвина , базовой единицы термодинамической температуры в Международной системе единиц (СИ). [3] Кельвин был определен так, что тройная точка воды равна точно 273,16 К, но это изменилось с переопределением базовых единиц СИ в 2019 году , когда Кельвин был переопределен так, что постоянная Больцмана равна точно 1,380649 × 10. −23 J⋅K −1 , а тройная точка воды стала экспериментально измеренной константой.
Тройная точка воды
[ редактировать ]Тройная точка газ-жидкость-твердое тело
[ редактировать ]
После переопределения базовых единиц СИ в 2019 году значение тройной точки воды больше не используется в качестве определяющей точки. Однако его эмпирическое значение остается важным: уникальное сочетание давления и температуры, при котором жидкая вода , твердый лед и водяной пар сосуществуют в устойчивом равновесии, составляет примерно 273,16 ± 0,0001 К. [4] и давление пара 611,657 паскаля (6,11657 мбар; 0,00603659 атм). [5] [6]
Жидкая вода может существовать только при давлении, равном или превышающем тройную точку. Ниже этого, в вакууме космического пространства , твердый лед сублимируется , превращаясь непосредственно в водяной пар при нагревании при постоянном давлении. И наоборот, выше тройной точки твердый лед сначала плавится в жидкую воду при нагревании при постоянном давлении, затем испаряется или кипит с образованием пара при более высокой температуре.
Для большинства веществ тройная точка газ-жидкость-твердое тело является минимальной температурой, при которой может существовать жидкость. Для воды это не так. Температура плавления обычного льда уменьшается с увеличением давления, как показано пунктирной зеленой линией на фазовой диаграмме . Чуть ниже тройной точки сжатие при постоянной температуре превращает водяной пар сначала в твердое состояние, а затем в жидкость.
Исторически сложилось так, что во время миссии «Маринера-9» на Марс трехточечное давление воды использовалось для определения «уровня моря». Теперь лазерную альтиметрию и гравитационные измерения. для определения высоты Марса предпочитают использовать [7]
Фазы высокого давления
[ редактировать ]При высоких давлениях вода имеет сложную фазовую диаграмму с 15 известными фазами льда и несколькими тройными точками, в том числе 10, координаты которых показаны на диаграмме. Например, тройная точка при 251 К (-22 ° C) и 210 МПа (2070 атм) соответствует условиям сосуществования льда Ih (обычного льда), льда III и жидкой воды, находящихся в равновесии. Существуют также тройные точки сосуществования трех твердых фаз, например льда II , льда V и льда VI при 218 К (-55 ° C) и 620 МПа (6120 атм).
Для тех форм льда, находящихся под высоким давлением, которые могут существовать в равновесии с жидкостью, диаграмма показывает, что температура плавления увеличивается с увеличением давления. При температуре выше 273 К (0 °C) увеличение давления водяного пара приводит сначала к образованию жидкой воды, а затем к образованию льда под высоким давлением. В диапазоне 251–273 К сначала образуется лед I, затем жидкая вода, затем лед III или лед V, а затем другие, еще более плотные формы высокого давления.

| Фазы в устойчивом равновесии | Давление | Температура |
|---|---|---|
| жидкая вода, лед I h и водяной пар | 611 657 Па [8] | 273,16 К (0,01 °С) |
| жидкая вода, лед I h и лед III | 209,9 МПа | 251 К (-22 ° С) |
| жидкая вода, лед III и лед V | 350,1 МПа | −17,0 °С |
| жидкая вода, лед V и лед VI | 632,4 МПа | 0,16 °С |
| лед I h , лед II и лед III | 213 МПа | −35 °С |
| лед II, лед III и лед V | 344 МПа | −24 °С |
| лед II, лед V и лед VI | 626 МПа | −70 °С |
Трехточечные ячейки
[ редактировать ]Трехточечные ячейки используются калибровке термометров . при Для выполнения сложных работ трехточечные ячейки обычно заполняются химическим веществом высокой чистоты, например водородом, аргоном, ртутью или водой (в зависимости от желаемой температуры). Чистота этих веществ может быть такой, что только одна часть на миллион является примесью, называемой «шесть девяток», поскольку ее чистота составляет 99,9999%. определенный изотопный состав (для воды VSMOW Используется ), поскольку изменения изотопного состава вызывают небольшие изменения в тройной точке. Ячейки с тройной точкой настолько эффективны для достижения высокоточных и воспроизводимых температур, что международный стандарт калибровки термометров под названием ITS-90 опирается на ячейки с тройной точкой из водорода , неона , кислорода , аргона , ртути и воды для определения шести ее температур. определенные температурные точки.
Таблица тройных очков
[ редактировать ]В этой таблице перечислены тройные точки газ-жидкость-твердое тело нескольких веществ. Если не указано иное, данные взяты из Национального бюро стандартов США (ныне NIST , Национальный институт стандартов и технологий). [9]
| Вещество | Т [ К ] ( °С ) | p [ кПа ]* ( атм ) |
|---|---|---|
| Ацетилен | 192,4 К (-80,7 ° С) | 120 кПа (1,2 атм) |
| Аммиак | 195,40 К (-77,75 ° С) | 6,060 кПа (0,05981 атм) |
| Аргон | 83,8058 К (-189,3442 ° С) | 68,9 кПа (0,680 атм) |
| Мышьяк | 1090 К (820 ° С) | 3628 кПа (35,81 атм) |
| Бутан [10] | 134,6 К (-138,6 ° С) | 7 × 10 −4 кПа (6,9 × 10 −6 банкомат) |
| Углерод ( графит ) | 4765 К (4492 ° С) | 10132 кПа (100,00 атм.) |
| Углекислый газ | 216,55 К (-56,60 ° С) | 517 кПа (5,10 атм) |
| Окись углерода | 68,10 К (-205,05 ° С) | 15,37 кПа (0,1517 атм) |
| Хлороформ [11] [12] | 209,61 К (-63,54 ° С) | ? |
| Дейтерий | 18,63 К (-254,52 ° С) | 17,1 кПа (0,169 атм) |
| Этан | 89,89 К (-183,26 ° С) | 1.1 × 10 −3 кПа (1,1 × 10 −5 банкомат) |
| Этанол [13] | 150 К (-123 ° С) | 4.3 × 10 −7 кПа (4,2 × 10 −9 банкомат) |
| Этилен | 104,0 К (-169,2 ° С) | 0,12 кПа (0,0012 атм) |
| Муравьиная кислота [14] | 281,40 К (8,25 °С) | 2,2 кПа (0,022 атм) |
| Гелий-4 (пар-He-I-He-II) [15] | 2,1768 К (-270,9732 ° С) | 5,048 кПа (0,04982 атм) |
| Гелий-4 ( ГПУ - ОЦК - He-II) [16] | 1,463 К (-271,687 ° С) | 26,036 кПа (0,25696 атм) |
| Гелий-4 (bcc-He-I-He-II) [16] | 1,762 К (-271,388 ° С) | 29,725 кПа (0,29336 атм) |
| Гелий-4 (hcp-bcc-He-I) [16] | 1,772 К (-271,378 ° С) | 30,016 кПа (0,29623 атм) |
| Гексафторэтан [17] | 173,08 К (-100,07 ° С) | 26,60 кПа (0,2625 атм) |
| Водород | 13,8033 К (-259,3467 ° С) | 7,04 кПа (0,0695 атм) |
| Водород-1 (Протий) [18] | 13,96 К (-259,19 ° С) | 7,18 кПа (0,0709 атм) |
| Хлороводород | 158,96 К (-114,19 ° С) | 13,9 кПа (0,137 атм) |
| Йод [19] | 386,65 К (113,50 °С) | 12,07 кПа (0,1191 атм) |
| изобутан [20] | 113,55 К (-159,60 ° С) | 1.9481 × 10 −5 кПа (1,9226 × 10 −7 банкомат) |
| Криптон | 115,76 К (-157,39 ° С) | 74,12 кПа (0,7315 атм) |
| Меркурий | 234,3156 К (-38,8344 ° С) | 1.65 × 10 −7 кПа (1,63 × 10 −9 банкомат) |
| Метан | 90,68 К (-182,47 ° С) | 11,7 кПа (0,115 атм) |
| Неон | 24,5561 К (-248,5939 ° С) | 43,332 кПа (0,42765 атм) |
| Оксид азота | 109,50 К (-163,65 ° С) | 21,92 кПа (0,2163 атм) |
| Азот | 63,18 К (-209,97 ° С) | 12,6 кПа (0,124 атм) |
| Закись азота | 182,34 К (-90,81 ° С) | 87,85 кПа (0,8670 атм) |
| Кислород | 54,3584 К (-218,7916 ° С) | 0,14625 кПа (0,0014434 атм) |
| Палладий | 1825 К (1552 ° С) | 3.5 × 10 −3 кПа (3,5 × 10 −5 банкомат) |
| Платина | 2045 К (1772 ° С) | 2 × 10 −4 кПа (2,0 × 10 −6 банкомат) |
| Радон | 202 К (-71 ° С) | 70 кПа (0,69 атм) |
| (моно)Силан [21] | 88,48 К (-184,67 ° С) | 0,019644 кПа (0,00019387 атм) |
| Диоксид серы | 197,69 К (-75,46 ° С) | 1,67 кПа (0,0165 атм) |
| Титан | 1941 К (1668 ° С) | 5.3 × 10 −3 кПа (5,2 × 10 −5 банкомат) |
| Гексафторид урана | 337,17 К (64,02 ° С) | 151,7 кПа (1,497 атм) |
| Ксенон | 161,3 К (-111,8 ° С) | 81,5 кПа (0,804 атм) |
| Цинк | 692,65 К (419,50 °С) | 0,065 кПа (0,00064 атм) |
Примечания:
- Для сравнения, типичное атмосферное давление составляет 101,325 кПа (1 атм).
- До нового определения единиц СИ тройная точка воды, 273,16 К, была точным числом.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Онлайн исправленная версия: (1994) « Тройная точка ». дои : 10.1351/goldbook.T06502 .
- ^ Джеймс Томсон (1873) «Количественное исследование некоторых отношений между газообразным, жидким и твердым состояниями водного вещества» , Труды Королевского общества , 22 : 27–36. Из сноски на странице 28: «…три кривые встречаются или пересекают друг друга в одной точке, которую я назвал тройной точкой ».
- ^ Определение кельвина в BIPM.
- ^ «Брошюра СИ: Международная система единиц (СИ) – 9-е издание» . БИПМ . Проверено 21 февраля 2022 г.
- ^ Международные уравнения для давления вдоль кривой плавления и сублимации обычного водного вещества . В. Вагнер, А. Саул и А. Прусс (1994), J. Phys. хим. Ссылка. Данные, 23 , 515.
- ^ Мерфи, DM (2005). «Обзор давления пара льда и переохлажденной воды для атмосферных применений» . Ежеквартальный журнал Королевского метеорологического общества . 131 (608): 1539–1565. Бибкод : 2005QJRMS.131.1539M . дои : 10.1256/qj.04.94 . S2CID 122365938 .
- ^ Карр, Майкл Х. (2007). Поверхность Марса . Издательство Кембриджского университета. п. 5 . ISBN 978-0-521-87201-0 .
- ^ Мерфи, DM (2005). «Обзор давления пара льда и переохлажденной воды для атмосферных применений» . Ежеквартальный журнал Королевского метеорологического общества . 131 (608): 1539–1565. Бибкод : 2005QJRMS.131.1539M . дои : 10.1256/qj.04.94 . S2CID 122365938 .
- ^ Ценгель, Юнус А.; Тернер, Роберт Х. (2004). Основы тепложидкостных наук . Бостон: МакГроу-Хилл. п. 78. ИСБН 0-07-297675-6 .
- ^ См. Бутан (страница данных).
- ^ См . Хлороформ (страница данных).
- ^ «Трихлорметан» . Интернет-книга NIST по химии, SRD 69 . NIST (Национальный институт науки и технологий) . Проверено 11 мая 2024 г.
- ^ См. Этанол (страница данных).
- ^ См. Муравьиную кислоту (страница данных).
- ^ Доннелли, Рассел Дж.; Баренги, Карло Ф. (1998). «Наблюдаемые свойства жидкого гелия при давлении насыщенного пара». Журнал физических и химических справочных данных . 27 (6): 1217–1274. Бибкод : 1998JPCRD..27.1217D . дои : 10.1063/1.556028 .
- ^ Перейти обратно: а б с Хоффер, Дж. К.; Гарднер, WR; Уотерфилд, КГ; Филлипс, штат Невада (апрель 1976 г.). «Термодинамические свойства 4 Он. II. Фаза ОЦК и фазовые диаграммы PT и VT ниже 2 К». Журнал физики низких температур . 23 (1): 63–102. Bibcode : 1976JLTP...23...63H . doi : 10.1007/BF00117245 . S2CID 120473493 .
- ^ См. Гексафторэтан (страница данных).
- ^ «Протий | изотоп | Британика» . 27 января 2024 г.
- ^ Валас, С.М. (1990). Химическое технологическое оборудование – выбор и проектирование . Амстердам: Эльзевир. п. 639. ИСБН 0-7506-7510-1 .
- ^ См . Изобутан (страница данных).
- ^ «Силан-газовая энциклопедия» . Газовая энциклопедия . Эйр Ликид.
Внешние ссылки
[ редактировать ] СМИ, связанные с Тройной точкой, на Викискладе?
СМИ, связанные с Тройной точкой, на Викискладе?
