Диаграмма Давенпорта
В кислотно-основной физиологии диаграмма Давенпорта представляет собой графический инструмент, разработанный Хорасом В. Давенпортом , который позволяет клиницисту или исследователю описывать в крови бикарбоната концентрации и pH крови после респираторного и / или метаболического кислотно-щелочного нарушения. На схеме изображена трехмерная поверхность, описывающая все возможные состояния равновесия между газообразным углекислым газом , водным раствором бикарбоната и водными протонами на физиологически сложной границе раздела альвеол легких химического и альвеолярных капилляров . Хотя поверхность, представленная на диаграмме, определена экспериментально, диаграмма Давенпорта редко используется в клинических условиях, но позволяет исследователю предвидеть влияние физиологических изменений на химический состав кислотно-основного состава крови. Для клинического использования есть две недавние инновации: кислотно-щелочная диаграмма, которая предоставляет текстовые описания отклонений. [1] и версию для большой высоты , содержащую текстовые описания, соответствующие высоте. [2]
Вывод
[ редактировать ]Когда образец крови подвергается воздействию воздуха, либо в альвеолах легких, либо в лабораторных экспериментах in vitro , углекислый газ в воздухе быстро вступает в равновесие с производными углекислого газа и другими веществами в водном растворе. Рисунок 1 иллюстрирует наиболее важные равновесные реакции углекислого газа в крови, связанные с кислотно-щелочной физиологией:
система HB/B Обратите внимание, что в этом уравнении буферная представляет собой все небикарбонатные буферы, присутствующие в крови, такие как гемоглобин в его различных протонированных и депротонированных состояниях. Поскольку в крови человека присутствует множество различных небикарбонатных буферов, состояние окончательного равновесия, достигаемое при любом заданном pCO 2 , является очень сложным и не может быть легко предсказано, используя только теорию. Изображая экспериментальные результаты, диаграмма Давенпорта обеспечивает простой подход к описанию поведения этой сложной системы.
На рисунке 2 показана диаграмма Давенпорта, обычно изображаемая в учебниках и литературе. Чтобы понять, как следует интерпретировать диаграмму, полезно в первую очередь понять, как она формируется. Рассмотрим следующий эксперимент. У здорового пациента берут небольшой образец крови и помещают в камеру, в которой парциальное давление углекислого газа (PCO 2 ) поддерживается на уровне 40 мм рт. ст. После достижения равновесия измеряют pH и концентрацию бикарбоната и наносят их на график, как показано на рис. 3.
Затем PCO 2 в камере поддерживается постоянным, в то время как pH образца крови изменяется сначала путем добавления сильной кислоты , затем путем добавления сильного основания . При изменении pH строится кривая титрования образца (рис. 4). Обратите внимание, что эта кривая титрования действительна только при PCO 2 40 мм рт. ст., поскольку на протяжении всего эксперимента в камере поддерживалось это парциальное давление.
Далее представьте, что экспериментатор получает новый, идентичный образец крови от того же пациента. Однако вместо помещения образца в камеру с PCO 2 40 мм рт. ст. в камере устанавливается значение P CO 2 60 мм рт. ст. После уравновешивания достигается новая точка, указывающая на новый pH и новую концентрацию бикарбоната (рис. 5). Обратите внимание, что концентрация бикарбоната при новом, более высоком PCO 2 больше , чем при первом измерении, тогда как pH теперь меньше. Ни один из результатов не должен вызывать удивления. Увеличение PCO 2 означает , что общее количество углекислого газа в системе увеличилось. Поскольку газообразный диоксид углерода находится в равновесии с производными диоксида углерода в растворе, концентрации производных диоксида углерода, включая бикарбонат, также должны увеличиться. Падение pH также неудивительно, поскольку образование молекулы бикарбоната сопровождается высвобождением протона (см. рис. 1).
Если тот же самый эксперимент повторить при различных парциальных давлениях углекислого газа, будет получен ряд точек. Через эти точки можно провести линию, называемую буферной линией (рис. 6).
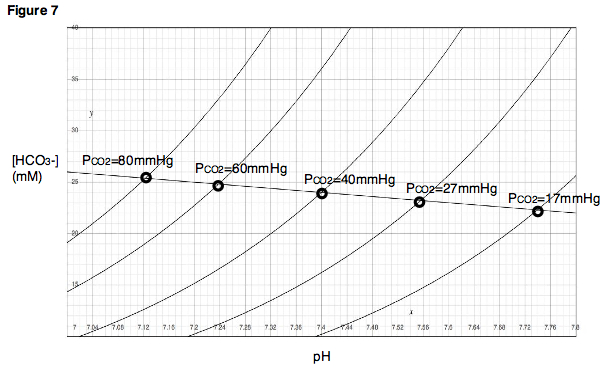
Буферная линия может быть использована для прогнозирования результата изменения P CO 2 в диапазоне, близком к экспериментально определенным точкам. Кроме того, для каждой экспериментальной точки можно провести эксперимент по титрованию, в котором pH варьируется, в то время как P CO 2 поддерживается постоянным, и кривые титрования могут быть построены для каждого парциального давления диоксида углерода (рис. 7). На диаграмме Давенпорта эти кривые титрования называются изоплетами , поскольку они создаются при фиксированном парциальном давлении углекислого газа.
Ключевой концепцией понимания диаграммы Давенпорта является то, что при увеличении PCO 2 величина результирующего изменения pH зависит от буферной способности небикарбонатных буферов, присутствующих в растворе. Если присутствуют сильные небикарбонатные буферы, то они быстро поглотят подавляющее большинство протонов, высвобождаемых при образовании бикарбоната, и pH изменится очень мало при данном повышении концентрации бикарбоната. В результате получится буферная линия с очень крутым уклоном (рис. 8). С другой стороны, если присутствуют только слабые небикарбонатные буферы (или если небикарбонатный буфер вообще отсутствует), то при данном изменении концентрации бикарбоната будет наблюдаться гораздо большее изменение pH, и линия буфера будет иметь наклон, близкий к нулю.
Поучительно отметить, что наклон бикарбонатной линии фактически никогда не достигнет нуля (т. е. никогда не будет горизонтальным) в условиях равновесия, даже при полном отсутствии небикарбонатных буферов. Это связано с тем, что образование протонов в результате увеличения PCO 2 одновременно с образованием ионов бикарбоната, как упоминалось ранее. Таким образом, снижение pH в результате увеличения PCO 2 всегда должно происходить при некотором минимальном увеличении концентрации бикарбоната. Аналогично, повышение pH по тем же причинам должно происходить при некотором минимальном снижении концентрации бикарбоната.
Двумерное представление трехмерной поверхности
[ редактировать ]Напомним, что зависимость, представленная на диаграмме Давенпорта, представляет собой связь между тремя переменными: P CO 2 , концентрацией бикарбоната и pH. Таким образом, рис. 7 можно рассматривать как топографическую карту , то есть двумерное представление трехмерной поверхности, где каждая изоплета указывает на различное парциальное давление или «высоту».
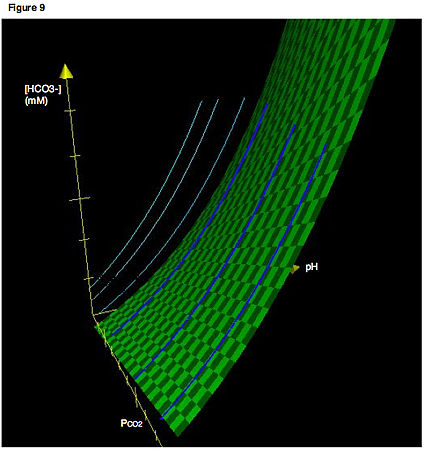
Более точное изображение будет включать три оси. На рисунке 9 показана диаграмма Давенпорта в трех измерениях. Голубые линии обозначают изоплеты в том виде, в каком мы их обычно встречаем, ограниченные двумерной плоскостью. Темно-синие кривые показывают фактическое расположение изоплет в трех измерениях. Таким образом, голубые линии — это просто проекции изоплет трехмерного пространства на двумерную плоскость. Опять же, вспомним, что изоплета — это всего лишь кривая титрования, то есть путь, который прослеживается, если pH изменяется, а PCO 2 поддерживается постоянным. Зеленая поверхность описывает все комбинации P CO 2 , [HCO 3 − ] и pH, которые удовлетворяют равновесию системы. Все изоплеты в их фактической трехмерной ориентации должны быть ограничены этой поверхностью.
Вторая ключевая концепция заключается в том, что движение вдоль буферной линии должно соответствовать изменению PCO 2 . Таким образом, как и изоплеты, буферная линия, нарисованная на типичной диаграмме Давенпорта (например, рис. 6), на самом деле представляет собой проекцию линии, существующей в трехмерном пространстве, на двумерную плоскость. Как и в случае с изоплетами, буферные линии в их фактической трехмерной ориентации ограничены поверхностью, представляющей значения P CO 2 , [HCO 3 − ] и pH, которые удовлетворяют равновесию системы. На рис. 10 темно-красные линии — это реальные буферные линии в трехмерном пространстве, а светло-красные линии — это проекции буферных линий на двумерную плоскость. (Позже мы увидим, как можно определить несколько параллельных буферных линий для данной системы).
Респираторные и метаболические нарушения кислотно-щелочного режима.
[ редактировать ]Одной из наиболее важных особенностей диаграммы Давенпорта является ее полезность для изображения движения от одной точки поверхности равновесия к другой в результате изменений дыхания и/или метаболизма . Могут возникнуть четыре фундаментальных изменения, которые влияют на кислотно-щелочной баланс в организме: респираторный ацидоз , респираторный алкалоз , метаболический ацидоз и метаболический алкалоз . Кроме того, одновременно могут возникать респираторные и метаболические нарушения, например респираторный ацидоз с последующим компенсаторным сдвигом в сторону метаболического алкалоза.
Дыхательные нарушения
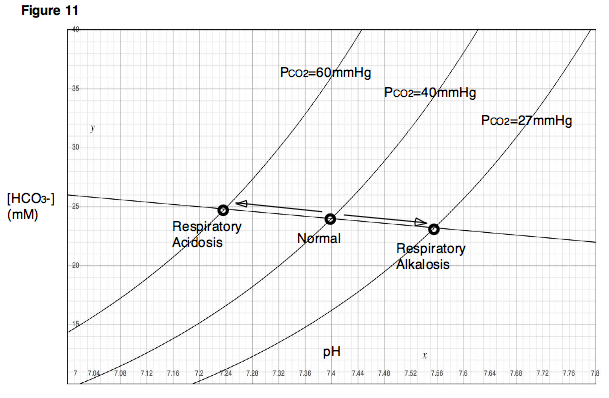
[ редактировать ]Чтобы понять, как изменения дыхания могут повлиять на pH крови , рассмотрим влияние вентиляции на PCO 2 в легких. Если бы кто-то задержал дыхание (или дышал очень медленно, как в случае с угнетением дыхания ), кровь продолжала бы доставлять углекислый газ к альвеолам легких, и количество углекислого газа в легких увеличилось бы. С другой стороны, если бы кто-то гипервентилировал , то свежий воздух попал бы в легкие, и углекислый газ быстро бы выдулся. В первом случае, поскольку в легких накапливается углекислый газ, альвеолярное PCO 2 становится очень высоким. Во втором случае, поскольку углекислый газ быстро выходит из легких, альвеолярное P CO 2 будет очень низким. Обратите внимание, что эти две ситуации, угнетение дыхания и гипервентиляция, производят эффекты, которые непосредственно аналогичны описанному ранее эксперименту, в котором изменялось парциальное давление углекислого газа и наблюдались результирующие изменения pH. Как видно из диаграммы Давенпорта, угнетение дыхания, что приводит к высокому P CO 2 снижает pH крови. Гипервентиляция будет иметь противоположный эффект. Снижение pH крови вследствие угнетения дыхания называется респираторным ацидозом. Повышение рН крови вследствие гипервентиляции называется респираторным алкалозом (рис. 11).
Метаболические нарушения
[ редактировать ]Изменения метаболического состава крови также могут влиять на pH крови. Опять же, вспомните наш первоначальный эксперимент: если к образцу крови добавить сильную кислоту или сильное основание, pH и концентрация бикарбоната соответственно изменятся, что приведет к появлению кривой титрования. гидроксида Например, ионы при добавлении в раствор вступают в реакцию со свободными ионами водорода и повышают pH раствора. Кроме того, ионы гидроксида будут отрывать протоны от угольной кислоты в растворе, вызывая увеличение концентрации бикарбоната. Новое положение на диаграмме после добавления гидроксид-ионов больше не лежит на нашей исходной буферной линии. Однако если теперь изменить PCO 2 без дальнейшего добавления к раствору сильной кислоты или сильного основания, можно определить новую буферную линию, которая лежит выше и примерно параллельно исходной буферной линии.
Аналогичным образом, в такой физиологической системе, как живой организм, удаление протонов, например, путем рвоты кислым содержимым желудка , приведет к увеличению pH и увеличению концентрации бикарбоната, что приведет систему к новому, более высокому состоянию. буферная линия. Такое нарушение называется метаболическим алкалозом (рис. 12). Альтернативно, если протоны добавляются в кровоток в форме кислых метаболитов , как это происходит при диабетическом кетоацидозе , тогда pH падает вместе с концентрацией бикарбоната. Этот тип нарушений называется метаболическим ацидозом. В случае метаболического ацидоза новая буферная линия располагается ниже исходной линии.
Ссылки
[ редактировать ]- ^ Грогоно, Алан (1 апреля 2019 г.). «Отчеты о кислотно-основном составе требуют текстового пояснения» . Анестезиология . 130 (4): 668–669. дои : 10.1097/ALN.0000000000002628 . Проверено 1 апреля 2019 г.
- ^ Грогоно, Алан (1 января 2021 г.). «Корректировка интерпретации кислотного основания для больших высот» . Анестезиология . 134 (1): 133–135. дои : 10.1097/ALN.0000000000003581 . Проверено 1 января 2021 г.
- Давенпорт, Гораций В. (1974). Азбука кислотно-щелочной химии: элементы физиологической химии газов крови для студентов-медиков и врачей (Шестое изд.). Чикаго: Издательство Чикагского университета.
- Борон, Уолтер Ф. и Булпап, Эмиль Л. (2003). Медицинская физиология: клеточный и молекулярный подход. Филадельфия: Сондерс.