Вариант поверхностного гликопротеина
| Гликопротеин с переменной поверхностью | |
|---|---|
| Идентификаторы | |
| Организм | |
| Символ | ТБ927.5.4730 |
| Альт. символы | ТБ05.26С7.380 |
| Входить | 3657576 |
| Другие данные | |
| хромосома | 5: 1,41 - 1,41 Мб |
| Вариант поверхностного гликопротеина MITAT 1.2 | |||
|---|---|---|---|
| Идентификаторы | |||
| Организм | |||
| Символ | Н/Д | ||
| Альт. символы | ВСГ 221 | ||
| ЮниПрот | P26332 | ||
| |||
Вариантный поверхностный гликопротеин ( VSG ) представляет собой белок размером ~60 кДа, который плотно упаковывает поверхность клеток простейших принадлежащих паразитов, к роду Trypanosoma . Этот род известен своими белками клеточной поверхности. Впервые они были выделены из Trypanosoma brucei в 1975 году Джорджем Кроссом . [ 1 ] VSG позволяет трипаносоматидным паразитам уклоняться от иммунной системы хозяина-млекопитающего за счет обширных антигенных вариаций . Они образуют поверхностный слой толщиной 12–15 нм. Димеры VSG составляют ~90% всего белка клеточной поверхности и ~10% общего клеточного белка. [ нужна ссылка ] По этой причине эти белки обладают высокой иммуногенностью, и иммунный ответ, возникающий против специфической оболочки VSG, быстро убивает трипаносомы, экспрессирующие этот вариант. Однако при каждом делении клеток существует вероятность того, что потомство переключит экспрессию, чтобы изменить экспрессируемый VSG. VSG не имеет предписанной биохимической активности.

Паразит имеет большой клеточный репертуар антигенно различных VSG (~1500/2000 [ нужна ссылка ] полные и частичные ( псевдогены ) расположенные в теломерных и субтеломерных массивах (на мегабазных хромосомах или минихромосомах ). VSG экспрессируются из сайта экспрессии кровотока (BES, ES) в полицистроне с помощью РНК-полимеразы I рибосомного типа (рекрутированной на промоторе ) с другими ES-ассоциированными генами (ESAG), из которых рецептор трансферрина (Tfr: ESAG6, ESAG7) один. Одновременно экспрессируется только один ген VSG, поскольку в клетке активен только один из ~15 ES. Экспрессия VSG «переключается» за счет гомологичной рекомбинации молчащей базовой копии гена из массива (направленной гомологией) в активный сайт экспрессии, расположенный в теломерах. [ 2 ] Во время этого перехода трипаносомы одновременно отображают на своей поверхности VSG как до, так и после переключения. Этот процесс замены оболочки имеет решающее значение для выживания недавно переключенных клеток, поскольку начальные VSG остаются мишенями для возрастающего ответа антител хозяина. Мозаичные гены VSG могут быть созданы путем гомологичной рекомбинации частичного гена VSG из массива. Этот частичный ген может заменить любую часть существующего гена VSG, создавая новый мозаичный VSG. Измерения периода полураспада VSG позволяют предположить, что первоначальные VSG могут сохраняться на поверхности генетически переключенных трипаносом в течение нескольких дней. Остается неясным, является ли регуляция переключения VSG чисто стохастической или на частоту переключения влияют стимулы окружающей среды. Тот факт, что переключение происходит in vitro, предполагает, что в этом процессе есть по крайней мере некоторый независимый от хозяина стохастический элемент.
Антигенная вариация вызывает циклические волны паразитемии, что является одной из характеристик африканского трипаносомоза человека . Циклический процесс занимает 5–8 дней. Это происходит потому, что разнообразие слоев, экспрессируемых популяцией трипаносом, означает, что иммунная система всегда отстает на шаг: для развития иммунного ответа против данного VSG требуется несколько дней, что дает популяции время для диверсификации по мере дальнейшего переключения особей. события. Повторение этого процесса предотвращает исчезновение заражающей популяции трипаносом, обеспечивая хроническое сохранение паразитов в организме хозяина и увеличивая возможности передачи.
В Trypanosoma brucei
[ редактировать ]У Trypanosoma brucei поверхность клеток покрыта плотным слоем размером ~5 х 10 6 ВСГ димеры , [ 3 ] ~90% всего белка клеточной поверхности и ~10% общего клеточного белка. [ нужна ссылка ]
Свойства оболочки VSG, позволяющие уклоняться от иммунитета:
- Экранирование - плотная природа оболочки VSG (белки VSG упаковываются плечом к плечу) предотвращает доступ иммунной системы хозяина-млекопитающего к плазматической мембране или любым другим паразитическим инвариантным поверхностным эпитопам (таким как ионные каналы , транспортеры , рецепторы и т. д.). ). Оболочка однородная, состоящая из миллионов копий одной и той же молекулы; следовательно, VSG — единственная часть трипаносомы, которую может распознать иммунная система. [ 4 ]
- Периодические антигенные вариации : оболочка VSG подвергается частым стохастическим генетическим модификациям — «переключениям», позволяющим вариантам, экспрессирующим новую оболочку VSG, избежать специфического иммунного ответа, возникшего против предыдущей оболочки. Эта антигенная вариация создает циклические волны паразитемии, характерные для африканского трипаносомоза человека. [ 5 ]
- «Очистка» антигена и рециркуляция VSG. VSG эффективно перерабатывается через жгутиковый карман трипаносомы, позволяя антителам «очищаться» от VSG перед повторным включением обратно в клеточную мембрану. Важно отметить, что VSG, распознаваемые и связываемые антителами, избирательно продвигаются к жгутиковому карману с большей скоростью, чем неидентифицированные VSG; в этом сценарии антитело действует как «парус», который ускоряет процесс доставки VSG в зону переработки. [ 6 ]
VSG T. brucei прикрепляются к плазматической мембране посредством ковалентного присоединения к двум гликозилфосфатидилинозитоловым (GPI) якорям (по одному на мономер ). [ 7 ] который направляет его прямую доставку из ЭР в жгутиковый карман для включения в мембрану, как предсказывает гипотеза валентности GPI. [ 8 ] [ 9 ]
VSG заменяются столь же плотным слоем проциклинов , когда паразит дифференцируется в проциклическую форму в средней кишке мухи цеце . Происходит очень быстрое ингибирование транскрипции гена VSG, которое происходит при понижении температуры. [ 10 ]
Выражение
[ редактировать ]Источником изменчивости VSG во время заражения является большой «архив» генов VSG , присутствующий в T. brucei геноме . Некоторые из них представляют собой полноразмерные интактные гены ; другие являются псевдогенами (обычно с мутациями со сдвигом рамки считывания , преждевременными стоп-кодонами или фрагментацией). [ 11 ] Экспрессия антигенно отличающегося VSG может происходить путем простого переключения на другой полноразмерный ген VSG путем переключения сайта экспрессии (переключение того, какой ES активен). Кроме того, химерные или «мозаичные» гены VSG могут быть созданы путем объединения сегментов более чем одного молчащего гена VSG . Формирование мозаичных VSG позволяет (частично) экспрессировать псевдогены VSG , которые могут составлять основную часть архива VSG и могут непосредственно способствовать антигенной изменчивости, значительно увеличивая способность трипаносом к уклонению от иммунной системы и создавая серьезную проблему для разработка вакцины . [ 12 ]
Гены VSG могут молчать и включаться в любой момент времени. Экспрессированный VSG всегда расположен в сайте экспрессии (ES), который представляет собой специализированные локусы экспрессии , обнаруженные в теломерах некоторых крупных и промежуточных хромосом. Каждый ES представляет собой полицистронную единицу, содержащую ряд генов, связанных с сайтом экспрессии (ESAG), которые экспрессируются вместе с активным VSG. Хотя существует несколько ES, одновременно активен только один. В этом процессе, по-видимому, участвует ряд механизмов, но точная природа молчания до сих пор неясна. [ 13 ]
Экспрессированный VSG можно переключить либо путем активации другого сайта экспрессии (и, таким образом, изменения для экспрессии VSG в этом сайте), либо путем замены гена VSG в активном сайте на другой вариант. Геном содержит множество копий генов VSG как на минихромосомах, так и в повторяющихся участках внутри хромосом. Обычно они молчат, обычно с опущенными участками или преждевременными стоп-кодонами, но важны для эволюции новых генов VSG. По оценкам, до 10% генома T.brucei может состоять из генов или псевдогенов VSG . Любой из этих генов можно переместить в активный сайт путем рекомбинации для экспрессии. Опять же, точные механизмы, которые контролируют это, неясны, но этот процесс, по-видимому, основан на механизме восстановления ДНК и процессе гомологичной рекомбинации . [ 14 ]
Сайт экспрессии кровотока (BES), или сайт теломерной экспрессии, используется для обмена вариантными поверхностными гликопротеинами, когда они находятся в кровотоке хозяина, чтобы избежать системы комплемента . BES полиморфны по размеру и структуре, но обнаруживают удивительно консервативную архитектуру в контексте обширной рекомбинации. Действительно существуют очень маленькие BES, и многие функционирующие BES не содержат полного набора генов, связанных с сайтом экспрессии (ESAG). [ 15 ] Существует коллекция из примерно 20-30 сайтов, каждый из которых активен одновременно. [ 16 ] Активные сайты экспрессии VSG лишены нуклеосом . [ 17 ]
Репертуар генов T. brucei разошелся и стал штаммоспецифичным. [ 18 ]
Вариантные гены поверхностных гликопротеинов T. brucei были разделены на две группы в зависимости от того, наблюдается или нет дупликация генов при их экспрессии. [ 19 ]

Секретарный оборот
[ редактировать ]Трипаносомы имеют простую поляризованную мембранную транспортную систему, состоящую из одной ЭР , лизосомы и аппарата Гольджи .
VSG сначала транскрибируется как полицистрон, а затем подвергается трипаносоматид-специфическому полиаденилированию и транс-сплайсингу, управляемому полипиримидиновыми путями . Поскольку транскрипционного контроля нет, 3'UTR VSG важен для стабильности его РНК (наиболее важно, 8-мерного и 14-мерного). Затем VSG транскрибируется на мембраносвязанных полисомах , и появление N-концевой сигнальной последовательности направляет VSG в ЭР. Таким образом, VSG котрансляционно транспортируется в просвет ЭР, быстро N-гликозилируется (на сайтах asn-x-ser/thr) и GPI закрепляется в сайте ω посредством реакции трансаминирования (удаление С-концевых гидрофобных 17 или 23 аминокислотных остатков). Последовательность привязки GPI). Сайт ω всегда представляет собой Ser (обычно в пептидах с сигнальной последовательностью из 17 аминокислот), Asp (обычно в пептидах с сигнальной последовательностью из 23 аминокислот) или Asn. Также может варьироваться количество сайтов N-гликозилирования на VSG (обычно 1-3 N-гликана). VSG MITat.1.5 гликозилирован по всем трем потенциальным сайтам N-гликозилирования. [ 20 ]
Затем VSG подвергается циклу сворачивания кальретикулин / кальнексин (кальнексин отсутствует у Trypanosoma brucei ), где он временно моноглюкозилируется и деглюкозилируется и взаимодействует с различными белками-шаперонами ER, такими как BiP, для правильного сворачивания. VSG эффективно сворачивается и димеризуется (что указывает на благоприятную структуру складки) и транспортируется через аппарат Гольджи в жгутиковый карман для включения в клеточную мембрану.
Важно отметить, что после включения в клеточную мембрану VSG может позже быть повторно использован через жгутиковый карман и снова отсортирован на поверхности клетки. VSG не подвергается лизосомальным или протеосомным каноническим путям деградации, [ 21 ] но вместо этого теряется из клетки в результате специфического расщепления якоря GPI с помощью GPI-специфического PLC .
Структура
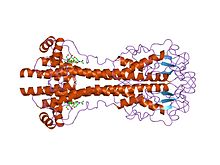
[ редактировать ]Гены VSG чрезвычайно изменчивы на уровне последовательности (первичном), но считается, что варианты имеют строго консервативные структурные (третичные) особенности, основанные на двух определенных трехмерных структурах. [ 22 ] и сохранение мотивов двумерной последовательности (нисходящие и восходящие альфа-спирали, составляющие интерфейс димеризации), что позволяет им выполнять аналогичную защитную функцию. [ 23 ] VSG состоят из N-концевого домена , состоящего примерно из 300–350 аминокислот с низкой гомологией последовательностей (идентичность 13–30%), и более консервативного С-концевого домена, состоящего из ~ 100 аминокислот. N-концевые домены сгруппированы в классы AC в зависимости от структуры их цистеина. С-концевые домены сгруппированы по гомологии последовательностей в классы I-III, по-видимому, без ограничений на то, с какими N-концевыми классами они могут соединяться, образуя полный VSG. Для димеризации N-концевые домены VSG образуют пучок из четырех альфа-спиралей, направляемых гидрофобными взаимодействиями, вокруг которых нависают более мелкие структурные элементы (пять меньших спиралей и три бета-листа).
VSG прикрепляется к клеточной мембране с помощью гликофосфатидилинозитолового (GPI) якоря — нековалентной связи от С-конца, которая направляет его прямой транспорт от ЭР к мембране. Этот якорь GPI специфически расщепляется фосфолипазой C GPI, расщепляя мембранную форму VSG и позволяя белку VSG и части якоря GPI потеряться во внеклеточную среду в виде растворимого VSG (sVSG, который можно распознать как перекрестно реагирующий Детерминантный, или CRD), сохраняя при этом две цепи 1,2-димиристолглицерина в мембране.
Антигенная вариация
[ редактировать ]VSG обладает высокой иммуногенностью , и иммунный ответ, возникающий против специфической оболочки VSG, быстро убивает трипаносомы, экспрессирующие этот вариант. Опосредованное антителами уничтожение трипаносом также можно наблюдать in vitro с помощью , опосредованного комплементом лизиса анализа . Однако при каждом делении клеток существует вероятность того, что одно или оба потомства изменят экспрессию, чтобы изменить экспрессируемый VSG. Измеренная частота переключения VSG составляет примерно 0,1% на деление. [ 24 ] хотя скорость переключения действительно различается в культуре и в естественных условиях . Поскольку популяция T. brucei может достигать максимального размера в 10 особей, 11 внутри хоста [ 25 ] такая быстрая скорость переключения гарантирует постоянное разнообразие популяции паразитов. Разнообразный диапазон оболочек, выраженный популяцией трипаносом, означает, что иммунная система всегда отстает на шаг: для развития иммунного ответа против данного VSG требуется несколько дней, что дает популяции время для диверсификации по мере того, как люди подвергаются дальнейшим переключениям. Повторение этого процесса предотвращает исчезновение заражающей популяции трипаносом, обеспечивая хроническое персистенцию паразитов в организме хозяина, увеличивая возможности передачи. Клиническим эффектом этого цикла являются последовательные «волны» паразитемии (трипаносомы в крови). [ 3 ]
У других трипаносом
[ редактировать ]Вариабельные поверхностные гликопротеины обнаружены и у других Trypanosoma видов .
У Trypanosoma Equiperdum , паразита, вызывающего покровную болезнь у лошадей, эти белки позволяют паразиту эффективно уклоняться от иммунной системы животного-хозяина. [ 26 ] Эти VSG позволяют организму постоянно манипулировать и изменять поверхностную структуру своих белков, что означает, что он постоянно представляется иммунной системе как новый чужеродный организм, и это не позволяет организму создать достаточно сильный иммунный ответ, чтобы искоренить болезнь. [ 26 ] В этом смысле Trypanosoma Equiperdum — очень эффективный организм; он может заразить меньше видов, чем другие болезни, но он очень эффективно заражает и выживает внутри определенных хозяев. Белки VSG у T.equiperdum также фосфорилированы . [ 27 ]
Ген VSG Trypanosoma evansi , паразита, вызывающего форму сурры у животных, был клонирован в Escherichia coli . Экспрессированный белок иммунореактивен со всеми комбинациями сывороток. Животные, иммунизированные цельноклеточным лизатом или рекомбинантным белком, демонстрируют сходные реакции антител в ИФА (иммуноферментный анализ) и КАТТ ( карточный тест агглютинации на трипаносомоз ). [ 28 ] с вариабельным поверхностным гликопротеином RoTat 1.2 ПЦР может использоваться в качестве специфического диагностического инструмента для выявления инфекций T. evansi . [ 29 ]
Самый маленький белок VSG (размером 40 кДа) на сегодняшний день (1996 г.) был обнаружен у Trypanosoma vivax , который содержит мало углеводов. [ 30 ]
У Trypanosoma congolense анализы in vitro включенных сахаров после гидролиза гликопротеина показали, что глюкозамин и манноза используются непосредственно в биосинтезе углеводной части, тогда как галактоза, возможно, преобразуется в другие промежуточные соединения перед включением в антиген. Негликозилированный ВСГ с молекулярной массой 47 кДа полностью утратил размерную гетерогенность. [ 31 ]
См. также
[ редактировать ]- Амастин , еще один поверхностный (трансмембранный) гликопротеин трипаносоматидных паразитов. [ 32 ]
- Белок оболочки (значения)
- гликокаликс
- Список кодов MeSH (D23)
- Список кодов MeSH (D12.776.395)
- Список кодов MeSH (D12.776.543)
Ссылки
[ редактировать ]- ^ Кросс Г.А. (1975). «Идентификация, очистка и свойства клоноспецифичных гликопротеиновых антигенов, составляющих поверхностную оболочку Trypanosoma brucei». Паразитология . 71 (3): 393–417. дои : 10.1017/s003118200004717x . ПМИД 645 . S2CID 20749130 .
- ^ Бак Г.А., Жакмо С., Бальц Т., Эйзен Х. (декабрь 1984 г.). «Реэкспрессия инактивированного гена вариабельного поверхностного гликопротеина у Trypanosoma Equiperdum». Джин . 32 (3): 329–36. дои : 10.1016/0378-1119(84)90008-8 . ПМИД 6530143 .
- ^ Jump up to: а б Барри Дж. Д., Маккалок Р. (2001). «Антигенная вариация трипаносом: усиленная фенотипическая изменчивость эукариотического паразита». Достижения паразитологии Том 49 . Том. 49. стр. 1–70. дои : 10.1016/S0065-308X(01)49037-3 . ISBN 978-0-12-031749-3 . ПМИД 11461029 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Оверат П., Чаудри М., Стевердинг Д., Зигельбауэр К. (февраль 1994 г.). «Инвариантные поверхностные белки в формах кровотока Trypanosoma brucei». Паразитология сегодня . 10 (2): 53–8. дои : 10.1016/0169-4758(94)90393-X . ПМИД 15275499 .
- ^ Росс Р., Томсон Д. (июнь 1910 г.). «Обнаружен случай сонной болезни, показывающий регулярное периодическое увеличение количества паразитов» . Британский медицинский журнал . 1 (2582): 1544–5. дои : 10.1136/bmj.1.2582.1544 . ПМК 2331906 . ПМИД 20765166 .
- ^ Руденко Г (24 октября 2011 г.). «Африканские трипаносомы: геном и приспособления для уклонения от иммунитета». Очерки по биохимии . 51 : 47–62. дои : 10.1042/bse0510047 . ПМИД 22023441 .
- ^ Граб Дж., Верджи Ю. «Локализация переменной поверхности гликопротеина, фосфатидилинозитол-специфической фосфолипазы-C в Trypanosoma brucei brucei» . Хранилище корпоративных документов ФАО . Продовольственная и сельскохозяйственная организация Объединенных Наций. Архивировано из оригинала 31 августа 2018 г. Проверено 28 июля 2013 г.
- ^ Вице-президент Триггса, Джей Ди Бэнгс (февраль 2003 г.). «Гликозилфосфатидилинозитол-зависимый транспорт белков на стадии кровотока Trypanosoma brucei» . Эукариотическая клетка . 2 (1): 76–83. дои : 10.1128/ec.2.1.76-83.2003 . ПМЦ 141176 . ПМИД 12582124 .
- ^ Шварц К.Дж., Пек Р.Ф., Тазе Н.Н., Бэнгс Дж.Д. (декабрь 2005 г.). «Валентность GPI и судьба секреторных мембранных белков в африканских трипаносомах». Журнал клеточной науки . 118 (Часть 23): 5499–511. дои : 10.1242/jcs.02667 . ПМИД 16291721 .
- ^ Пэйс Э, Кокеле Х, Пэйс А, Тебаби П, Штайнерт М (сентябрь 1989 г.). «Trypanosoma brucei: посттранскрипционный контроль сайта экспрессии генов вариабельного поверхностного гликопротеина» . Молекулярная и клеточная биология . 9 (9): 4018–21. дои : 10.1128/mcb.9.9.4018 . ПМЦ 362464 . ПМИД 2779574 .
- ^ Марчелло Л., Барри Джей Ди (сентябрь 2007 г.). «Анализ молчащего архива гена VSG у Trypanosoma brucei показывает, что мозаичная экспрессия генов играет важную роль в антигенных вариациях и ей благоприятствует субструктура архива» . Геномные исследования . 17 (9): 1344–52. дои : 10.1101/гр.6421207 . ПМК 1950903 . ПМИД 17652423 .
- ^ Барбур А.Г., Рестрепо Б.И. (2000). «Антигенная изменчивость трансмиссивных патогенов» . Новые инфекционные заболевания . 6 (5): 449–57. дои : 10.3201/eid0605.000502 . ПМК 2627965 . ПМИД 10998374 .
- ^ Платит E (ноябрь 2005 г.). «Регуляция экспрессии генов антигенов у Trypanosoma brucei». Тенденции в паразитологии . 21 (11): 517–20. дои : 10.1016/j.pt.2005.08.016 . ПМИД 16126458 .
- ^ Моррисон Л.Дж., Марчелло Л., Маккалок Р. (декабрь 2009 г.). «Антигенная вариация африканской трипаносомы: молекулярные механизмы и фенотипическая сложность» (PDF) . Клеточная микробиология . 11 (12): 1724–34. дои : 10.1111/j.1462-5822.2009.01383.x . ПМИД 19751359 . S2CID 26552797 .
- ^ Герц-Фаулер С, Фигейредо Л.М., Куэйл М.А., Беккер М., Джексон А., Бэйсон Н., Брукс К., Черчер С., Фахкро С., Гудхед И., Хит П., Картвелишвили М., Мангалл К., Харрис Д., Хаузер Х., Сандерс М., Сондерс Д., Сигер К., Шарп С., Тейлор Дж.Э., Уокер Д., Уайт Б., Янг Р., Кросс Г.А., Руденко Г., Барри Дж.Д., Луи Э.Дж., Берриман М. (2008). «Теломерные сайты экспрессии у Trypanosoma brucei высоко консервативны» . ПЛОС ОДИН . 3 (10): е3527. Бибкод : 2008PLoSO...3.3527H . дои : 10.1371/journal.pone.0003527 . ПМК 2567434 . ПМИД 18953401 .
- ^ Ванхамм Л., Лекордье Л., Пэйс Э. (май 2001 г.). «Контроль и функция сайтов экспрессии поверхностных гликопротеинов кровотока у Trypanosoma brucei». Международный журнал паразитологии . 31 (5–6): 523–31. дои : 10.1016/S0020-7519(01)00143-6 . ПМИД 11334937 .
- ^ Станне Т.М., Руденко Г. (январь 2010 г.). «Активные сайты экспрессии VSG у Trypanosoma brucei обеднены нуклеосомами» . Эукариотическая клетка . 9 (1): 136–47. дои : 10.1128/EC.00281-09 . ПМК 2805301 . ПМИД 19915073 .
- ^ Хатчинсон О.К., Пикоцци К., Джонс Н.Г., Мотт Х., Шарма Р., Уэлберн С.К., Кэррингтон М. (июль 2007 г.). «Вариантные репертуары генов поверхностных гликопротеинов у Trypanosoma brucei разошлись и стали штаммоспецифичными» . БМК Геномика . 8 : 234. дои : 10.1186/1471-2164-8-234 . ЧВК 1934917 . ПМИД 17629915 .
- ^ Янг-младший, Тернер М.Дж., Уильямс Р.О. (1984). «Роль дупликации в экспрессии вариабельного гена поверхностного гликопротеина Trypanosoma brucei». Журнал клеточной биохимии . 24 (3): 287–95. дои : 10.1002/jcb.240240309 . ПМИД 6736139 . S2CID 73535 .
- ^ Мелерт А., Бонд К.С., Фергюсон М.А. (октябрь 2002 г.). «Гликоформы поверхностного гликопротеина варианта Trypanosoma brucei и молекулярное моделирование гликозилированного поверхностного слоя». Гликобиология . 12 (10): 607–12. дои : 10.1093/гликоб/cwf079 . ПМИД 12244073 .
- ^ Тиенгве С., Мураторе К.А., Бэнгс Дж.Д. (ноябрь 2016 г.). «Поверхностные белки, ERAD и антигенные вариации Trypanosoma brucei» . Клеточная микробиология . 18 (11): 1673–1688. дои : 10.1111/cmi.12605 . ПМЦ 5575760 . ПМИД 27110662 .
- ^ Фрейманн Д., Даун Дж., Кэррингтон М., Родити И., Тернер М., Уайли Д. (1990). «Структура с разрешением 2,9 Å N-концевого домена варианта поверхностного гликопротеина Trypanosoma brucei». Журнал молекулярной биологии . 216 (1): 141–60. дои : 10.1016/S0022-2836(05)80066-X . ПМИД 2231728 .
- ^ Блюм М.Л., Даун Дж.А., Гернетт А.М., Кэррингтон М., Тернер М.Дж., Уайли, округ Колумбия (апрель 1993 г.). «Структурный мотив варианта поверхностных гликопротеинов Trypanosoma brucei». Природа . 362 (6421): 603–9. Бибкод : 1993Natur.362..603B . дои : 10.1038/362603a0 . ПМИД 8464512 . S2CID 4370099 .
- ^ Тернер CM (август 1997 г.). «Степень антигенной изменчивости при инфекциях Trypanosoma brucei, передающихся мухами и шприцами». Письма FEMS по микробиологии . 153 (1): 227–31. дои : 10.1111/j.1574-6968.1997.tb10486.x . ПМИД 9252591 .
- ^ Барри Дж.Д., Холл Дж.П., Плендерлейт Л. (сентябрь 2012 г.). «Гиперэволюция генома и успех паразита» . Анналы Нью-Йоркской академии наук . 1267 (1): 11–7. Бибкод : 2012NYASA1267...11B . дои : 10.1111/j.1749-6632.2012.06654.x . ПМЦ 3467770 . ПМИД 22954210 .
- ^ Jump up to: а б Райбо А., Гайяр С., Лонгакр С., Хибнер У., Бак Г., Бернарди Г., Эйзен Х. (июль 1983 г.). «Геномная среда вариантов генов поверхностных антигенов Trypanosoma Equiperdum» . Труды Национальной академии наук Соединенных Штатов Америки . 80 (14): 4306–10. Бибкод : 1983PNAS...80.4306R . дои : 10.1073/pnas.80.14.4306 . ПМК 384026 . ПМИД 6308614 .
- ^ Бальц Т., Жиру С., Бальц Д., Дювилье Г., Деганд П., Демайль Ж., Паутризель Р. (1982). «Гликопротеины вариабельной поверхности Trypanosoma Equiperdum фосфорилируются» . Журнал ЭМБО . 1 (11): 1393–8. дои : 10.1002/j.1460-2075.1982.tb01328.x . ПМЦ 553222 . ПМИД 6821334 .
- ^ Сенгупта П.П., Балумахендиран М., Баламуруган В., Рудрамурти Г.Р., Прабхудас К. (июнь 2012 г.). «Экспрессируемый укороченный N-концевой гликопротеин вариабельной поверхности (VSG) Trypanosoma evansi в E. coli проявляет иммунореактивность». Ветеринарная паразитология . 187 (1–2): 1–8. дои : 10.1016/j.vetpar.2012.01.012 . ПМИД 22277627 .
- ^ Клаас Ф., Радванска М., Уракава Т., Маджива П.А., Годдерис Б., Бюшер П. (сентябрь 2004 г.). «ПЦР вариабельного поверхностного гликопротеина RoTat 1.2 как специфический диагностический инструмент для выявления инфекций Trypanosoma evansi» . Кинетопластидная биология и болезни . 3 (1): 3. дои : 10.1186/1475-9292-3-3 . ПМК 521498 . ПМИД 15377385 .
- ^ Гардинер П.Р., Нене В., Барри М.М., Тэтти Р., Берли Б., Кларк М.В. (ноябрь 1996 г.). «Характеристика небольшого гликопротеина с переменной поверхностью Trypanosoma vivax». Молекулярная и биохимическая паразитология . 82 (1): 1–11. дои : 10.1016/0166-6851(96)02687-4 . ПМИД 8943146 .
- ^ Рейнвальд Э., Гейдрих С., Риссе Х.Дж. (май 1984 г.). «Исследование in vitro биосинтеза поверхностного гликопротеина Trypanosoma congolense». Журнал протозоологии . 31 (2): 300–6. дои : 10.1111/j.1550-7408.1984.tb02966.x . ПМИД 6470988 .
- ^ Джексон AP (январь 2010 г.). «Эволюция поверхностных гликопротеинов амастина у трипаносоматидных паразитов» . Молекулярная биология и эволюция . 27 (1): 33–45. дои : 10.1093/molbev/msp214 . ПМЦ 2794310 . ПМИД 19748930 .
Внешние ссылки
[ редактировать ]- Варианты поверхностных гликопротеинов, трипаносома, Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- www.icp.ucl.ac.be