Треонин аммиак-лиаза
| L -Тереонин аммиак -линейаза | |||
|---|---|---|---|
 3D мультипликационное изображение треониновой деаминазы тетрамера | |||
| Идентификаторы | |||
| ЕС №. | 4.3.1.19 | ||
| Базы данных | |||
| Intenz | Intenz View | ||
| Бренда | Бренда вход | ||
| Расширение | Вид Nicezyme | ||
| Кегг | Кегг вход | ||
| Метатический | Метаболический путь | ||
| Напрямую | профиль | ||
| PDB Структуры | RCSB PDB PDBE PDBSUM | ||
| Джин Онтология | Друг / Quickgo | ||
| |||
Треонин-аммиак-линейаза (EC 4.3.1.19, систематическое название - (2-оксобутаноат-образец) также обычно называемое деаминазой или треонин дегидратазо , треонин - триреонин - аммиак линиаза L - α-кетобутират и аммиак :
- L -триреонин = 2 -оксобутаноат + NH 3 (общая реакция)
- (1a) l -threonine = 2-аминобут-2-enoate + h 2 o
- (1b) 2-аминобут-2-enoate = 2-аминобутаноат (спонтанный)
- (1C) 2-аминобутаноат + H2O = 2-оксобутаноат + NH3 (спонтанный)
α-кетобутират может быть преобразован в L - изолецин , поэтому триониновые аммиачные функции в качестве ключевого фермента в BCAA синтезе . [ 1 ] Он использует пиридоксаль-5'-фосфата кофактор , похожий на многие ферменты, участвующие в метаболизме аминокислот . Он встречается у бактерий , дрожжей и растений , хотя большинство исследований на сегодняшний день было сосредоточено на формах фермента в бактериях. Этот фермент был одним из первых, в котором отрицательное ингибирование обратной связи к конечному продукту метаболического пути наблюдалось непосредственно и изучалось. [ 2 ] Фермент служит отличным примером регуляторных стратегий, используемых при аминокислотном гомеостазе .
Структура
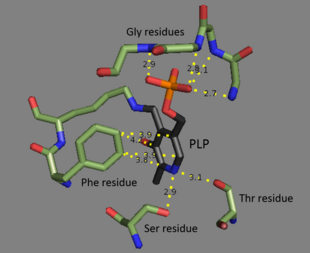
[ редактировать ]Треонин-аммиак-линейаза является тетрамером идентичных субъединиц и расположена как димер димеров. Каждая субъединица имеет два домена : домен, содержащий каталитический активный сайт, и домен с аллостерическими регуляторными сайтами. Было показано, что эти два различных областях, [ 3 ] Но регуляторная площадка одной субъединицы фактически взаимодействует с каталитическим местом другой субъединицы. [ 4 ] Оба домена содержат повторяющийся структурный мотив бета -листов, окруженных альфа -спиралями . [ 5 ] В то время как сайт связывания треонина не полностью понят, структурные исследования показывают, как связан пиридоксальфосфатный кофактор. [ 4 ] Кофактор PLP связан с остатками лизина с помощью основания SCHIFF , а фосфатная группа PLP удерживается на месте аминными группами, полученными из повторяющейся последовательности остатков глицина . Ароматическое остатками , кольцо связано с фенилаланином , а азот на кольце связан водородом с содержащими гидроксильную группу. [ 6 ]
Механизм
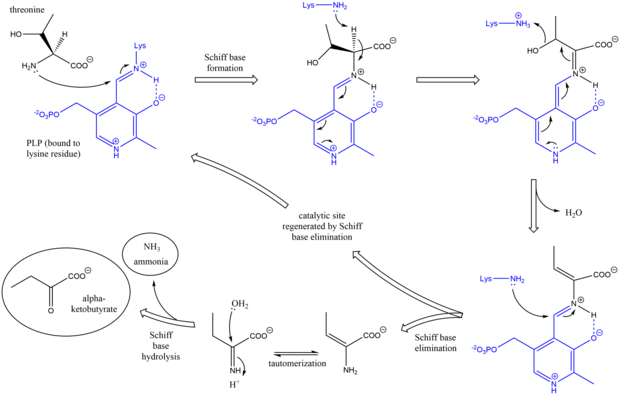
[ редактировать ]Механизм треониновой аммиак-линиазы аналогичен другими ферментами Deaminiting PLP в использовании промежуточных продуктов базы Schiff . [ 7 ] Первоначально, аминская группа треонина атакует основание Schiff лизина/PLP, смещает лизин. После депротонирования аминокислотного альфа -углерода и последующего дегидратации (отсюда и общее название треониндегидратаза ) образуется новая основа Schiff. Эта база Schiff заменяется атакой лизина, реформируя каталитически активную PLP и освобождая первоначальный продукт, содержащий алкен . Этот продукт таутомеры , и после гидролиза основания Schiff генерируются конечные продукты. [ 8 ] [ 9 ] После получения конечного альфа-кетобутиратного продукта изолецин синтезируется путем прогрессирования через промежуточный альфа-ацетогидроксибутират до альфа-бета-дигидрокси-бета-метилвалерат, а затем к альфа-кето-бета-метилвалеральному. [ 10 ]
Регулирование
[ редактировать ]Было показано, что треонин-аммиак-линейаза не следовала кинетике Михаэлиса-Мюрмита , скорее, она подвержена сложному аллостерическому контролю. [ 11 ] Фермент ингибируется изолецином, продуктом пути, в котором он участвует, и активируется валином , продуктом параллельного пути. [ 1 ] Таким образом, увеличение концентрации изолецина отключается от его производства, и увеличение концентрации валина отвлекает начальный материал (гидроксиэтил- TPP ) от производства валина. Фермент имеет два сайта связывания для изолецина; Один имеет высокое сродство к изолецину, а другой имеет низкое сродство. [ 12 ] Связывание изолецина с сайтом высокой аффинности увеличивает аффинность связывания сайта низкой аффинности, а дезактивация фермента возникает, когда изолейцин связывается с сайтом низкой аффинности. Валин способствует активности ферментов путем конкурентного связывания с местом высокой аффинности, предотвращая ингибирующий эффект. [ 12 ] Комбинация этих двух методов обратной связи уравновешивает концентрацию BCAA.

Изоформы и другие функции
[ редактировать ]Множественные формы треониновой аммиак-лиазы наблюдались у различных видов организма. В Escherichia coli , система, в которой фермент широко изучался, обнаружены две разные формы фермента. Один из них является биосинтетическим и напоминает характеристики фермента, представленные здесь, в то время как другой является деградативным , а функции для генерации углеродных фрагментов для производства энергии . [ 2 ] Пара изоформ также наблюдалась у других бактерий. Во многих бактериях биоразлагательная изоформа фермента экспрессируется в анаэробных условиях и способствует цАМФ и треонину, в то время как биосинтетическая изоформа экспрессируется в аэробных условиях. [ 13 ] Это позволяет бактерии сбалансировать запасы энергии и ингибировать энергетические синтетические пути, когда энергия не в изобилии.
У растений треонин-аммиак-линиза важна в защитных механизмах от травоядных и активируется в ответ на абиотический стресс . [ 14 ] Адаптированная изоформа фермента с уникальными свойствами, которые сдерживают травоядные, выражается в листьях растений. Каталитический домен этой изоформы чрезвычайно устойчив к протеолизу , в то время как регуляторный домен легко разлагается, поэтому при приеме проглатывания другим организмом возможности треонина фермента оставались без контроля. Этот ухудшает треонин до того, как травоядное животное может поглотить его, голодая травоядным животным незаменимой аминокислотой . [ 15 ] Исследования треониновой аммиак-линизы в растениях также предлагали новые стратегии в разработке ГМО с повышенной питательной ценностью за счет увеличения содержания незаменимых аминокислот. [ 14 ]
Были обнаружены другие более экзотические формы фермента, которые чрезвычайно малы по размеру, но все же сохраняют все каталитические и регуляторные функции. [ 4 ]
Эволюция
[ редактировать ]Существует пять основных типов сгиба для PLP-зависимых ферментов. Треонин-аммиак-линейаза является членом семейства сгиба типа II, также известного как семейство триптофан-синтазы . [ 7 ] Хотя треонин-аммиак-линейаза не обладает субстратом, как это делает триптофансинтаза, она содержит много консервативную гомологию . Треонин-аммиак-линейаза наиболее тесно связана с сериндегидратазой , и оба обладают одним и тем же общим каталитическим механизмом. [ 9 ] На самом деле, было показано, что треонин-аммиак-линейза демонстрирует некоторую специфичность в отношении серина и может превратить серин в пируват . [ 2 ] Регуляторный домен треониновой аммиак-линейзы очень похож на регуляторный домен фосфоглицератной дегидрогеназы . [ 4 ] Все эти отношения демонстрируют, что треонин-аммиак-линиаза имеет тесные эволюционные связи с этими ферментами. Из -за степени консервативной структуры и последовательности в ферментах, которые распознают аминокислоты, вполне вероятно, что эволюционное разнообразие этих ферментов возникло при сопоставлении индивидуальных регуляторных и каталитических доменов различными способами. [ 1 ]
Актуальность для людей
[ редактировать ]Треонин-аммиак-линиаза не обнаружена у людей. Таким образом, это один из примеров того, почему люди не могут синтезировать все 20 протеиногенных аминокислот ; В этом конкретном случае люди не могут преобразовать треонин в изолецин и должны потреблять изолецин в рационе. [ 1 ] Фермент также был изучен в прошлом как возможный агент, подавляющий опухоль по ранее описанным причинам, в том, что он лишает опухолевые клетки незаменимой аминокислоты и убивает их, [ 16 ] Но это лечение не использовалось.
Ссылки
[ редактировать ]- ^ Jump up to: а беременный в дюймовый и Berg JM, Tymoczko JL, Stryer L (2012). Биохимия (7 -е изд.). Нью -Йорк: WH Freeman and Company. ISBN 978-1-4292-7635-1 .
- ^ Jump up to: а беременный в Umbarger He, Brown B (январь 1957 г.). «Треониновое дезаминирование в Escherichia coli . II. Доказательства для двух L-треониновых деаминаз» . Журнал бактериологии . 73 (1): 105–12. doi : 10.1128/jb.73.1.105-112.1957 . PMC 289754 . PMID 13405870 .
- ^ Changeux JP (1963). «Аллостерические взаимодействия на биосинтетической L-треониновой деаминазе из E. coli K12». Симпозии Cold Spring Harbor по количественной биологии . 28 : 497–504. doi : 10.1101/sqb.1963.028.01.066 .
- ^ Jump up to: а беременный в дюймовый Gallagher DT, Gilliland GL, Xiao G, Zondlo J, Fisher KE, Chinchilla D, Eisenstein E (апрель 1998 г.). «Структура и контроль пиридоксальной фосфат -зависимой аллостерической треониновой деаминазы» . Структура 6 (4): 465–75. doi : 10.1016/s0969-2126 (98) 00048-3 . PMID 9562556 .
- ^ Schneider G, Käck H, Lindqvist Y (январь 2000 г.). «Разлив витамина B6 -зависимых ферментов» . Структура 8 (1): R1-6. doi : 10.1016/s0969-2126 (00) 00085-x . PMID 10673430 .
- ^ Jump up to: а беременный Goto M (2005). «Кристаллическая структура T.th. HB8 треонин деаминаза». doi : 10.2210/pdb1ve5/pdb .
{{cite journal}}: CITE Journal требует|journal=( помощь ) - ^ Jump up to: а беременный Eliot AC, Kirsch JF (2004). «Пиридоксальные фосфатные ферменты: механистические, структурные и эволюционные соображения». Ежегодный обзор биохимии . 73 (1): 383–415. doi : 10.1146/annurev.biochem.73.011303.074021 . PMID 15189147 .
- ^ Jump up to: а беременный Umbarger HE (2009). «Треонин деаминазы». В Meister A (ред.). Достижения в области фермеров и связанных с ними областей молекулярной биологии . Достижения в области фермеров - и связанных с ними областей молекулярной биологии. Тол. 37. Джон Уайли и сыновья. С. 349–95. doi : 10.1002/9780470122822.ch6 . ISBN 978-0-471-59172-6 Полем PMID 4570068 .
- ^ Jump up to: а беременный в Jin J, Hanefeld U (март 2011 г.). «Селективное добавление воды в связи C = C; ферменты являются лучшими химиками». Химическая связь . 47 (9): 2502–10. doi : 10.1039/c0cc04153j . PMID 21243161 .
- ^ Squires CH, Levinthal M, De Felice M (ноябрь 1981 г.). «Роль треониновой деаминазы в регуляции альфа-ацетолактатного биосинтеза в Escherichia coli K12» . Журнал общей микробиологии . 127 (1): 19–25. doi : 10.1099/00221287-127-1-19 . PMID 7040602 .
- ^ Changeux JP (1961). «Механизмы контроля обратной связи биосинтетической L-треониновой деаминазы с помощью L-изолецина». Симпозии Cold Spring Harbor по количественной биологии . 26 : 313–8. doi : 10.1101/sqb.1961.026.01.037 . PMID 13878122 .
- ^ Jump up to: а беременный Wessel PM, Graciet E, Douce R, Dumas R (декабрь 2000 г.). «Доказательства двух различных эффекторных сайтов в треониновой деаминазе с помощью сайт-направленного мутагенеза, кинетических и связывающих экспериментов» (PDF) . Биохимия . 39 (49): 15136–43. doi : 10.1021/bi001625c . PMID 11106492 .
- ^ Luginbuhl GH, Hofler JG, Decedue CJ, Burns Ro (октябрь 1974 г.). «Биоразлагательная L-треонин-деаминаза Salmonella typhimurium» . Журнал бактериологии . 120 (1): 559–61. doi : 10.1128/jb.120.1.559-561.1974 . PMC 245803 . PMID 4370904 .
- ^ Jump up to: а беременный Джоши В., Джунг Дж. «Взаимозависимость метаболизма треонина, метионина и изолецина в растениях: накопление и регуляция транскрипции при абиотическом стрессе». Аминокислоты . 39 (4): 933–47. doi : 10.1007/s00726-010-0505-7 . PMID 20186554 . S2CID 22641155 .
- ^ Гонсалес-Видж Э., Бьянчетти С.М., Филлипс Г.Н., Хоу Г.А. (апрель 2011 г.). «Адаптивная эволюция треониновой деаминазы в защите растений от травоядных насекомых» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (14): 5897–902. Bibcode : 2011pnas..108.5897g . doi : 10.1073/pnas.1016157108 . PMC 3078374 . PMID 21436043 .
- ^ Greenfield RS, Wellner D (август 1977 г.). «Влияние треониновой деаминазы на рост и жизнеспособность клеток млекопитающих в тканевой культуре и ее селективной цитотоксичности к клеткам лейкемии». РАНКА . 37 (8 пт 1): 2523–9. PMID 559542 .