Фториназа
| Фториназа (аденозилфторидсинтаза) | |||
|---|---|---|---|
 | |||
| Идентификаторы | |||
| Номер ЕС. | 2.5.1.63 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
Фермент фториназа ( EC 2.5.1.63 , также известный как аденозилфторидсинтаза) катализирует реакцию между фторид -ионом и кофактором S -аденозил-L-метионином с образованием L-метионина и 5'-фтор-5'-дезоксиаденозина. , первый зафиксированный продукт пути биосинтеза фторметаболитов. [1] Первоначально фториназа была выделена из почвенной бактерии Streptomycesttleya , но с тех пор гомологи были идентифицированы у ряда других видов бактерий, включая Streptomyces sp. MA37, Nocardia brasiliensis и Actinoplanes sp. Н902-109. [2] Это единственный известный фермент, способный катализировать образование связи углерод-фтор, самой прочной одинарной связи в органической химии. [3]

Гомологичный фермент хлориназа , который катализирует ту же реакцию с ионом хлорида, а не фторида, был выделен из Salinospora tropica , на пути биосинтеза А. салиноспорамида [4]
Реактивность
[ редактировать ]Фториназа катализирует нуклеофильное замещение типа S N 2 в положении С-5' SAM, тогда как L-метионин действует как нейтральная уходящая группа. [5] [6] По оценкам, реакция, катализируемая флюориназой, составляет от 10 6 [6] и 10 15 [7] раз быстрее, чем некаталитическая реакция, что означает значительное повышение скорости. на это, фториназу по-прежнему считают медленным ферментом с числом оборота ( kcat Несмотря ) 0,06 мин. −1 . [8] Высокий кинетический барьер реакции объясняется сильной сольватацией иона фтора в воде, что приводит к высокой энергии активации, связанной с отщеплением молекул воды от водного иона фтора, превращая фторид в мощный нуклеофил внутри активного центра.
Реакция, катализируемая фториназой, обратима, и при инкубации 5'-фтор-5'-дезоксиаденозина и L-метионина с фториназой образуются SAM и фторид-ион. [9] Замена L-метионина на L-селенометионин приводит к ускорению обратной реакции в 6 раз. [9] из-за повышенной нуклеофильности селенового центра по сравнению с серным центром.
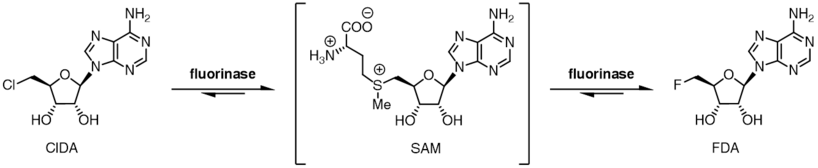
Флуориназа демонстрирует степень толерантности к субстрату для галогенид-иона и может также использовать хлорид-ион вместо иона фторида. В то время как равновесие реакции между SAM и фторид-ионом лежит в сторону продуктов FDA и L-метионина, в случае хлорид-иона положение равновесия меняется на противоположное. Инкубация SAM и хлорид-иона с фториназой не приводит к образованию 5'-хлор-5'-дезоксиаденозина (ClDA), если не дополнительный фермент, оксидаза L-аминокислот добавляется . Аминокислотная оксидаза удаляет L-метионин из реакции, превращая его в соответствующую оксокислоту.

Предпочтение галогенидов в сочетании с положением двух реакционных равновесий позволяет катализировать чистую реакцию трансгалогенирования ферментом. [9] Инкубация 5'-хлорнуклеозидов с ферментом вместе с каталитическим L-селенометионином или L-метионином приводит к образованию 5-фторнуклеозидов. Когда [ 18 F]фторид используется, эта реакция трансгалогенирования может быть использована для синтеза радиофармпрепаратов для позитронно-эмиссионной томографии . [10] [11]
Структурные исследования
[ редактировать ]По состоянию на конец 2007 года 9 структур для этого класса ферментов было решено PDB с кодами доступа 1RQP , 1RQR , 2C2W , 2C4T , 2C4U , 2C5B , 2C5H , 2CBX и 2CC2 .
Названия, данные ферменту, обусловлены не структурой, а функцией: синтезируемой молекулой является 5-фтор-5-дезоксиаденозин. Структура гомологична ферментному ряду duf-62 . Фермент представляет собой димер тримеров (2 молекулы с тремя субъединицами). Активные центры расположены между этими субъединицами. (интерфейсы субъединиц), каждый из которых может одновременно связываться с одной молекулой SAM. [12]
Биосинтез фторометаболитов
[ редактировать ]Этот раздел пуст. Вы можете помочь, добавив к нему . ( ноябрь 2015 г. ) |
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б О'Хаган Д., Шаффрат С., Кобб С.Л., Гамильтон Дж.Т., Мерфи CD (март 2002 г.). «Биохимия: биосинтез фторорганической молекулы» . Природа . 416 (6878): 279. дои : 10.1038/416279a . ПМИД 11907567 .
- ^ Дэн Х, Ма Л, Бандаранаяка Н, Цинь З, Манн Г, Кьереме К, Ю Ю, Шеперд Т, Нейсмит Дж. Х., О'Хаган Д. (февраль 2014 г.). «Идентификация фториназ Streptomyces sp MA37, Norcardia brasiliensis и Actinoplanes sp N902-109 путем анализа генома». ХимБиоХим . 15 (3): 364–8. дои : 10.1002/cbic.201300732 . ПМИД 24449539 .
- ^ О'Хаган Д. (февраль 2008 г.). «Понимание фторорганической химии. Введение в связь CF». Обзоры химического общества . 37 (2): 308–19. дои : 10.1039/b711844a . ПМИД 18197347 .
- ^ Эустакио А.С., Похер Ф., Ноэль Дж.П., Мур Б.С. (январь 2008 г.). «Открытие и характеристика морской бактериальной SAM-зависимой хлориназы» . Химическая биология природы . 4 (1): 69–74. дои : 10.1038/nchembio.2007.56 . ПМЦ 2762381 . ПМИД 18059261 .
- ^ Кадикамо CD, Куртье Дж., Денг Х., Меддур А., О'Хаган Д. (май 2004 г.). «Ферментативное фторирование у Streptomycesttleya происходит с инверсией конфигурации, соответствующей механизму реакции SN2». ХимБиоХим . 5 (5): 685–90. дои : 10.1002/cbic.200300839 . ПМИД 15122641 .
- ^ Jump up to: а б Сенн Х.М., О'Хаган Д., Тиль В. (октябрь 2005 г.). «Понимание образования ферментативных связей CF на основе расчетов QM и QM/MM». Журнал Американского химического общества . 127 (39): 13643–55. дои : 10.1021/ja053875s . ПМИД 16190730 .
- ^ Ломан, округ Колумбия, Эдвардс Д.Р., Вулфенден Р. (октябрь 2013 г.). «Катализ путем десольватации: каталитическое мастерство SAM-зависимых галогенид-алкилирующих ферментов». Журнал Американского химического общества . 135 (39): 14473–5. дои : 10.1021/ja406381b . ПМИД 24041082 .
- ^ Чжу X, Робинсон Д.А., Макьюэн А.Р., О'Хаган Д., Нейсмит Дж.Х. (ноябрь 2007 г.). «Механизм ферментативного фторирования у Streptomycesttleya» . Журнал Американского химического общества . 129 (47): 14597–604. дои : 10.1021/ja0731569 . ПМЦ 3326528 . ПМИД 17985882 .
- ^ Jump up to: а б с Дэн Х., Кобб С.Л., Макьюэн А.Р., МакГлинчи Р.П., Нейсмит Дж.Х., О'Хаган Д., Робинсон Д.А., Спенсер Дж.Б. (январь 2006 г.). «Фториназа Streptomyces Cattleya также является хлориназой» . Ангеванде Хеми . 45 (5): 759–62. дои : 10.1002/anie.200503582 . ПМК 3314195 . ПМИД 16370017 .
- ^ Дэн Х, Кобб С.Л., Джи А.Д., Локхарт А., Мартарелло Л., МакГлинчи Р.П., О'Хаган Д., Онега М. (февраль 2006 г.). «Опосредованное фториназой образование связи C-(18)F, ферментативный инструмент для мечения ПЭТ». Химические коммуникации (6): 652–4. дои : 10.1039/b516861a . PMID 16446840 .
- ^ Томпсон С., Онега М., Эшворт С., Флеминг И.Н., Пасшир Дж., О'Хаган Д. (сентябрь 2015 г.). «Двухэтапное мечение пептида RGD для позитронно-эмиссионной томографии, опосредованное ферментом фториназой (18)F» . Химические коммуникации . 51 (70): 13542–5. дои : 10.1039/c5cc05013h . hdl : 10023/7790 . ПМИД 26221637 .
- ^ Донг С., Хуанг Ф., Дэн Х., Шаффрат С., Спенсер Дж.Б., О'Хаган Д., Нейсмит Дж.Х. (февраль 2004 г.). «Кристаллическая структура и механизм бактериального фторирующего фермента». Природа . 427 (6974): 561–5. дои : 10.1038/nature02280 . ПМИД 14765200 .