Циклофан

В органической химии циклофан состоящий — это углеводород, из ароматической единицы (обычно бензольного кольца) и цепи , образующей мост между двумя несмежными положениями ароматического кольца. Известны также более сложные производные с множеством ароматических звеньев и мостиков, образующих клеточные структуры. Циклофаны являются хорошо изученными примерами напряженных органических соединений. [1] [2]
[н]-Циклофаны [ править ]
Структуры [ править ]

Парациклофаны принимают конформацию лодочки, обычно наблюдаемую в циклогексанах . Меньшее значение n приводит к большим искажениям. Рентгеновская кристаллография «[6]парациклофана» показывает, что атом углерода ароматического мостика образует угол 20,5 ° с плоскостью. Бензильные атомы углерода отклоняются еще на 20,2°. Изменение длины связи углерод-углерод увеличилось с 0 для бензола до 39 пм . [3] [4] Несмотря на свою искаженную структуру, циклофаны сохраняют свою ароматичность , что определено методом УФ-Вид-спектроскопии . [1]
Реактивность [ править ]
Что касается их реакционной способности, циклофаны часто проявляют диеноподобное поведение, несмотря на свидетельства ароматичности даже самого искаженного [6]-циклофана. Этот сильно искаженный циклофан фотохимически превращается в производное бензола Дьюара . Тепло обращает реакцию вспять. [5] С диметилацетилендикарбоксилатом [6]метациклофан быстро вступает в реакцию Дильса-Альдера . [6]
Для пиридинофана зафиксировано расстояние несвязывающего азота к арену, равное 244 пм, а в необычном суперфане два бензольных кольца разделены всего на 262 пм. Другими представителями этой группы являются ин-метилциклофаны , [7] ин-кетоциклофаны [8] и в -Бис ( гидросилан). [9]
Свойства ЯМР [ править ]
Спектры протонного ЯМР циклофана интенсивно исследовались, чтобы понять ароматичность бензольного кольца. Также большой интерес представляет экранирующее действие ароматического кольца на углеводородную полоску. Обычно ароматические протоны появляются вблизи своих обычных положений около 7,2 частей на миллион, что указывает на то, что даже при серьезных искажениях кольцо сохраняет ароматичность. Центральные метиленовые протоны алифатического мостика экранируются до уровня около -0,5 м.д. [6]
Синтез [ править ]

[6]парациклофан можно синтезировать, начиная с реакции Бэмфорда-Стивенса с образованием 1 спирокетона по схеме 3 , перегруппировываясь в реакции пиролиза через карбен промежуточный 4 . Отдельный путь к форме Дьюара включает Ag + -индуцированная реакция перегруппировки бициклопропенильного соединения 7 . [10]
Метациклофаны обычно менее напряжены и, следовательно, их легче получить, чем парациклофаны. Ниже показан путь к [14][14]метапарациклофану. [11] на схеме 4 [12] демонстрирующий in-situ реакцию Рамберга-Беклунда, превращающую сульфон 3 в алкен 4 .
![Схема 4. [14][14]метапарациклофан.](http://upload.wikimedia.org/wikipedia/commons/thumb/9/93/Metaparacyclophane.png/600px-Metaparacyclophane.png)
Встречающиеся в природе [н]-циклофаны [ править ]
В природе существует несколько циклофанов. Одним из примеров метациклофана является кавикулярин .
Хауамин А — парациклофан, обнаруженный в некоторых видах оболочников . Из-за его потенциального применения в качестве противоракового препарата он также доступен в результате полного синтеза посредством алкин - пироновой реакции Дильса-Альдера на решающей стадии с выделением углекислого газа ( схема 5 ). [13]
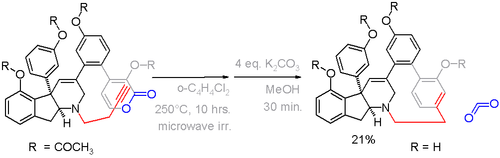
В этом соединении отклонение от планарности составляет 13° для бензольного кольца и 17° для атомов углерода мостика. [14] Альтернативная стратегия образования циклофана на схеме 6. [15] был разработан на основе ароматизации кольца уже после образования мостика.

Два дополнительных типа циклофана были открыты в природе при их выделении из двух видов цианобактерий семейства Nostocacae . [16] Эти два класса циклофанов оба являются [7,7] парациклофанами и были названы в честь вида, из которого они были извлечены: цилиндроциклофаны из Cylindrospermum lichenforme и ностоциклофаны из Nostoc linckia .
[nn]Парациклофаны [ править ]

Хорошо изученным членом семейства [nn]парациклофана является [2.2]парациклофан . [17] [18] Одним из методов его получения является 1,6-Гофманом удаление гидроксида 4-метилбензилтриметиламмония : [19]

[2.2]парациклофан-1,9-диен был применен в ROMP к поли(п-фениленвинилену) с чередующимися цис-алкеновыми и транс-алкеновыми связями с использованием катализатора Граббса второго поколения : [20]

Движущей силой раскрытия цикла и полимеризации является разгрузка от натяжения. Считается, что реакция представляет собой живую полимеризацию из-за отсутствия конкурирующих реакций.
Поскольку два бензольных кольца находятся в непосредственной близости, этот тип циклофана также служит подопытным кроликом для реакций фотохимической димеризации , как показано в этом примере: [21]

Образующийся продукт имеет октаэдровый скелет. Когда аминогруппа заменяется метиленовой группой, реакции не происходит: димеризация требует сквозного перекрытия между ароматическими пи-электронами и сигма-электронами в связи CN в реагентах LUMO .
Янусене [ править ]

Симметричная молекула [3.3]ортоциклофана, также известная как янузен, представляет собой циклофан, содержащий 4 бензольных кольца в форме щели. Впервые синтезирован в 1967 году Стэнли Дж. Кристолом путем и дибензобаррелена циклоприсоединения антрацена . [22] Молекула использовалась для изучения укладки и взаимодействия между катионами и пи-орбиталями, особенно с ионами серебра . [23] Производные и комплексы янусена были созданы для изучения катион-пи-взаимодействий, трансаннулярных взаимодействий в подобных жестких ароматических молекулах и систем, зависящих от расстояний углерод-углерод.
С момента открытия оригинальной реакции циклоприсоединения были разработаны различные синтетические методы получения янусена, включая с использованием микроволнового излучения . реакции [24] и перенос ацетилена из 5,6,7,8-тетрафторбензобаррелена. [25]
Фанес [ править ]
Обобщение циклофанов привело к появлению понятия фанов в номенклатуре ИЮПАК. Некоторые примеры систематических названий фанов:
- [14]метациклофан представляет собой 1(1,3)-бензенациклопентадекафан.
- [2,2']парациклофан (или [2,2]парациклофан) представляет собой 1,4(1,4)-дибензенациклогексафан.
В «1(1,3)-бензенациклопентадекафане» цифра «1» относится к первому положению кольца как «суператому», цифра «(1,3)» описывает «мета»-положение, «бензол» относится к кольцо, а «пентадека» (15) описывает длину цепи, считая кольцо за один атом.
См. также [ править ]
- Циклопарафенилен , циклические полностью пара-связанные фенильные группы. [26]
- Каликсарены
Общие источники [ править ]
- Б. Х. Смит, Мостиковые ароматические соединения, Academic Press, Нью-Йорк, 1964. ISBN 978-0-323-16321-7
- П.М. Кин, С.М. Розенфельд (ред.), Циклофаны, Vols. 1 и 2, Academic Press, Нью-Йорк, 1983. doi : 10.1016/B978-0-12-403001-5.X5001-7 ISBN 978-0-12-403001-5
- Ф. Фогтле, Ф., Г. Хонер, Топ. Курс. хим. 1978, 74, 1. два : 10.1007/BFb0050144
- Ф. Фёгтле, П. Нойман, Топ. Курс. хим. 1983, 113, 1; 1985, 115, 1.
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Планер, Рольф; Хопф, Хеннинг (2004). Современная химия циклофана . Вайнхайм: Wiley-VCH. ISBN 3527603964 .
- ^ Тобе, Ёсито; Канеда, Терухиса; Одайра, Ёсинобу; Касаи, Нобутами (1987). 109 Журнал Американского химического общества . ( 4): 1136–1144. doi : 10.1021/ja00238a024 .
- ^ Голод, Юрген; Вольф, Кристиан; дочь Вернер; Петерс, Ева-Мария; Петерс, Карл; фон Шнеринг, Ганс Георг (1986). «Синтез средних и больших колец, XVI. Лодкообразные арены — Синтез, строение и свойства [7]парациклофана и [7](1,4)нафталинофанов». Химические отчеты . 119 (9): 2698–2722. дои : 10.1002/cber.19861190904 .
- ^ Каммула, Сита Л.; Ирофф, Линда Д.; Джонс, Мейтленд; Ван Стратен, JW; Де Вольф, Вашингтон; Бикельхаупт, Ф. (1977). «Взаимное превращение [6] парациклофана и 1,4-гексаметилена (бензола Дьюара)». Журнал Американского химического общества . 99 (17): 5815. doi : 10.1021/ja00459a055 .
- ↑ Перейти обратно: Перейти обратно: а б Ф. Бикельхаупт (1990). «Маленькие циклофаны: бизнес по производству бензола» . Чистое приложение. Хим . 62 (3): 373. doi : 10.1351/pac199062030373 . S2CID 55279751 .
- ^ Сун, Цюлин; Хо, Дуглас М.; Паскаль, Роберт А. (2005). «Стерически конгестедин-метилциклофаны». Журнал Американского химического общества . 127 (32): 11246–11247. дои : 10.1021/ja0529384 . ПМИД 16089445 .
- ^ Цинь, Цянь; Маг, Джоэл Т.; Паскаль, Роберт А. (2010). «Анин-Кетоциклофан». Органические письма . 12 (5): 928–930. дои : 10.1021/ol9028572 . ПМИД 20112943 .
- ^ Цзун, Цзе; Маг, Джоэл Т.; Паскаль, Роберт А. (2013). «Исключительная стерическая перегрузка в ин-бис(гидросилане)». Журнал Американского химического общества . 135 (36): 13235–13237. дои : 10.1021/ja407398w . ПМИД 23971948 .
- ↑ Перейти обратно: Перейти обратно: а б Кейн, Винаяк В.; Вольф, Энтони Д.; Джонс, Мейтленд (1974). «[6]Парациклофан». Журнал Американского химического общества . 96 (8): 2643–2644. дои : 10.1021/ja00815a070 .
- ^ Вэй, Чунмей; Мо, Кай-Фор; Чан, Цзе-Лок (2003). «[14][14]Метапарациклофан: первый пример [m][n]метапарациклофана». Журнал органической химии . 68 (7): 2948–2951. дои : 10.1021/jo0267044 . ПМИД 12662074 .
- ^ с пара-кольцом на месте, замыкание мета-части путем замещения дибромида дисульфидом Схема 4. Схема реакции : нуклеофильного . Затем окисление сульфида до сульфона перекисью водорода с последующей реакцией Рамберга-Беклунда in-situ с донором галогенида дибромдифторметаном и основным гидроксидом калия . Заключительная стадия гидрирования алкена . водородом и палладием на угле
- ^ Бэран, Фил С.; Бернс, Ной З. (2006). «Полный синтез (±)-хауамина А». Журнал Американского химического общества . 128 (12): 3908–3909. дои : 10.1021/ja0602997 . ПМИД 16551088 . Авторы отмечают биосинтетическое происхождение как загадочное.
- ^ Випф, Питер; Фурегати, Маркус (2006). «Синтез 3-аза-[7]-парациклофанового ядра хауамина А и Б». Органические письма . 8 (9): 1901–1904. дои : 10.1021/ol060455e . ПМИД 16623580 .
- ^ Схема 6. Схема реакции: I стадия, реакция отщепления метанола трифторэтанолом и диизопропиламином , II стадия метилирование диметилсульфатом , . Ns = нозилат
- ^ Мур, Брэдли С.; Чен, Цзянь Лу; Паттерсон, Грегори М.Л.; Мур, Ричард Э.; Бринен, Линда С.; Като, Йоко; Кларди, Джон (1990). «[7.7] Парациклофаны из сине-зеленых водорослей». Дж. Ам. хим. Соц. 112 (10): 4061–4063. дои : 10.1021/ja00166a066 .
- ^ Хасан, Захид; Спулинг, Эдуард; Нолл, Дэниел М.; Лаханн, Йорг; Брезе, Стефан (2018). «Плоские хиральные [2.2] парациклофаны: от синтетического любопытства к применению в асимметричном синтезе и материалах». Обзоры химического общества . 47 (18): 6947–6963. дои : 10.1039/C7CS00803A . ПМИД 30065985 .
- ^ Хасан, Захид; Спулинг, Эдуард; Нолл, Дэниел М.; Брезе, Стефан (2019). «Региоселективная функционализация [2.2] парациклофана: недавний синтетический прогресс и перспективы» . Angewandte Chemie, международное издание . 59 (6): 2156–2170. дои : 10.1002/anie.201904863 . ISSN 1521-3773 . ПМЦ 7003812 . ПМИД 31283092 .
- ^ Х. Э. Винберг, Ф. С. Фосетт (1962). «[2.2]Парациклофан». Органические синтезы . 42 : 83. дои : 10.15227/orgsyn.042.0083 .
- ^ Ю, Чин-Ян; Тернер, Майкл Л. (2006). «Растворимые поли(п-фениленвинилены) посредством метатезисной полимеризации с раскрытием кольца». Angewandte Chemie, международное издание . 45 (46): 7797–7800. дои : 10.1002/anie.200602863 . ПМИД 17061303 .
- ^ Окамото, Хидеки; Сатаке, Кёске; Исида, Хироюки; Кимура, Масару (2006). «Фотореакция производного 2,11-диаза[3.3]парациклофана: образование октаэдрана путем фотохимической димеризации бензола». Журнал Американского химического общества . 128 (51): 16508–16509. дои : 10.1021/ja067350r . ПМИД 17177393 .
- ^ Коласо, Матеус К.; Карамори, Джованни Ф.; Паррейра, Ренато LT; Лаали, Кеннет К. (2022). «Янусен как поглотитель ионов серебра: результаты вычислений» . Новый химический журнал . 46 (5): 2393–2404. дои : 10.1039/D1NJ03833H . ISSN 1144-0546 .
- ^ Мучелини, Джонатан; Острем, Ина; Ортолан, Александр О.; Андриани, Карла Ф.; Карамори, Джованни Ф.; Паррейра, Ренато LT; Лаали, Кеннет К. (2019). «Понимание взаимодействия между π – π и взаимодействиями катион – π в системах [янусен – Ag] + хозяин-гость: вычислительный подход» . Транзакции Далтона . 48 (35): 13281–13292. дои : 10.1039/C9DT02307K . ISSN 1477-9226 .
- ^ Штрбац, Петар; Маргетич, Давор (14 ноября 2020 г.). «Одностадийный синтез 5а,11а-янузенимида с использованием 2,3-дибром-N-метилмалеимида в качестве ацетиленового эквивалента» . Труды по химии . 3 (1). MDPI: 87. doi : 10.3390/ecsoc-24-08426 .
- ^ Кантрелл, Гэри Л.; Филлер, Роберт (сентябрь 1984 г.). «Внутримолекулярный перенос ацетилена между антраценом и 5,6,7,8-тетрафторбензобарреленом. Новый синтез янусена и дибензобаррелена» . Журнал органической химии . 49 (18): 3406–3407. дои : 10.1021/jo00192a038 . ISSN 0022-3263 .
- ^ Херст, Элизабет С.; Джасти, Рамеш (2012). «Изгиб бензола: синтез [n] циклопарафениленов». Журнал органической химии . 77 (23): 10473–10478. дои : 10.1021/jo302186h . ПМИД 23126565 .