Селенид никеля
 | |
| Имена | |
|---|---|
| Название ИЮПАК
Селенид никеля(II)
| |
| Другие имена
Селенид никеля
| |
| Идентификаторы | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.013.834 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| НиСе | |
| Молярная масса | 137.65 g/mol |
| Появление | черный порох |
| Плотность | 7,2 г/см 3 |
| нерастворимый | |
| Опасности | |
| Паспорт безопасности (SDS) | [] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Селенид никеля — неорганическое соединение формулы NiSe. Как и для многих халькогенидов металлов , фазовая диаграмма селенида никеля (II) сложна. Известны два других селенида никеля: NiSe 2 со пирита структурой и Ni 2 Se 3 . Кроме того, NiSe обычно нестехиометричен и часто описывается формулой Ni 1-x Se, где 0 < x < 0,15. [ 1 ] Этот материал представляет собой твердое полупроводниковое вещество и может быть получен в виде черного мелкодисперсного порошка или серебра, если оно получено в виде более крупных кристаллов. Селенид никеля(II) нерастворим во всех растворителях, но может разлагаться сильными окисляющими кислотами.
Синтез и структура
[ редактировать ]Обычно NiSe получают путем высокотемпературной реакции элементов. Такие реакции обычно дают смешанные фазовые продукты. Более мягкие методы также были описаны с использованием более специализированных методов, таких как реакции элементов в жидком аммиаке в сосуде под давлением. [ 2 ]
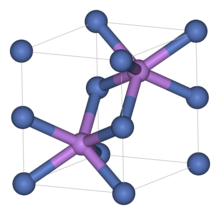
Как и многие родственные материалы, селенид никеля (II) имеет мотив арсенида никеля . В этой структуре никель имеет октаэдрическую форму, а селениды расположены в тригонально-призматических позициях. [ 3 ]
Ссылки
[ редактировать ]- ^ Чжунбинь Чжуан, Цин Пэн Цзин Чжуан, Сюнь Ван, Ядун Ли «Контролируемый гидротермальный синтез и структурная характеристика серии селенида никеля» Химия - Европейский журнал 2005, Том 12, страницы 211–217. doi : 10.1002/chem.200500724
- ^ Джефф Хеншоу, Иван П. Паркин, Грэм А. Шоу «Удобные пути получения жидкого аммиака при комнатной температуре к халькогенидам металлов» J. Chem. Soc., Dalton Trans., 1997, 231-236. дои : 10.1039/A605665B
- ^ Уэллс, А.Ф. (1984) Структурная неорганическая химия, Оксфорд: Clarendon Press. ISBN 0-19-855370-6 .