Рэйни никель
 Сухой активированный никель Ренея
| |
| Идентификаторы | |
|---|---|
| НЕКОТОРЫЙ | |
| Характеристики | |
| Появление | Светло-серый порошок |
| Опасности | |
| СГС Маркировка : | |
  
| |
| Х250 , Х317 , Х351 , Х372 , Х412 | |
| П210 , П273 , П280 , П302 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Никель Ренея / ˈ r eɪ n iː ˈ n ɪ k əl / , также называемый губчатым никелем , [ 1 ] представляет собой мелкозернистое твердое вещество, состоящее в основном из никеля, полученного из никель- алюминиевого сплава. [ 2 ] [ 3 ] Известно несколько марок, большинство из которых представляют собой твердые вещества серого цвета. Некоторые из них пирофорны , но большинство из них используются в виде устойчивых на воздухе суспензий. Никель Ренея используется в качестве реагента и катализатора в органической химии . Он был разработан в 1926 году американским инженером Мюрреем Рэйни для гидрирования растительных масел. [ 4 ] [ 5 ] Raney является зарегистрированной торговой маркой WR Grace and Company . Другими крупными производителями являются Evonik и Johnson Matthey .
Подготовка
[ редактировать ]Подготовка сплава
[ редактировать ]
Сплав Ni–Al получают растворением никеля в расплавленном алюминии с последующим охлаждением («закалкой»). В зависимости от соотношения Ni:Al при закалке выделяются различные фазы. Во время процедуры гашения добавляются небольшие количества третьего металла, например цинка или хрома, для повышения активности полученного катализатора. Этот третий металл называется « промотором ». [ 6 ] Промотор превращает смесь из бинарного сплава в тройной сплав, что может привести к различным свойствам закалки и выщелачивания во время активации.
Активация
[ редактировать ]В процессе активации сплав, обычно в виде мелкодисперсного порошка, обрабатывается концентрированным раствором гидроксида натрия . [ 3 ] Упрощенная реакция выщелачивания описывается следующим химическим уравнением :
- 2 Al + 2 NaOH + 6 H 2 O → 2 Na[Al(OH) 4 ] + 3 H 2
Образование алюмината натрия (Na[Al(OH) 4 ]) требует использования растворов гидроксида натрия высокой концентрации, чтобы избежать образования гидроксида алюминия , который в противном случае выпал бы в осадок в виде байерита . [ 6 ] растворы гидроксида натрия с концентрацией до 5 М. Поэтому используют
Температура, используемая для выщелачивания сплава, оказывает заметное влияние на свойства катализатора. Обычно выщелачивание проводят при температуре от 70 до 100 °C. Площадь поверхности никеля Ренея (и связанных с ним катализаторов в целом) имеет тенденцию уменьшаться с увеличением температуры выщелачивания. [ 7 ] Это происходит из-за структурных перестроек внутри сплава, которые можно рассматривать как аналог спекания , когда связки сплава начинают слипаться друг с другом при более высоких температурах, что приводит к потере пористой структуры. [ нужна ссылка ]
В процессе активации Al выщелачивается из фаз NiAl 3 и Ni 2 Al 3, присутствующих в сплаве, тогда как большая часть Ni остается в форме NiAl. Удаление Al из некоторых фаз, но не из других, известно как « селективное выщелачивание ». Показано, что фаза NiAl обеспечивает структурную и термическую стабильность катализатора. В результате катализатор весьма устойчив к разложению («разрушению», обычно известному как «старение»). [ 7 ] Это сопротивление позволяет хранить и повторно использовать никель Ренея в течение длительного периода; однако для лабораторного использования обычно предпочтительны свежие препараты. [ 8 ] По этой причине коммерческий никель Ренея доступен как в «активной», так и в «неактивной» формах.
Перед хранением катализатор можно промыть дистиллированной водой при температуре окружающей среды для удаления остатков алюмината натрия. бескислородную ( дегазированную Для хранения предпочтительнее использовать ) воду, чтобы предотвратить окисление катализатора, которое может ускорить процесс его старения и привести к снижению каталитической активности. [ 6 ]
Характеристики
[ редактировать ]


Макроскопически никель Ренея представляет собой мелкодисперсный серый порошок. Микроскопически каждая частица этого порошка представляет собой трехмерную сетку с порами неправильного размера и формы, подавляющее большинство из которых создается в процессе выщелачивания. Никель Ренея отличается термической и структурной стабильностью, а также большой площадью поверхности Брунауэра - Эммета - Теллера ( БЭТ ). Эти свойства являются прямым результатом процесса активации и способствуют относительно высокой каталитической активности. [ нужна ссылка ]
Площадь поверхности обычно определяется методом БЭТ с использованием газа, который предпочтительно адсорбируется на металлических поверхностях, например водорода . С помощью этого типа измерений было показано, что почти вся открытая площадь частицы катализатора содержит Ni на своей поверхности. [ 6 ] Поскольку Ni является активным металлом катализатора, большая площадь поверхности Ni означает, что большая поверхность доступна для одновременного протекания реакций, что отражается на повышенной активности катализатора. Коммерчески доступный никель Ренея имеет среднюю площадь поверхности Ni 100 м². 2 на грамм катализатора. [ 6 ]
Высокая каталитическая активность в сочетании с тем фактом, что водород поглощается порами катализатора во время активации, делает никель Ренея полезным катализатором для многих гидрирования реакций . Его структурная и термическая стабильность (т. е. он не разлагается при высоких температурах) позволяет использовать его в широком диапазоне условий реакции. [ 9 ] [ 10 ] Кроме того, растворимость никеля Ренея незначительна в большинстве распространенных лабораторных растворителей, за исключением минеральных кислот , таких как соляная кислота, и его относительно высокая плотность (около 6,5 г · см3). −3 ) [ 1 ] также облегчает его отделение от жидкой фазы после завершения реакции.
Приложения
[ редактировать ]Никель Ренея используется во многих промышленных процессах и в органическом синтезе из-за его стабильности и высокой каталитической активности при комнатной температуре. [ 6 ] [ 11 ] [ 12 ]
Промышленное применение
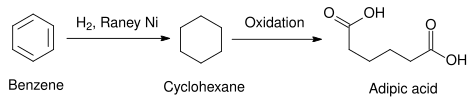
[ редактировать ]Ренея используется в качестве катализатора гидрирования бензола В коммерческом применении никель в циклогексан . другие гетерогенные катализаторы, например, с использованием платиновой группы элементов В некоторых случаях используются . Платиновые металлы, как правило, более активны и требуют более мягких температур, но они дороже, чем никель Ренея. [ 13 ] Полученный таким образом циклогексан можно использовать в синтезе адипиновой кислоты — сырья, используемого в промышленном производстве полиамидов , таких как нейлон. [ 14 ]
Другие промышленные применения никеля Ренея включают преобразование:
- Декстроза в сорбит ;
- Нитросоединения аминов ; , например, от 2,4- динитротолуола до 2,4-толуилендиамина
- Нитрилы в амины, например, стеаронитрил в стеариламин и адипонитрил в гексаметилендиамин ;
- Олефины в парафины , например, сульфолен в сульфолан ;
- Ацетилены превращаются в парафины, например, из 1,4-бутиндиола в 1,4-бутандиол .
Применение в органическом синтезе
[ редактировать ]Десульфурация
[ редактировать ]Никель Ренея используется в органическом синтезе для десульфурации . Например, тиоацетали будут восстановлены до углеводородов на последней стадии восстановления Мозинго : [ 14 ] [ 15 ]

Тиолы , [ 16 ] и сульфиды [ 17 ] можно удалить из алифатических , ароматических или гетероароматических соединений. Аналогично, никель Ренея удаляет серу из тиофена, образуя насыщенный алкан . [ 18 ]

Сокращение функциональных групп
[ редактировать ]Обычно его используют при восстановлении соединений с кратными связями , таких как алкины , алкены , [ 19 ] нитрилы , [ 20 ] диены , ароматические соединения [ 21 ] и карбонилсодержащие соединения. Кроме того, никель Ренея восстанавливает связи гетероатом-гетероатом, такие как гидразины , [ 22 ] нитрогруппы и нитрозамины. [ 23 ] Он также нашел применение при восстановительном алкилировании аминов . [ 24 ] и аминирование спиртов.
При восстановлении двойной связи углерод-углерод никель Ренея присоединяет водород син- образным образом. [ 14 ]
Родственные катализаторы
[ редактировать ]Также был описан кобальт Ренея.
В отличие от пирофорной природы некоторых форм никеля Ренея, катализаторы на основе силицида никеля представляют собой потенциально более безопасную альтернативу. [ 25 ]
Сплавы Ренея включают FeTi и другие неникелевые сплавы. FeTi рассматривался для хранения водорода под низким давлением. [ 26 ] Aldricimica Acta (от Sigma, урожденная Олдрич) содержит полный список сплавов Ренея.
Безопасность
[ редактировать ]

Из-за большой площади поверхности и большого объема содержащегося в нем газообразного водорода сухой активированный никель Ренея является пирофорным материалом, с которым необходимо обращаться в инертной атмосфере . Никель Ренея обычно поставляется в виде 50% суспензии в воде. Даже после реакции остаточный никель Ренея содержит значительное количество газообразного водорода и может самопроизвольно воспламениться при контакте с воздухом. [ 27 ]
Кроме того, острое воздействие никеля Ренея может вызвать раздражение дыхательных путей и полости носа, а также вызвать легочный фиброз при вдыхании. Проглатывание может привести к судорогам и кишечным расстройствам. Это также может вызвать раздражение глаз и кожи. Хроническое воздействие может привести к пневмониту и другим признакам сенсибилизации к никелю, таким как кожная сыпь («никелевый зуд»). [ 28 ]
| НФПА 704 площадь безопасности | |
|---|---|
Никель также классифицируется МАИР как возможный канцероген для человека группа ( тератоген 2B, категория 3 ЕС ) и , а вдыхание мелких частиц оксида алюминия связано с болезнью Шейвера .
Разработка
[ редактировать ]Мюррей Рэйни по специальности инженер-механик окончил Университет Кентукки в 1909 году. В 1915 году он присоединился к компании Lookout Oil and Refining Company в Теннесси и отвечал за установку электролизеров для производства водорода, который использовался при гидрировании растительных масел. . В то время в промышленности использовался никелевый катализатор, приготовленный из оксида никеля (II) . Полагая, что можно производить более качественные катализаторы, примерно в 1921 году он начал проводить независимые исследования, продолжая работать в Lookout Oil. с соотношением 1:1 В 1924 году был произведен сплав Ni/ Si , который после обработки гидроксидом натрия оказался в пять раз более активным, чем лучший катализатор, используемый при гидрировании хлопкового масла. Патент на это открытие был выдан в декабре 1925 года. [ 29 ]
Впоследствии Рени произвел сплав Ni/Al 1:1, следуя процедуре, аналогичной той, которая использовалась для никель-кремниевого катализатора. Он обнаружил, что полученный катализатор оказался еще более активным, и подал заявку на патент в 1926 году. [ 30 ] Сейчас это обычный состав сплава для современных никелевых катализаторов Ренея. [ 2 ] Другие распространенные составы сплавов включают Ni/Al 21:29 и Ni/Al 3:7. И активность, и протоколы приготовления этих катализаторов различаются. [ 2 ] [ 31 ]
После разработки никеля Ренея были рассмотрены другие системы сплавов с алюминием, наиболее известные из которых включают медь, рутений и кобальт . [ 32 ] Дальнейшие исследования показали, что добавление небольшого количества третьего металла в бинарный сплав будет способствовать активности катализатора. Некоторыми широко используемыми промоторами являются цинк, молибден и хром . Альтернативный способ получения энантиоселективного никеля Ренея был разработан путем поверхностной адсорбции кислоты винной . [ 33 ]
См. также
[ редактировать ]- алюминид никеля
- Ты знаешь никель
- Речной никель
- Катализатор на основе борида никеля
- Кобальт Ренея , аналогичный катализатор из сплава кобальта и алюминия, который иногда более селективен в отношении определенных продуктов гидрирования (например, первичных аминов посредством восстановления нитрила ). [ 2 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б «Губчатый никель» . Европейское космическое агентство . Архивировано из оригинала 10 апреля 2017 года . Проверено 7 ноября 2009 г.
- ^ Перейти обратно: а б с д Нисимура, Сигео (2001). Справочник по гетерогенному каталитическому гидрированию для органического синтеза (1-е изд.). Нью-Йорк: Wiley-Interscience . стр. 7–19. ISBN 9780471396987 .
- ^ Перейти обратно: а б Биллика, Гарри; Адкинс, Гомер (1949). «Катализатор, никель Ренея, W6 (с высоким содержанием алюминия и адсорбированного водорода)» . Органические синтезы . 29 : 24. дои : 10.15227/orgsyn.029.0024 ; Сборник томов , т. 3, с. 176 .
- ^ См.:
- Рэйни, Мюррей, «Метод получения мелкодисперсного никеля», Архивировано 5 марта 2017 г. в Wayback Machine, патент США № 1628190 (подана: 14 мая 1926 г.; выдана: 10 мая 1927 г.).
- М. С. Уэйнрайт, «3.2 Скелетные металлические катализаторы» в: Герхард Эртль, Гельмут Кноцингер и Йенс Вейткамп, ред., « Приготовление твердых катализаторов» (Вайнхайм, Федеративная Республика Германия: Wiley-VCH Verlag, 1999), страницы 28–29.
- ^ Ян, Тенг-Куэй; Ли, Донг-Шэн; Хаас, Джулия (2005). «Рейни Никель». Энциклопедия реагентов для органического синтеза . Нью-Йорк: Джон Уайли и сыновья . дои : 10.1002/047084289X.rr001.pub2 . ISBN 0471936235 .
- ^ Перейти обратно: а б с д и ж Эртль, Герхард; Кноцингер, Хельмут (1997). Приготовление твердых катализаторов . Уайли. стр. 30–34. ISBN 3-527-29826-6 .
- ^ Перейти обратно: а б Смит, Эй Джей; Тримм, Д.Л. (2005). «Приготовление скелетных катализаторов». Анну. Преподобный Матер. Рез. 35 : 127. Бибкод : 2005AnRMS..35..127S . дои : 10.1146/annurev.matsci.35.102303.140758 .
- ^ М. Гисне, изд. (1993). Гетерогенный катализ и тонкая химия III: материалы 3-го международного симпозиума . Эльзевир. п. 69. ИСБН 0-444-89063-7 .
- ^ Кроуфорд, Джеральд (апрель 2003 г.). «Экзотический сплав находит нишу» . Журнал «Никель» . Проверено 19 декабря 2006 г.
- ^ Каррутерс, В. (1986). Некоторые современные методы органического синтеза . Издательство Кембриджского университета . стр. 413–414. ISBN 0-521-31117-9 .
- ^ Гауптманн, Генрих; Вальтер, Вольфганг Фердинанд (1962). «Действие никеля Ренея на органические соединения серы». хим. Ред. 62 (5): 347. doi : 10.1021/cr60219a001 .
- ^ «Использование никеля Ренея в органическом синтезе» . 2005. Архивировано из оригинала 5 июня 2009 года . Проверено 1 августа 2009 г.
- ^ Кэмпбелл, М. Ларри (2011). «Циклогексан». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a08_209.pub2 . ISBN 978-3527306732 .
- ^ Перейти обратно: а б с Соломонс, Т.В. Грэм; Фрайл, Крейг Б. (2004). Органическая химия . Уайли. ISBN 0-471-41799-8 .
- ^ Джонатан Клейден; Ник Гривз; Стюарт Уоррен (2012). Органическая химия (2-е изд.). Издательство Оксфордского университета . ISBN 9780199270293 .
- ^ Грэм, Арканзас; Миллидж, AF; Янг, ДП (1954). «Продукты окисления диизобутилена. Часть III. Продукты раскрытия цикла 1,2-эпокси-2,4,4-триметилпентана». Журнал Химического общества (обновленный) : 2180. doi : 10.1039/JR9540002180 .
- ^ Гассман, П.Г.; ван Берген, Ти Джей (1988). «Индолы из анилинов: Этил-2-метилиндол-5-карбоксилат». Органические синтезы . дои : 10.15227/orgsyn.056.0072 ; Сборник томов , т. 6, с. 601 .
- ^ Хёгберг, Ханс Эрик; Хеденстрем, Эрик; Фэгерхаг, Йонас; Серви, Стефано (1992). «Энантиоселективный синтез ( S )-2-метил-1-алканолов с помощью пекарских дрожжей, опосредованный восстановлением 2-метил-3-(2-тиофен)пропеналей». Дж. Орг. хим. 57 (7): 2052–2059. дои : 10.1021/jo00033a028 .
- ^ Пейдж, Джорджия; Тарбелл, DS (1963). «β-( о -карбоксифенил)пропионовая кислота» . Органические синтезы . 34 : 8. дои : 10.15227/orgsyn.034.0008 ; Сборник томов , т. 4, с. 136 .
- ^ Робинсон, ХК; Снайдер, HR (1955). «β-Фенилэтиламин» . Органические синтезы . 23 : 71. дои : 10.15227/orgsyn.023.0071 ; Сборник томов , т. 3, с. 720 .
- ^ Швенк, Э.; Папа, Д.; Ханкин, Х.; Гинзберг, Х. (1955). «γ-н-пропилбутиролактон и β-(тетрагидрофурил)пропионовая кислота» . Органические синтезы . 27 : 68. дои : 10.15227/orgsyn.027.0068 ; Сборник томов , т. 3, с. 742 .
- ^ Алексакис, Алекс; Ленсен, Натали; Манжени, Пьер (1991). «Расщепление связей NN в гидразинах с помощью ультразвука, проведенное Никелем Рени». Синлетт . 1991 (9): 625–626. дои : 10.1055/s-1991-20818 .
- ^ Эндерс, Д.; Питер, Р.; Ренгер, Б.; Сибах, Д. (1988). «Нуклеофильное α-втор-аминоалкилирование: 2-(дифенилгидроксиметил)пирролиден» . Органические синтезы . 58 : 113. дои : 10.15227/orgsyn.058.0113 ; Сборник томов , т. 6, с. 542 .
- ^ Райс, Р.Г.; Кон, Э.Дж. (1963). « N , N' -Диэтилбензиден» . Органические синтезы . 36 : 21. дои : 10.15227/orgsyn.036.0021 ; Сборник томов , т. 4, с. 283 .
- ^ П. Рябчук, Г. Агостини, М.-М. Поль, Х. Лунд, А. Агапова, Х. Юнге, К. Юнге и М. Беллер, Sci. Adv., 2018, 4, eaat0761, https://www.science.org/doi/10.1126/sciadv.aat0761
- ^ https://scholars.cityu.edu.hk/files/135079297/129830072.pdf . [ только URL-адрес PDF ]
- ^ Броня, М.-А (2003). Руководство по утилизации опасных лабораторных химикатов . ЦРК Пресс. п. 331. ИСБН 1-56670-567-3 .
- ^ «Паспорт безопасности алюминида никеля» (PDF) . Международная электронная космическая продукция. 1994. [ постоянная мертвая ссылка ]
- ^ США 1563587 , Мюррей Рэйни, «Метод приготовления каталитического материала», выдан 1 декабря 1925 г. (оригинальный никель-кремниевый катализатор Рэйни).
- ^ США 1628190 , Мюррей Рэйни, «Способ производства мелкодисперсного никеля», выпущен 10 мая 1927 г.
- ^ Урусибара, Ёсиюки; Нисимура, Сигео (1957). «Способ приготовления катализатора из никеля Ренея с большей активностью» . Бык. хим. Соц. Япония. 30 (2): 199. doi : 10.1246/bcsj.30.199 .
- ^ Августин, Роберт Л. (1996). Гетерогенный катализ для химика-синтетика . ЦРК Пресс. стр. 248–249. ISBN 0-8247-9021-9 .
- ^ Баккер, ML; Янг, диджей; Уэйнрайт, М.С. (1988). «Селективное выщелачивание интерметаллидов NiAl 3 и Ni 2 Al 3 с образованием никеля Ренея». Дж. Матер. наук. 23 (11): 3921–3926. Бибкод : 1988JMatS..23.3921B . дои : 10.1007/BF01106814 . S2CID 95576771 .
Внешние ссылки
[ редактировать ]- Международная карта химической безопасности 0062
- Карманный справочник NIOSH по химическим опасностям
- Статья 1941 года, описывающая получение никеля Ренея марки W-2: Мозинго, Ральф (1941). «Катализатор, Рэйни Никель, W-2» . Органические синтезы . 21:15 . дои : 10.15227/orgsyn.021.0015 .
