Глюкоза
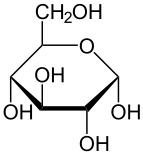
 Скелетная формула d -глюкоза | |
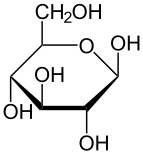
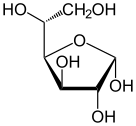
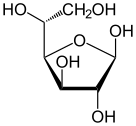
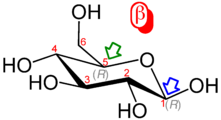
 Проекция Хаворта α- d -глюкопираноза | |
 Fischer projection of d-glucose | |
| Names | |
|---|---|
| Pronunciation | /ˈɡluːkoʊz/, /ɡluːkoʊs/ |
| IUPAC name Allowed trivial names:[1]
| |
| Preferred IUPAC name PINs are not identified for natural products. | |
Systematic IUPAC name
| |
| Other names Blood sugars Dextrose Corn sugar d-Glucose Grape sugar | |
| Identifiers | |
3D model (JSmol) |
|
| 3DMet | |
| Abbreviations | Glc |
| 1281604 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| EC Number |
|
| 83256 | |
| KEGG | |
| MeSH | Glucose |
PubChem CID | |
| RTECS number |
|
| UNII |
|
| Properties | |
| C6H12O6 | |
| Molar mass | 180.156 g/mol |
| Appearance | White powder |
| Density | 1.54 g/cm3 |
| Melting point | α-d-Glucose: 146 °C (295 °F; 419 K) β-d-Glucose: 150 °C (302 °F; 423 K) |
| 909 g/L (25 °C (77 °F)) | |
| −101.5×10−6 cm3/mol | |
| 10.5674 | |
| Thermochemistry | |
Heat capacity (C) | 218.6 J/(K·mol)[2] |
Std molar entropy (S⦵298) | 209.2 J/(K·mol)[2] |
Std enthalpy of formation (ΔfH⦵298) | −1271 kJ/mol[3] |
| 2,805 kJ/mol (670 kcal/mol) | |
| Pharmacology | |
| B05CX01 (WHO) V04CA02 (WHO), V06DC01 (WHO) | |
| Hazards | |
| NFPA 704 (fire diamond) | |
| Safety data sheet (SDS) | ICSC 08655 |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
Глюкоза – это сахар с молекулярной формулой С 6 Н 12 О 6 . Глюкоза в целом является наиболее распространенным моносахаридом . [4] подкатегория углеводов . Глюкоза в основном вырабатывается растениями и большинством водорослей в ходе фотосинтеза из воды и углекислого газа с использованием энергии солнечного света. Глюкоза используется растениями для производства целлюлозы — самого распространенного углевода в мире — для использования в клеточных стенках , а также всеми живыми организмами для производства аденозинтрифосфата (АТФ), который используется клеткой в качестве энергии. [5] [6] [7]
В энергетическом обмене глюкоза является важнейшим источником энергии во всех организмах . Глюкоза для метаболизма запасается в виде полимера , у растений главным образом в виде крахмала и амилопектина , а у животных - в виде гликогена . Глюкоза циркулирует в крови животных в виде сахара в крови . [5] [7] Природной формой глюкозы является d -глюкоза, а ее стереоизомер L -глюкоза производится синтетическим путем в сравнительно небольших количествах и менее биологически активна. [7] Глюкоза представляет собой моносахарид, содержащий шесть атомов углерода и альдегидную группу, и, следовательно, является альдогексозой . Молекула глюкозы может существовать как в открытой (ациклической), так и в кольцевой (циклической) форме. Глюкоза встречается в природе и в свободном состоянии содержится во фруктах и других частях растений. У животных глюкоза высвобождается в результате распада гликогена в процессе, известном как гликогенолиз .
Glucose, as intravenous sugar solution, is on the World Health Organization's List of Essential Medicines.[8] It is also on the list in combination with sodium chloride (table salt).[8]
The name glucose is derived from Ancient Greek γλεῦκος (gleûkos) 'wine, must', from γλυκύς (glykýs) 'sweet'.[9][10] The suffix -ose is a chemical classifier denoting a sugar.
History
[edit]Glucose was first isolated from raisins in 1747 by the German chemist Andreas Marggraf.[11][12] Glucose was discovered in grapes by another German chemist – Johann Tobias Lowitz – in 1792, and distinguished as being different from cane sugar (sucrose). Glucose is the term coined by Jean Baptiste Dumas in 1838, which has prevailed in the chemical literature. Friedrich August Kekulé proposed the term dextrose (from the Latin dexter, meaning "right"), because in aqueous solution of glucose, the plane of linearly polarized light is turned to the right. In contrast, l-fructose (usually referred to as d-fructose) (a ketohexose) and l-glucose (l-glucose) turn linearly polarized light to the left. The earlier notation according to the rotation of the plane of linearly polarized light (d and l-nomenclature) was later abandoned in favor of the d- and l-notation, which refers to the absolute configuration of the asymmetric center farthest from the carbonyl group, and in concordance with the configuration of d- or l-glyceraldehyde.[13][14]
Since glucose is a basic necessity of many organisms, a correct understanding of its chemical makeup and structure contributed greatly to a general advancement in organic chemistry. This understanding occurred largely as a result of the investigations of Emil Fischer, a German chemist who received the 1902 Nobel Prize in Chemistry for his findings.[15] The synthesis of glucose established the structure of organic material and consequently formed the first definitive validation of Jacobus Henricus van 't Hoff's theories of chemical kinetics and the arrangements of chemical bonds in carbon-bearing molecules.[16] Between 1891 and 1894, Fischer established the stereochemical configuration of all the known sugars and correctly predicted the possible isomers, applying Van 't Hoff's theory of asymmetrical carbon atoms. The names initially referred to the natural substances. Their enantiomers were given the same name with the introduction of systematic nomenclatures, taking into account absolute stereochemistry (e.g. Fischer nomenclature, d/l nomenclature).
For the discovery of the metabolism of glucose Otto Meyerhof received the Nobel Prize in Physiology or Medicine in 1922.[17] Hans von Euler-Chelpin was awarded the Nobel Prize in Chemistry along with Arthur Harden in 1929 for their "research on the fermentation of sugar and their share of enzymes in this process".[18][19] In 1947, Bernardo Houssay (for his discovery of the role of the pituitary gland in the metabolism of glucose and the derived carbohydrates) as well as Carl and Gerty Cori (for their discovery of the conversion of glycogen from glucose) received the Nobel Prize in Physiology or Medicine.[20][21][22] In 1970, Luis Leloir was awarded the Nobel Prize in Chemistry for the discovery of glucose-derived sugar nucleotides in the biosynthesis of carbohydrates.[23]
Chemical and physical properties
[edit]Glucose forms white or colorless solids that are highly soluble in water and acetic acid but poorly soluble in methanol and ethanol. They melt at 146 °C (295 °F) (α) and 150 °C (302 °F) (beta), decompose starting at 188 °C (370 °F) with release of various volatile products, ultimately leaving a residue of carbon.[24] Glucose has a pKa value of 12.16 at 25 °C (77 °F) in water.[25]
With six carbon atoms, it is classed as a hexose, a subcategory of the monosaccharides. d-Glucose is one of the sixteen aldohexose stereoisomers. The d-isomer, d-glucose, also known as dextrose, occurs widely in nature, but the l-isomer, l-glucose, does not. Glucose can be obtained by hydrolysis of carbohydrates such as milk sugar (lactose), cane sugar (sucrose), maltose, cellulose, glycogen, etc. Dextrose is commonly commercially manufactured from starches, such as corn starch in the US and Japan, from potato and wheat starch in Europe, and from tapioca starch in tropical areas.[26] The manufacturing process uses hydrolysis via pressurized steaming at controlled pH in a jet followed by further enzymatic depolymerization.[27] Unbonded glucose is one of the main ingredients of honey.[28][29][30][31][32]
The term dextrose is often used in a clinical (related to patient's health status) or nutritional context (related to dietary intake, such as food labels or dietary guidelines), while "glucose" is used in a biological or physiological context (chemical processes and molecular interactions),[33][34][35][36] but both terms refer to the same molecule, specifically D-glucose.[35][37]
Dextrose monohydrate is the hydrated form of D-glucose, meaning that it is a glucose molecule with an additional water molecule attached.[38] Its chemical formula is C6H12O6 · H2O.[38][39] Dextrose monohydrate is also called hydrated D-glucose, and commonly manufactured from plant starches.[38][40] Dextrose monohydrate is utilized as the predominant type of dextrose in food applications, such as beverage mixes—it is a common form of glucose widely used as a nutrition supplement in production of foodstuffs. Dextrose monohydrate is primarily consumed in North America as a corn syrup or high-fructose corn syrup.[35]
Anhydrous dextrose, on the other hand, is glucose that does not have any water molecules attached to it.[40] [41] Anhydrous chemical substances are commonly produced by eliminating water from a hydrated substance through methods such as heating or drying up (desiccation).[42][43][44] Dextrose monohydrate can be dehydrated to anhydrous dextrose in industrial setting.[45][46] Dextrose monohydrate is composed of approximately 9.5% water by mass; through the process of dehydration, this water content is eliminated to yield anhydrous (dry) dextrose.[40]
Anhydrous dextrose has the chemical formula C6H12O6, without any water molecule attached which is the same as glucose.[38] Anhydrous dextrose on open air tends to absorb moisture and transform to the monohydrate, and it is more expensive to produce.[40] Anhydrous dextrose (anhydrous D-glucose) has increased stability and increased shelf life,[43] has medical applications, such as in oral glucose tolerance test (OGTT).[47]
Whereas molecular weight (molar mass) for D-glucose monohydrate is 198.17 g/mol,[48][49] that for anhydrous D-glucose is 180.16 g/mol[50][51][52] The density of these two forms of glucose is also different.[specify]
In terms of chemical structure, glucose is a monosaccharide, that is, a simple sugar. Glucose contains six carbon atoms and an aldehyde group, and is therefore an aldohexose. The glucose molecule can exist in an open-chain (acyclic) as well as ring (cyclic) form—due to the presence of alcohol and aldehyde or ketone functional groups, the form having the straight chain can easily convert into a chair-like hemiacetal ring structure commonly found in carbohydrates.[53]
Structure and nomenclature
[edit]
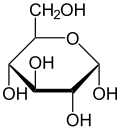
Glucose is present in solid form as a monohydrate with a closed pyran ring (α-glucopyranose monohydrate, sometimes known less precisely by dextrose hydrate). In aqueous solution, on the other hand, it is an open-chain to a small extent and is present predominantly as α- or β-pyranose, which interconvert. From aqueous solutions, the three known forms can be crystallized: α-glucopyranose, β-glucopyranose and α-glucopyranose monohydrate.[54] Glucose is a building block of the disaccharides lactose and sucrose (cane or beet sugar), of oligosaccharides such as raffinose and of polysaccharides such as starch, amylopectin, glycogen, and cellulose.[7][55] The glass transition temperature of glucose is 31 °C (88 °F) and the Gordon–Taylor constant (an experimentally determined constant for the prediction of the glass transition temperature for different mass fractions of a mixture of two substances)[55] is 4.5.[56]
| Forms and projections of d-glucose in comparison | ||
|---|---|---|
| Natta projection | Haworth projection | |
 |  α-d-glucofuranose α-d-glucofuranose | 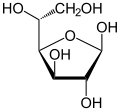 β-d-glucofuranose β-d-glucofuranose |
 α-d-glucopyranose α-d-glucopyranose |  β-d-glucopyranose β-d-glucopyranose | |
| α-d-Glucopyranose in (1) Tollens/Fischer (2) Haworth projection (3) chair conformation (4) Mills projection | ||
 | ||
Open-chain form
[edit]
A open-chain form of glucose makes up less than 0.02% of the glucose molecules in an aqueous solution at equilibrium.[57] The rest is one of two cyclic hemiacetal forms. In its open-chain form, the glucose molecule has an open (as opposed to cyclic) unbranched backbone of six carbon atoms, where C-1 is part of an aldehyde group H(C=O)−. Therefore, glucose is also classified as an aldose, or an aldohexose. The aldehyde group makes glucose a reducing sugar giving a positive reaction with the Fehling test.
Cyclic forms
[edit]In solutions, the open-chain form of glucose (either "D-" or "L-") exists in equilibrium with several cyclic isomers, each containing a ring of carbons closed by one oxygen atom. In aqueous solution, however, more than 99% of glucose molecules exist as pyranose forms. The open-chain form is limited to about 0.25%, and furanose forms exist in negligible amounts. The terms "glucose" and "D-glucose" are generally used for these cyclic forms as well. The ring arises from the open-chain form by an intramolecular nucleophilic addition reaction between the aldehyde group (at C-1) and either the C-4 or C-5 hydroxyl group, forming a hemiacetal linkage, −C(OH)H−O−.
The reaction between C-1 and C-5 yields a six-membered heterocyclic system called a pyranose, which is a monosaccharide sugar (hence "-ose") containing a derivatised pyran skeleton. The (much rarer) reaction between C-1 and C-4 yields a five-membered furanose ring, named after the cyclic ether furan. In either case, each carbon in the ring has one hydrogen and one hydroxyl attached, except for the last carbon (C-4 or C-5) where the hydroxyl is replaced by the remainder of the open molecule (which is −(C(CH2OH)HOH)−H or −(CHOH)−H respectively).
The ring-closing reaction can give two products, denoted "α-" and "β-". When a glucopyranose molecule is drawn in the Haworth projection, the designation "α-" means that the hydroxyl group attached to C-1 and the −CH2OH group at C-5 lies on opposite sides of the ring's plane (a trans arrangement), while "β-" means that they are on the same side of the plane (a cis arrangement). Therefore, the open-chain isomer D-glucose gives rise to four distinct cyclic isomers: α-D-glucopyranose, β-D-glucopyranose, α-D-glucofuranose, and β-D-glucofuranose. These five structures exist in equilibrium and interconvert, and the interconversion is much more rapid with acid catalysis.

The other open-chain isomer L-glucose similarly gives rise to four distinct cyclic forms of L-glucose, each the mirror image of the corresponding D-glucose.
The glucopyranose ring (α or β) can assume several non-planar shapes, analogous to the "chair" and "boat" conformations of cyclohexane. Similarly, the glucofuranose ring may assume several shapes, analogous to the "envelope" conformations of cyclopentane.
In the solid state, only the glucopyranose forms are observed.
Some derivatives of glucofuranose, such as 1,2-O-isopropylidene-D-glucofuranose are stable and can be obtained pure as crystalline solids.[58][59] For example, reaction of α-D-glucose with para-tolylboronic acid H3C−(C6H4)−B(OH)2 reforms the normal pyranose ring to yield the 4-fold ester α-D-glucofuranose-1,2:3,5-bis(p-tolylboronate).[60]
Mutarotation
[edit]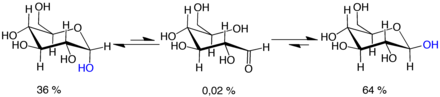
Mutarotation consists of a temporary reversal of the ring-forming reaction, resulting in the open-chain form, followed by a reforming of the ring. The ring closure step may use a different −OH group than the one recreated by the opening step (thus switching between pyranose and furanose forms), or the new hemiacetal group created on C-1 may have the same or opposite handedness as the original one (thus switching between the α and β forms). Thus, though the open-chain form is barely detectable in solution, it is an essential component of the equilibrium.
The open-chain form is thermodynamically unstable, and it spontaneously isomerizes to the cyclic forms. (Although the ring closure reaction could in theory create four- or three-atom rings, these would be highly strained, and are not observed in practice.) In solutions at room temperature, the four cyclic isomers interconvert over a time scale of hours, in a process called mutarotation.[61] Starting from any proportions, the mixture converges to a stable ratio of α:β 36:64. The ratio would be α:β 11:89 if it were not for the influence of the anomeric effect.[62] Mutarotation is considerably slower at temperatures close to 0 °C (32 °F).
Optical activity
[edit]Whether in water or the solid form, d-(+)-glucose is dextrorotatory, meaning it will rotate the direction of polarized light clockwise as seen looking toward the light source. The effect is due to the chirality of the molecules, and indeed the mirror-image isomer, l-(−)-glucose, is levorotatory (rotates polarized light counterclockwise) by the same amount. The strength of the effect is different for each of the five tautomers.
Note that the d- prefix does not refer directly to the optical properties of the compound. It indicates that the C-5 chiral centre has the same handedness as that of d-glyceraldehyde (which was so labelled because it is dextrorotatory). The fact that d-glucose is dextrorotatory is a combined effect of its four chiral centres, not just of C-5; and indeed some of the other d-aldohexoses are levorotatory.
The conversion between the two anomers can be observed in a polarimeter since pure α-d-glucose has a specific rotation angle of +112.2° mL/(dm·g), pure β-d-glucose of +17.5° mL/(dm·g).[63] When equilibrium has been reached after a certain time due to mutarotation, the angle of rotation is +52.7° mL/(dm·g).[63] By adding acid or base, this transformation is much accelerated. The equilibration takes place via the open-chain aldehyde form.
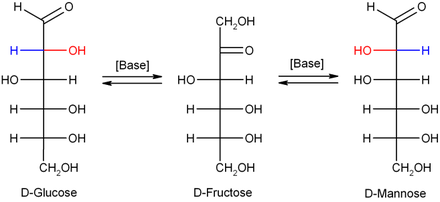
Isomerisation
[edit]In dilute sodium hydroxide or other dilute bases, the monosaccharides mannose, glucose and fructose interconvert (via a Lobry de Bruyn–Alberda–Van Ekenstein transformation), so that a balance between these isomers is formed. This reaction proceeds via an enediol:
Biochemical properties
[edit]| Metabolism of common monosaccharides and some biochemical reactions of glucose |
|---|
Glucose is the most abundant monosaccharide. Glucose is also the most widely used aldohexose in most living organisms. One possible explanation for this is that glucose has a lower tendency than other aldohexoses to react nonspecifically with the amine groups of proteins.[64] This reaction—glycation—impairs or destroys the function of many proteins,[64] e.g. in glycated hemoglobin. Glucose's low rate of glycation can be attributed to its having a more stable cyclic form compared to other aldohexoses, which means it spends less time than they do in its reactive open-chain form.[64] The reason for glucose having the most stable cyclic form of all the aldohexoses is that its hydroxy groups (with the exception of the hydroxy group on the anomeric carbon of d-glucose) are in the equatorial position. Presumably, glucose is the most abundant natural monosaccharide because it is less glycated with proteins than other monosaccharides.[64][65] Another hypothesis is that glucose, being the only d-aldohexose that has all five hydroxy substituents in the equatorial position in the form of β-d-glucose, is more readily accessible to chemical reactions,[66]: 194, 199 for example, for esterification[67]: 363 or acetal formation.[68] For this reason, d-glucose is also a highly preferred building block in natural polysaccharides (glycans). Polysaccharides that are composed solely of glucose are termed glucans.
Glucose is produced by plants through photosynthesis using sunlight,[69][70] water and carbon dioxide and can be used by all living organisms as an energy and carbon source. However, most glucose does not occur in its free form, but in the form of its polymers, i.e. lactose, sucrose, starch and others which are energy reserve substances, and cellulose and chitin, which are components of the cell wall in plants or fungi and arthropods, respectively. These polymers, when consumed by animals, fungi and bacteria, are degraded to glucose using enzymes. All animals are also able to produce glucose themselves from certain precursors as the need arises. Neurons, cells of the renal medulla and erythrocytes depend on glucose for their energy production.[70] In adult humans, there is about 18 g (0.63 oz) of glucose,[71] of which about 4 g (0.14 oz) is present in the blood.[72] Approximately 180–220 g (6.3–7.8 oz) of glucose is produced in the liver of an adult in 24 hours.[71]
Many of the long-term complications of diabetes (e.g., blindness, kidney failure, and peripheral neuropathy) are probably due to the glycation of proteins or lipids.[73] In contrast, enzyme-regulated addition of sugars to protein is called glycosylation and is essential for the function of many proteins.[74]
Uptake
[edit]Ingested glucose initially binds to the receptor for sweet taste on the tongue in humans. This complex of the proteins T1R2 and T1R3 makes it possible to identify glucose-containing food sources.[75][76] Glucose mainly comes from food—about 300 g (11 oz) per day is produced by conversion of food,[76] but it is also synthesized from other metabolites in the body's cells. In humans, the breakdown of glucose-containing polysaccharides happens in part already during chewing by means of amylase, which is contained in saliva, as well as by maltase, lactase, and sucrase on the brush border of the small intestine. Glucose is a building block of many carbohydrates and can be split off from them using certain enzymes. Glucosidases, a subgroup of the glycosidases, first catalyze the hydrolysis of long-chain glucose-containing polysaccharides, removing terminal glucose. In turn, disaccharides are mostly degraded by specific glycosidases to glucose. The names of the degrading enzymes are often derived from the particular poly- and disaccharide; inter alia, for the degradation of polysaccharide chains there are amylases (named after amylose, a component of starch), cellulases (named after cellulose), chitinases (named after chitin), and more. Furthermore, for the cleavage of disaccharides, there are maltase, lactase, sucrase, trehalase, and others. In humans, about 70 genes are known that code for glycosidases. They have functions in the digestion and degradation of glycogen, sphingolipids, mucopolysaccharides, and poly(ADP-ribose). Humans do not produce cellulases, chitinases, or trehalases, but the bacteria in the gut microbiota do.
In order to get into or out of cell membranes of cells and membranes of cell compartments, glucose requires special transport proteins from the major facilitator superfamily. In the small intestine (more precisely, in the jejunum),[77] glucose is taken up into the intestinal epithelium with the help of glucose transporters[78] via a secondary active transport mechanism called sodium ion-glucose symport via sodium/glucose cotransporter 1 (SGLT1).[79] Further transfer occurs on the basolateral side of the intestinal epithelial cells via the glucose transporter GLUT2,[79] as well uptake into liver cells, kidney cells, cells of the islets of Langerhans, neurons, astrocytes, and tanycytes.[80] Glucose enters the liver via the portal vein and is stored there as a cellular glycogen.[81] In the liver cell, it is phosphorylated by glucokinase at position 6 to form glucose 6-phosphate, which cannot leave the cell. Glucose 6-phosphatase can convert glucose 6-phosphate back into glucose exclusively in the liver, so the body can maintain a sufficient blood glucose concentration. In other cells, uptake happens by passive transport through one of the 14 GLUT proteins.[79] In the other cell types, phosphorylation occurs through a hexokinase, whereupon glucose can no longer diffuse out of the cell.
The glucose transporter GLUT1 is produced by most cell types and is of particular importance for nerve cells and pancreatic β-cells.[79] GLUT3 is highly expressed in nerve cells.[79] Glucose from the bloodstream is taken up by GLUT4 from muscle cells (of the skeletal muscle[82] and heart muscle) and fat cells.[83] GLUT14 is expressed exclusively in testicles.[84] Excess glucose is broken down and converted into fatty acids, which are stored as triglycerides. In the kidneys, glucose in the urine is absorbed via SGLT1 and SGLT2 in the apical cell membranes and transmitted via GLUT2 in the basolateral cell membranes.[85] About 90% of kidney glucose reabsorption is via SGLT2 and about 3% via SGLT1.[86]
Biosynthesis
[edit]In plants and some prokaryotes, glucose is a product of photosynthesis.[69] Glucose is also formed by the breakdown of polymeric forms of glucose like glycogen (in animals and mushrooms) or starch (in plants). The cleavage of glycogen is termed glycogenolysis, the cleavage of starch is called starch degradation.[87]
The metabolic pathway that begins with molecules containing two to four carbon atoms (C) and ends in the glucose molecule containing six carbon atoms is called gluconeogenesis and occurs in all living organisms. The smaller starting materials are the result of other metabolic pathways. Ultimately almost all biomolecules come from the assimilation of carbon dioxide in plants and microbes during photosynthesis.[67]: 359 The free energy of formation of α-d-glucose is 917.2 kilojoules per mole.[67]: 59 In humans, gluconeogenesis occurs in the liver and kidney,[88] but also in other cell types. In the liver about 150 g (5.3 oz) of glycogen are stored, in skeletal muscle about 250 g (8.8 oz).[89] However, the glucose released in muscle cells upon cleavage of the glycogen can not be delivered to the circulation because glucose is phosphorylated by the hexokinase, and a glucose-6-phosphatase is not expressed to remove the phosphate group. Unlike for glucose, there is no transport protein for glucose-6-phosphate. Gluconeogenesis allows the organism to build up glucose from other metabolites, including lactate or certain amino acids, while consuming energy. The renal tubular cells can also produce glucose.
Glucose also can be found outside of living organisms in the ambient environment. Glucose concentrations in the atmosphere are detected via collection of samples by aircraft and are known to vary from location to location. For example, glucose concentrations in atmospheric air from inland China range from 0.8 to 20.1 pg/L, whereas east coastal China glucose concentrations range from 10.3 to 142 pg/L.[90]
Glucose degradation
[edit]
In humans, glucose is metabolized by glycolysis[91] and the pentose phosphate pathway.[92] Glycolysis is used by all living organisms,[66]: 551 [93] with small variations, and all organisms generate energy from the breakdown of monosaccharides.[93] In the further course of the metabolism, it can be completely degraded via oxidative decarboxylation, the citric acid cycle (synonym Krebs cycle) and the respiratory chain to water and carbon dioxide. If there is not enough oxygen available for this, the glucose degradation in animals occurs anaerobic to lactate via lactic acid fermentation and releases much less energy. Muscular lactate enters the liver through the bloodstream in mammals, where gluconeogenesis occurs (Cori cycle). With a high supply of glucose, the metabolite acetyl-CoA from the Krebs cycle can also be used for fatty acid synthesis.[94] Glucose is also used to replenish the body's glycogen stores, which are mainly found in liver and skeletal muscle. These processes are hormonally regulated.
In other living organisms, other forms of fermentation can occur. The bacterium Escherichia coli can grow on nutrient media containing glucose as the sole carbon source.[67]: 59 In some bacteria and, in modified form, also in archaea, glucose is degraded via the Entner-Doudoroff pathway.[95] With Glucose, a mechanism for gene regulation was discovered in E. coli, the catabolite repression (formerly known as glucose effect).[96]
Use of glucose as an energy source in cells is by either aerobic respiration, anaerobic respiration, or fermentation.[97] The first step of glycolysis is the phosphorylation of glucose by a hexokinase to form glucose 6-phosphate. The main reason for the immediate phosphorylation of glucose is to prevent its diffusion out of the cell as the charged phosphate group prevents glucose 6-phosphate from easily crossing the cell membrane.[97] Furthermore, addition of the high-energy phosphate group activates glucose for subsequent breakdown in later steps of glycolysis.[98]
In anaerobic respiration, one glucose molecule produces a net gain of two ATP molecules (four ATP molecules are produced during glycolysis through substrate-level phosphorylation, but two are required by enzymes used during the process).[99] In aerobic respiration, a molecule of glucose is much more profitable in that a maximum net production of 30 or 32 ATP molecules (depending on the organism) is generated.[100]
Click on genes, proteins and metabolites below to link to respective articles.[§ 1]
- ^ The interactive pathway map can be edited at WikiPathways: "GlycolysisGluconeogenesis_WP534".
Tumor cells often grow comparatively quickly and consume an above-average amount of glucose by glycolysis,[101] which leads to the formation of lactate, the end product of fermentation in mammals, even in the presence of oxygen. This is called the Warburg effect. For the increased uptake of glucose in tumors various SGLT and GLUT are overly produced.[102][103]
In yeast, ethanol is fermented at high glucose concentrations, even in the presence of oxygen (which normally leads to respiration rather than fermentation). This is called the Crabtree effect.
Glucose can also degrade to form carbon dioxide through abiotic means. This has been demonstrated to occur experimentally via oxidation and hydrolysis at 22 °C and a pH of 2.5.[104]
Energy source
[edit]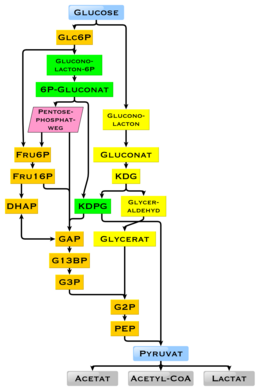
Glucose is a ubiquitous fuel in biology. It is used as an energy source in organisms, from bacteria to humans, through either aerobic respiration, anaerobic respiration (in bacteria), or fermentation. Glucose is the human body's key source of energy, through aerobic respiration, providing about 3.75 kilocalories (16 kilojoules) of food energy per gram.[105] Breakdown of carbohydrates (e.g., starch) yields mono- and disaccharides, most of which is glucose. Through glycolysis and later in the reactions of the citric acid cycle and oxidative phosphorylation, glucose is oxidized to eventually form carbon dioxide and water, yielding energy mostly in the form of adenosine triphosphate (ATP). The insulin reaction, and other mechanisms, regulate the concentration of glucose in the blood. The physiological caloric value of glucose, depending on the source, is 16.2 kilojoules per gram[106] or 15.7 kJ/g (3.74 kcal/g).[107] The high availability of carbohydrates from plant biomass has led to a variety of methods during evolution, especially in microorganisms, to utilize glucose for energy and carbon storage. Differences exist in which end product can no longer be used for energy production. The presence of individual genes, and their gene products, the enzymes, determine which reactions are possible. The metabolic pathway of glycolysis is used by almost all living beings. An essential difference in the use of glycolysis is the recovery of NADPH as a reductant for anabolism that would otherwise have to be generated indirectly.[108]
Glucose and oxygen supply almost all the energy for the brain,[109] so its availability influences psychological processes. When glucose is low, psychological processes requiring mental effort (e.g., self-control, effortful decision-making) are impaired.[110][111][112][113] In the brain, which is dependent on glucose and oxygen as the major source of energy, the glucose concentration is usually 4 to 6 mM (5 mM equals 90 mg/dL),[71] but decreases to 2 to 3 mM when fasting.[114] Confusion occurs below 1 mM and coma at lower levels.[114]
The glucose in the blood is called blood sugar. Blood sugar levels are regulated by glucose-binding nerve cells in the hypothalamus.[115] In addition, glucose in the brain binds to glucose receptors of the reward system in the nucleus accumbens.[115] The binding of glucose to the sweet receptor on the tongue induces a release of various hormones of energy metabolism, either through glucose or through other sugars, leading to an increased cellular uptake and lower blood sugar levels.[116] Artificial sweeteners do not lower blood sugar levels.[116]
The blood sugar content of a healthy person in the short-time fasting state, e.g. after overnight fasting, is about 70 to 100 mg/dL of blood (4 to 5.5 mM). In blood plasma, the measured values are about 10–15% higher. In addition, the values in the arterial blood are higher than the concentrations in the venous blood since glucose is absorbed into the tissue during the passage of the capillary bed. Also in the capillary blood, which is often used for blood sugar determination, the values are sometimes higher than in the venous blood. The glucose content of the blood is regulated by the hormones insulin, incretin and glucagon.[115][117] Insulin lowers the glucose level, glucagon increases it.[71] Furthermore, the hormones adrenaline, thyroxine, glucocorticoids, somatotropin and adrenocorticotropin lead to an increase in the glucose level.[71] There is also a hormone-independent regulation, which is referred to as glucose autoregulation.[118] After food intake the blood sugar concentration increases. Values over 180 mg/dL in venous whole blood are pathological and are termed hyperglycemia, values below 40 mg/dL are termed hypoglycaemia.[119] When needed, glucose is released into the bloodstream by glucose-6-phosphatase from glucose-6-phosphate originating from liver and kidney glycogen, thereby regulating the homeostasis of blood glucose concentration.[88][70] In ruminants, the blood glucose concentration is lower (60 mg/dL in cattle and 40 mg/dL in sheep), because the carbohydrates are converted more by their gut microbiota into short-chain fatty acids.[120]
Some glucose is converted to lactic acid by astrocytes, which is then utilized as an energy source by brain cells; some glucose is used by intestinal cells and red blood cells, while the rest reaches the liver, adipose tissue and muscle cells, where it is absorbed and stored as glycogen (under the influence of insulin). Liver cell glycogen can be converted to glucose and returned to the blood when insulin is low or absent; muscle cell glycogen is not returned to the blood because of a lack of enzymes. In fat cells, glucose is used to power reactions that synthesize some fat types and have other purposes. Glycogen is the body's "glucose energy storage" mechanism, because it is much more "space efficient" and less reactive than glucose itself.
As a result of its importance in human health, glucose is an analyte in glucose tests that are common medical blood tests.[121] Eating or fasting prior to taking a blood sample has an effect on analyses for glucose in the blood; a high fasting glucose blood sugar level may be a sign of prediabetes or diabetes mellitus.[122]
Гликемический индекс — это показатель скорости резорбции и преобразования в уровень глюкозы в крови из принятых углеводов, измеряемый как площадь под кривой уровня глюкозы в крови после потребления по сравнению с глюкозой (глюкоза определяется как 100). [123] The clinical importance of the glycemic index is controversial,[123][124] as foods with high fat contents slow the resorption of carbohydrates and lower the glycemic index, e.g. ice cream.[124] An alternative indicator is the insulin index,[125] measured as the impact of carbohydrate consumption on the blood insulin levels. The glycemic load is an indicator for the amount of glucose added to blood glucose levels after consumption, based on the glycemic index and the amount of consumed food.
Предшественник
[ редактировать ]Организмы используют глюкозу в качестве предшественника для синтеза ряда важных веществ. Крахмал, целлюлоза и гликоген («животный крахмал») являются распространенными полимерами глюкозы (полисахаридами). Некоторые из этих полимеров (крахмал или гликоген) служат запасами энергии, тогда как другие (целлюлоза и хитин , который производится из производного глюкозы) играют структурную роль. Олигосахариды глюкозы в сочетании с другими сахарами служат важными запасами энергии. К ним относятся лактоза, преобладающий сахар в молоке, который представляет собой дисахарид глюкозы-галактозы, и сахароза, еще один дисахарид, состоящий из глюкозы и фруктозы. Глюкоза также добавляется к определенным белкам и липидам в процессе, называемом гликозилированием . Зачастую это имеет решающее значение для их функционирования. Ферменты, которые соединяют глюкозу с другими молекулами, обычно используют фосфорилированную глюкозу для формирования новой связи путем ее соединения с разрывом глюкозо-фосфатной связи.
Помимо прямого использования в качестве мономера, глюкоза может расщепляться для синтеза множества других биомолекул. Это важно, поскольку глюкоза служит одновременно основным хранилищем энергии и источником органического углерода. Глюкоза может расщепляться и превращаться в липиды . Он также является предшественником синтеза других важных молекул, таких как витамин С (аскорбиновая кислота). В живых организмах глюкоза превращается в несколько других химических соединений, которые являются исходным материалом для различных метаболических путей . Среди них все остальные моносахариды [126] такие как фруктоза (по полиольному пути ), [79] манноза (эпимер глюкозы в положении 2), галактоза (эпимер в положении 4), фукоза, различные уроновые кислоты и аминосахара . Из глюкозы образуются [81] Помимо фосфорилирования до глюкозо-6-фосфата, являющегося частью гликолиза, глюкоза может окисляться при ее распаде до глюконо-1,5-лактона . Глюкоза используется у некоторых бактерий в качестве строительного блока при биосинтезе трегалозы или декстрана , а у животных — как строительный блок гликогена. Глюкоза также может превращаться из бактериальной ксилозоизомеразы во фруктозу. Кроме того, метаболиты глюкозы производят все заменимые аминокислоты, сахарные спирты, такие как маннит и сорбит , жирные кислоты , холестерин и нуклеиновые кислоты . [126] Наконец, глюкоза используется в качестве строительного материала при гликозилировании белков до гликопротеинов , гликолипидов , пептидогликанов , гликозидов и других веществ (катализируемого гликозилтрансферазами ) и может быть отщеплена от них гликозидазами .
Патология
[ редактировать ]Диабет
[ редактировать ]Диабет — это нарушение обмена веществ, при котором организм не может регулировать уровень глюкозы в крови либо из-за недостатка инсулина в организме, либо из-за неспособности клеток организма должным образом реагировать на инсулин. Каждая из этих ситуаций может быть вызвана устойчиво высоким уровнем глюкозы в крови вследствие истощения поджелудочной железы и резистентности к инсулину . – Поджелудочная железа орган, ответственный за секрецию гормонов инсулина и глюкагона. [127] Инсулин — это гормон, который регулирует уровень глюкозы, позволяя клеткам организма поглощать и использовать глюкозу. Без него глюкоза не может попасть в клетку и, следовательно, не может использоваться в качестве топлива для функций организма. [128] Если поджелудочная железа подвергается постоянному повышению уровня глюкозы в крови, инсулин-продуцирующие клетки поджелудочной железы могут быть повреждены, что приведет к нехватке инсулина в организме. Инсулинорезистентность возникает, когда поджелудочная железа пытается вырабатывать все больше и больше инсулина в ответ на постоянно повышенный уровень глюкозы в крови. В конце концов, остальная часть тела становится резистентной к инсулину, который вырабатывает поджелудочная железа, что требует большего количества инсулина для достижения того же эффекта снижения уровня глюкозы в крови и вынуждает поджелудочную железу вырабатывать еще больше инсулина, чтобы конкурировать с резистентностью. Эта негативная спираль способствует выгоранию поджелудочной железы и прогрессированию диабета.
Чтобы контролировать реакцию организма на сахароснижающую терапию, можно измерить уровень глюкозы. Мониторинг уровня глюкозы в крови может осуществляться несколькими методами, например, с помощью теста на глюкозу натощак, который измеряет уровень глюкозы в крови после 8 часов голодания. Другой тест — это 2-часовой тест на толерантность к глюкозе (GTT). Для этого теста человек проходит тест на глюкозу натощак, затем выпивает 75-граммовый напиток с глюкозой и проходит повторное тестирование. Этот тест измеряет способность организма человека перерабатывать глюкозу. Со временем уровень глюкозы в крови должен снизиться, поскольку инсулин позволяет ему поглощаться клетками и выходить из кровотока.
Управление гипогликемией
[ редактировать ]
Люди с диабетом или другими заболеваниями, которые приводят к низкому уровню сахара в крови, часто имеют при себе небольшое количество сахара в различных формах. Одним из наиболее часто используемых видов сахара является глюкоза, часто в форме таблеток глюкозы (глюкоза, спрессованная в форму таблетки, иногда с одним или несколькими другими ингредиентами в качестве связующего вещества), леденца или пакета сахара .
Источники
[ редактировать ]
Большинство пищевых углеводов содержат глюкозу либо в качестве единственного строительного блока (как в полисахаридах, крахмале и гликогене), либо вместе с другим моносахаридом (как в гетерополисахаридах, сахарозе и лактозе). [129] Несвязанная глюкоза является одним из основных ингредиентов меда. Глюкоза чрезвычайно распространена и была выделена из различных природных источников по всему миру, включая мужские шишки хвойного дерева Wollemia nobilis в Риме, [130] корни растений Ilex asprella в Китае, [131] и соломка из риса в Калифорнии. [132]
| Еда элемент | Углеводы, общий, [а] включая пищевые волокна | Общий сахар | Бесплатно фруктоза | Бесплатно глюкоза | Сахароза | Соотношение фруктоза/ глюкоза | Сахароза как доля общее количество сахаров (%) |
|---|---|---|---|---|---|---|---|
| Фрукты | |||||||
| Яблоко | 13.8 | 10.4 | 5.9 | 2.4 | 2.1 | 2.0 | 19.9 |
| Абрикос | 11.1 | 9.2 | 0.9 | 2.4 | 5.9 | 0.7 | 63.5 |
| Банан | 22.8 | 12.2 | 4.9 | 5.0 | 2.4 | 1.0 | 20.0 |
| Инжир , сушеный | 63.9 | 47.9 | 22.9 | 24.8 | 0.9 | 0.93 | 0.15 |
| Виноград | 18.1 | 15.5 | 8.1 | 7.2 | 0.2 | 1.1 | 1 |
| Пупок оранжевый | 12.5 | 8.5 | 2.25 | 2.0 | 4.3 | 1.1 | 50.4 |
| Персик | 9.5 | 8.4 | 1.5 | 2.0 | 4.8 | 0.9 | 56.7 |
| Груша | 15.5 | 9.8 | 6.2 | 2.8 | 0.8 | 2.1 | 8.0 |
| Ананас | 13.1 | 9.9 | 2.1 | 1.7 | 6.0 | 1.1 | 60.8 |
| слива | 11.4 | 9.9 | 3.1 | 5.1 | 1.6 | 0.66 | 16.2 |
| Овощи | |||||||
| Свекла , красная | 9.6 | 6.8 | 0.1 | 0.1 | 6.5 | 1.0 | 96.2 |
| Морковь | 9.6 | 4.7 | 0.6 | 0.6 | 3.6 | 1.0 | 77 |
| Красный перец , сладкий | 6.0 | 4.2 | 2.3 | 1.9 | 0.0 | 1.2 | 0.0 |
| Лук , сладкий | 7.6 | 5.0 | 2.0 | 2.3 | 0.7 | 0.9 | 14.3 |
| Сладкий картофель | 20.1 | 4.2 | 0.7 | 1.0 | 2.5 | 0.9 | 60.3 |
| Вещи | 27.9 | 0.5 | Следы | Следы | Следы | — | Следы |
| Сахарный тростник | 13–18 | 0.2–1.0 | 0.2–1.0 | 11–16 | 1.0 | высокий | |
| Сахарная свекла | 17–18 | 0.1–0.5 | 0.1–0.5 | 16–17 | 1.0 | высокий | |
| Зерна | |||||||
| Кукуруза , сладкая | 19.0 | 6.2 | 1.9 | 3.4 | 0.9 | 0.61 | 15.0 |
- ^ Количество углеводов рассчитывается в базе данных Министерства сельского хозяйства США и не всегда соответствует сумме сахаров, крахмала и «пищевых волокон».
Коммерческое производство
[ редактировать ]Глюкозу производят в промышленности из крахмала путем ферментативного гидролиза с помощью глюкозамилазы или с использованием кислот . Ферментативный гидролиз в значительной степени вытеснил реакции гидролиза, катализируемые кислотами. [134] В результате получается глюкозный сироп (ферментативно с содержанием глюкозы более 90% в сухом веществе). [134] с годовым мировым объемом производства 20 миллионов тонн (по состоянию на 2011 год). [135] Это причина бывшего распространенного названия «крахмальный сахар». Амилазы чаще всего происходят из Bacillus licheniformis. [136] или Bacillus subtilis (штамм MN-385), [136] которые более термостабильны, чем первоначально используемые ферменты. [136] [137] Начиная с 1982 года пуллуланазы Aspergillus niger использовались в производстве глюкозного сиропа для превращения амилопектина в крахмал (амилозу), тем самым увеличивая выход глюкозы. [138] Реакцию проводят при pH = 4,6–5,2 и температуре 55–60 °С. [11] Кукурузный сироп содержит от 20% до 95% глюкозы в сухом веществе. [139] [140] Японская форма глюкозного сиропа « Мизуаме » изготавливается из сладкого картофеля или рисового крахмала. [141] Мальтодекстрин содержит около 20% глюкозы.
Многие сельскохозяйственные культуры могут использоваться в качестве источника крахмала. кукуруза , [134] рис, [134] пшеница , [134] маниока , [134] картофель , [134] ячмень , [134] сладкий картофель, [142] кукурузная шелуха и саго используются в разных частях мира. В Штатах Соединенных кукурузный крахмал почти исключительно используется (из кукурузы). Некоторая коммерческая глюкоза встречается в составе инвертного сахара — смеси глюкозы и фруктозы в соотношении примерно 1:1, получаемой из сахарозы. В принципе, целлюлозу можно гидролизовать до глюкозы, но этот процесс пока коммерчески непрактичен. [54]
Превращение во фруктозу
[ редактировать ], представляющей собой смесь глюкозы и фруктозы, используется почти исключительно кукуруза (точнее, кукурузный сироп) В США в качестве источника глюкозы для производства изоглюкозы , поскольку фруктоза обладает более высокой подслащивающей способностью – при той же физиологической калорийности в 374 килокалории. за 100 г. Ежегодное мировое производство изоглюкозы составляет 8 миллионов тонн (по состоянию на 2011 год). [135] При изготовлении кукурузного сиропа конечным продуктом является кукурузный сироп с высоким содержанием фруктозы (HFCS).
Коммерческое использование
[ редактировать ]
Глюкоза в основном используется для производства фруктозы и глюкозосодержащих продуктов. В пищевых продуктах он используется в качестве подсластителя и увлажнителя для увеличения объема и создания более мягкого вкуса . [134] Различные источники глюкозы, такие как виноградный сок (для вина) или солод (для пива), используются для ферментации до этанола при производстве алкогольных напитков . В большинстве безалкогольных напитков в США используется HFCS-55 (с содержанием фруктозы 55% в сухой массе), тогда как в большинстве других подслащенных HFCS продуктов питания в США используется HFCS-42 (с содержанием фруктозы 42% в сухой массе). ). [144] В Мексике, напротив, безалкогольные напитки подслащивают тростниковым сахаром, который обладает более высокой подслащивающей способностью. [145] Кроме того, сироп глюкозы используется, в частности, при производстве кондитерских изделий, таких как конфеты , ириски и помадки . [146] Типичными химическими реакциями глюкозы при нагревании в безводных условиях являются карамелизация и, в присутствии аминокислот, реакция Майяра .
Кроме того, из глюкозы можно биотехнологически получать различные органические кислоты, например, путем ферментации с Clostridium thermoaceticum для получения уксусной кислоты , с Penicillium notatum для производства арабоаскорбиновой кислоты , с Rhizopus delemar для производства фумаровой кислоты , с Aspergillus niger для производства фумаровой кислоты. производство глюконовой кислоты , с Candida brumptii для производства изолимонной кислоты , с Aspergillus terreus для производства итаконовой кислоты , с Pseudomonas fluorescens для производства 2-кетоглюконовой кислоты , с Gluconobacter suboxydans для производства 5-кетоглюконовой кислоты , с Aspergillus oryzae для производства койевой кислоты , с Lactobacillus delbrueckii для производства молочной кислоты , с Lactobacillus brevis для производства яблочной кислоты , с Propionibacter shermanii для производства пропионовой кислоты , с Pseudomonas aeruginosa для производства пировиноградной кислоты и с Gluconobacter suboxydans для производства винной кислоты . [147] [ необходимы дополнительные ссылки ] Недавно сообщалось о мощных биоактивных натуральных продуктах, таких как триптолид, которые ингибируют транскрипцию млекопитающих посредством ингибирования субъединицы XPB общего фактора транскрипции TFIIH в качестве конъюгата глюкозы для воздействия на гипоксические раковые клетки с повышенной экспрессией переносчика глюкозы. [148] В последнее время глюкоза получила коммерческое применение в качестве ключевого компонента «наборов», содержащих молочную кислоту и инсулин, предназначенных для индукции гипогликемии и гиперлактатемии для борьбы с различными видами рака и инфекциями. [149]
Анализ
[ редактировать ]Когда молекулу глюкозы необходимо обнаружить в определенном положении в более крупной молекуле, спектроскопию ядерного магнитного резонанса , рентгеноструктурный анализ или лектина иммуноокрашивание проводят с использованием конъюгата репортерного фермента конканавалина А , который связывает только глюкозу или маннозу.
Классические качественные реакции обнаружения
[ редактировать ]Эти реакции имеют лишь историческое значение:
тест Фелинга
[ редактировать ]Проба Фелинга – классический метод выявления альдоз. [150] Из-за мутаротации глюкоза всегда присутствует в небольшой степени в виде альдегида с открытой цепью. При добавлении реагентов Фелинга (раствора Фелинга (I) и раствора Фелинга (II)) альдегидная группа окисляется до карбоновой кислоты , а Cu 2+ тартратный комплекс восстанавливается до Cu + и образует осадок кирпично-красного цвета (Cu 2 O).
Прохождение теста
[ редактировать ]В тесте Толленса после добавления аммиачного AgNO 3 к раствору образца глюкоза снижает Ag + к элементарному серебру . [151]
Тест босиком
[ редактировать ]В Барфоеда тесте [152] раствор растворенного ацетата меди , ацетата натрия К раствору испытуемого сахара добавляют и уксусной кислоты и затем нагревают на водяной бане в течение нескольких минут. Глюкоза и другие моносахариды быстро окрашиваются в красноватый цвет и образуют красновато-коричневый оксид меди(I) (Cu 2 O).
тест Нюландера
[ редактировать ]Глюкоза, являясь редуцирующим сахаром, реагирует в тесте Нюландера . [153]
Другие тесты
[ редактировать ]При нагревании разбавленного раствора гидроксида калия с глюкозой до 100°С появляется сильное красновато-коричневое окрашивание и карамельный запах. [154] Концентрированная серная кислота растворяет сухую глюкозу без почернения при комнатной температуре с образованием сахарной серной кислоты. [154] [ нужна проверка ] В дрожжевом растворе при спиртовом брожении образуется углекислый газ в соотношении 2,0454 молекулы глюкозы на одну молекулу СО 2 . [154] Глюкоза образует черную массу с хлоридом олова . [154] В аммиачном растворе серебра глюкоза (а также лактоза и декстрин) приводит к отложению серебра. В аммиачном ацетата свинца растворе гликозиды свинца , которые при варке становятся менее растворимыми и становятся коричневыми. в присутствии глюкозы образуются [154] В аммиачном растворе меди оксида меди желтого цвета, а при кипячении - красный оксид меди (то же самое с декстрином, за исключением аммиачного раствора ацетата меди). с глюкозой при комнатной температуре образуется гидрат [154] При использовании реактива Хагера глюкоза образует оксид ртути . при кипячении [154] Щелочной раствор висмута используется для осаждения элементарного черно-коричневого висмута глюкозой. [154] Глюкоза, кипяченная в растворе молибдата аммония, окрашивает раствор в синий цвет. Раствор с индигокармином и карбонатом натрия окрашивается при кипячении с глюкозой. [154]
Инструментальная количественная оценка
[ редактировать ]Рефрактометрия и поляриметрия
[ редактировать ]В концентрированных растворах глюкозы с низкой долей других углеводов ее концентрацию можно определить поляриметром. Для сахарных смесей концентрацию можно определить с помощью рефрактометра , например, при определении Охсле в процессе производства вина.
Фотометрические ферментативные методы в растворе
[ редактировать ]Фермент глюкозооксидаза (GOx) превращает глюкозу в глюконовую кислоту и перекись водорода, потребляя при этом кислород. Другой фермент, пероксидаза, катализирует хромогенную реакцию (реакцию Триндера). [155] фенола до с 4-аминоантипирином пурпурного красителя. [156]
Фотометрический метод тест-полосок
[ редактировать ]Метод тест-полосок использует вышеупомянутое ферментативное превращение глюкозы в глюконовую кислоту с образованием перекиси водорода. Реагенты иммобилизуются на полимерной матрице, так называемой тест-полоске, которая принимает более или менее интенсивный цвет. Это можно измерить рефлектометрически при длине волны 510 нм с помощью портативного фотометра на основе светодиодов. Это позволяет обычным специалистам определять уровень сахара в крови. Помимо реакции фенола с 4-аминоантипирином разработаны новые хромогенные реакции, позволяющие проводить фотометрию при более высоких длинах волн (550 нм, 750 нм). [156] [157]
Амперометрический датчик глюкозы
[ редактировать ]Электроанализ глюкозы также основан на упомянутой выше ферментативной реакции. Полученную перекись водорода можно количественно определить амперометрически путем анодного окисления при потенциале 600 мВ. [158] GOx иммобилизуют на поверхности электрода или в мембране, расположенной вблизи электрода. В электродах используются драгоценные металлы, такие как платина или золото, а также электроды из углеродных нанотрубок, которые, например, легированы бором. [159] Нанопроволоки Cu–CuO также используются в качестве безэнзимных амперометрических электродов, предел обнаружения которых достигает 50 мкмоль/л. [160] Особенно многообещающим методом является так называемая «ферментатная проводка», при которой электрон, текущий во время окисления, переносится по молекулярной проволоке непосредственно от фермента к электроду. [161]
Другие сенсорные методы
[ редактировать ]Существует множество других химических сенсоров для измерения глюкозы. [162] [163] Учитывая важность анализа глюкозы в науках о жизни, были также разработаны многочисленные оптические зонды для сахаридов на основе использования бороновых кислот. [164] которые особенно полезны для внутриклеточных сенсорных приложений, где другие (оптические) методы недоступны или применимы лишь условно. Помимо органических производных бороновой кислоты, которые часто высокоспецифично связываются с 1,2-диольными группами сахаров, существуют также другие концепции зондов, классифицированные по функциональным механизмам, которые используют селективные глюкозосвязывающие белки (например, конканавалин А) в качестве рецептора. . Кроме того, были разработаны методы, которые косвенно определяют концентрацию глюкозы через концентрацию продуктов метаболизма, например, путем потребления кислорода с использованием флуоресцентно-оптических датчиков. [165] Наконец, существуют концепции, основанные на ферментах, которые используют собственное поглощение или флуоресценцию (флуоресцентно-меченных) ферментов в качестве репортеров. [162]
Медная йодометрия
[ редактировать ]Глюкозу можно определить количественно с помощью йодометрии меди. [166]
Хроматографические методы
[ редактировать ]В частности, для анализа сложных смесей, содержащих глюкозу, например, в меде, используются хроматографические методы, такие как высокоэффективная жидкостная хроматография и газовая хроматография. [166] часто используются в сочетании с масс-спектрометрией . [167] [168] Принимая во внимание соотношение изотопов, этими методами также можно надежно обнаружить фальсификацию меда добавлением сахара. [169] Обычно используется дериватизация с использованием реагентов силилирования. [170] Также можно количественно определить пропорции ди- и трисахаридов.
Анализ in vivo
[ редактировать ]Поглощение глюкозы клетками организмов измеряют с помощью 2-дезокси-D-глюкозы или фтордезоксиглюкозы . [114] ( 18 Е)фтордезоксиглюкоза используется в качестве индикатора при позитронно-эмиссионной томографии в онкологии и неврологии, [171] где это, безусловно, наиболее часто используемый диагностический агент. [172]
Ссылки
[ редактировать ]- ^ Номенклатура углеводов (рекомендации 1996 г.) | 2-Carb-2. Архивировано 27 августа 2023 года в Wayback Machine . iupac.qmul.ac.uk .
- ^ Перейти обратно: а б Боэрио-Гоутс Дж. (1991), «Измерения теплоемкости и термодинамические функции кристаллической α-D-глюкозы при температурах от 10 К до 340 К», J. Chem. Термодин. , 23 (5): 403–09, Бибкод : 1991JChTh..23..403B , doi : 10.1016/S0021-9614(05)80128-4
- ^ Пономарев В.В., Мигарская Л.Б. (1960), "Теплоты сгорания некоторых аминокислот", Рус. Дж. Физ. хим. (англ. пер.) , 34 : 1182–83.
- ^ Домб А.Дж., Кост Дж., Уайзман Д. (4 февраля 1998 г.). Справочник по биоразлагаемым полимерам . ЦРК Пресс. п. 275. ИСБН 978-1-4200-4936-7 .
- ^ Перейти обратно: а б «NCATS Inxight Drugs — ДЕКСТРОЗА, НЕУКАЗАННАЯ ФОРМА» . Архивировано из оригинала 11 декабря 2023 года . Проверено 18 марта 2024 г.
- ^ Камид К. (2005). Целлюлозные продукты и производные целлюлозы: молекулярная характеристика и ее применение (1-е изд.). Амстердам: Эльзевир. п. 1. ISBN 978-0-08-045444-3 . Проверено 13 мая 2021 г.
- ^ Перейти обратно: а б с д «L-глюкоза» . Статьи, учебные пособия и онлайн-словари по биологии . 7 октября 2019 года. Архивировано из оригинала 25 мая 2022 года . Проверено 6 мая 2022 г.
- ^ Перейти обратно: а б Всемирная организация здравоохранения (2019). Модельный список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г. Женева: Всемирная организация здравоохранения. hdl : 10665/325771 . ВОЗ/MVP/EMP/IAU/2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ «Онлайн-этимологический словарь» . Этимонлайн.com . Архивировано из оригинала 26 ноября 2016 года . Проверено 25 ноября 2016 г. .
- ^ Тенар, Гей-Люссак, Био и Дюма (1838) «Отчет о мемуарах М. Пелижио, озаглавленных: Исследования природы и химических свойств сахаров» . Архивировано 6 декабря 2015 года в Wayback Machine (Отчет о мемуарах г-на Пелижио под названием: Исследования природы и химических свойств сахаров), Comptes rén , 7 : 106–113. Со страницы 109 . Архивировано 6 декабря 2015 года в Wayback Machine : «В результате сравнений, проведенных г-ном Пелиго, виноградный сахар, крахмальный сахар, диабетический сахар и медовый сахар имеют совершенно одинаковый состав и одинаковые свойства и составляют единое тело, которое мы предлагаем. называть Глюкозу (1...(1) γλευχος, сусло, сладкое вино». Из сравнений, сделанных г-ном Пелиго, следует, что сахар из винограда, сахар из крахмала, сахар из диабета и сахар из меда имеют совершенно одинаковый состав и одинаковые свойства и составляют одно и то же вещество, которое мы предлагаем назвать глюкозой ( 1) ... (1) γλευχος, сусло, сладкое вино.
- ^ Перейти обратно: а б Энциклопедия продуктов питания и здоровья . Академическая пресса. 2015. с. 239. ИСБН 978-0-12-384953-3 . Архивировано из оригинала 23 февраля 2018 года.
- ^ Маргграф (1747 г.) «Химические эксперименты, проведенные с целью извлечения настоящего сахара из различных растений, растущих в наших странах». Архивировано 24 июня 2016 г. в Wayback Machine [Химические эксперименты, проведенные с целью извлечения настоящего сахара из различных растений, растущих в наших странах. наши земли], История Королевской академии наук и изящной словесности Берлина , стр. 79–90. Со страницы 90: Архивировано 27 октября 2014 г. в Wayback Machine. «Сушеный виноград, смоченный небольшим количеством воды, чтобы он стал мягким, затем можно раздавить, а выжатый сок, очищенный и сгущенный, обеспечит разновидность сахара». (Виноград, смоченный небольшим количеством воды, чтобы он стал мягче, можно затем отжать, и выжатый сок, [после] очистки и сгущения, даст своего рода сахар.)
- ^ Джон Ф. Робит: Основы химии углеводов. Springer Science & Business Media, 2012, ISBN 978-1-461-21622-3 . п. 7.
- ^ Розанов М.А. (1906). «О классификации стереоизомеров Фишера.1» . Журнал Американского химического общества . 28 : 114–121. дои : 10.1021/ja01967a014 . Архивировано из оригинала 17 декабря 2019 года . Проверено 1 июля 2019 г.
- ^ Эмиль Фишер , Нобелевский фонд, архивировано из оригинала 3 сентября 2009 г. , получено 2 сентября 2009 г.
- ^ Fraser-Reid B, «Глюкоза Вант-Хоффа», Chem. англ. Новости , 77 (39): 8
- ^ «Отто Мейерхоф - Факты - NobelPrize.org». Архивировано 15 июля 2018 года в Wayback Machine . NobelPrize.org . Проверено 5 сентября 2018 г.
- ^ «Ганс фон Эйлер-Хельпин — Факты — NobelPrize.org». Архивировано 3 сентября 2018 года в Wayback Machine . NobelPrize.org . Проверено 5 сентября 2018 г.
- ^ «Артур Харден - Факты - NobelPrize.org». Архивировано 3 сентября 2018 г. в Wayback Machine . NobelPrize.org . Проверено 5 сентября 2018 г.
- ^ «Бернардо Уссей — Факты — NobelPrize.org». Архивировано 15 июля 2018 года в Wayback Machine . NobelPrize.org . Проверено 5 сентября 2018 г.
- ^ «Карл Кори — Факты — NobelPrize.org». Архивировано 15 июля 2018 года в Wayback Machine . NobelPrize.org . Проверено 5 сентября 2018 г.
- ^ «Герти Кори - Факты - NobelPrize.org». Архивировано 15 июля 2018 г. в Wayback Machine . NobelPrize.org . Проверено 5 сентября 2018 г.
- ^ «Луис Лелуар — Факты — NobelPrize.org». Архивировано 15 июля 2018 года в Wayback Machine . NobelPrize.org . Проверено 5 сентября 2018 г.
- ^ Венюэ Кан и Чжицзюнь Чжан (2020): «Селективное производство уксусной кислоты посредством каталитического быстрого пиролиза гексоз над калийными солями», Катализаторы , том 10, страницы 502–515. дои : 10.3390/catal10050502
- ^ Бош Л., Файлс Т., Джеймс Т. (ноябрь 2004 г.). «Бинарные и тройные комплексы фенилборной кислоты с сахаридами и основаниями Льюиса». Тетраэдр . 60 (49): 11175–11190. дои : 10.1016/j.tet.2004.08.046 .
- ^ Йебра-Бюррун М (2005), «Подсластители», Энциклопедия аналитической науки , Elsevier, стр. 562–572, doi : 10.1016/b0-12-369397-7/00610-5 , ISBN 978-0-12-369397-6
- ^ «Глюкоза». Энциклопедия Колумбии, 6-е изд., 2015. Encyclepedia.com. 17 ноября 2015 г. http://www.encyclepedia.com. Архивировано 26 апреля 2009 г. в Wayback Machine .
- ^ Ага М.Б., Шарма В., Дар А.Х., Даш К.К., Сингх А., Шамс Р. и др. (2023). «Комплексный обзор функциональных и нутрицевтических свойств меда» . Еда . 4 (2). дои : 10.1002/efd2.71 .
- ^ Бобиш О, Дезмирян Д.С., Моис А.Р. (2018). «Мед и диабет: важность натуральных простых сахаров в рационе для профилактики и лечения различных типов диабета» . Окислительная медицина и клеточное долголетие . 2018 : 1–12. дои : 10.1155/2018/4757893 . ПМК 5817209 . ПМИД 29507651 .
- ^ Вани Х.А., Маджид С., Хан М.С., Бхат А.А., Вани Р.А., Бхат С.А. и др. (2020). «Применение меда при диабете и нарушениях обмена веществ». Терапевтическое применение меда и его фитохимических веществ . стр. 195–217. дои : 10.1007/978-981-15-7305-7_9 . ISBN 978-981-15-7304-0 .
- ^ Альварес-Суарес Х.М., Тулипани С., Романдини С., Бертоли Э., Баттино М. (2010). «Вклад меда в питание и здоровье человека: обзор». Средиземноморский журнал питания и обмена веществ . 3 : 15–23. дои : 10.1007/s12349-009-0051-6 .
- ^ Ищаек Дж.И., Керн М. (август 2006 г.). «Американский мед с разным содержанием глюкозы и фруктозы имеет одинаковые гликемические индексы». Журнал Американской диетической ассоциации . 106 (8): 1260–1262. дои : 10.1016/j.jada.2006.05.003 . ПМИД 16863724 .
- ^ «Потенциально важный вклад декстрозы, используемой в качестве разбавителя, в гипергликемию у госпитализированных пациентов | Лечение диабета | Американская диабетическая ассоциация» . Архивировано из оригинала 29 мая 2022 года . Проверено 18 марта 2024 г.
- ^ «Декстроза: почему она содержится в продуктах питания и лекарствах?» . 24 июня 2018 г. Архивировано из оригинала 13 февраля 2024 г. Проверено 18 марта 2024 г.
- ^ Перейти обратно: а б с «Что такое декстроза, как она используется и полезна ли она для здоровья? - The Nutrition Insider» . 27 октября 2023 г. Архивировано из оригинала 14 февраля 2024 г. Проверено 18 марта 2024 г.
- ^ «Декстроза против глюкозы: равны ли эти сахара?» . Архивировано из оригинала 29 сентября 2023 года . Проверено 18 марта 2024 г.
- ^ Барон Д.Н., Макинтайр Н. (1976). «Письмо: Глюкоза — это декстроза — это глюкоза» . Британский медицинский журнал . 2 (6026): 41–42. дои : 10.1136/bmj.2.6026.41-c . ПМЦ 1687736 . ПМИД 938892 .
- ^ Перейти обратно: а б с д «Пракаш Кемикалс Интернэшнл» . Архивировано из оригинала 6 июня 2023 года . Проверено 18 марта 2024 г.
- ^ «АФИ | моногидрат глюкозы» . Архивировано из оригинала 24 марта 2023 года . Проверено 18 марта 2024 г.
- ^ Перейти обратно: а б с д «Разница между безводной декстрозой и моногидратом декстрозы» . 28 декабря 2022 года. Архивировано из оригинала 18 марта 2024 года . Проверено 18 марта 2024 г.
- ^ «Декстроза безводная» . Архивировано из оригинала 18 марта 2024 года . Проверено 18 марта 2024 г.
- ^ Хворова Л.С., Андреев Н.Р., Лукин Н.Д. (январь 2020). «Изучение условий применения поверхностно-активных веществ в производстве кристаллической глюкозы». Российские сельскохозяйственные науки . 46 (1): 90–93. Бибкод : 2020РуАгС..46...90К . дои : 10.3103/S1068367420010048 .
- ^ Перейти обратно: а б «Чем отличается безводная глюкоза от глюкозы» . Архивировано из оригинала 18 марта 2024 года . Проверено 18 марта 2024 г.
- ^ «Безводный и моногидрат – в чем разница?» . Архивировано из оригинала 18 марта 2024 года . Проверено 18 марта 2024 г.
- ^ Траси Н.С., Boerrigter SX, Бирн С.Р., Карвахал ТМ (15 марта 2011 г.). «Исследование влияния условий дегидратации на компактность глюкозы». Международный фармацевтический журнал . 406 (1–2): 55–61. doi : 10.1016/j.ijpharm.2010.12.042 . ПМИД 21232587 .
- ^ Митра Б., Вулф С., Ву С.Дж. (4 мая 2018 г.). «Моногидрат декстрозы в качестве альтернативного разбавителя неживотного происхождения в составах таблеток для влажной грануляции с высоким сдвиговым усилием». Разработка лекарств и промышленная фармация . 44 (5): 817–828. дои : 10.1080/03639045.2017.1414231 . ПМИД 29300107 .
- ^ «Тесты на диабет и преддиабет - NIDDK» . Архивировано из оригинала 16 декабря 2023 года . Проверено 18 марта 2024 г.
- ^ «Декстроза моногидрат» . Архивировано из оригинала 2 декабря 2023 года . Проверено 18 марта 2024 г.
- ^ «D-(+)-глюкоза моногидрат» . Архивировано из оригинала 18 марта 2024 года . Проверено 18 марта 2024 г.
- ^ «Д-Глюкоза» . Архивировано из оригинала 15 декабря 2023 года . Проверено 18 марта 2024 г.
- ^ «Д-(+)-Глюкоза» . Архивировано из оригинала 18 марта 2024 года . Проверено 18 марта 2024 г.
- ^ «Д-(+)-Глюкоза» . Архивировано из оригинала 18 марта 2024 года . Проверено 18 марта 2024 г.
- ^ «Глюкоза (Декстроза)» . 2 октября 2013 г. Архивировано из оригинала 21 декабря 2023 г. Проверено 18 марта 2024 г.
- ^ Перейти обратно: а б Шенк ФВ (2006). «Глюкоза и глюкозосодержащие сиропы». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a12_457.pub2 . ISBN 978-3-527-30673-2 .
- ^ Перейти обратно: а б Патрик Ф. Фокс: Advanced Dairy Chemistry, том 3: Лактоза, вода, соли и витамины , Springer, 1992. Том 3, ISBN 9780412630200 . п. 316.
- ^ Бенджамин Кабальеро, Пол Финглас, Фидель Толдра: Энциклопедия продуктов питания и здоровья . Академическое издательство (2016). ISBN 9780123849533 , Том 1, с. 76.
- ^ «16.4: Циклические структуры моносахаридов» . Химия LibreTexts . 18 июля 2014 г. Архивировано из оригинала 17 апреля 2023 г. Проверено 17 апреля 2023 г.
- ^ Такаги С., Джеффри Г.А. (1979). «1,2-О-изопропилиден-D-глюкофураноза». Acta Crystallographica Раздел B. Б35 (6): 1522–1525. Бибкод : 1979AcCrB..35.1522T . дои : 10.1107/S0567740879006968 .
- ^ Белецкий М., Эггерт Х., Кристиан Норрильд Дж. (1999). «Флуоресцентный датчик глюкозы, ковалентно связывающийся со всеми пятью гидроксильными группами α-D-глюкофуранозы. Повторное исследование». Журнал Химического общества, Perkin Transactions . 2 (3): 449–456. дои : 10.1039/A808896I .
- ^ Чандран С.К., Нангия А (2006). «Модулированная кристаллическая структура (Z ′ = 2) α-d-глюкофуранозо-1,2:3,5-бис(п-толил)бороната». CrystEngComm . 8 (8): 581–585. дои : 10.1039/B608029D .
- ^ Макмерри Дж. Э. (1988), Органическая химия (2-е изд.), Brooks/Cole, p. 866, ISBN 0534079687 .
- ^ Хуаристи Э., Куэвас Дж. (1995), Аномерный эффект , CRC Press, стр. 9–10, ISBN 978-0-8493-8941-2
- ^ Перейти обратно: а б Манфред Гессе, Герберт Мейер, Бернд Зе, Стефан Биенц, Лоран Биглер, Томас Фокс: Спектроскопические методы в органической химии . 8-е исправленное издание. Георг Тиме, 2011 г., ISBN 978-3-13-160038-7 , с. 34 (на немецком языке).
- ^ Перейти обратно: а б с д Банн Х.Ф., Хиггинс П.Дж. (1981). «Реакция моносахаридов с белками: возможное эволюционное значение». Наука . 213 (4504): 222–24. Бибкод : 1981Sci...213..222B . дои : 10.1126/science.12192669 . ПМИД 12192669 .
- ^ Джереми М. Берг: Биохимия Страйера. Издательство Спрингер, 2017, ISBN 978-3-662-54620-8 , с. 531. (Немецкий)
- ^ Перейти обратно: а б Гарретт Р.Х. (2013). Биохимия (5-е изд.). Бельмонт, Калифорния: Брукс/Коул, Cengage Learning. ISBN 978-1-133-10629-6 .
- ^ Перейти обратно: а б с д Фут D, Фут JG (2011). Биохимия (4-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons. ISBN 978-0-470-57095-1 .
- ^ Альберт Л. Ленинджер, Биохимия, 6-е издание , Worth Publishers Inc., 1972, ISBN 0-87901-009-6 стр. 228.
- ^ Перейти обратно: а б «Химия для биологов: Фотосинтез» . www.rsc.org . Архивировано из оригинала 4 августа 2016 года . Проверено 5 февраля 2018 г.
- ^ Перейти обратно: а б с Питер К. Генрих: Биохимия и патобиохимия Леффлера / Петридса. Спрингер Верлаг, 2014 г., ISBN 978-3-642-17972-3 , с. 195. (Немецкий)
- ^ Перейти обратно: а б с д и У. Сатьянараяна: Биохимия. Elsevier Health Sciences, 2014 г., ISBN 978-8-131-23713-7 . п. 674.
- ^ Вассерман Д.Х. (2009). «Четыре грамма глюкозы» . Американский журнал физиологии. Эндокринология и обмен веществ . 296 (1): Е11–21. дои : 10.1152/ajpendo.90563.2008 . ПМК 2636990 . ПМИД 18840763 .
- ^ «Высокий уровень глюкозы в крови и осложнения диабета: накопление молекул, известных как AGE, может быть ключевым звеном» , Diabetes Forecast , Американская диабетическая ассоциация, 2010 г., ISSN 0095-8301 , заархивировано из оригинала 14 октября 2013 г. , получено 20 мая 2010 г.
- ^ Варки А., Каммингс Р.Д., Эско Дж.Д., Фриз Х.Х., Стэнли П., Бертоцци С.Р. и др. (2009). Варки А (ред.). Основы гликобиологии (2-е изд.). Издательство Колд-Спринг-Харбор Лабораториз. ISBN 978-0-87969-770-9 . ПМИД 20301239 . Архивировано из оригинала 6 декабря 2016 года.
- ^ «Показ соединения D-глюкозы (FDB012530) - FooDB» . Архивировано из оригинала 6 декабря 2022 года . Проверено 18 марта 2024 г.
- ^ Перейти обратно: а б Питер К. Генрих: Биохимия и патобиохимия Леффлера / Петридса. Спрингер Верлаг, 2014 г., ISBN 978-3-642-17972-3 , с. 404.
- ^ Гарольд А. Харпер: Медицинская биохимия. Спрингер Верлаг, 2013, ISBN 978-3-662-22150-1 , с. 641. (на немецком языке)
- ^ Навале А.М., Паранджапе А.Н. (2016). «Переносчики глюкозы: физиологические и патологические роли» . Биофизические обзоры . 8 (1): 5–9. дои : 10.1007/s12551-015-0186-2 . ПМЦ 5425736 . ПМИД 28510148 .
- ^ Перейти обратно: а б с д и ж Питер К. Генрих: Биохимия и патобиохимия Леффлера / Петридса. Спрингер Верлаг, 2014 г., ISBN 978-3-642-17972-3 , с. 199, 200. (на немецком языке)
- ^ Торенс Б (2015). «GLUT2, чувствительность к глюкозе и гомеостаз глюкозы» (PDF) . Диабетология . 58 (2): 221–32. дои : 10.1007/s00125-014-3451-1 . ПМИД 25421524 . Архивировано (PDF) из оригинала 2 декабря 2023 года . Проверено 18 марта 2024 г.
- ^ Перейти обратно: а б Питер К. Генрих: Биохимия и патобиохимия Леффлера / Петридса. Спрингер Верлаг, 2014 г., ISBN 978-3-642-17972-3 , с. 214. (на немецком языке)
- ^ Хуанг С., член парламента Чехии (2007 г.). «Переносчик глюкозы GLUT4» . Клеточный метаболизм . 5 (4): 237–52. дои : 10.1016/j.cmet.2007.03.006 . ПМИД 17403369 .
- ^ Говерс Р. (2014). Клеточная регуляция поглощения глюкозы транспортером глюкозы GLUT4 . Достижения клинической химии. Том. 66. стр. 173–240. дои : 10.1016/B978-0-12-801401-1.00006-2 . ISBN 978-0-12-801401-1 . ПМИД 25344989 .
- ^ Ву X, Freeze HH (декабрь 2002 г.). «GLUT14, дубликон GLUT3, специфически экспрессируется в семенниках как альтернативные формы сплайсинга». Геномика . 80 (6): 553–7. дои : 10.1006/geno.2002.7010 . ПМИД 12504846 .
- ^ Гецци С., Лу ДДФ, Райт Э.М. (2018). «Физиология обработки глюкозы почками через SGLT1, SGLT2 и GLUT2» . Диабетология . 61 (10): 2087–2097. дои : 10.1007/s00125-018-4656-5 . ПМК 6133168 . ПМИД 30132032 .
- ^ Поулсен С.Б., Фентон Р.А., Риг Т. (2015). «Котранспорт натрия-глюкозы» . Современное мнение по нефрологии и гипертонии . 24 (5): 463–9. дои : 10.1097/MNH.0000000000000152 . ПМК 5364028 . ПМИД 26125647 .
- ^ Смит, Элисон М., Зееман, Сэмюэл К., Смит, Стивен М. (2005). «Деградация крахмала». Анну. Преподобный Плант Биол . 56 : 73–98. doi : 10.1146/annurev.arplant.56.032604.144257 . ПМИД 15862090 .
- ^ Перейти обратно: а б Лешек Шаблевский: Гомеостаз глюкозы и резистентность к инсулину. Издательство Бентам Сайенс, 2011 г., ISBN 978-1-608-05189-2 , с. 46.
- ^ Питер К. Генрих: Биохимия и патобиохимия Леффлера / Петрида. Спрингер Верлаг, 2014 г., ISBN 978-3-642-17972-3 , с. 389. (на немецком языке)
- ^ Ван Дж., Кавамура К., Хатакеяма С., Таками А., Ли Х., Ван В. (май 2007 г.). «Авиационное измерение органических аэрозолей над Китаем». Экологические науки и технологии . 41 (9): 3115–3120. Бибкод : 2007EnST...41.3115W . дои : 10.1021/es062601h . ПМИД 17539513 .
- ^ Адева-Андани М.М., Перес-Фельпете Н., Фернандес-Фернандес С., Донапетри-Гарсия С., Пасос-Гарсия С. (2016). «Метаболизм глюкозы в печени человека» . Отчеты по биологическим наукам . 36 (6): e00416. дои : 10.1042/BSR20160385 . ПМЦ 5293555 . ПМИД 27707936 .
- ^ Х. Роберт Хортон, Лоуренс А. Моран, К. Грей Скримджер, Марк Д. Перри, Дж. Дэвид Роун: Биохимия . Исследования Пирсона; 4-е обновленное издание, 2008 г.; ISBN 978-3-8273-7312-0 ; п. 490–496. (Немецкий)
- ^ Перейти обратно: а б Брайан К. Холл: Эволюция Стрикбергера. Издательство «Джонс и Бартлетт», 2013 г., ISBN 978-1-449-61484-3 , с. 164.
- ^ Джонс Дж.Г. (2016). «Печеночная глюкоза и липидный обмен» . Диабетология . 59 (6): 1098–103. дои : 10.1007/s00125-016-3940-5 . ПМИД 27048250 .
- ^ Энтнер Н., Дудоров М. (1952). «Окисление глюкозы и глюконовой кислоты Pseudomonas saccharophila» . J Биол Хим . 196 (2): 853–862. дои : 10.1016/S0021-9258(19)52415-2 . ПМИД 12981024 .
- ^ Аммар Э.М., Ван Х, Рао К.В. (январь 2018 г.). «Регуляция обмена веществ у Escherichia coli при росте на смесях неглюкозных сахаров: арабинозы, лактозы и ксилозы» . Научные отчеты . 8 (1): 609. Бибкод : 2018НатСР...8..609А . дои : 10.1038/s41598-017-18704-0 . ПМК 5766520 . ПМИД 29330542 .
- ^ Перейти обратно: а б Бонадонна Р.К., Бонора Э., Дель Прато С., Саккомани М., Кобелли С., Натали А. и др. (июль 1996 г.). «Роль транспорта глюкозы и фосфорилирования глюкозы в мышечной резистентности к инсулину при ИНСД» (PDF) . Диабет . 45 (7): 915–25. дои : 10.2337/диаб.45.7.915 . ПМИД 8666143 . S2CID 219249555 . Архивировано (PDF) из оригинала 6 марта 2017 года . Проверено 5 марта 2017 г.
- ^ «Глюкоза» . Архивировано из оригинала 5 декабря 2023 года . Проверено 18 марта 2024 г.
- ^ Краткий обзор медицинской биохимии @Google book , Blackwell Publishing, 2006, стр. 52, ISBN 978-1-4051-1322-9 , заархивировано из оригинала 23 февраля 2018 г.
- ^ Краткий обзор медицинской биохимии @Google book , Blackwell Publishing, 2006, стр. 50, ISBN 978-1-4051-1322-9 , заархивировано из оригинала 23 февраля 2018 г.
- ^ Аннибальди А, Видманн С (2010). «Метаболизм глюкозы в раковых клетках». Текущее мнение о клиническом питании и метаболической помощи . 13 (4): 466–70. дои : 10.1097/MCO.0b013e32833a5577 . ПМИД 20473153 . S2CID 205782021 .
- ^ Шаблевский Л (2013). «Экспрессия переносчиков глюкозы при раке». Biochimica et Biophysical Acta (BBA) - Обзоры о раке . 1835 (2): 164–9. дои : 10.1016/j.bbcan.2012.12.004 . ПМИД 23266512 .
- ^ Адекола К., Розен С.Т., Шанмугам М. (2012). «Переносчики глюкозы в метаболизме рака» . Современное мнение в онкологии . 24 (6): 650–4. дои : 10.1097/CCO.0b013e328356da72 . ПМК 6392426 . ПМИД 22913968 .
- ^ Шуман У, Грюндлер П (сентябрь 1998 г.). «Электрохимическая деградация органических веществ на анодах PbO2: мониторинг путем непрерывного измерения CO2». Исследования воды . 32 (9): 2835–2842. дои : 10.1016/s0043-1354(98)00046-3 .
- ^ «Глава 3: Расчет энергетического содержания пищевых продуктов – коэффициенты преобразования энергии» , Энергия пищевых продуктов – методы анализа и коэффициенты преобразования , Документ ФАО по продуктам питания и питанию 77, Рим: Продовольственная и сельскохозяйственная организация, 2003, ISBN 978-92-5-105014-9 , заархивировано из оригинала 24 мая 2010 г.
- ^ Георг Шведт: Сахарно-сладкая химия. Джон Уайли и сыновья, 2012 г., ISBN 978-3-527-66001-8 , с. 100 (на немецком языке) .
- ^ Шмидт, Ланг: Физиология человека , 30-е издание. Springer Verlag, 2007, с. 907 (на немецком языке) .
- ^ Дандекар Т., Шустер С., Снел Б., Хуйнен М., Борк П. (1999). «Выравнивание путей: применение к сравнительному анализу гликолитических ферментов» . Биохимический журнал . 343 (1): 115–124. дои : 10.1042/bj3430115 . ПМЦ 1220531 . ПМИД 10493919 .
- ^ Дэш П. «Гематоэнцефалический барьер и церебральный метаболизм (раздел 4, глава 11)» . Neuroscience Online: Электронный учебник по нейронаукам . Кафедра нейробиологии и анатомии – Медицинская школа Техасского университета в Хьюстоне. Архивировано из оригинала 17 ноября 2016 года.
- ^ Fairclough SH, Houston K (2004), «Метаболический показатель умственных усилий», Biol. Психол. , 66 (2): 177–190, doi : 10.1016/j.biopsycho.2003.10.001 , PMID 15041139 , S2CID 44500072
- ^ Gailliot MT, Baumeister RF, DeWall CN, Plant EA, Brewer LE, Schmeichel BJ и др. (2007), «Самоконтроль зависит от глюкозы как ограниченного источника энергии: сила воли — это больше, чем метафора» (PDF) , J. Pers. Соц. Психол. , 92 (2): 325–336, CiteSeerX 10.1.1.337.3766 , doi : 10.1037/0022-3514.92.2.325 , PMID 17279852 , S2CID 7496171 , заархивировано (PDF) из оригинала 18 августа 2017 г.
- ^ Gailliot MT, Baumeister RF (2007), «Физиология силы воли: связь уровня глюкозы в крови с самоконтролем», Personal. Соц. Психол. Rev. , 11 (4): 303–327, CiteSeerX 10.1.1.475.9484 , doi : 10.1177/1088868307303030 , PMID 18453466 , S2CID 14380313
- ^ Масикампо Э.Дж., Баумайстер Р.Ф. (2008), «К физиологии двухпроцессного рассуждения и суждения: лимонад, сила воли и дорогой анализ, основанный на правилах», Psychol. наук. , 19 (3): 255–60, doi : 10.1111/j.1467-9280.2008.02077.x , PMID 18315798 , S2CID 38596025
- ^ Перейти обратно: а б с Донард Дуайер: Метаболизм глюкозы в мозге. Академическое издательство, 2002, ISBN 978-0-123-66852-3 , с. XIII.
- ^ Перейти обратно: а б с Куккук Л.Л., Мул Дж.Д., Ла Флер С.В. (2017). «Ощущение глюкозы в системе вознаграждения» . Границы в неврологии . 11 : 716. дои : 10.3389/fnins.2017.00716 . ПМЦ 5742113 . ПМИД 29311793 .
- ^ Перейти обратно: а б Такер Р.М., Тан С.Ю. (2017). «Влияют ли некалорийные подсластители на острый гомеостаз глюкозы у людей? Систематический обзор» . Физиология и поведение . 182 : 17–26. дои : 10.1016/j.physbeh.2017.09.016 . ПМИД 28939430 . S2CID 38764657 . Архивировано из оригинала 29 июля 2020 года . Проверено 7 июня 2020 г.
- ^ Ла Флер С.Э., Флайерс Э., Калсбек А. (2014). «Нейронаука гомеостаза глюкозы». Диабет и нервная система . Справочник по клинической неврологии. Том. 126. стр. 341–351. дои : 10.1016/B978-0-444-53480-4.00026-6 . ISBN 978-0-444-53480-4 . ПМИД 25410233 . .
- ^ Бисшоп П.Х., Флайерс Э., Калсбек А. (2015). «Вегетативная регуляция продукции глюкозы печенью». Комплексная физиология . 5 (1): 147–165. дои : 10.1002/cphy.c140009 . ПМИД 25589267 .
- ^ WA Scherbaum, BM Lobnig, В: Ханс-Петер Вольф, Томас Р. Вейраух: Внутренняя терапия 2006, 2007 . 16-е издание. Эльзевир, 2006, ISBN 3-437-23182-0 , с. 927, 985 (на немецком языке) .
- ^ Гарольд А. Харпер: Медицинская биохимия . Спрингер Верлаг, 2013, ISBN 978-3-662-22150-1 , с. 294.
- ^ Кларк С.Ф., Фостер-младший (2012). «История глюкометров и их роль в самоконтроле сахарного диабета». Британский журнал биомедицинской науки . 69 (2): 83–93. CiteSeerX 10.1.1.468.2196 . дои : 10.1080/09674845.2012.12002443 . ПМИД 22872934 . S2CID 34263228 .
- ^ «Диагностика диабета и изучение предиабета» . Американская диабетическая ассоциация . Архивировано из оригинала 28 июля 2017 года . Проверено 20 февраля 2018 г.
- ^ Перейти обратно: а б Ричард А. Харви, Дениз Р. Ферье: Биохимия . 5-е издание, Липпинкотт Уильямс и Уилкинс, 2011 г., ISBN 978-1-608-31412-6 , с. 366.
- ^ Перейти обратно: а б У Сатьянараяна: Биохимия . Elsevier Health Sciences, 2014 г., ISBN 978-8-131-23713-7 , с. 508.
- ^ Холт С.Х., Миллер Дж.К., Петоч П. (1997). «Инсулиновый индекс пищевых продуктов: потребность в инсулине, создаваемая порциями обычных продуктов питания массой 1000 кДж» . Американский журнал клинического питания . 66 (5): 1264–1276. дои : 10.1093/ajcn/66.5.1264 . ПМИД 9356547 .
- ^ Перейти обратно: а б Питер К. Генрих: Биохимия и патобиохимия Леффлера / Петридса. Спрингер Верлаг, 2014 г., ISBN 978-3-642-17972-3 , с. 27. (на немецком языке)
- ^ Рёдер П.В., Ву Б, Лю Ю, Хан В (2016). «Поджелудочная регуляция гомеостаза глюкозы» . Эксп. Мол. Мед . 48 (3 марта): e219–. дои : 10.1038/emm.2016.6 . ПМЦ 4892884 . ПМИД 26964835 .
- ^ Эстела, Карлос (2011) «Уровни глюкозы в крови», Студентский журнал математического моделирования: один + два: Том. 3: Вып. 2, статья 12.
- ^ «Углеводы и уровень сахара в крови» . Источник питания . 5 августа 2013 года. Архивировано из оригинала 30 января 2017 года . Получено 30 января 2017 г. - через Гарвардскую школу общественного здравоохранения им. Т.Ч. Чана.
- ^ Вендитти А., Фрецца С., Винченти Ф., Броделла А., Скиубба Ф., Монтесано С. и др. (февраль 2019 г.). «Производное син-энт-лабдадиена с редкой функцией спиро-β-лактона из мужских шишек Wollemia nobilis». Фитохимия . 158 : 91–95. Бибкод : 2019PChem.158...91В . doi : 10.1016/j.phytochem.2018.11.012 . ПМИД 30481664 .
- ^ Лей Ю, Ши СП, Сон ЮЛ, Би Д, Ту ПФ (май 2014 г.). «Тритерпеновые сапонины из корней Ilex asprella». Химия и биоразнообразие . 11 (5): 767–775. дои : 10.1002/cbdv.201300155 . ПМИД 24827686 .
- ^ Балан В., Балс Б., Чундават С.П., Маршалл Д., Дейл Б.Е. (2009). «Предварительная обработка лигноцеллюлозной биомассы с использованием AFEX». Биотопливо . Методы молекулярной биологии. Том. 581. стр. 61–77. дои : 10.1007/978-1-60761-214-8_5 . ISBN 978-1-60761-213-1 . ПМИД 19768616 .
- ^ «ФудДата Централ» . fdc.nal.usda.gov . Архивировано из оригинала 3 декабря 2019 года . Проверено 18 марта 2024 г.
- ^ Перейти обратно: а б с д и ж г час я PJ Fellows: Технология пищевой промышленности. Издательство Вудхед , 2016, ISBN 978-0-081-00523-1 , с. 197.
- ^ Перейти обратно: а б Томас Беккер, Дитмар Брайтаупт, Хорст Вернер Дёлле, Армин Фихтер, Гюнтер Шлегель, Сакаю Симидзу, Хидеаки Ямада: Биотехнология , в: Энциклопедия промышленной химии Ульмана , 7-е издание, Wiley-VCH, 2011. ISBN 978-3-527-32943-4 . Том 6, с. 48.
- ^ Перейти обратно: а б с Японское общество исследования амилазы: Справочник по амилазам и родственным ферментам. Эльзевир, 2014, ISBN 978-1-483-29939-6 , с. 195.
- ^ Мэдсен ГБ, Норман Б.Е., Слотт С. (1973). «Новая термостабильная бактериальная амилаза и ее использование при высокотемпературном сжижении». Крахмал – Старке . 25 (9): 304–308. дои : 10.1002/star.19730250906 .
- ^ Норман Б.Е. (1982). «Новый разветвляющий фермент для применения в производстве глюкозных сиропов». Крахмал – Старке . 34 (10): 340–346. дои : 10.1002/star.19820341005 .
- ^ Джеймс Н. БеМиллер, Рой Л. Уистлер (2009). Крахмал: химия и технология . Пищевая наука и технология (3-е изд.). Нью-Йорк: Академическая пресса. ISBN 978-0-08-092655-1 .
- ^ БеМиллер, Джеймс Н., Уистлер, Рой Л., ред. (2009). Крахмал: химия и технология . Пищевая наука и технология (3-е изд.). Нью-Йорк: Академическая пресса. ISBN 978-0-08-092655-1 . Проверено 25 ноября 2016 г. .
- ^ Алан Дэвидсон: Оксфордский компаньон по еде (1999). «Мизуаме», с. 510 ISBN 0-19-211579-0 .
- ^ Алан Дэвидсон: Оксфордский справочник по еде . ОУП Оксфорд, 2014 г., ISBN 978-0-191-04072-6 , с. 527.
- ^ «Сахар» . Обучение, Продовольственные ресурсы. food.oregonstate.edu . Университет штата Орегон , Корваллис, Орегон. 23 мая 2012 года. Архивировано из оригинала 18 июля 2011 года . Проверено 28 июня 2018 г.
- ^ «Кукурузный сироп с высоким содержанием фруктозы: вопросы и ответы» . Управление по контролю за продуктами и лекарствами США. 5 ноября 2014 г. Архивировано из оригинала 25 января 2018 г. . Проверено 18 декабря 2017 г.
- ↑ Кевин Панг: Мексиканская кока-кола стала хитом в США. В: Seattle Times , 29 октября 2004 г.
- ^ Стив Т. Беккет: Промышленное производство и использование шоколада Беккета . Джон Уайли и сыновья, 2017, ISBN 978-1-118-78014-5 , с. 82.
- ^ Джеймс А. Кент: Справочник Ригеля по промышленной химии . Springer Science & Business Media, 2013, ISBN 978-1-475-76431-4 , с. 938.
- ^ Датан Э., Минн И., Пэн Х., Хе К.Л., Ан Х., Ю Б. и др. (2020). «Конъюгат глюкозы-триптолида избирательно воздействует на раковые клетки в условиях гипоксии» . iScience . 23 (9): 101536. Бибкод : 2020iSci...23j1536D . дои : 10.1016/j.isci.2020.101536 . ПМЦ 7509213 . ПМИД 33083765 .
- ^ Гудвин М.Л., Глэдден Л.Б., Нейстен М.В. (3 сентября 2020 г.). «Лактат-защищенная гипогликемия (ЛПГ)» . Границы в неврологии . 14 : 920. дои : 10.3389/fnins.2020.00920 . ISSN 1662-453X . ПМЦ 7497796 . ПМИД 33013305 .
- ^ Х. Фелинг: Количественное определение сахара в моче . В: Архив физиологической медицины (1848), том 7, с. 64–73 (на немецком языке).
- ^ Б. Толленс: О аммонийно-щелочном растворе серебра как реагенте для определения альдегида. Архивировано 19 февраля 2022 года в Wayback Machine . В «Отчетах Немецкого химического общества» (1882 г.), том 15, с. 1635–1639 (на немецком языке).
- ^ Барфоед С. (1873 г.). «Об обнаружении глюкозы рядом с декстрином и родственными ему тельцами» . Журнал аналитической химии (на немецком языке). 12 :27-32. дои : 10.1007/BF01462957 . S2CID 95749674 . Архивировано из оригинала 29 июля 2020 года . Проверено 1 июля 2019 г.
- ^ Эмиль Нюландер: О щелочном растворе висмута как реагенте для определения глюкозы в моче , Журнал физиологической химии . Том 8, выпуск 3, 1884 г., с. 175-185 Аннотация . Архивировано 23 сентября 2015 г. в Wayback Machine (на немецком языке).
- ^ Перейти обратно: а б с д и ж г час я Георг Шведт: Сахарно-сладкая химия . Джон Уайли и сыновья, 2012 г., ISBN 978-3-527-66001-8 , с. 102 (на немецком языке).
- ^ Триндер П. (1969). «Определение глюкозы в крови с использованием глюкозооксидазы с альтернативным акцептором кислорода» . Анналы клинической биохимии . 6 : 24–27. дои : 10.1177/000456326900600108 . S2CID 58131350 .
- ^ Перейти обратно: а б Чжан Ц, Чжао Г, Ян Н, Чжан Л (2019). «Уровень глюкозы в крови натощак у больных с различными видами заболеваний». Часть А. Гликаны и гликозаминогликаны как клинические биомаркеры и терапевтические средства . Прогресс молекулярной биологии и трансляционной науки. Том. 162. стр. 277–292. дои : 10.1016/bs.pmbts.2019.01.004 . ISBN 978-0-12-817738-9 .
- ^ Мидзогучи М., Исияма М., Сига М. (1998). «Водорастворимый хромогенный реагент для колориметрического обнаружения перекиси водорода - альтернатива 4-аминоантипирину, работающему на длинной волне». Аналитические коммуникации . 35 (2): 71–74. дои : 10.1039/A709038B .
- ^ Ван Дж (2008). «Электрохимические биосенсоры глюкозы». Химические обзоры . 108 (2): 814–825. дои : 10.1021/cr068123a . ПМИД 18154363 . .
- ^ Чен X, Чен J, Дэн C, Сяо C, Ян Y, Не Z и др. (2008). «Амперометрический биосенсор глюкозы на основе модифицированного электрода из углеродных нанотрубок, легированных бором». Таланта . 76 (4): 763–767. дои : 10.1016/j.talanta.2008.04.023 . ПМИД 18656655 .
- ^ Ван Г, Вэй Ю, Чжан В, Чжан Икс, Фан Б, Ван Л (2010). «Безферментное амперометрическое определение глюкозы с использованием композитов нанопроволоки Cu-CuO». Микрохимика Акта . 168 (1–2): 87–92. дои : 10.1007/s00604-009-0260-1 . S2CID 98567636 .
- ^ Охара Т.Дж., Раджагопалан Р., Хеллер А. (1994). « Проводные» ферментные электроды для амперометрического определения глюкозы или лактата в присутствии мешающих веществ». Аналитическая химия . 66 (15): 2451–2457. дои : 10.1021/ac00087a008 . ПМИД 8092486 .
- ^ Перейти обратно: а б Борисов С.М., Вольфбайс О.С. (2008). «Оптические биосенсоры». Химические обзоры . 108 (2): 423–461. дои : 10.1021/cr068105t . ПМИД 18229952 .
- ^ Ферри С., Кодзима К., Соде К. (2011). «Обзор глюкозооксидаз и глюкозодегидрогеназ: взгляд на ферменты, чувствительные к глюкозе», с высоты птичьего полета . Журнал науки и технологий о диабете . 5 (5): 1068–76. дои : 10.1177/193229681100500507 . ПМЦ 3208862 . ПМИД 22027299 .
- ^ Мадер Х.С., Wolfbeis OS (2008). «Зонды на основе бороновой кислоты для микроопределения сахаридов и гликозилированных биомолекул». Микрохимика Акта . 162 (1–2): 1–34. дои : 10.1007/s00604-008-0947-8 . S2CID 96768832 .
- ^ Вольфбайс О.С., Эме И., Папковская Н., Климант И. (2000). «Золь-гель биосенсоры глюкозы с использованием оптических преобразователей кислорода и метод компенсации переменного кислородного фона». Биосенсоры и биоэлектроника . 15 (1–2): 69–76. дои : 10.1016/S0956-5663(99)00073-1 . ПМИД 10826645 .
- ^ Перейти обратно: а б Галант А.Л., Кауфман Р.К., Уилсон Дж.Д. (2015). «Глюкоза: обнаружение и анализ». Пищевая химия . 188 : 149–160. doi : 10.1016/j.foodchem.2015.04.071 . ПМИД 26041177 .
- ^ Санс М.Л., Санс Дж., Мартинес-Кастро I (2004 г.). «Газохроматографо-масс-спектрометрический метод качественного и количественного определения дисахаридов и трисахаридов в меде». Журнал хроматографии А. 1059 (1–2): 143–148. дои : 10.1016/j.chroma.2004.09.095 . ПМИД 15628134 .
- ^ Институт молекулярной физиологии растений Макса Планка в базе данных Гольма (19 июля 2007 г.). «Масс-спектр глюкозы» . База данных метаболомов Голма . Архивировано из оригинала 9 сентября 2018 года . Проверено 4 июня 2018 г.
- ^ Кабаньеро А.И., Ресио Х.Л., Руперес М. (2006). «Жидкостная хроматография в сочетании с масс-спектрометрией изотопного соотношения: новый взгляд на обнаружение фальсификации меда». J Agric Food Chem . 54 (26): 9719–9727. дои : 10.1021/jf062067x . ПМИД 17177492 .
- ^ Беккер М., Либнер Ф., Розенау Т., Поттаст А. (2013). «Подход этоксимации-силилирования для анализа моно- и дисахаридов и характеристики параметров их идентификации с помощью ГХ/МС». Таланта . 115 : 642–51. дои : 10.1016/j.talanta.2013.05.052 . ПМИД 24054643 .
- ↑ Общество немецких химиков : wayback=20100331071121 Приложения к позиционному документу Отдела ядерной химии. Архивировано 31 марта 2010 г. в Wayback Machine , февраль 2000 г.
- ^ Машауэр С., Пранте О (2014). «Подслащивание фармацевтической радиохимии путем (18) f-фторгликозилирования: краткий обзор» . БиоМед Исследования Интернэшнл . 2014 : 1–16. дои : 10.1155/2014/214748 . ПМЦ 4058687 . ПМИД 24991541 .