Дефицит галактозоэпимеразы
Эта статья нуждается в дополнительных цитатах для проверки . ( май 2020 г. ) |
| Дефицит галактозоэпимеразы | |
|---|---|
| Другие имена | Дефицит уридиндифосфатгалактозо-4-эпимеразы |
 | |
| Уридиндифосфат глюкозы | |
Дефицит галактозоэпимеразы , также известный как дефицит GALE , галактоземия III. [1] и дефицит УДФ-галактозо-4-эпимеразы , [2] — редкая, аутосомно- рецессивная форма галактоземии , связанная с дефицитом фермента галактозоэпимеразы .
Симптомы и признаки
[ редактировать ]Симптомы врожденной галактоземии III типа проявляются с рождения, но различаются по степени тяжести в зависимости от того, присутствует ли периферическая или генерализованная форма заболевания. Симптомы могут включать: [3] [4]
- Детская желтуха
- Инфантильная гипотония
- Дисморфические черты
- Нейросенсорная тугоухость
- Нарушение роста
- Когнитивные недостатки
- Истощение клеток Пуркинье мозжечка
- Овариальная недостаточность (ПНЯ) и гипертрофический гипергонадизм
- Печеночная недостаточность
- Почечная недостаточность
- Спленомегалия
- Катаракта
Исследования симптомов галактоземии III типа в основном носят описательный характер, а точные патогенетические механизмы остаются неизвестными. Во многом это связано с отсутствием функциональных животных моделей классической галактоземии. Недавняя разработка мутанта Drosophila melanogaster GALE, проявляющего галактосемические симптомы, может стать многообещающей будущей животной моделью. [3]
Генетика
[ редактировать ]
галактозоэпимеразы является Дефицит аутосомно-рецессивным заболеванием. [5] это означает, что дефектный ген расположен на аутосоме , и для наследования заболевания необходимы две копии дефектного гена — по одной от каждого родителя. Родители человека с аутосомно-рецессивным заболеванием несут по одной копии дефектного гена, но обычно не испытывают никаких признаков или симптомов заболевания. [ нужна ссылка ]
Генетическая основа
[ редактировать ]Были идентифицированы различные мутации GALE человека, приводящие к галактоземии III типа. [6] Функциональный анализ этих мутантных изоформ GALE предполагает, что сниженная каталитическая эффективность и повышенная вероятность протеолитического расщепления действуют как причины галактоземии типа III. [6]
| Мутировавший остаток | Биохимический эффект | Клиническое проявление |
|---|---|---|
| В94М, К257Р, Л313М, Р335Х | Сильно нарушенное число оборотов и константа специфичности. | Тяжелая генерализованная галактоземия. [3] |
| С81Р, Т150М, П293Л | Легкое ухудшение числа оборотов | Промежуточная галактоземия. [6] |
| Л183П, Д103Г, Г90Э, Н34С | Сильно нарушены число оборотов и константа специфичности; усиление протеолитического пищеварения. | Тяжелая генерализованная галактоземия. [3] |
Биохимическая основа
[ редактировать ]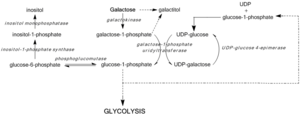
Дефицит GALE ингибирует регенерацию УДФ-глюкозы, предотвращая образование глюкозо-1-фосфата и приводя к накоплению галактозы и галактозо-1-фосфата. Было показано, что высокие уровни галактозо-1-фосфата мешают работе фосфоглюкомутазы . [7] гликогенфосфорилаза , [8] УДФ-гликопирофосфорилаза, [9] активность на бактериальных моделях и in vitro , однако механизмы токсичности in vivo еще не подтверждены. [3] Тем не менее, средние уровни галактозо-1-фосфата действуют как наиболее точные предикторы тяжести симптомов, связанных с галактоземией III типа. [10]
Блокировка пути Лелуара вследствие дефицита или дисфункции GALE активирует альтернативные пути метаболизма глюкозы и приводит к образованию галактита и галактоната. Галактонат метаболизируется по пентозофосфатному пути и не считается токсичным. [11] Однако галактитол может накапливаться в волокнах хрусталика, нарушая проницаемость эпителиальных клеток хрусталика и приводя к гибели клеток и образованию катаракты. [12] Дефицит GALE также нарушает биосинтез гликолипидов и гликопротеинов из-за снижения производства UDP-GalNAc из UDP-GlcNAc. [3]
Диагностика
[ редактировать ]Скрининг повышенных уровней галактозы может выявить дефицит или дисфункцию GALE у младенцев, а исследования мутаций GALE клинически доступны. [13]
Классификация
[ редактировать ]Существует 2 формы дефицита эпимеразы: доброкачественный дефицит эритроцитов и тяжелый дефицит печени. Тяжелая форма аналогична галактоземии . [ нужна ссылка ]
Уход
[ редактировать ]Лица с галактоземией III типа должны соблюдать диету с ограничением лактозы и галактозы, исключая молочные продукты и слизистые растения. [4] Диетические ограничения являются единственным доступным в настоящее время методом лечения дефицита GALE. Однако, поскольку метаболизм гликопротеинов и гликолипидов приводит к образованию эндогенной галактозы, галактоземию III типа нельзя решить только за счет диетических ограничений. [3]
Ссылки
[ редактировать ]- ^ Интернет-менделевское наследование у человека (OMIM): дефицит галактозоэпимеразы - 230350
- ^ Интернет-менделевское наследование у человека (OMIM): UDP-галактозо-4-эпимераза - 606953
- ^ Jump up to: а б с д и ж г час Лай К., Эльзас Л.Дж., Виеренга К.Дж. (ноябрь 2009 г.). «Галактозная токсичность у животных» . ИУБМБ Жизнь . 61 (11): 1063–74. дои : 10.1002/iub.262 . ПМК 2788023 . ПМИД 19859980 .
- ^ Jump up to: а б Уолтер Дж.Х., Робертс Р.Э., Бесли Г.Т., Рэйт Дж.Э., Клири М.А., Холтон Дж.Б., Макфол Р. (апрель 1999 г.). «Генерализованный дефицит уридиндифосфатгалактозо-4-эпимеразы» . Арх. Дис. Ребенок . 80 (4): 374–6. дои : 10.1136/adc.80.4.374 . ПМК 1717903 . ПМИД 10086948 .
- ^ Пак Х.Д., Пак КУ, Ким JQ, Шин CH, Ян С.В., Ли Д.Х., Сон YH, Сон J (ноябрь 2005 г.). «Молекулярная основа галактоземии с дефицитом УДФ-галактозо-4-эпимеразы (GALE) у корейских пациентовxz» . Генетика в медицине . 7 (9): 646–9. дои : 10.1097/01.gim.0000194023.27802.2d . ПМИД 16301867 .
- ^ Jump up to: а б с Тимсон DJ (декабрь 2005 г.). «Функциональный анализ болезнетворных мутаций УДФ-галактозо-4-эпимеразы человека» . ФЕБС Дж . 272 (23): 6170–7. дои : 10.1111/j.1742-4658.2005.05017.x . ПМИД 16302980 .
- ^ де Йонг В.А., Бро С., Остергаард С., Регенберг Б., Олссон Л., Нильсен Дж. (октябрь 2008 г.). «Роль галактитола, галактозо-1-фосфата и фосфоглюкомутазы в токсичности, вызванной галактозой, у Saccharomyces cerevisiae ». Биотехнология. Биоинж . 101 (2): 317–26. дои : 10.1002/бит.21890 . ПМИД 18421797 . S2CID 205497901 .
- ^ Маддайя В.Т., Мэдсен Н.Б. (сентябрь 1966 г.). «Кинетика очищенной фосфорилазы печени» . Ж. Биол. Хим . 241 (17): 3873–81. дои : 10.1016/S0021-9258(18)99788-7 . ПМИД 5920799 .
- ^ Лай К., Эльза LJ (май 2000 г.). «Сверхэкспрессия человеческой УДФ-глюкозопирофосфорилазы спасает дрожжи с дефицитом галактозо-1-фосфатуридилтрансферазы». Биохим. Биофиз. Рез. Коммун . 271 (2): 392–400. дои : 10.1006/bbrc.2000.2629 . ПМИД 10799308 .
- ^ Герреро Н.В., Сингх Р.Х., Манатунга А. , Берри Г.Т., Штайнер Р.Д., Эльсас Л.Дж. (декабрь 2000 г.). «Факторы риска преждевременной недостаточности яичников у женщин с галактоземией». Ж. Педиатр . 137 (6): 833–41. дои : 10.1067/mpd.2000.109148 . ПМИД 11113841 .
- ^ Верли С.Л., Берри Г.Т., Палмиери М., Мазур А., Эльзас Л., Сигал С. (декабрь 1997 г.). «Галактонат мочи у пациентов с галактоземией: количественный анализ с помощью спектроскопии ядерного магнитного резонанса» . Педиатр. Рез . 42 (6): 855–61. дои : 10.1203/00006450-199712000-00022 . ПМИД 9396569 .
- ^ Киносита Дж. Х., Дворник Д., Крамл М., Габбай К. Х. (июнь 1968 г.). «Влияние ингибитора альдозоредуктазы на хрусталик кролика, подвергшийся воздействию галактозы». Биохим. Биофиз. Акта . 158 (3): 472–5. дои : 10.1016/0304-4165(68)90305-х . ПМИД 5660111 .
- ^ Алано А., Алмашану С., Чински Дж. М., Костеас П., Блитцер М.Г., Вульфсберг Э.А., Коуэн Т.М. (июнь 1998 г.). «Молекулярная характеристика уникального пациента с галактоземией с дефицитом эпимеразы» . Дж. Наследовать. Метаб. Дис . 21 (4): 341–50. дои : 10.1023/А:1005342306080 . ПМИД 9700591 . S2CID 27586949 .