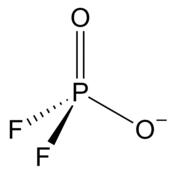
Дифторфосфат
| |||
| |||
| Имена | |||
|---|---|---|---|
| Систематическое название ИЮПАК
Дифторфосфат [ 1 ] | |||
| Идентификаторы | |||
3D model ( JSmol )
|
|||
| ХимическийПаук | |||
ПабХим CID
|
|||
Панель управления CompTox ( EPA )
|
|||
| Характеристики | |||
| ПО 2 Ф − 2 | |||
| Молярная масса | 100.97 g mol −1 | ||
| Структура | |||
| Тетракоординированный у фосфора атома | |||
| Тетраэдр у атома фосфора | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |||
Дифторфосфат или дифтордиоксофосфат или фосфородифторидат представляет собой анион формулы ПО 2 F - 2 . Он имеет один отрицательный заряд и напоминает перхлорат ( ClO - 4 ) и монофторсульфонат ( SO3СО3Ф − ) по форме и соединениям. [ 2 ] Эти ионы изоэлектронны , наряду с тетрафторалюминатом, фосфатом , ортосиликатом и сульфатом . [ 2 ] [ 3 ] Он образует ряд соединений. Ион токсичен для млекопитающих, поскольку он блокирует усвоение йода щитовидной железой. Однако он разлагается в организме в течение нескольких часов. [ 2 ]
Соединения, содержащие дифторфосфат, могут иметь его в виде простого неотрицательного иона, он может действовать как дифторфосфатный лиганд, где он ковалентно связан с одним или двумя атомами металла, или продолжать образовывать сетчатое твердое вещество. [ 4 ] Он может быть ковалентно связан с неметаллическим или органическим фрагментом с образованием сложного эфира или амида.
Формирование
[ редактировать ]Дифторфосфат аммония ( [NH 4 ]PO 2 F 2 ) образуется при обработке пятиокиси фосфора фторидом аммония . [ 2 ] Именно так ион был впервые получен его первооткрывателем Вилли Ланге в 1929 году. [ 3 ] [ 5 ]
щелочных металлов Хлориды могут реагировать с сухой дифторфосфорной кислотой с образованием солей щелочных металлов . [ 6 ]
- NaCl + HPO 2 F 2 → NaPO 2 F 2 + HCl( г )
Фторирование дихлорфосфатов может привести к образованию дифторфосфатов. [ 7 ] Другой метод — фторирование фосфатов или полифосфатов . [ 5 ]
Триметилсилилдифторфосфат ( (CH 3 ) 3 Si-O-P(=O)F 2 ) реагирует с хлоридами металлов с образованием дифторфосфатов. [ 8 ]
Ангидрид дифторфосфорной кислоты ( HPO 2 F 2 ), оксид фосфорилдифторида ( P 2 O 3 F 4 ) реагирует с оксидами , такими как UO 3 с образованием дифторфосфатов. [ 9 ] Оксид фосфорилдифторида также реагирует с фторидами щелочных металлов с образованием дифторфосфатов. [ 10 ]
Характеристики
[ редактировать ]Ион дифторфосфата в дифторфосфате аммония и дифторфосфате калия имеет следующие межатомные размеры: [ 11 ]
| Дифторфосфатная соль | Длина P-O | Длина P – F | Угол О-П-О | Угол F–P–O | Угол F–P–F |
|---|---|---|---|---|---|
| Дифторфосфат аммония | 1,457 Å | 1541 Å | 118.7° | 109.4° | 98.6° |
| Дифторфосфат калия | 1470 Å | 1575 Å | 122.4° | 108.6° | 97.1° |
Водородная связь иона аммония с атомами кислорода вызывает изменение иона дифторфосфата в соли аммония . [ 11 ]
При нагревании солей , не принадлежащих щелочным или щелочноземельным металлам , дифторфосфаты разлагаются в первую очередь с выделением POF 3 образует монофторфосфат ( ПО 3 Ф 2− ) соединение, а затем оно, в свою очередь, разлагается до ортофосфата. Соединение ПО 3- 4 . [ 12 ] [ 13 ]
Дифторфосфатные соли обычно растворимы и стабильны в воде . Однако в кислых или щелочных условиях они могут гидролизоваться до монофторфосфатов и плавиковой кислоты . [ 14 ] цезия . и калия Наименее растворимы соли [ 14 ]
Облучение дифторфосфата калия может гамма-лучами привести к образованию свободных радикалов. •PO 2 F − , •PO 3 F − и •PO 2 F 2 . [ 15 ] [ 16 ]
Соединения
[ редактировать ]| Формула | Имя | Структура | Инфракрасный спектр | Температура плавления | Комментарии | Ссылка |
|---|---|---|---|---|---|---|
| ЛиПО 2 Ф 2 | Дифторфосфат лития | 360 °С | [ 5 ] [ 6 ] | |||
| Be(PO 2 F 2 ) 2 | Дифторфосфат бериллия | >400 °С г | приготовленный из BeCl 2 и кислота | [ 17 ] | ||
| СН 3 СН 2 −O−P(=O)F 2 | Этилдифторфосфат | [ 18 ] | ||||
| [НХ 4 ] + ПО 2 Ф − 2 | Дифторфосфат аммония | орторомбическая: a = 8,13 Å, b = 6,43 Å, c = 7,86 Å, Z = 4 пространственная группа Pnma | П–Ф растяжка 842 и 860 см. −1 ; П–О растяжением 1138 и 1292 см. −1 | 213 °С | ||
| [НЕТ 2 ] + ПО 2 Ф − 2 | Дифторфосфат нитрония | 515, 530, 550, 560, 575, 845, 880, 1145, 1300, 2390, 3760 см. −1 | нитроний, образующийся из ангидрида и Н 2 О 5 | [ 19 ] | ||
| [НЕТ] + ПО 2 Ф − 2 | Нитрозония дифторфосфат | 500, 840, 880, 1130, 1272, 1315, 2278 см −1 | нитрозоний, образующийся из ангидрида и N2ON2O3 | [ 19 ] | ||
| NaPO 2 F 2 | Дифторфосфат натрия | 210 °С | [ 6 ] | |||
| Mg(PO 2 F 2 ) 2 | Дифторфосфат магния | 200 °С | [ 5 ] | |||
| [НХ 4 ] + мг 2+ (ПО 2 F - 2 ) 3 | Дифторфосфат аммония-магния | Смсм а= 5,411 б =15,20 в =12,68 | [ 20 ] | |||
| Al(PO 2 F 2 ) 3 | Дифторфосфат алюминия | полимерный [ 4 ] | 505, 541, 582, 642, 918, 971, 1200, 1290 см. −1 (при росте 355 см −1 примесь) | сформированный из Al(CH 2 CH 3 ) 3 и кислота; бесцветный нерастворимый порошок [ 4 ] | [ 7 ] [ 8 ] | |
| Si(-O-P(=O)F 2 ) 4 | Дифторфосфат кремния(IV) | сформированный из SiCl 4 и ангидрид | [ 18 ] | |||
| (CH 3 ) 3 Si-O-P(=O)F 2 | Триметилсилилдифторфосфат | образуется из ангидрида и [(CH 3 ) 3 Si] 2 О | [ 4 ] [ 18 ] | |||
| КПО 2 Ф 2 | Дифторфосфат калия | ромбический: a = 8,03 Å, b = 6,205 Å, c = 7,633 Å, Z = 4, V=380,9 Å 3 , плотность = 2,44 г/см 3 | 510, 525, 570, 835, 880, 1145, 1320, 1340 см −1 | 263 °С | бесцветные удлиненные призмы | [ 6 ] [ 11 ] [ 19 ] [ 21 ] [ 22 ] |
| (К + ) 4 (PO 2 F - 2 ) 2 (S 2 О 2 - 7 ) | Пиросульфат дифторфосфата тетракалия | C 2/ c : a = 13,00 Å, b = 7,543 Å, c = 19,01 Å, β = 130,07°, Z = 4 | [ 23 ] | |||
| Ca(PO 2 F 2 ) 2 · CH 3 COOCH 2 CH 3 | Дифторфосфат кальция - этилацетата 1:1 сольват | [ 24 ] | ||||
| Са(PO 2 F 2 ) 2 | Дифторфосфат кальция | >345 °С г | [ 5 ] | |||
| [ГОЛОС 2 ] + ПО 2 Ф − 2 | Перванадил дифторфосфат | [ 9 ] | ||||
| CrO 2 (PO 2 F 2 ) 2 | Хромилдифторфосфат | образован из ангидрида; красно-коричневый | [ 25 ] | |||
| Cr(PO 2 F 2 ) 3 | Дифторфосфат хрома(III) | 320, 385, 490, 575, 905, 955, 1165, 1255 см −1 | образуется из избытка ангидрида, зеленый | [ 25 ] | ||
| Mn(CO) 5 PO 2 F 2 [ нужны разъяснения ] | 184 °С | [ 26 ] | ||||
| HMn(PO 2 F 2 ) 3 [ нужны разъяснения ] | растворить марганец в кислоте; белый | [ 27 ] | ||||
| [NH + 4 ](Mn 2+ ) 3 (PO 2 F − 2 )(PO 3 F 2− ) 2 (Ф − ) 2 | [ 28 ] | |||||
| Fe(PO 2 F 2 ) 2 | Дифторфосфат железа(II) | 463, 496, 668 (слабый), 869 (двойной), 1139, 1290 см. −1 | 180 °С г | цвет сине-зеленый, гигроскопичен, плавится при 250 °C, при температуре выше 300 °C начинает разлагаться до Fe 3 (PO 4 ) 2 | [ 12 ] | |
| Fe(PO 2 F 2 ) 3 | Дифторфосфат железа(III) | 262, 493, 528, 570, 914, 965, 1173, 1242 см. −1 | >400 °С | разлагается при 230 ° C с образованием FeF3 ; растворить железо в кислоте в присутствии кислорода | [ 7 ] | |
| К + (Фе 2+ ) 3 (PO 2 F − 2 )(PO 3 F 2− ) 2 (Ф − ) 2 | [ 28 ] | |||||
| Со(PO 2 F 2 ) 2 | Дифторфосфат кобальта(II) | 173 °С | приготовленный из CoCl 2 и кислота; розовый или голубой; синий цвет получается при нагревании розового до 140 °C. | [ 17 ] | ||
| HCo(PO 2 F 2 ) 3 [ нужны разъяснения ] | растворить кобальт в кислоте; красно-фиолетовый | [ 27 ] | ||||
| Co(PO 2 F 2 ) 2 ·2 CH 3 CN | Дифторфосфат кобальта(II) - сольват метилцианида 1:2 | ромбический: a = 9,227 Å, b = 13,871 Å, c = 9,471 Å, V = 1212 Å 3 , Z = 4, плотность = 1,88 г/см 3 | обращаться HCo(PO 2 F 2 ) 3 с CH 3 CN в течение нескольких недель; красные кристаллы | [ 29 ] | ||
| [NH + 4 ](Со 2+ ) 3 (PO 2 F − 2 )(PO 3 F 2− ) 2 (Ф − ) 2 | [ 28 ] | |||||
| Ni(PO 2 F 2 ) 2 | Дифторфосфат никеля(II) | 255 °С г | медленно готовится из NiCl 2 и кислота; желтый | [ 17 ] | ||
| HNi(PO 2 F 2 ) 3 [ нужны разъяснения ] | растворить никель в кислоте; желтый | [ 27 ] | ||||
| Cu(PO 2 F 2 ) 2 | Дифторфосфат меди(II) | ромбический Fddd : a = 10,134 Å, b = 24,49 Å, c = 34,06 Å, Z = 48, V = 8454,3 Å 3 , плотность = 2,50 г/см 3 | 265 °С г | бледно-голубые иглы | [ 5 ] [ 29 ] | |
| CuI( ксантфос ) 2 ( μ -PO 2 F 2 ) | полимерный; моноклинная: а = 12,435 Å, b = 10,887 Å, c = 25,682 Å, β = 100,220°, V = 3421 Å 3 | бесцветный | [ 30 ] | |||
| Zn(PO 2 F 2 ) 2 | Дифторфосфат цинка(II) | в. 25 °С? | стеклянный | [ 5 ] | ||
| Н 2 [Zn(PO 2 F 2 ) 4 ] | Тетра(дифторфосфато)цинковая(II) кислота | |||||
| Ga(PO 2 F 2 ) 3 | Дифторфосфат галлия(III) | |||||
| [(CH 3 ) 2 GaPO 2 F 2 ] 2 | Дифторфосфат диметилгаллия(III) | димерный | 380, 492, 520, 551, 616, 709, 750, 899, 949, 1171, 1218, 1262, 1295, 1404, 2922, 2982 см. −1 | [ 4 ] [ 31 ] | ||
| РбПО 2 Ф 2 | Дифторфосфат рубидия | ромбический: a = 8,15 Å, b = 6,45 Å, c = 7,79 Å, Z = 4, V = 409,5 Å 3 плотность = 3,02 г/см 3 | П–Ф растяжка 827 и 946 см. −1 ; П–О протяженностью 1145 и 1320 см. −1 | 160 °С | белый | [ 6 ] [ 11 ] [ 21 ] |
| Sr(PO 2 F 2 ) 2 | Дифторфосфат стронция | 250 °С г | приготовленный из SrCl 2 и кислота | [ 17 ] | ||
| [NH 4 ]Sr(PO 2 F 2 ) 3 | Дифторфосфат аммония-стронция | Триклиника Р 1 а =7,370 б =11,054 в =13,645 а =88,861 б =87,435° в =89,323° | [ 20 ] | |||
| AgPO 2 F 2 | Дифторфосфат серебра(I) | [ 32 ] | ||||
| Ag 9 (PO 2 F 2 ) 14 [ нужны разъяснения ] | [ 28 ] | |||||
| Ag(1-метил-2-алкилтиометил- 1Н - бензимидазол ) ПО 2 Ф 2 | [ 32 ] | |||||
| Ag(2,6-бис-[(2-метилтиофенил)-2-азаэтенил] пиридин ) ПО 2 Ф 2 | Триклиника Р 1: а = 7,687 Å, b = 10,740 Å, c = 13,568 Å, α = 99,52°, β = 96,83°, γ = 99,83°, Z = 2, V = 1076 Å 3 , плотность = 1,81 г/см 3 | [ 33 ] | ||||
| - дицианодифенилацетилен Ag( 4,4' ) ПО 2 Ф 2 | ||||||
| Cd(PO 2 F 2 ) 2 | Дифторфосфат кадмия(II) | 245 °С г | [ 5 ] | |||
| В(PO 2 F 2 ) 3 | Дифторфосфат индия(III) | 269, 492, 528, 567, 910, 962, 1179, 1269 см. −1 | белый, разлагается при 260 °C с образованием ИнФ 3 | [ 7 ] | ||
| [(CH 3 ) 2 InPO 2 F 2 ] 2 | Дифторфосфат диметилиндия(III) | димерный | 373, 490, 500, 535, 559, 735, 878, 925, 1128, 1179, 1275, 1435, 2928, 3000 см. −1 | [ 31 ] | ||
| SnCl 2 (PO 2 F 2 ) 2 | Дифторфосфат дихлорида олова(IV) | [ 34 ] | ||||
| (СН 3 ) 2 Sn(PO 2 F 2 ) 2 | Дифторфосфат диметилолова(IV) | 204 °С г | приготовленный из (CH 3 ) 2 SnCl 2 и кислота; желтый | [ 17 ] | ||
| (СН 3 СН 2 ) 2 Sn(PO 2 F 2 ) 2 | Дифторфосфат диэтилолова(IV) | 262 °С г | приготовленный из (CH 3 CH 2 ) 2 SnCl 2 и кислота; желтый | [ 17 ] | ||
| (СН 3 СН 2 СН 2 ) 2 Sn(PO 2 F 2 ) 2 | Дифторфосфат дипропилолова(IV) | 245 °С г | приготовленный из (СН 3 СН 2 СН 2 ) 2 SnCl 2 и кислоту; желтый | [ 17 ] | ||
| (СН 3 (СН 2 ) 3 ) 2 Sn(PO 2 F 2 ) 2 | Дифторфосфат дибутилолова(IV) | 235 °С г | приготовленный из (СН 3 (СН 2 ) 7 ) 2 SnCl 2 и кислота; желтый | [ 17 ] | ||
| (СН 3 (СН 2 ) 7 ) 2 Sn(PO 2 F 2 ) 2 | Дифторфосфат диоктилолова(IV) | 114 °С | приготовленный из (СН 3 (СН 2 ) 7 ) 2 SnCl 2 и кислота; желтый | [ 17 ] | ||
| SbCl 4 PO 2 F 2 | Дифторфосфат тетрахлорида сурьмы(V) | [ 34 ] | ||||
| СбФ 4 ПО 2 Ф 2 | Дифторфосфат тетрафторида сурьмы(V) | [ 34 ] | ||||
| (2,2-дипирадил) 2Re(CO) 2 PO 2 F 2 [ нужны разъяснения ] | [ 35 ] | |||||
| Au[бис(трифенилфосфинсульфид- S )] ПО 2 Ф 2 [ нужны разъяснения ] | [ 36 ] | |||||
| ИО 2 ПО 2 Ф 2 [ нужны разъяснения ] | Рамановское : 130, 163, 191, 219, 295, 323, 329, 378, 637, 713, 737, 781, 799, 839, 918, 1163 см. −1 | желтоватого цвета, производится из IO 3 , разлагается водой | [ 37 ] | |||
| ИО 3 ПО 2 Ф 2 [ нужны разъяснения ] | Рамановское : 217, 247, 269, 305, 343, 367, 395, 473, 569, 643, 671, 717, 797, 891, 1123 см. −1 | желтоватого цвета, производится из H 5 IO 6 , разлагается водой | [ 37 ] | |||
| FXePO 2 Ф 2 | Дифторфосфат ксенона(II) фторида | [ 38 ] | ||||
| Хе(PO 2 F 2 ) 2 | Дифторфосфат ксенона(II) | [ 38 ] | ||||
| ЦсПО 2 Ф 2 | Дифторфосфат цезия | ромбический: a = 8,437 Å, b = 6,796 Å, c = 8,06 Å, Z = 4, V = 462,1 Å 3 , плотность = 3,36 г/см 3 | 286 °С | [ 6 ] [ 11 ] [ 21 ] | ||
| (Cs + ) 2 (Фе 3+ ) 2 (PO 2 F − 2 )(PO 3 F 2− ) 2 (Ф − ) 3 | [ 28 ] | |||||
| Ба(PO 2 F 2 ) 2 | Дифторфосфат бария | орторомбический I 4 2 d а =10,4935 б =10,4935 в =26,030 | >400 °С | [ 5 ] [ 20 ] | ||
| [NH 4 ] 2 Ba(PO 2 F 2 ) 4 | Дифторфосфат диаммония-бария | P 2/ na=14,285 b=5,472 c=19,474 β=97,607° | [ 20 ] | |||
| Re(CO) 5 PO 2 F 2 | [ 35 ] | |||||
| Hg(PO 2 F 2 ) 2 | Дифторфосфат ртути(II) | [ 5 ] | ||||
| Ртуть 2 (PO 2 F 2 ) 2 | Дифторфосфат ртути(I) или ди(дифторфосфато)димеркуран | Раман : 220 см −1 | производится из ангидрида | [ 5 ] | ||
| ТlPO 2 F 2 | Дифторфосфат таллия(I) | производится из ангидрида или кислоты на TlCl | [ 5 ] | |||
| [(CH 3 ) 2 TlPO 2 F 2 ] 2 | Дифторфосфат диметилталлия(III) | димерный | 360, 374, 500, 505, 520, 559, 850, 880, 1120, 1140, 1195, 1250, 1285, 2932, 3020 см. −1 | [ 31 ] | ||
| Pb(PO 2 F 2 ) 2 | Дифторфосфат свинца(II) | 189 °С г | [ 5 ] | |||
| УО 2 (ПО 2 F 2 ) 2 | Уранил дифторфосфат | 260, 498, 854, 924, 980, 1124 см −1 | ИК-спектр из-за УО 2+ 2 | [ 9 ] | ||
| [(СН 3 СН 2 ) 4 Н] + ПО 2 Ф − 2 | Дифторфосфат тетраэтиламмония | [ 39 ] | ||||
| Дифторфосфат 1-этил-3-метилимидазолия | ионная жидкость | [ 40 ] | ||||
| Дифторфосфат 1-бутил-3-метилимидазолия | ионная жидкость | [ 40 ] | ||||
| Дифторфосфат 1-бутил-1-метилпирролидиния | ионная жидкость | [ 40 ] | ||||
| Дифторфосфат 1-бутил-1-метилпиперидиния | ионная жидкость | [ 40 ] | ||||
| ди(3,3',4,4'-тетраметил-2,2',5,5'-тетраселенафульвалениум)дифторфосфат | Переходы в металлическое состояние ниже 137 К (-136 ° С) | [ 41 ] | ||||
| 1,4-дифенил-3,5-энанило-4,5-дигидро-1,2,4-триазол (нитрон) | моноклинный P 2 1 / n : a = 7,3811 Å, b = 14,9963 Å, c = 16,922 Å, β = 102,138°, V = 1361,2 Å 3 , Z = 4 | нерастворимый; желто-коричневый | [ 2 ] [ 28 ] | |||
| Стрихнин ПО 2 Ф 2 | [ 3 ] | |||||
| Кокаин ПО 2 Ф 2 | [ 3 ] | |||||
| Бруцин ПО 2 Ф 2 | [ 3 ] | |||||
| Морфий ПО 2 Ф 2 | [ 3 ] | |||||
| [Н(СН 3 ) 4 ] + ПО 2 Ф − 2 | Дифторфосфат тетраметиламмония | [ 3 ] | ||||
| Н[В(PO 2 F 2 ) 4 ] | Тетра(дифторфосфат)борная кислота | 469, 502, 552, 647, 836, 940, 994, 1093, 1348, 1567 см. −1 | сформированный из BBr 3 и кислота; жидкость | [ 4 ] | ||
| Li[B(PO 2 F 2 ) 4 ] | Тетра(дифторфосфат)борат лития | моноклинный P 2 1 / c : a =7,9074 Å, b = 14,00602 Å, c = 13,7851 Å, β = 121,913°, Z = 4 | 479, 502, 568, 833, 945, 1002, 1080, 1334 см. −1 | сформированный из HB(PO 2 F 2 ) 4 и бутиллитий ; бесцветный | [ 4 ] | |
| [HS(CH 3 ) 2 ] + [В(РО 2 F 2 ) 4 ] − | Тетра(дифторфосфат)борат диметилсульфония | 472, 511, 555, 648, 832, 933, 993, 1082, 1337, 1436, 2851, 2921, 3042 см. −1 | сформированный из BH 3 · S(CH 3 ) 2 и кислота; ионная жидкость | [ 4 ] | ||
| [Li((СН 3 СН 2 ) 2 О) + ] 3 [Al(PO 2 F 2 ) 6 ] − | (Диэтиловый эфир)гекса(дифторфосфат)алюминат лития | тригональный R3 = : a = 17,4058 Å, b = 17,4058 Å, c 21,4947 Å, γ = 120°, Z = 6 | 417, 503, 536, 624, 723, 891, 922, 964, 1174, 1204, 1283 см. −1 | образуется из бутиллития , триэтилалюминия и кислоты; белый | [ 4 ] | |
| К 2 CrO 2 (PO 2 F 2 ) 4 | 305, 370, 485, 550, 870, 920, 1050, 1130, 1250 см. −1 | 145 °С г | образуется из ангидрида и К 2 CrO 4 ; коричневый | [ 25 ] | ||
| Na 2 MoO 2 (PO 2 F 2 ) 4 | аморфный | 280, 490, 620, 880, 915, 950, 1020, 1070, 1140, 1280 см. −1 | 125 °С г | образуется из ангидрида и К 2 МоО 4 ; белый | [ 25 ] | |
| Na 2 WO 2 (PO 2 F 2 ) 4 | аморфный | 280, 474, 620, 930, 1030, 1130, 1230 см −1 | 109 °С г | образуется из ангидрида и К 2 ВО 4 ; белый | [ 25 ] |
Родственные вещества
[ редактировать ]Дифторфосфорная кислота
[ редактировать ]Дифторфосфорная кислота ( HPO 2 F 2 ) — одна из фторфосфорных кислот. Он образуется при реакции фосфорилфторида с водой:
- ПОФ 3 + H 2 O → HPO 2 F 2 + HF
Она, в свою очередь, гидролизуется с образованием монофторфосфорной кислоты ( H 2 PO 3 F ) и следы гексафторфосфорной кислоты ( HPF 6 ). HPO 2 F 2 также образуется при реакции HF с пятиокисью фосфора . Еще один метод включает получение дифторфосфорной кислоты в качестве побочного продукта фторида кальция при нагревании с влажной пятиокисью фосфора. Способ получения чистой дифторфосфорной кислоты включает нагревание фосфорилфторида с монофторфосфорной кислотой и отделение продукта перегонкой: [ 42 ]
- ПОФ 3 + Н 2 ПО 3 Ф → 2 ГПО 2 Ф 2
Дифторфосфорную кислоту также можно получить фторированием оксихлоридов фосфора. P 2 O 3 Cl 4 и POCl 3 Реакция взаимодействия и раствора фтороводорода с образованием HPO 2 Cl 2 и затем ГПО 2 F 2 . [ 43 ] Еще один способ – обработка ортофосфатом ( PO 3− 4 ) с сернофтористоводородной кислотой ( HSO3F ) . [ 44 ]
Дифторфосфорная кислота представляет собой бесцветную жидкость. Он плавится при температуре -96,5 ° C (-141,7 ° F) и кипит при 115,9 ° C (240,6 ° F). Его плотность при 25 °C составляет 1,583 г/см. 3 . [ 14 ]
Оксид фосфорилдифторида
[ редактировать ]Ангидрид дифторфосфорной кислоты, также известный как оксид фосфорилдифторида или дифосфорилтетрафторид ( F 2 (O=)P-O-P(=O)F 2 или P 2 O 3 F 4 ) — ангидрид дифторфосфорной кислоты. Кристаллизуется в ромбической системе с пространственной группой Pcca и Z = 4. [ 45 ] P 2 O 3 F 4 можно получить кипячением дифторфосфорной кислоты с пятиокисью фосфора . P 2 O 3 F 4 кипит при 71 °С. [ 46 ]
Замена
[ редактировать ]Помимо изоэлектронного ряда, к ионам, связанным замещением фтора или кислорода другими элементами, относятся монофторфосфат , дифтортиофосфат , дихлортиофосфат , дихлорфосфат , хлорфтортиофосфат , хлорфторфосфат , дибромфосфат и бромфторфосфат . [ 47 ]
Аддукты
[ редактировать ]Дифторфосфат может образовывать аддукты с ПФ 5 и АсФ 5 . В них атомы кислорода образуют донорно-акцепторную связь между атомами P и As (или P), связывая дифториды с пентафторидами. Примеры солей включают КПО 2 Ф 2 2АсФ 5 , КПО 2 Ф 2 ·АсФ 5 , КПО 2 Ф 2 ·2ПФ 5 и КПО 2 Ф 2 ·ПФ 5 . [ 48 ]
Амины могут реагировать с фосфорилфторидом с образованием веществ формулы RR'N-P(=O)F 2 . К таким аминам относятся этиламин , изопропиламин , н -бутиламин , трет -бутиламин , диметиламин и диэтиламин . Моноамины могут в дальнейшем реагировать с образованием фторида алкилиминофосфорной кислоты ( R-N=P(=O)F ). [ 49 ]
Ссылки
[ редактировать ]- ^ Той, Артур Д.Ф. (22 октября 2013 г.). Химия фосфора . Пергамские тексты в неорганической химии. Том. 3. Пергамон Пресс. стр. 536–537. ISBN 9781483147413 . Проверено 19 июня 2015 г.
- ^ Jump up to: а б с д и Анбар, М.; Гутманн, С.; Левитус, З. (30 мая 1959 г.). «Влияние ионов монофторсульфоната, дифторфосфата и фторбората на поглощение йода щитовидной железой». Природа . 183 (4674): 1517–1518. Бибкод : 1959Natur.183.1517A . дои : 10.1038/1831517a0 . ПМИД 13666792 . S2CID 4291858 .
- ^ Jump up to: а б с д и ж г Ланге, Вилли (3 апреля 1929 г.). «О дифторфосфорной кислоте и образовании ее перхлоратподобной соли». Отчеты Немецкого химического общества (серии A и B) . 62 (4): 786–792. дои : 10.1002/cber.19290620408 .
- ^ Jump up to: а б с д и ж г час я Шульц, Кристоф; Эйден, Филипп; Клозе, Петра; Эрмантраут, Андреас; Шмидт, Майкл; Гарсух, Арнд; Кроссинг, Инго (2015). «Гомолептичные бораты и алюминаты, содержащие дифторфосфатный лиганд – [M(O 2 PF 2 ) x ] и — – синтез и характеристика» . Dalton Trans . 44 (15): 7048–7057. doi : 10.1039/c5dt00469a . PMID 25785817 .
- ^ Jump up to: а б с д и ж г час я дж к л м Васт, П.; Семмуд, А.; Адду, А.; Палавит, Г. (март 1988 г.). «Методическое исследование синтеза дифтордиоксофосфатов металлов из оксида фосфорилдифторида». Журнал химии фтора . 38 (3): 297–302. дои : 10.1016/S0022-1139(00)81065-9 .
- ^ Jump up to: а б с д и ж Томпсон, Колорадо; Рид, В. (июль 1969 г.). «Получение и инфракрасные спектры дифторфосфатов щелочных металлов». Письма по неорганической и ядерной химии . 5 (7): 581–585. дои : 10.1016/0020-1650(69)80034-6 .
- ^ Jump up to: а б с д Вайдлайн, Дж. (апрель 1968 г.). «Внешний вид, свойства и ИК-спектры OTi(O 2 PCl 2 ) 2 , Fe(O 2 PF 2 ) 3 и In(O 2 PF 2 ) 3 » [Описание, свойства и ИК-спектры...]. Журнал неорганической и общей химии . 358 (1–2): 13–20. дои : 10.1002/zaac.19683580103 .
- ^ Jump up to: а б Шихада, Абдель-Фаттах; Мохаммед, Абдулла Т. (1 января 1980 г.). «О реакциях триметилсилилдифторфосфата, триметилсилилдиметилфосфината и 4 SbCl 5 » TiCl дифторфосфорной кислоты с и ангидрида . Журнал естественных исследований Б. 35 (1): 60–63. дои : 10.1515/znb-1980-0114 . S2CID 96302051 .
- ^ Jump up to: а б с Васт, П.; Семмуд, А. (январь 1985 г.). «Получение новых дифтордиоксофосфатов из фосфорилдифторидоксида. Часть V. Реакции на триоксид урана» [Получение новых дифтордиоксофосфатов из фосфорилдифторидоксида. Часть V. Реакции с диоксидом урана. Журнал химии фтора . 27 (1): 47–52. дои : 10.1016/S0022-1139(00)80896-9 .
- ^ Адду, А.; Васт, П.; Легран, П. (январь 1982 г.). «Локальное силовое поле локальной симметрии оксифторсодержащих соединений фосфора (V). I. Les diфтордиоксофосфаты (DFP) алкалины» [Локальное силовое поле симметрии оксифтористых соединений фосфора (V). I. Щелочные дифтордиоксофосфаты (ДФП)]. Spectrochimica Acta Часть A: Молекулярная спектроскопия . 38 (7): 785–790. Бибкод : 1982AcSpA..38..785A . дои : 10.1016/0584-8539(82)80068-8 .
- ^ Jump up to: а б с д и Харрисон, RW; Троттер, Джеймс (1969). «Структура дифторфосфата аммония». Журнал Химического общества A: Неорганическое, физическое, теоретическое : 1783. doi : 10.1039/J19690001783 .
- ^ Jump up to: а б Васт, П.; Семмуд, А. (июнь 1994 г.). «Термическое поведение дифтордиоксофосфата железа». Журнал термического анализа . 41 (6): 1489–1493. дои : 10.1007/bf02549945 . S2CID 95079191 .
- ^ Васт, П.; Семмуд, А.; Палавит, Г. (декабрь 1986 г.). «Приготовление монофтортриоксофосфорной кислоты H 2 PO 3 F из части дифтордиоксофосфорной кислоты HPO 2 F 2 » [Приготовление монофтортриоксофосфорной кислоты H 2 PO 3 F из дифтордиоксофосфорной кислоты HPO 2 F 2 ]. Журнал химии фтора . 34 (2): 229–232. дои : 10.1016/s0022-1139(00)85072-1 .
- ^ Jump up to: а б с Рид, Уильям (сентябрь 1965 г.). Исследования дифторфосфорной кислоты и ее солей щелочных металлов (Диссертация) . Проверено 23 апреля 2023 г.
- ^ Бегум, Афрози; Субраманиан, С.; Саймонс, MCR (1970). «Нестабильные интермедиаты. Часть LXVIII. Электронно-спиновый резонанс радикалов O 3 PF − и O 2 PF 2 ". Журнал Химического общества A: Inorganic, Physical, Theoretical : 1323. doi : 10.1039/J19700001323 .
- ^ Бегум, А.; Субраманиан, С.; Саймонс, MCR (1971). «Нестабильные интермедиаты. Часть LXXXVI. Электронно-спиновым резонансным исследованием воздействия γ-лучей на дифторфосфат калия: радикал PO 2 F?». Журнал Химического общества A: Неорганическое, физическое, теоретическое : 700–702. дои : 10.1039/J19710000700 .
- ^ Jump up to: а б с д и ж г час я Тан, Тиам Хок (август 1970 г.). Получение и свойства дифторфосфатов металлов (Диссертация). Университет Британской Колумбии. Архивировано из оригинала (PDF) 4 марта 2016 г.
- ^ Jump up to: а б с Роски, Герберт В. (июль 1967 г.). «О реакциях с пирофосфорилтетрафторидом». Химические отчеты . 100 (7): 2147–2150. дои : 10.1002/cber.19671000706 .
- ^ Jump up to: а б с Адду, А.; Васт, П. (август 1979 г.). «Получение новых дифтордиоксофосфатов из оксида фосфорилдифторида. Часть I. Реакции на оксиды азота» [Получение новых дифтордиоксофосфатов из оксида фосфорилдифторида. Часть I. Реакции с оксидами азота. Журнал химии фтора . 14 (2): 163–169. дои : 10.1016/S0022-1139(00)82884-5 .
- ^ Jump up to: а б с д Чжан, Вэньяо; Цзинь, Вэньци; Ченг, Мэн; Чжан, Руонань; Ян, Чжихуа; Пан, Шили (2021). «От центросимметричного к нецентросимметричному: влияние катиона на кристаллические структуры и значения двулучепреломления (NH 4 ) n-2 AE(PO 2 F 2 ) n (AE = Mg, Sr и Ba; n = 2, 3 и 4) " . Транзакции Далтона . 50 (29): 10206–10213. дои : 10.1039/D1DT00698C . ISSN 1477-9226 . ПМИД 34231608 . S2CID 235758275 .
- ^ Jump up to: а б с Троттер, Джеймс; Уитлоу, SH (1967). «Строение дифторфосфатов цезия и рубидия». Журнал Химического общества A: Неорганическое, физическое, теоретическое : 1383–1386. дои : 10.1039/J19670001383 .
- ^ Харрисон, RW; Томпсон, Колорадо; Троттер, Джеймс (1966). «Строение дифторфосфата калия». Журнал Химического общества A: Неорганическое, физическое, теоретическое : 1775. doi : 10.1039/J19660001775 .
- ^ Чжан, Вэньяо; Ян, Чжихуа; Пан, Шили (2020). K 4 (PO 2 F 2 ) 2 (S 2 O 7 ): первый фтороксофосфорсульфат со смешанным анионом [S 2 O 7 ]. 2− и [PO 2 F 2 ] − группы» . Транзакции Далтона . 49 (48): 17658–17664. : 10.1039 /D0DT03307C . ISSN 1477-9226 . PMID 33231582. S2CID doi 227157666 .
- ^ Грант, Х.; Йост, К.-Х.; Вольф, Г.-У. (апрель 1969 г.). «Соли галогенфосфорных кислот. V. Представление и строение бис(этилацетат)дифторфосфата кальция Ca[PO 2 F 2 ] 2 · 2 CH 3 COOC 2 H 5 » [Соли галогенфосфорных кислот. V. Описание и строение бис(этилацетат)дифторфосфата кальция...]. Журнал неорганической и общей химии . 365 (5–6): 294–300. дои : 10.1002/zaac.19693650509 .
- ^ Jump up to: а б с д и Браун, SD; Эмме, LM; Гард, Г.Л. (декабрь 1975 г.). «Реакция триоксида хрома и солей оксидов металлов с P 2 O 3 F 4 ». Журнал неорганической и ядерной химии . 37 (12): 2557–2558. дои : 10.1016/0022-1902(75)80891-8 .
- ^ Уиммер, Флорида; Сноу, MR (1978). «Перхлоратные и дифторфосфатные координационные производные карбонила марганца». Австралийский химический журнал . 31 (2): 267. doi : 10.1071/CH9780267 .
- ^ Jump up to: а б с Дав, Майкл Ф.А.; Хибберт, Ричард К.; Логан, Норман (1985). «Дифторфосфатные комплексы хрома, марганца, железа, кобальта и никеля». Журнал Химического общества, Dalton Transactions (4): 707. doi : 10.1039/DT9850000707 .
- ^ Jump up to: а б с д и ж Вейль, Матиас; Фюрст, Маркус (01 июля 2020 г.). «Кристаллическая структура (1,4-дифенил-4 H -1,2,4-триазол-3-ил)фениламин дифторфосфата и обзор дифторфосфат-аниона (PO 2 F 2 − )" . Acta Crystallographica Раздел E . 76 (7): 1003–1006. doi : 10.1107/S2056989020006933 . ISSN 2056-9890 . PMC 7336792 . PMID 32695441 .
- ^ Jump up to: а б Бегли, Майкл Дж.; Дав, Майкл Ф.А.; Хибберт, Ричард К.; Логан, Норман; Нанн, Майкл; Сауэрби, Д. Брайан (1985). «Кристаллические структуры дифторфосфатных комплексов Co(O 2 PF 2 ) 2 · 2MeCN и Cu(O 2 PF 2 ) 2 ». Журнал Химического общества, Dalton Transactions (11): 2433–2436. дои : 10.1039/DT9850002433 .
- ^ Келлер, Сара; Бруннер, Фабиан; Прешимоне, Алессандро; Констебль, Эдвин С.; Хаускрофт, Кэтрин Э. (август 2015 г.). «Частичный гидролиз гексафторидофосфата, приводящий к одномерному координационному полимеру [{Cu (ксантфос) ( μ -PO 2 F 2 )} n ]». Неорганическая химия . 58 : 64–66. дои : 10.1016/j.inoche.2015.06.002 .
- ^ Jump up to: а б с Шайбле, Б.; Вейдлайн, Дж. (февраль 1974 г.). «Исследования диалкилметаллофосфатов и фосфиновых производных элементов алюминия, галлия, индия и таллия. II. Колебательные спектры дифтор- и дихлорфосфатов» [Исследования диалкилметаллофосфатов и фосфитных производных элементов алюминия, галлия, индия и таллия . II. Колебательная спектроскопия дифтор- и дихлорфосфатов. Журнал неорганической и общей химии . 403 (3): 301–309. дои : 10.1002/zaac.19744030309 .
- ^ Jump up to: а б Альбрехт, Маркус; Хюблер, Клаус; Каим, Вольфганг (май 2000 г.). «Синтез, строение и свойства комплексов [Ag(N∧S) n ](X), N∧S = 1-Метил-2-(алкилтиометил)-1 H -бензимидазолов, X = PF 6 ( n = 2 ) или PO 2 F 2 ( n = 1)». Журнал неорганической и общей химии . 626 (5): 1033–1037. doi : 10.1002/(SICI)1521-3749(200005)626:5<1033::AID-ZAAC1033>3.0.CO;2-A .
- ^ Фесслер, Т. У.; Хюбенер, Р.; Стреле, Дж. (сентябрь 1997 г.). «Синтез комплексов меди и серебра с пентадентатными N , S и гексадентатными N , O хелатными лигандами - характеристика и кристаллические структуры {Cu 2 [C 6 H 4 (SO 2 )NC(O)] 2 (C 5 H 5 N)» 4 }, {Cu 2 [C 5 H 3 N(CHNC 6 H 4 SCH 3 ) 2 ] 2 }(PF 6 ) 2 и {Ag[C H 3 N (CHNC 6 H 4 SCH 3 ) 2 ]}PO 2 F 2 " [Синтез комплексов меди и серебра с пентадентатами N , S- и гексадентатами N , O- 5 хелатные лиганды – характеристика и кристаллические структуры...]. Журнал неорганической и общей химии . 623 (9): 1367–1374. дои : 10.1002/zaac.19976230908 .
- ^ Jump up to: а б с Крюгер, Н.; Денике, К.; Шихада, А.-Ф. (февраль 1978 г.). «Дифторфосфаты олова(IV) и сурьмы(V)». Журнал неорганической и общей химии . 438 (1): 169–175. дои : 10.1002/zaac.19784380118 .
- ^ Jump up to: а б Хорн, Э.; Сноу, MR (1980). «Перхлоратные и дифторфосфатные координационные производные карбонила рения». Австралийский химический журнал . 33 (11): 2369. doi : 10.1071/CH9802369 .
- ^ ЛеБлан, диджей; Бриттен, Дж. Ф.; Лок, CJL (15 сентября 1997 г.). «Дифторфосфат бис(трифенилфосфинсульфид-)золота(I)(V)» . Acta Crystallographica Раздел C. 53 (9): 1204–1206. дои : 10.1107/S0108270197005209 .
- ^ Jump up to: а б Адду, А.; Васт, П. (июль 1980 г.). «Получение новых дифтордиоксофосфатов из оксида фосфорилдифторида. Часть II. Реакции с иодовой и периодической кислотами» [Получение новых дифтордиоксофосфатов из оксида фосфорилдифторида. Часть II. Реакции с йодовой и периодной кислотами. Журнал химии фтора . 16 (1): 89–96. дои : 10.1016/s0022-1139(00)85151-9 .
- ^ Jump up to: а б Айзенберг, Макс; Демарто, Дэррил Д. (август 1972 г.). «Дифторфосфаты ксенона (II). Препараты, свойства и доказательства существования свободного радикала дифторфосфата». Неорганическая химия . 11 (8): 1901–1904. дои : 10.1021/ic50114a033 .
- ^ Мацумото, Кадзухико; Окава, Такеши; Хагивара, Рика (2012). «Фазовый переход дифторфосфата и тетрафторбората тетраэтиламмония в кристалл-пластик». Химические письма . 41 (4): 394–396. дои : 10.1246/кл.2012.394 . HDL : 2433/259816 . S2CID 97011854 .
- ^ Jump up to: а б с д Мацумото, Кадзухико; Хагивара, Рика (3 августа 2009 г.). «Новая серия ионных жидкостей на основе дифторфосфат-аниона». Неорганическая химия . 48 (15): 7350–7358. дои : 10.1021/ic9008009 . ПМИД 19580312 .
- ^ Эрикс, К.; Ван, Х.Х.; Рид, ЧП; Бено, Массачусетс; Аппельман, Э.Х.; Уильямс, Дж. М. (15 февраля 1985 г.). «Ди(3,3',4,4'-тетраметил-2,2',5,5'-тетраселенафульвалениум)дифторфосфат, (C 10 H 12 Se 4 ) 2 PO 2 F 2 , при 293 и 125 К» . Acta Crystallographica Раздел C. 41 (2): 257–260. дои : 10.1107/S0108270185003535 .
- ^ Ланге, Вилли; Ливингстон, Ральф (март 1950 г.). «Исследование фторофосфорных кислот и их производных. XIV. Получение безводной дифторфосфорной кислоты». Журнал Американского химического общества . 72 (3): 1280–1281. дои : 10.1021/ja01159a057 .
- ^ Семмуд, А.; Бенгалем, А.; Адду, А. (январь 1990 г.). «Дифторфосфорная кислота: новый препарат» [Дифторфосфорная кислота: новый препарат]. Журнал химии фтора . 46 (1): 1–6. дои : 10.1016/S0022-1139(00)81555-9 .
- ^ Васт, П.; Семмуд, А.; Адду, А.; Палавит, Г. (март 1985 г.). «Новый метод получения дифторфосфорной кислоты». Журнал химии фтора . 27 (3): 319–325. дои : 10.1016/S0022-1139(00)81312-3 .
- ^ Цзэн, Сяоцин; Геркен, Майкл; Беккерс, Хельмут; Виллнер, Хельге (17 июня 2010 г.). "ХимИнформ Реферат: Спектроскопические и структурные исследования дифторфосфорилазида F 2 P(O)N 3 , дифторфосфорилизоцианата F 2 P(O)NCO и ангидрида дифторфосфорной кислоты F 2 (O)POP(O)F 2 ". ХимИнформ . 41 (28): нет. дои : 10.1002/chin.201028001 . Первоначально в Inorg. хим. 49 (2010) 6, 3002–3010
- ^ Робинсон, Э.А. (сентябрь 1962 г.). «Получение и спектр комбинационного рассеяния дифосфорилтетрафторида: сравнение со спектром дифосфорилтетрахлорида» . Канадский химический журнал . 40 (9): 1725–1729. дои : 10.1139/v62-264 .
- ^ Денике, Курт; Шихада, Абдель-Фаттах (1976). «Структурные и связующие аспекты химии фосфора - неорганические производные оксогалогенфосфорных кислот». Электроны в структуре и связи кислород- и серосодержащих лигандов . Структура и связь. 28 : 51–82. дои : 10.1007/3-540-07753-7_2 . ISBN 978-3-540-07753-4 .
- ^ Кристе, КО; ГНАНН, Р.; ВАГНЕР, Род-Айленд; УИЛСОН, WW (4 августа 2010 г.). «Химинформ» Реферат: (PO 2 F 2 ×2 AsF 5 ) − Анион, пример стабильного кислород-мостикового донорно-акцепторного полиядерного аниона 1:2». ChemInform . 28 (2): № doi : 10.1002/chin.199702025 . Полная статья в Eur. J. Solid State Inorg. Chem. 33 (1996) 9, 865–877.
- ^ Ола, Джордж; Освальд, Алексиус; Кун, Стефан (4 августа 1959 г.). «Исследования фосфорорганических соединений. III. Представление об алкиламидах дифторфосфорной кислоты и дифтортиофосфорной кислоты» [Исследования фосфорорганических соединений. III. описание дифторфосфорных и дифтортиофосфорных алкиламидов. «Анналы химии» Юстуса Либиха . 625 (1): 88–91. дои : 10.1002/jlac.19596250111 .

