HPG80
Тема этой статьи может не соответствовать рекомендациям Википедии по известности неологизмов . ( август 2020 г. ) |
hPG80 относится к внеклеточной и онкогенной версии прогастрина . Это название впервые появилось в научной публикации в январе 2020 года. [ 1 ] До этой даты в научных публикациях упоминался только « прогастрин », без обязательного точного указания, является ли он внутриклеточным (в контексте пищеварения ) или внеклеточным (циркулирующим и обнаруживаемым в плазме) в патологических условиях опухоли .
Для большей ясности в оставшейся части статьи для обозначения внеклеточного прогастрина используется исключительно название hPG80.
Связь между этим белком и раком известна уже более 30 лет. hPG80 участвует в большинстве биологических функций, обеспечивающих существование рака . [ 2 ] Пептид . секретируется опухолевыми клетками и обнаруживается в плазме больных раком на ранних стадиях [ 1 ] Тогда он выполняет функции, независимые от пищеварения и полностью отличающиеся от прогастрина, а также его единственную роль внутриклеточного предшественника гастрина .
Терминология
[ редактировать ]В названии hPG80 буква «h» описывает человеческий вид: человек; «PG» — это общепринятое название белка прогастрина , а число 80 соответствует размеру белка: 80 аминокислот .
Таким образом, название hPG80 было предложено в публикации, ставшей результатом работы профессора Бенуа Ю под руководством Доминика Жубера и Александра Приера, чтобы устранить неясности между внутриклеточной версией белка (в функции пищеварения) и его внеклеточной версией. белок (в случае онкологических больных), который, несмотря на свое название, больше не является предшественником гастрина . [ 1 ]
Более того, существование фонетически идентичного пептида, высвобождающего прогастрин пептида (proGRP), усилило возможную путаницу вокруг названия прогастрин и необходимость специального названия.
Хронология научных открытий по hPG80
[ редактировать ]1990: hPG80 секретируется клетками рака поджелудочной железы . [ 3 ]
1993–1994: hPG80 секретируется яичников и клетками рака толстой кишки . [ 4 ] [ 5 ]
1996–1997: hPG80 идентифицирован как необходимый для пролиферации и онкогенеза клеток рака толстой кишки . [ 6 ]
2000–2001: Ген GAST является мишенью пути β-катенин/Tcf4. [ 7 ] Присутствие hPG80 продемонстрировано в плазме больных колоректальным раком . [ 8 ]
2003: hPG80 участвует в регуляции диссоциации адгезионных и плотных соединений. [ 2 ] Src опосредует влияние hPG80 на рост клеток. [ 9 ]
2005: Пути Ras и β-катенин/Tcf4 вызывают синергетическую активацию гена GAST , способствуя возможному неопластическому прогрессированию. [ 10 ]
2007: Ингибирование экспрессии hPG80 ингибирует путь Wnt /β-катенин, вызывая снижение роста и дифференцировки опухоли на моделях опухолей кишечника . [ 11 ]
2012: Мутация гена p53 увеличивает hPG80-зависимую пролиферацию толстой кишки и образование рака. [ 12 ]
2014: hPG80 идентифицирован как новый проангиогенный фактор. [ 13 ]
2016: Аутокринная секреция hPG80 способствует выживанию и самообновлению стволовых клеток при раке толстой кишки. [ 14 ]
2017: Использование антител, направленных против hPG80 для воздействия на путь Wnt и раковые стволовые клетки, представляет собой новый терапевтический подход к лечению рака. [ 15 ]
2020: hPG80 обнаружен в плазме пациентов с 11 различными типами рака. Была продемонстрирована связь между продольными изменениями уровней hPG80 и эффективностью противоракового лечения. [ 1 ]
Роль в раке
[ редактировать ]С помощью различных механизмов, которые имеют решающее значение для роста и выживания опухоли, исследования продемонстрировали важную роль, которую hPG80 играет в зарождении и прогрессировании опухоли, обычно используя колоректальный рак в качестве модели. Бардрам был первым, кто выдвинул гипотезу о наличии hPG80 на ранних стадиях заболевания. [ 3 ] Он оценил наличие hPG80 и продуктов его созревания в сыворотке пациентов с синдромом Золлингера-Эллисона . Эта работа показала, что измерение hPG80 более точно отражает опухоль, чем обычное измерение амида гастрина. Действительно, hPG80 более чем в 700 раз более распространен, чем амид гастрина, в колоректальных опухолях. [ 16 ]
В начале 90-х годов было показано, что hPG80 не полностью созревает в клеточных линиях рака толстой кишки человека и, что более важно, секретируется клетками in vitro. [ 5 ] Эти наблюдения привели к изучению аутокринной и паракринной функции hPG80 в опухолевых клетках. [ 17 ] В целом было показано, что hPG80 не созревает должным образом в раковых клетках, особенно при колоректальном раке, поскольку ферменты созревания либо отсутствуют, либо нефункциональны. [ 4 ] [ 5 ] [ 16 ] [ 18 ] [ 19 ] [ 20 ] [ 21 ]
В 1996 году было продемонстрировано, что экспрессия гена GAST необходима для онкогенеза клеток рака толстой кишки человека. [ 6 ] От 60 до 80% случаев рака толстой кишки экспрессируют ген GAST .
Изменение гена GAST или нейтрализация hPG80 посредством различных экспериментальных конфигураций приводило к уменьшению количества опухолей у мышей с опухолевой предрасположенностью (мутация гена APC). И наоборот, значительное увеличение образования опухолей наблюдалось у мышей со сверхэкспрессией прогастрина, обработанных азоксиметаном (АОМ), химическим канцерогеном. [ 7 ] [ 11 ] [ 15 ] [ 22 ] [ 23 ]
Проангиогенный фактор
[ редактировать ]Когда опухоль развивается, ее потребность в кислороде и питательных веществах приводит к образованию новых кровеносных сосудов. Этот процесс называется неоангиогенезом . В 2015 году было показано, что hPG80 является проангиогенным фактором. [ 13 ] Действительно, hPG80 стимулирует пролиферацию и миграцию эндотелиальных клеток и увеличивает их способность образовывать капилляроподобные структуры in vitro. Блокирование выработки hPG80 (с shRNA ) в клетках ксенотрансплантата опухоли у голых мышей снижает неоваскуляризацию .
Антиапоптотический фактор
[ редактировать ]Обработка эпителиальных клеток кишечника hPG80 приводит к значительной потере активации каспазы 9 и каспазы 3 и уменьшению фрагментации ДНК. Следовательно, влияние hPG80 на выживаемость клеток является результатом как увеличения пролиферации, так и снижения апоптоза . [ 24 ]
Регуляция клеточных соединений
[ редактировать ]Миграция клеток основана на их способности становиться независимыми от соседних клеток. Целостность межклеточных контактов необходима для регуляции поглощения электролитов, а также для предотвращения метастазирования опухоли . В 2003 году было продемонстрировано, что блокирование секреции hPG80 с помощью антисмысловой конструкции, направленной против мРНК прогастрина, позволяет восстановить мембранную локализацию белков, составляющих плотные и адгезионные соединения, в клеточной линии колоректальной карциномы человека DLD-1. [ 2 ] Таким образом, hPG80 играет роль в целостности клеточных контактов.
Роль в раковых стволовых клетках
[ редактировать ]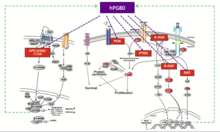
Раковые стволовые клетки (РСК) составляют небольшую часть опухоли, обычно от 1 до 5%. Но они необходимы для выживания опухоли, поскольку действуют как «реактор». Жиро и др. продемонстрировали важную роль, которую играет hPG80 в РСК. [ 14 ] Эти авторы показали, что экспрессия hPG80 сильно увеличивается в колоректального рака, клетках культивируемых в условиях, когда CSC обогащены. Затем они показали, что hPG80 способен регулировать частоту ОСК (выживание и самообновление) in vitro и in vivo. Впоследствии Приер и др. продемонстрировали, что когда нейтрализующее антитело добавляется к клеточной культуре или когда мышам с имплантированными клетками колоректального рака человека обрабатывают такое антитело in vivo, частота РСК снижается в тех же пропорциях. [ 15 ] Эти две научные статьи ясно показывают, что hPG80 является фактором выживания РСК. Более того, ингибирование hPG80 будет вызывать дифференцировку РСК, открывая возможность дифференцировочной терапии, а не классической антипролиферативной терапии. Его основная функция — помочь РСК выжить и распространиться с образованием метастазов , что, вероятно, объясняет, почему этот пептид можно рассматривать как потенциальный прогностический маркер наличия метастазов в печени при колоректальном раке. [ 25 ]
hPG80 и онкогенные сигнальные пути
[ редактировать ]Wnt и K-Ras
[ редактировать ]Первым событием, приводящим к раку толстой кишки, в 80–90% случаев является конститутивная активация онкогенного пути Wnt/β-катенин, индуцированная мутациями в гене, кодирующем APC ( аденоматозный полипоз coli ), или гене, кодирующем β-катенин. Индукция мутаций в нормальных стволовых клетках кишечника достаточна для запуска онкогенеза . [ 26 ] Ген GAST , кодирующий hPG80, активируется онкогенным путем Wnt . Это нижестоящая мишень сигнального пути β-катенин/Tcf-4. [ 7 ]
Демонстрация связи между hPG80 и онкогенным путем была описана для K-Ras . Клеточные линии и ткани рака толстой кишки с мутациями K-Ras имели значительно более высокие уровни мРНК GAST , чем K-Ras дикого типа. [ 27 ] Эффекты K-Ras на экспрессию GAST обусловлены активацией пути передачи сигнала Raf-MEK-ERK, финальным этапом которой является активация промотора гена GAST .
Поскольку и K-Ras, и путь Wnt индуцируют экспрессию GAST , была исследована гипотеза о возможном сотрудничестве между этими двумя путями для регуляции экспрессии hPG80. [ 10 ] Чакадар и др. обнаружили значительную синергетическую стимуляцию промотора гена GAST (в 25–40 раз) за счет комбинации онкогенного β-катенина и сверхэкспрессии K-Ras. Также было показано, что активация промотора гена GAST зависит от других сигнальных сигналов: усиливается или подавляется совместной экспрессией SMAD4 дикого типа или доминантно-негативным мутантом SMAD4 соответственно и прекращается ингибированием PI3K. Таким образом, конститутивная активация пути Wnt, который считается началом онкогенеза в толстой кишке, и онкогена K-Ras, присутствующего в 50% колоректальных опухолей человека, синергически стимулируют выработку hPG80, промотора онкогенеза. Онкогенез, индуцированный активацией пути Wnt, частично зависит от hPG80.
СРЦ, ПИ3К/Акт, НФ-кБ и Як/Стат
[ редактировать ]Онкоген pp60 (c-Src) активируется в клетках рака толстой кишки и приводит к увеличению количества hPG80. [ 9 ] Это означает, что продукция hPG80, которая происходит во время раннего онкогенеза, может играть роль в этой активации, которая известна как раннее событие онкогенеза толстой кишки. [ 11 ] [ 28 ] [ 29 ] Путь PI3K/Akt, который особенно участвует в пролиферации, также активируется hPG80. NF-kappaB — еще один важный посредник передачи сигналов, регулируемый hPG80. [ 11 ] [ 30 ] Его участие в механизмах, ответственных за антиапоптотический эффект hPG80, было продемонстрировано на клетках рака поджелудочной железы in vitro и in vivo у мышей, сверхэкспрессирующих ген GAST . [ 31 ] [ 32 ] Увеличение JAK2 (Janus-активируемой киназы 2), STAT3 и киназ, регулируемое внеклеточными сигналами, также наблюдалось в слизистой оболочке толстой кишки мышей hGAS. [ 30 ]
ВЫРЕЗКА
[ редактировать ]Было показано, что опухолевые клетки толстой кишки, не экспрессирующие hPG80, возвращаются в «нормальное» состояние. Это связано с тем, что при инактивации пути Wnt ген JAG1 репрессируется, индуцируя инактивацию пути Notch, который играет важную роль в приобретении дифференцированного клеточного фенотипа. [ 33 ]
р-53
[ редактировать ]В 2012 году было показано, что мутация гена P53 увеличивает hPG80-зависимую пролиферацию клеток толстой кишки и образование рака толстой кишки у мышей. [ 12 ]
рецептор hPG80
[ редактировать ]Идентификация рецептора hPG80 стала предметом нескольких исследований в последние годы. Однако идентичность рецептора hPG80 остается реальной проблемой в научном сообществе. Рецептор может активировать ряд сигнальных путей прямо или косвенно, что довольно необычно для рецептора. Это может указывать на особенность данного рецептора и на то, почему его сложно идентифицировать. Неидентифицированный рецептор hPG80 передает сигнал прогастрина через различные внутриклеточные промежуточные соединения, которые, как известно, участвуют в онкогенезе.
Сайты связывания с высоким сродством были впервые описаны в эпителиальных клетках кишечника с использованием рекомбинантного человеческого прогастрина-йода. [ 34 ] Сродство находилось в диапазоне 0,5-1 нМ, что соответствует рецептору. Когда связывание биотинилированного прогастрина оценивали с помощью проточной цитометрии, также было обнаружено сильное и специфическое связывание прогастрина с определенными клеточными линиями (IEC-6, IEC-18, HT-29, COLO320). [ 35 ] Специфичность связывания была подтверждена конкуренцией с холодным немеченым hPG80, но не с гастрином, содержащим карбокси-концевой глицин, или амидированным гастрином-17. На связывание не влияло присутствие классического рецептора CCK-2.
Из этих двух исследований ясно, что существует сайт/рецептор связывания hPG80, который отличается от связывания с амидированным гастрином-17 и с гастрином-17 с карбокси-концевым глицином (G17-Gly). Последовательность hPG80, взаимодействующая с этим рецептором, вероятно, расположена в последних 26 аминокислотных остатках карбокси-конца hPG80, которых, как было показано, достаточно для его функции. [ 36 ] Однако эта предполагаемая идентичность рецептора неизвестна.
Одним из кандидатов является аннексин А2, который, как установлено, способен связывать прогастрин и производные пептиды. [ 37 ] Аннексин А2 является частичным медиатором эффекта прогастрина/гастринов. В частности, аннексин А2 опосредует активацию NF-каппаВ и β-катенина в ответ на прогастрин у мышей и HEK-293 . клеток [ 38 ] Кроме того, аннексин А2 может участвовать в прогастрин-зависимом эндоцитозе клатрина. Однако сродство прогастрина к аннексину А2 не соответствует ожидаемому для конкретного рецептора. И хотя аннексин А2 играет роль в функциях прогастрина, он не выполняет функцию рецептора.
Другим кандидатом является рецептор 56, связанный с G-белком (GPCR56), экспрессирующийся как на стволовых клетках толстой кишки, так и на раковых клетках. [ 39 ] В то время как человеческий рекомбинантный hPG80 способствует росту in vitro и выживанию органоидов толстой кишки диких мышей , органоиды мышей с дефицитом GPCR56 (GPCR56-/-) устойчивы к hPG80. Однако, хотя было показано, что hPG80 связывается с клетками, экспрессирующими GPCR56, авторы не предоставили прямых доказательств того, что hPG80 связан с самим GPCR56. GPCR56 является хорошим кандидатом, но доказательства того, что это рецептор hPG80, до сих пор не установлены.
Клинические применения
[ редактировать ]hPG80 посредством различных механизмов можно рассматривать как основной стимулятор онкогенеза. hPG80 обнаруживается в плазме онкологических больных, и его нейтрализация вызывает реверсию опухоли.
Скрининг
[ редактировать ]Универсальный биомаркер
[ редактировать ]Колоректальный рак — не единственный тип рака, экспрессирующий hPG80. Его экспрессия также была продемонстрирована при раке яичников , опухолях печени и опухолях поджелудочной железы . [ 4 ] [ 40 ] [ 41 ] Таким образом, некоторые типы опухолей экспрессируют несозревший пептид. hPG80 можно обнаружить и количественно оценить в крови онкологических больных. Впервые при колоректальном раке было продемонстрировано увеличение уровней hPG80 и неамидного гастрина в плазме у этих пациентов по сравнению с контрольной группой (здоровые люди). [ 8 ] Кроме того, повышение hPG80 наблюдалось у пациентов с аденоматозными полипами. [ 15 ] Таким образом, hPG80 экспрессируется опухолью на всех стадиях, от ранних стадий до метастазов.
Обнаружение множественного рака
[ редактировать ]
hPG80 обнаруживается в различных типах опухолей и секретируется in vitro некоторыми раковыми клетками. Исследование показало его присутствие в крови пациентов с 11 различными видами рака: раком молочной железы , колоректальным раком , раком желудка/ пищевода , раком почки , раком печени , немелкоклеточным раком легких , меланомой кожи , раком яичников , раком поджелудочной железы. , рак предстательной железы и рак матки (эндометрия/цервикального канала). [ 1 ]
hPG80 при наблюдении за остаточными заболеваниями и ответе на терапию.
[ редактировать ]До- и послеоперационные анализы hPG80 в плазме у пациентов с колоректальным раком показывают, что присутствие hPG80 отражает образование опухоли. [ 42 ]
Было замечено, что концентрации hPG80 повышаются у пациентов с риском развития колоректальной карциномы . [ 43 ] Кроме того, увеличение hPG80 наблюдалось в гиперпластических полипах , перешедших в рак. [ 44 ] [ 45 ]
hPG80 также может быть биомаркером метастазирования в печень при колоректальном раке. [ 25 ]
Кроме того, Вы и др. наблюдали снижение уровня hPG80 после операции в группе пациентов с раком желудочно-кишечного тракта с поражением брюшины, получавших послеоперационную химиотерапию и циторедуктивную хирургию. [ 1 ]
Кроме того, более раннее выявление небольших поражений и мониторинг рецидивов можно улучшить путем измерения уровней hPG80 в качестве дополнительного биомаркера крови в когорте пациентов с гепатоцеллюлярной карциномой, получающих местную или системную терапию (рис. 3). [ 1 ] Измеренные уровни hPG80 актуальны для пациентов, у которых уровень альфа-фетопротеина (АФП) ниже 20 нг/мл, что является пороговым значением, установленным в клинической практике. [ 46 ] В зависимости от тактики лечения, пациенты в стадии ремиссии имеют более низкие уровни hPG80, чем те, у кого рак все еще активен.
Цель борьбы с раком
[ редактировать ]Антителовая терапия
[ редактировать ]На сегодняшний день ни один препарат не способен воздействовать на РСК. Гуманизированные антитела против hPG80, используемые отдельно или в сочетании с химиотерапией , представляются многообещающим подходом. [ 15 ] Использование антител против hPG80 также обсуждалось как потенциальное лечение пациентов с колоректальным раком с мутацией гена KRAS . Было показано нацеливание на hPG80 с помощью гуманизированного антитела против hPG80:
1. снижение способности к самообновлению РСК различного происхождения;
2. продление химиочувствительности in vitro и in vivo и отсроченный рецидив после обработки ксенотрансплантированных клеток мыши T84;
3. снижение опухолевой нагрузки и усиление дифференцировки клеток в оставшихся опухолях у трансгенных мышей, у которых развивалась Wnt-индуцированная неоплазия кишечника.
Недавно это было подтверждено в отношении рака яичников, молочной железы, пищевода, печени и желудка, что делает это терапевтическое антитело потенциальным лекарственным средством от мультирака. [ 1 ]
Сенсибилизация к лучевой терапии
[ редактировать ]Было показано, что hPG80 является радиорезистентным фактором, который можно нацелить на сенсибилизацию радиационно-устойчивого рака прямой кишки. [ 47 ] Снижение экспрессии hPG80 увеличивает чувствительность к облучению в колоректального рака, клеточных линиях что приводит к усилению радиационно-индуцированного повреждения ДНК и апоптоза . В той же линии нацеливание на hPG80 также приводит к ингибированию радиационно-индуцированных путей выживания, Akt и ERK.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д и ж г час Ты, Бенуа; Мерсье, Фредерик; Ассенат, Эрик; Ланглуа-Жак, Кэрол; Глеэн, Оливье; Суле, Жюльен; Пайен, Леа; Кепенекян, Ваан; Дюпюи, Мари; Белуэн, Фанни; Моренси, Эрик (январь 2020 г.). «Онкогенный и поддающийся лекарственному воздействию hPG80 (прогастрин) сверхэкспрессируется при многих видах рака и обнаруживается в крови пациентов» . Электронная биомедицина . 51 : 102574. doi : 10.1016/j.ebiom.2019.11.035 . ISSN 2352-3964 . ПМЦ 6938867 . ПМИД 31877416 .
- ^ Перейти обратно: а б с Олланд, Ф. (1 апреля 2003 г.). «Слипчивые соединения и плотные соединения регулируются различными путями с помощью прогастрина в эпителиальных клетках» . Журнал клеточной науки . 116 (7): 1187–1197. дои : 10.1242/jcs.00321 . ПМИД 12615962 . S2CID 21931954 .
- ^ Перейти обратно: а б Бардрам, Л.; Хилстед, Л.; Рефельд, Дж. Ф. (1 января 1990 г.). «Экспрессия прогастрина в поджелудочной железе млекопитающих» . Труды Национальной академии наук . 87 (1): 298–302. Бибкод : 1990PNAS...87..298B . дои : 10.1073/pnas.87.1.298 . ISSN 0027-8424 . ПМК 53250 . ПМИД 2296587 .
- ^ Перейти обратно: а б с ван Солинге, WW; Одум, Л.; Рефельд, Дж. Ф. (15 апреля 1993 г.). «Рак яичников экспрессирует и перерабатывает прогастрин». Исследования рака . 53 (8): 1823–1828. ISSN 0008-5472 . ПМИД 8467501 .
- ^ Перейти обратно: а б с Сингх, П.; Сюй, З.; Дай, Б.; Раджараман, С.; Рубин, Н.; Дхрува, Б. (1 марта 1994 г.). «Неполная обработка прогастрина, экспрессируемого клетками рака толстой кишки человека: роль некарбоксиамидированных гастринов». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени . 266 (3): G459–G468. дои : 10.1152/ajpgi.1994.266.3.g459 . ISSN 0193-1857 . ПМИД 8166285 .
- ^ Перейти обратно: а б Сингх, П.; Оулия, А.; Варрон, А.; Дай, Б.; Раджараман, С.; Вуд, Т. (15 сентября 1996 г.). «Экспрессия гена гастрина необходима для пролиферации и туморогенности клеток рака толстой кишки человека». Исследования рака . 56 (18): 4111–4115. ISSN 0008-5472 . ПМИД 8797575 .
- ^ Перейти обратно: а б с Кох, Теодор Дж; Чен, Дуань (сентябрь 2000 г.). «Гастрин как фактор роста желудочно-кишечного тракта». Регуляторные пептиды . 93 (1–3): 37–44. дои : 10.1016/s0167-0115(00)00176-2 . ISSN 0167-0115 . ПМИД 11033051 . S2CID 26008211 .
- ^ Перейти обратно: а б Сиддхешвар, РК (1 января 2001 г.). «Уровни прогастрина в плазме, но не амидированного гастрина или глицин-продленного гастрина, повышены у пациентов с колоректальной карциномой» . Гут . 48 (1): 47–52. дои : 10.1136/gut.48.1.47 . ISSN 0017-5749 . ПМЦ 1728168 . ПМИД 11115822 .
- ^ Перейти обратно: а б Браун, Д.; Яллампалли, У.; Оулия, А.; Сингх, П. (1 января 2003 г.). «Киназа pp60c-Src опосредует ростовые эффекты полноразмерного пептида-предшественника прогастрина 1–80 на эпителиальные клетки кишечника крысы in vitro» . Эндокринология . 144 (1): 201–211. дои : 10.1210/en.2002-220501 . ISSN 0013-7227 . ПМИД 12488346 .
- ^ Перейти обратно: а б Чакладар, Абхиджит; Дубейковский, Александр; Войтукевич, Линдси Дж.; Пратап, Джитеш; Лей, Ши; Ван, Тимоти К. (октябрь 2005 г.). «Синергетическая активация промотора мышиного гастрина онкогенным Ras и β-катенином включает вовлечение SMAD». Связь с биохимическими и биофизическими исследованиями . 336 (1): 190–196. дои : 10.1016/j.bbrc.2005.08.061 . ISSN 0006-291X . ПМИД 16139800 .
- ^ Перейти обратно: а б с д Паннекен, Джули; Делоне, Натали; Бухерт, Майкл; Сюррел, Фанни; Бурго, Жан-Франсуа; Райан, Джоанн; Буаро, Стефани; Коэльо, Джессика; Пелегрен, Андре; Сингх, Помила; Шалкс, Артур (ноябрь 2007 г.). «Ингибирование β-катенина/Tcf-4 после воздействия прогастрина снижает рост и стимулирует дифференцировку опухолей кишечника» . Гастроэнтерология . 133 (5): 1554–1568. дои : 10.1053/j.gastro.2007.08.023 . ISSN 0016-5085 . ПМИД 17920061 .
- ^ Перейти обратно: а б Раманатан, Винешваран; Цзинь, Гуанчунь; Вестфален, Кристоф Бенедикт; Уилан, Эшли; Дубейковский, Александр; Такаиси, Сигео; Ван, Тимоти К. (5 апреля 2012 г.). «Мутация гена P53 увеличивает прогастрин-зависимую пролиферацию толстой кишки и образование рака толстой кишки у мышей» . Исследование рака . 30 (4): 275–286. дои : 10.3109/07357907.2012.657814 . ISSN 0735-7907 . ПМК 3697930 . ПМИД 22480191 .
- ^ Перейти обратно: а б Наджиб, С; Ковальски-Човель, А; С, С; Рош, С; Коэн-Джонатан-Мойал, Э; Сева, Ц (11 августа 2014 г.). «Прогастрин — новый проангиогенный фактор при колоректальном раке» . Онкоген . 34 (24): 3120–3130. дои : 10.1038/onc.2014.255 . ISSN 0950-9232 . ПМИД 25109333 . S2CID 20661274 .
- ^ Перейти обратно: а б Жиро, Ж.; Фаилла, LM; Паскусси, Ж.-М.; Лагерквист, Э.Л.; Олье, Дж.; Финетти, П.; Бертуччи, Ф.; Да, К.; Гасми, И.; Бурго, Ж.-Ф.; Прюдом, М. (04 мая 2016 г.). «Аутокринная секреция прогастрина способствует выживанию и самообновлению стволовых клеток рака толстой кишки» . Исследования рака . 76 (12): 3618–3628. дои : 10.1158/0008-5472.can-15-1497 . ISSN 0008-5472 . ПМИД 27197176 .
- ^ Перейти обратно: а б с д и Приер, Александр; Каппеллини, Моника; Хабиф, Гийом; Лефранк, Мари-Поль; Мазар, Тибо; Моренси, Эрик; Паскусси, Жан-Марк; Фласельер, Мод; Каузак, Натали; Вир, Беранжер; Дубук, Бенджамин (9 июня 2017 г.). «Нацеливание на путь Wnt и раковые стволовые клетки с помощью гуманизированных антител против прогастрина как потенциальное лечение колоректального рака с мутацией K-RAS» . Клинические исследования рака . 23 (17): 5267–5280. дои : 10.1158/1078-0432.ccr-17-0533 . ISSN 1078-0432 . ПМИД 28600477 . S2CID 22085894 .
- ^ Перейти обратно: а б Отделение гастроэнтерологии, отделение внутренней медицины, Медицинский центр штата Вирджиния, Мичиганский университет, и Мичиганский центр исследования желудочно-кишечных пептидов, Анн-Арбор, Мичиган, 48109, США Отделение гастроэнтерологии, отделение внутренней медицины, Медицинский центр штата Вирджиния, Мичиганский университет, и Мичиганский исследовательский центр желудочно-кишечных пептидов, Анн-Арбор, Мичиган 48109, США Отделение гастроэнтерологии, отделение Педиатрия, Медицинский центр штата Вирджиния и Мичиганский университет, а также Мичиганский исследовательский центр желудочно-кишечных пептидов, Анн-Арбор, Мичиган 48109, Отделение гастроэнтерологии США, отделение внутренней медицины, Медицинский центр штата Вирджиния и Мичиганский университет, и Мичиганский исследовательский центр желудочно-кишечных пептидов, Анн-Арбор, Мичиган 48109, США Кочман, Майкл Ли ДельВалле, Джон Дикинсон, Крис Джон Боланд, К. Ричард (10 апреля 2006 г.). Посттрансляционная обработка гастрина в неопластических тканях толстой кишки человека . Эльзевир. OCLC 894059948 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка ) - ^ Ван Солинг, Воутер В.; Нильсен, Финн К.; Фриис-Хансен, Леннарт; Фолкмер, Урсула Г.; Рефельд, Йенс Ф. (апрель 1993 г.). «Экспрессия, но неполное созревание прогастрина при колоректальном раке» . Гастроэнтерология . 104 (4): 1099–1107. дои : 10.1016/0016-5085(93)90279-л . ISSN 0016-5085 . ПМИД 8462798 .
- ^ Чиккотосто, Джузеппе Д.; Маклиш, Эндрю; Харди, Кеннет Дж.; Шалкс, Артур (октябрь 1995 г.). «Экспрессия, обработка и секреция гастрина у пациентов с колоректальной карциномой» . Гастроэнтерология . 109 (4): 1142–1153. дои : 10.1016/0016-5085(95)90572-3 . ISSN 0016-5085 . ПМИД 7557079 .
- ^ «Экспрессия гена гастрина при раке поджелудочной железы и толстой кишки человека». Гастроэнтерология . 108 (4): А1246. Апрель 1995 г. doi : 10.1016/0016-5085(95)29280-2 . ISSN 0016-5085 .
- ^ Имдал, А.; Эггштейн, С.; Болдуин, Дж.С.; Фартманн, Э.Х. (апрель 1995 г.). «Экспрессия гастрина, гастрина/CCK-B- и гастрина/CCK-C. Рецепторы при колоректальном раке человека» . Гастроэнтерология . 108 (4): А484. дои : 10.1016/0016-5085(95)26249-0 . ISSN 0016-5085 .
- ^ Немет, Дж; Тейлор, Б; Пауэлс, С; Варрон, А; Докрей, Дж.Дж. (1 января 1993 г.). «Идентификация пептидов, производных прогастрина, в экстрактах колоректальной карциномы» . Гут . 34 (1): 90–95. дои : 10.1136/gut.34.1.90 . ISSN 0017-5749 . ПМК 1374107 . ПМИД 8432459 .
- ^ Кобб, Стефани; Вуд, Томас; Сеси, Джеффри; Варрон, Андреа; Веласко, Марко; Сингх, Помила (15 марта 2004 г.). «Кишечная экспрессия мутантного прогастрина и прогастрина дикого типа значительно увеличивает канцерогенез толстой кишки в ответ на азоксиметан у трансгенных мышей» . Рак . 100 (6): 1311–1323. дои : 10.1002/cncr.20094 . ISSN 0008-543X . ПМИД 15022301 . S2CID 2139822 .
- ^ Сингх, Помила; Веласко, Марко; Учитывая, Рэндалл; Варгович, Михаил; Варрон, Андреа; Ван, Тимоти К. (01 марта 2000 г.). «Мыши со сверхэкспрессией прогастрина предрасположены к развитию аберрантных очагов крипт толстой кишки в ответ на АОМ». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени . 278 (3): G390–G399. дои : 10.1152/ajpgi.2000.278.3.g390 . ISSN 0193-1857 . ПМИД 10712258 . S2CID 19068321 .
- ^ Ву, Хай; Сова, Азармидохт; Сингх, Помила (декабрь 2003 г.). «Пептид-предшественник прогастрин 1-80 снижает апоптоз эпителиальных клеток кишечника и повышает уровень цитохром с-оксидазы Vb и синтез АТФ». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени . 285 (6): G1097–G1110. дои : 10.1152/ajpgi.00216.2003 . ISSN 0193-1857 . ПМИД 12881229 .
- ^ Перейти обратно: а б Вествуд, Дэвид А; Патель, Онель; Кристофи, Кристофер; Шалкс, Артур; Болдуин, Грэм С. (21 апреля 2017 г.). «Прогастрин: потенциальный прогностический маркер метастазирования в печень при колоректальном раке». Международный журнал колоректальных заболеваний . 32 (7): 1061–1064. дои : 10.1007/s00384-017-2822-8 . ISSN 0179-1958 . ПМИД 28432443 . S2CID 4574556 .
- ^ Хьюлс, диджей; Сансом, О.Дж. (2015). «Стволовые и нестволовые клетки происхождения колоректального рака» . Британский журнал рака . 113 (1): 1–5. дои : 10.1038/bjc.2015.214 . ISSN 0007-0920 . ПМЦ 4647531 . ПМИД 26110974 .
- ^ Хори, Хироюки Наката, Хирохиса Игучи, Гэндзо Ямада, Хадзиме Чихара, Кадзуо Баба, Хисамицу (01 апреля 2010 г.). «Онкогенный ras индуцирует экспрессию генов рецептора гастрина/CCKB в клеточных линиях рака толстой кишки человека LoVo и Colo320HSR» (PDF) . Журнал лабораторной и клинической медицины . 141 (5). Международный журнал клинической психологии: 335–341. дои : 10.1016/S0022-2143(03) 00021-0 OCLC 997679353 . ПМИД 12761477 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Картрайт, Калифорния; Мейслер, А.И.; Экхарт, В. (1 января 1990 г.). «Активация протеинкиназы pp60c-src является ранним событием канцерогенеза толстой кишки» . Труды Национальной академии наук . 87 (2): 558–562. Бибкод : 1990PNAS...87..558C . дои : 10.1073/pnas.87.2.558 . ISSN 0027-8424 . ПМЦ 53304 . ПМИД 2105487 .
- ^ Кондо, Дзюмпей; Пауэлл, Энн Э.; Коффи, Роберт Дж. (2016). «466 Бегство от подавления роста, опосредованного BMP4, является ранним событием неоплазии толстой кишки». Гастроэнтерология . 150 (4): С102–С103. дои : 10.1016/s0016-5085(16)30451-6 . ISSN 0016-5085 .
- ^ Перейти обратно: а б Ферран, Одри; Бертран, Клодин; Портолан, Гислен; Цуй, Гуанлинь; Карлсон, Джейн; Прадайроль, Люсьен; Фурми, Дэниел; Дюфрен, Марлен; Ван, Тимоти С.; Сева, Екатерина (1 апреля 2005 г.). «Сигнальные пути, связанные с гиперпролиферацией слизистой оболочки толстой кишки у мышей со сверхэкспрессией предшественников гастрина» . Исследования рака . 65 (7): 2770–2777. дои : 10.1158/0008-5472.can-04-0978 . ISSN 0008-5472 . ПМИД 15805277 .
- ^ Ренгифо-Кам, В.; Умар, С.; Саркар, С.; Сингх, П. (2007). «Антиапоптотическое действие прогастрина на клетки рака поджелудочной железы опосредовано устойчивой активацией ядерного фактора-B» . Исследования рака . 67 (15): 7266–7274. дои : 10.1158/0008-5472.can-07-1206 . ISSN 0008-5472 . ПМИД 17671195 .
- ^ Умар, С; Саркар, С; Коуи, С; Сингх, П. (2 июня 2008 г.). «Активация NF-κB необходима для обеспечения пролиферативного и антиапоптотического действия прогастрина на проксимальные крипты толстой кишки мышей in vivo» . Онкоген . 27 (42): 5599–5611. дои : 10.1038/onc.2008.169 . ISSN 0950-9232 . ПМЦ 2891442 . ПМИД 18521082 .
- ^ Паннекен, Дж.; Боннан, К.; Делоне, Н.; Райан, Дж.; Бурго, Ж.-Ф.; Жубер, Д.; Олланд, Ф. (21 июля 2009 г.). «Цель Wnt Jagged-1 опосредует активацию передачи сигналов Notch прогастрином в клетках колоректального рака человека» . Исследования рака . 69 (15): 6065–6073. дои : 10.1158/0008-5472.can-08-2409 . ISSN 0008-5472 . ПМИД 19622776 .
- ^ Сингх, П.; Лу, Х.; Кобб, С.; Миллер, Британская Колумбия; Тарасова Н.; Варрон, А.; Оулия, А. (1 февраля 2003 г.). «Прогастрин 1–80 стимулирует рост эпителиальных клеток кишечника in vitro через сайты связывания с высоким сродством». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени . 284 (2): G328–G339. дои : 10.1152/ajpgi.00351.2002 . ISSN 0193-1857 . ПМИД 12388191 . S2CID 36872664 .
- ^ Дубейковский, Александр; Нгуен, Томас; Дубейковская, Зинаида; Лей, Ши; Ван, Тимоти К. (2008). «Проточно-цитометрическое обнаружение взаимодействия прогастрина с клетками желудочно-кишечного тракта» . Регуляторные пептиды . 151 (1–3): 106–114. дои : 10.1016/j.regpep.2008.07.001 . ISSN 0167-0115 . ПМК 2630224 . ПМИД 18674570 .
- ^ Оттевелл, PD; Варрон, А.; Докрей, Дж.Дж.; Киртон, CM; Уотсон, AJM; Ван, TC; Дималин, Р.; Причард, DM (2005). «СООН-концевые 26-аминокислотные остатки прогастрина достаточны для стимуляции митоза в эпителии толстой кишки мышей in vivo». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени . 288 (3): G541–G549. дои : 10.1152/ajpgi.00268.2004 . ISSN 0193-1857 . ПМИД 15486344 . S2CID 36435882 .
- ^ Сингх, П; Ву, Х; Кларк, К; Сова, А (10 июля 2006 г.). «Аннексин II связывает прогастрин и гастриноподобные пептиды и опосредует влияние факторов роста аутокринных и экзогенных гастринов на рак толстой кишки и эпителиальные клетки кишечника» . Онкоген . 26 (3): 425–440. дои : 10.1038/sj.onc.1209798 . ISSN 0950-9232 . ПМИД 16832341 . S2CID 10850923 .
- ^ Саркар, Шубхашиш; Сверч, Рафаль; Кантара, Карла; Хаджар, Кэтрин А.; Сингх, Помила (2011). «Аннексин А2 опосредует усиление регуляции NF-κB, β-катенина и стволовых клеток в ответ на прогастрин у мышей и клеток HEK-293» . Гастроэнтерология . 140 (2): 583–595.е4. дои : 10.1053/j.gastro.2010.08.054 . ISSN 0016-5085 . ПМК 3031715 . ПМИД 20826156 .
- ^ Цзинь, Гуанчунь; Сакитани, Косуке; Ван, Хуншань; Джин, Ин; Дубейковский, Александр; Уортли, Дэниел Л.; Портной Ягнеш; Ван, Тимоти К. (23 марта 2017 г.). «Рецептор 56, связанный с G-белком, экспрессируемый в стволовых и раковых клетках толстой кишки, связывает прогастрин, способствуя пролиферации и канцерогенезу» . Онкотаргет . 8 (25): 40606–40619. дои : 10.18632/oncotarget.16506 . ISSN 1949-2553 . ПМЦ 5522213 . ПМИД 28380450 . S2CID 4727270 .
- ^ Кэплин, Мэн; Сэвидж, К.; Хан, К.; Роде, Дж.; Бретт, Б.; Варрон, А.; Михаэли, Д.; Паундер, Р.Э.; Диллон, AP (1998). «Экспрессия и обработка гастрина у пациентов с гепатоцеллюлярной карциномой, фиброламеллярной карциномой и холангиокарциномой». Гастроэнтерология . 114 : А1219. дои : 10.1016/s0016-5085(98)84945-7 . ISSN 0016-5085 .
- ^ Кэплин, М.; Сэвидж, К.; Хан, К.; Бретт, Б.; Роде, Дж.; Варрон, А.; Диллон, А. (1 августа 2000 г.). «Экспрессия и обработка гастрина при аденокарциноме поджелудочной железы». Британский журнал хирургии . 87 (8): 1035–1040. дои : 10.1046/j.1365-2168.2000.01488.x . ISSN 0007-1323 . ПМИД 10931047 . S2CID 24292877 .
- ^ Дюбуа, Раймонд Н. (2009), «Циклооксигеназа-2 при колоректальном раке», Энциклопедия рака , Берлин, Гейдельберг: Springer Berlin Heidelberg, стр. 799, номер домена : 10.1007/978-3-540-47648-1_1436 , ISBN 978-3-540-36847-2
- ^ Патерсон, Адриенн С; Макрэ, Финли А; Пиззи, Кэти; Болдуин, Грэм С; Шалкс, Артур (19 февраля 2014 г.). «Циркулирующие концентрации гастрина у пациентов с повышенным риском развития колоректальной карциномы». Журнал гастроэнтерологии и гепатологии . 29 (3): 480–486. дои : 10.1111/jgh.12417 . ISSN 0815-9319 . ПМИД 24716212 . S2CID 25335053 .
- ^ До, К.; Бертран, К.; Паласс, Дж.; Делиль, М.-Б.; Шулкс, А.; Коэн-Джонатан-Мойал, Э.; Ферран, А.; Сева, К. (24 февраля 2012 г.). «Новый биомаркер, который предсказывает исход неоплазии толстой кишки у пациентов с гиперпластическими полипами толстой кишки» . Исследования по профилактике рака . 5 (4): 675–684. дои : 10.1158/1940-6207.capr-11-0408 . ISSN 1940-6207 . ПМИД 22366915 . S2CID 53420 .
- ^ Да, Кэтрин; Бертран, Клодин; Палас, Жюльен; Делиль, Мари-Бернадетт; Коэн-Джонатан-Мойал, Элизабет; Сева, Екатерина (08.11.2013). «Активация проонкогенных путей при колоректальных гиперпластических полипах» . БМК Рак . 13 (1): 531. дои : 10.1186/1471-2407-13-531 . ISSN 1471-2407 . ПМЦ 3829387 . ПМИД 24209454 .
- ^ Карр, Брайан I; Панкошка, Петр; Бранч, Роберт А. (25 февраля 2010 г.). «Гепатоцеллюлярная карцинома с низким содержанием альфа-фетопротеина» . Журнал гастроэнтерологии и гепатологии . 25 (9): 1543–1549. дои : 10.1111/j.1440-1746.2010.06303.x . ISSN 0815-9319 . ПМИД 20796153 .
- ^ Ковальски-Шовель, Алин; Гуаз-Андерссон, Валери; Виньоль-Видони, Аликс; Дельмас, Кэролайн; Тулас, Кристина; Коэн-Джонатан-Мойал, Элизабет; Сева, Екатерина (20 апреля 2017 г.). «Нацеливание на прогастрин усиливает радиосенсибилизацию клеток колоректального рака» . Онкотаргет . 8 (35): 58587–58600. дои : 10.18632/oncotarget.17274 . ISSN 1949-2553 . ПМК 5601677 . ПМИД 28938581 .