Вектор клонирования

Вектор клонирования представляет собой небольшой участок ДНК , который может стабильно сохраняться в организме и в который можно вставить чужеродный фрагмент ДНК для целей клонирования . [1] Вектором клонирования может быть ДНК, взятая из вируса , клетки высшего организма или плазмида бактерии . Вектор содержит признаки, которые позволяют удобно вставлять фрагмент ДНК в вектор или удалять его из вектора, например, благодаря наличию сайтов рестрикции . Вектор и чужеродную ДНК можно обработать ферментом рестрикции , который разрезает ДНК, и полученные таким образом фрагменты ДНК содержат либо тупые концы, либо выступающие концы, известные как липкие концы, а векторную ДНК и чужеродную ДНК с совместимыми концами можно затем соединить путем молекулярного лигирования. . После того как фрагмент ДНК был клонирован в клонирующий вектор, его можно дополнительно субклонировать в другой вектор, предназначенный для более специфического использования.
Существует много типов векторов клонирования, но наиболее часто используемые из них — это генно-инженерные плазмиды . Клонирование обычно сначала выполняется с использованием Escherichia coli , а векторы клонирования в E. coli включают плазмиды, бактериофаги (такие как фаг λ ), космиды и бактериальные искусственные хромосомы (BAC). Однако некоторая ДНК не может стабильно сохраняться в E.coli , например, очень большие фрагменты ДНК, и могут быть использованы другие организмы, такие как дрожжи. Векторы клонирования дрожжей включают искусственные хромосомы дрожжей (YAC).
Особенности вектора клонирования
[ редактировать ]Все обычно используемые векторы клонирования в молекулярной биологии имеют ключевые особенности, необходимые для их функции, такие как подходящий сайт клонирования и селектируемый маркер. Другие могут иметь дополнительные функции, специфичные для их использования. Из соображений простоты и удобства клонирование часто проводят с использованием E.coli . Таким образом, используемые векторы клонирования часто содержат элементы, необходимые для их размножения и поддержания в E.coli , такие как функциональный источник репликации (ori). Начало ColE1 репликации обнаружено во многих плазмидах. Некоторые векторы также включают элементы, которые позволяют им сохраняться в другом организме помимо E. coli , и эти векторы называются челночными векторами .
Клонирование сайта
[ редактировать ]Все векторы для клонирования обладают функциями, которые позволяют удобно вставлять ген в вектор или удалять из него. Это может быть сайт множественного клонирования (MCS) или полилинкер, который содержит множество уникальных сайтов рестрикции . Сайты рестрикции в MCS сначала расщепляются ферментами рестрикции, затем амплифицированный с помощью ПЦР целевой ген, также расщепленный теми же ферментами, лигируется в векторы с использованием ДНК-лигазы . Если это желательно, целевая последовательность ДНК может быть вставлена в вектор в определенном направлении. При необходимости сайты рестрикции могут быть дополнительно использованы для субклонирования в другой вектор. [ нужна ссылка ]
В других векторах клонирования вместо лигазы может использоваться топоизомераза , и клонирование может осуществляться быстрее без необходимости рестрикционного расщепления вектора или вставки. В этом методе клонирования TOPO линеаризованный вектор активируется путем присоединения топоизомеразы I к его концам, и этот «TOPO-активированный» вектор может затем принимать продукт ПЦР путем лигирования обоих 5'-концов продукта ПЦР, высвобождая топоизомеразу и образуя круговой вектор в процессе. [2] Другим методом клонирования без использования расщепителя ДНК и лигазы является рекомбинация ДНК , например, как это используется в системе клонирования Gateway . [3] [4] Ген, однажды клонированный в клонирующий вектор (называемый в этом методе входным клоном), может быть удобно введен в различные векторы экспрессии путем рекомбинации. [5]
Выбираемый маркер
[ редактировать ], Вектор несет селектируемый маркер позволяющий отбирать положительно трансформированные клетки. Устойчивость к антибиотикам часто используется в качестве маркера, примером может служить ген бета-лактамазы , который придает устойчивость к пенициллиновой группе бета-лактамных антибиотиков, таких как ампициллин . Некоторые векторы содержат два селектируемых маркера, например, плазмида pACYC177 имеет ген устойчивости как к ампициллину, так и к канамицину . [6] Челночный вектор, который предназначен для поддержания в двух разных организмах, также может потребовать двух селектируемых маркеров, хотя некоторые селектируемые маркеры, такие как устойчивость к зеоцину и гигромицину B, эффективны в разных типах клеток. маркеры ауксотрофной селекции, которые позволяют ауксотрофному организму расти в минимальной питательной среде Также можно использовать ; примерами являются LEU2 и URA3 , которые используются с соответствующими ауксотрофными штаммами дрожжей. [7]
Другой тип селектируемого маркера позволяет провести положительный отбор плазмиды с клонированным геном. Это может включать использование гена, летального для клеток-хозяев, такого как барназа . [8] CCDA , [9] и токсины parD/parE . [10] [11] Обычно это работает путем разрушения или удаления летального гена во время процесса клонирования, а неудачные клоны, в которых летальный ген все еще остается неповрежденным, убивают клетки-хозяева, поэтому отбираются только успешные клоны.
Репортерный ген
[ редактировать ]Репортерные гены используются в некоторых векторах клонирования для облегчения скрининга успешных клонов за счет использования свойств этих генов, которые позволяют легко идентифицировать успешный клон. Такими особенностями, присутствующими в векторах клонирования, могут быть lacZ α-фрагмент для α-комплементации в сине-белой селекции и/или маркерный ген или репортерные гены в рамке с и фланкирующие MCS для облегчения продукции слитых белков . Примерами партнеров слияния, которые можно использовать для скрининга, являются зеленый флуоресцентный белок (GFP) и люцифераза .
Элементы для выражения
[ редактировать ]Вектор клонирования не обязательно должен содержать подходящие элементы для экспрессии клонированного гена-мишени, такие как промотор и сайт связывания рибосомы (RBS), однако многие из них содержат и могут затем работать как вектор экспрессии . Целевая ДНК может быть вставлена в сайт, находящийся под контролем конкретного промотора, необходимого для экспрессии целевого гена у выбранного хозяина. Если присутствует промотор, экспрессия гена предпочтительно жестко контролируется и индуцируется, так что белки производятся только тогда, когда это необходимо. Некоторыми обычно используемыми промоторами являются T7 и lac промоторы . Присутствие промотора необходимо при таких методов скрининга, как сине-белая селекция использовании .
Векторы для клонирования без промотора и RBS для клонированной последовательности ДНК иногда используются, например, при клонировании генов, продукты которых токсичны для E. coli клеток . Промотор и RBS для клонированной последовательности ДНК также не нужны при первом создании геномной библиотеки или библиотеки кДНК клонов, поскольку клонированные гены обычно субклонируются в более подходящий вектор экспрессии, если требуется их экспрессия.
Некоторые векторы предназначены только для транскрипции без экспрессии гетерологичного белка, например, для производства мРНК in vitro . Эти векторы называются векторами транскрипции. У них может отсутствовать последовательность, необходимая для полиаденилирования и терминации, поэтому их нельзя использовать для производства белка.
Типы векторов клонирования
[ редактировать ]Доступно большое количество векторов клонирования, и выбор вектора может зависеть от ряда факторов, таких как размер вставки, количество копий и метод клонирования. Большая вставка не может стабильно сохраняться в обычном векторе клонирования, особенно для векторов с большим количеством копий, поэтому для клонирования больших фрагментов может потребоваться более специализированный вектор клонирования. [6]
Плазмида
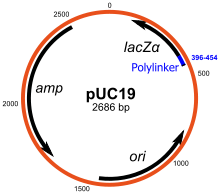
[ редактировать ]Плазмиды автономно реплицируют кольцевую внехромосомную ДНК. Это стандартные векторы клонирования и наиболее часто используемые. Большинство обычных плазмид можно использовать для клонирования вставок ДНК размером до 15 т.п.н. Одним из первых широко используемых векторов клонирования является плазмида pBR322 . Другие векторы клонирования включают серию плазмид pUC , и доступно большое количество различных плазмидных векторов клонирования. Многие плазмиды имеют высокую копийность, например, pUC19 имеет число копий 500-700 копий на клетку. [6] и большое число копий полезно, поскольку оно дает больший выход рекомбинантной плазмиды для последующих манипуляций. Однако плазмиды с низким числом копий предпочтительно можно использовать в определенных обстоятельствах, например, когда белок клонированного гена токсичен для клеток. [12]
Некоторые плазмиды содержат точку начала репликации бактериофага М13 и могут использоваться для создания одноцепочечной ДНК. Они называются фагмидами , и примером может служить pBluescript серия векторов клонирования .
Бактериофаг
[ редактировать ]Бактериофагами, используемыми для клонирования, являются фаг λ и фаг М13 . [13] Существует верхний предел количества ДНК, которое может быть упаковано в фаг (максимум 53 т.п.н.), поэтому, чтобы обеспечить возможность вставки чужеродной ДНК в ДНК фага, в векторах для клонирования фага может потребоваться удаление некоторых несущественных генов. , например, гены лизогении , поскольку использование фага λ в качестве вектора клонирования включает только литический цикл. [14] Существует два типа фаговых векторов λ: вектор вставки и вектор замены. Инсерционные векторы содержат уникальный сайт расщепления, посредством которого можно вставить чужеродную ДНК размером 5–11 т.п.н. В замещающих векторах сайты расщепления фланкируют область, содержащую гены, не необходимые для литического цикла, и эта область может быть удалена и заменена вставкой ДНК в процессе клонирования, а также может быть вставлена ДНК большего размера (8–24 т.п.н.). [6]
Существует также нижний предел размера ДНК, которая может быть упакована в фаг, а слишком маленькая векторная ДНК не может быть должным образом упакована в фаг. Это свойство можно использовать для выбора — вектор без вставки может быть слишком мал, поэтому для распространения можно выбирать только векторы со вставкой. [15]
Космид
[ редактировать ]Космиды — это плазмиды, которые включают сегмент ДНК бактериофага λ, имеющий когезивный конечный сайт ( cos ), который содержит элементы, необходимые для упаковки ДНК в частицы λ. При правильном начале репликации (ori) он может реплицироваться как плазмида. Обычно его используют для клонирования больших фрагментов ДНК размером от 28 до 45 т.п.н. [6]
Бактериальная искусственная хромосома
[ редактировать ]Вставки размером до 350 КБ можно клонировать в бактериальную искусственную хромосому (ВАС). BAC сохраняются в E. coli с числом копий всего 1 на клетку. [6] BAC основаны на плазмиде F , другая искусственная хромосома, называемая PAC, основана на фаге P1 .
Дрожжевая искусственная хромосома
[ редактировать ]Искусственные хромосомы дрожжей используются в качестве векторов для клонирования фрагментов ДНК размером более 1 мегаоснования (1 МБ = 1000 КБ). Они полезны при клонировании более крупных фрагментов ДНК, что необходимо при картировании геномов, например, в проекте «Геном человека» . Он содержит теломерную последовательность, автономно реплицирующуюся последовательность (функции, необходимые для репликации линейных хромосом в дрожжевых клетках). Эти векторы также содержат подходящие сайты рестрикции для клонирования чужеродной ДНК, а также гены, которые можно использовать в качестве селектируемых маркеров.
Человеческая искусственная хромосома
[ редактировать ]Искусственная хромосома человека может быть потенциально полезна в качестве векторов переноса генов для доставки генов в клетки человека, а также в качестве инструмента для исследований экспрессии и определения функции хромосом человека. Он может нести очень большой фрагмент ДНК (для практических целей нет верхнего предела размера), поэтому у него нет проблемы ограниченной способности клонирования других векторов, а также избегается возможный инсерционный мутагенез, вызванный интеграцией в хромосомы хозяина вирусом. вектор. [16] [17]
Вирусные векторы животных и растений
[ редактировать ]Вирусы, поражающие клетки растений и животных, также подвергались манипуляциям с целью внедрения чужеродных генов в клетки растений и животных. Естественная способность вирусов адсорбироваться в клетках, внедрять свою ДНК и реплицироваться сделала их идеальными средствами для переноса чужеродной ДНК в эукариотические клетки в культуре. Вектор на основе обезьяньего вируса 40 (SV40) использовался в первом эксперименте по клонированию клеток млекопитающих. Ряд векторов на основе других типов вирусов, таких как аденовирусы и вирус папилломы, использовался для клонирования генов млекопитающих. В настоящее время для клонирования генов в клетках млекопитающих популярны ретровирусные векторы. В случае таких растений, как вирус мозаики цветной капусты , вирус табачной мозаики и вирусы Близнецов, использовались с ограниченным успехом.

Экранирование: пример сине-белого экрана
[ редактировать ]Многие векторы общего назначения, такие как pUC19, обычно включают систему обнаружения присутствия клонированного фрагмента ДНК, основанную на потере легко поддающегося оценке фенотипа. Наиболее широко используется ген, кодирующий E. coli β-галактозидазу , активность которой можно легко обнаружить по способности кодируемого им фермента гидролизовать растворимый бесцветный субстрат X-гал (5-бром-4-хлор-3 -индолил-бета-d-галактозид) в нерастворимый продукт синего цвета (5,5'-дибром-4,4'-дихлор индиго). Клонирование фрагмента ДНК в векторной последовательности lacZα β-галактозидазы предотвращает выработку активного фермента. Если X-gal включен в чашки с селективным агаром, колонии трансформантов обычно имеют синий цвет в случае вектора без встроенной ДНК и белый цвет в случае вектора, содержащего фрагмент клонированной ДНК.
См. также
[ редактировать ]- Вектор (молекулярная биология)
- Вектор трансформации растений
- Клоны кДНК ИЗОБРАЖЕНИЯ
- фосмиды
- Клонирование Золотых Ворот
Ссылки
[ редактировать ]- ^ «Определение вектора клонирования» . Геномный словарь . Проверено 18 октября 2012 г.
- ^ «Технология клонирования TOPO®» . Инвитроген .
- ^ Эспозито Д., Гарви Л.А., Чакиат К.С. (2009). «Клонирование шлюзов для экспрессии белков» . Высокопроизводительная экспрессия и очистка белков . Методы молекулярной биологии. Том. 498. стр. 31–54 . дои : 10.1007/978-1-59745-196-3_3 . ISBN 978-1-58829-879-9 . ПМИД 18988017 .
- ^ «Методы клонирования. Системы рекомбинационного клонирования» . ЭМБЛ .
- ^ «Технология рекомбинационного клонирования Gateway®» . Инвитроген .
- ^ Jump up to: а б с д и ж Казали Н., Престон А. (2003). E. coli Плазмидные векторы . Методы молекулярной биологии. Том. 235. с. 23. ISBN 978-1-58829-151-6 .
- ^ Романос М.А., бомбардир Калифорния, Клэр Дж.Дж. (июнь 1992 г.). «Экспрессия чужеродных генов у дрожжей: обзор». Дрожжи . 8 (6): 423–488. дои : 10.1002/да.320080602 . ПМИД 1502852 . S2CID 15674832 .
- ^ Язынин С.А., Деев С.М., Джукович М., Хартли Р.В. (февраль 1996 г.). «Плазмидный вектор с позитивной селекцией и направленным клонированием на основе условно летального гена» . Джин . 169 (1): 131–132. дои : 10.1016/0378-1119(95)00814-4 . ПМИД 8635737 .
- ^ Бернард П. (август 1996 г.). «Положительный отбор рекомбинантной ДНК с помощью CcdB» . БиоТехники . 21 (2): 320–323. дои : 10.2144/96212pf01 . ПМИД 8862819 .
- ^ Габант П., Ван Рит Т., Дрез П.Л., Фаэлен М., Шпирер С., Шпирер Дж. (апрель 2000 г.). «Новая система положительной селекции на основе системы parD (kis/kid) плазмиды R1». БиоТехники . 28 (4): 784–788. ПМИД 10769758 .
- ^ Ким Х.Г., Ким Х.С., Хван Х.Дж., Чунг С.К., Ли Дж.М., Чунг Д.К. (ноябрь 2004 г.). «Конструирование вектора pTOC-T с использованием токсина GST-ParE для прямого клонирования и отбора продуктов ПЦР». Биотехнологические письма . 26 (21): 1659–1663. дои : 10.1007/s10529-004-3518-z . ПМИД 15604816 . S2CID 10312859 .
- ^ «Копировать номер» . Институт генетики, Inc. Архивировано из оригинала 19 апреля 2013 г. Проверено 06 марта 2013 г.
- ^ Чаутайвале В.М., Терват А., Дешпанде В.В. (декабрь 1992 г.). «Бактериофаг лямбда как вектор клонирования» . Микробиологические обзоры . 56 (4): 577–591. дои : 10.1128/мр.56.4.577-591.1992 . ПМЦ 372889 . ПМИД 1480110 .
- ^ Глик Б.Р., Пастернак Дж.Дж. (2005). Принципы молекулярной биотехнологии и применение рекомбинантной ДНК (3-е изд.). АСМ Пресс. ISBN 9781555816124 .
- ^ Т. А. Браун (19 апреля 2010 г.). Клонирование генов и анализ ДНК: введение . Уайли-Блэквелл. п. 100. ИСБН 978-1444334074 .
- ^ Ким Дж.Х., Кононенко А., Эрлиандри И., Ким Т.А., Накано М., Иида Ю. и др. (декабрь 2011 г.). «Вектор искусственной хромосомы человека (HAC) с условной центромерой для коррекции генетических дефектов в клетках человека» . Труды Национальной академии наук Соединенных Штатов Америки . 108 (50): 20048–20053. Бибкод : 2011PNAS..10820048K . дои : 10.1073/pnas.1114483108 . ПМК 3250132 . ПМИД 22123967 .
- ^ Куприна Н., Эрншоу В.К., Масумото Х., Ларионов В. (апрель 2013 г.). «Новое поколение искусственных хромосом человека для функциональной геномики и генной терапии» . Клеточные и молекулярные науки о жизни . 70 (7): 1135–1148. дои : 10.1007/s00018-012-1113-3 . ПМЦ 3522797 . ПМИД 22907415 .