Лямбда-фаг
В этой статье есть несколько проблем. Пожалуйста, помогите улучшить его или обсудите эти проблемы на странице обсуждения . ( Узнайте, как и когда удалять эти шаблонные сообщения )
|
| Вирус эшерихии Лямбда | |
|---|---|

| |
| Электронная микрофотография вирусной частицы вида Escherichiavirus Lambda. | |
| Классификация вирусов | |
| (без рейтинга): | Вирус |
| Область : | Дуплоднавирия |
| Королевство: | Хынггунвирэ |
| Тип: | Уровироката |
| Сорт: | Каудовирицеты |
| Заказ: | Каудовирусы |
| Семья: | Сифовирусиды |
| Род: | Лямбдавирус |
| Разновидность: | Вирус эшерихии Лямбда
|

Фаг энтеробактерий λ ( фаг лямбда , колифаг λ , официально вирус Escherichia Lambda ) представляет собой бактериальный вирус или бактериофаг , который заражает бактериальный вид Escherichia coli ( E. coli ). Его открыла Эстер Ледерберг в 1950 году. [ 2 ] Дикий тип этого вируса имеет умеренный жизненный цикл, который позволяет ему либо находиться в геноме хозяина посредством лизогении , либо вступать в литическую фазу, во время которой он убивает и лизирует клетку для производства потомства. Штаммы Lambda, мутировавшие в определенных сайтах, не способны лизогенизировать клетки; вместо этого они растут и вступают в литический цикл после суперинфицирования уже лизогенизированной клетки. [ 3 ]
Фаговая частица состоит из головки (также известной как капсид ), [ 4 ] хвост и хвостовые волокна (см. изображение вируса ниже). Головка содержит двухцепочечный линейный геном ДНК фага . Во время инфекций фаговая частица распознает своего хозяина, E. coli , и связывается с ним, вызывая выброс ДНК из головки фага через хвост в цитоплазму бактериальной клетки. Обычно наступает « литический цикл », во время которого лямбда-ДНК реплицируется и внутри клетки образуются новые фаговые частицы. За этим следует лизис клеток , в результате чего содержимое клетки, включая собранные вирионы, высвобождается в окружающую среду. Однако при определенных условиях ДНК фага может интегрироваться в хромосому клетки-хозяина по лизогенному пути. В этом состоянии ДНК λ называется профагом хозяина и остается в геноме без видимого вреда для хозяина. Хозяин называется лизогеном, когда присутствует профаг. Этот профаг может войти в литический цикл, когда лизоген попадает в стрессовое состояние.
Анатомия
[ редактировать ]
Вирусная частица состоит из головки и хвоста, которые могут иметь хвостовые волокна. Вся частица состоит из 12–14 различных белков, всего более 1000 белковых молекул и одной молекулы ДНК, расположенной в головке фага. Однако до сих пор не совсем ясно, входят ли белки L и M в состав вириона. [ 5 ] Все охарактеризованные лямбдоидные фаги обладают механизмом антитерминации транскрипции, опосредованным N-белком, за исключением фага HK022. [ 6 ]

содержится В геноме 48 502 [ 7 ] пары оснований двухцепочечной линейной ДНК с одноцепочечными сегментами по 12 оснований на обоих 5'-концах. [ 8 ] Эти два одноцепочечных сегмента представляют собой «липкие концы» так называемого cos- сайта. Сайт cos осуществляет циркуляризацию ДНК в цитоплазме хозяина. Таким образом, в своей кольцевой форме геном фага имеет длину 48 502 пары оснований. [ 8 ] Геном лямбда может быть встроен в хромосому E. coli и тогда называется профагом. Подробности см. в разделе ниже.
Хвост лямбда-фагов состоит как минимум из 6 белков (H, J, U, V, Stf, Tfa) и для сборки требуется еще 7 (I, K, L, M, Z, G/T). Этот процесс сборки начинается с белка J, который затем рекрутирует белки I, L, K и G/T для добавления белка H. Как только G и G/T покидают комплекс, белок V может собраться на каркасе J/H. Затем к головному проксимальному концу хвоста добавляют белок U. Белок Z способен соединять хвост с головой. Белок H расщепляется за счет действия белков U и Z. [ 5 ]
Жизненный цикл
[ редактировать ]Инфекция
[ редактировать ]
Фаг лямбда представляет собой несокращающийся хвостатый фаг, то есть во время заражения он не может «проталкивать» свою ДНК через мембрану бактериальной клетки. Вместо этого он должен использовать существующий путь для проникновения в клетку-хозяина, развив кончик своего хвоста для взаимодействия с определенной порой, чтобы обеспечить проникновение своей ДНК в хозяев.
- Бактериофаг Лямбда связывается с клеткой E. coli посредством белка J в кончике хвоста. Белок J взаимодействует с порином внешней мембраны мальтозы (продуктом гена lamB ) E. coli . [ 9 ] молекула порина, входящая в состав мальтозного оперона.
- Геном линейного фага вводится через внешнюю мембрану.
- ДНК проходит через маннозопермеазный комплекс во внутренней мембране. [ 10 ] [ 11 ] (кодируется генами manXYZ) и немедленно циркулирует с использованием сайтов cos , 12-основанных GC-богатых когезивных «липких концов». Концы одноцепочечной вирусной ДНК лигируются ДНК-лигазой хозяина . Обычно не осознается, что когезионные концы лямбда длиной 12 пар оснований были предметом первого прямого нуклеотидного секвенирования биологической ДНК. [ 6 ]

- хозяина ДНК-гираза образует отрицательные суперспирали в кольцевой хромосоме, заставляя богатые АТ области раскручиваться и управлять транскрипцией.
- Транскрипция начинается с конститутивных PL « , PR продуцирующих и PR ', промоторов непосредственно ранние» транскрипты. Сначала они экспрессируют гены N и cro , производя N, Cro и короткий неактивный белок.

- Cro связывается с OR3 , предотвращая доступ к PRM промотору , предотвращая экспрессию гена cI . N связывается с двумя сайтами Nut (утилизация N): одним в гене N в рамке считывания PL в и одним в cro гене PR рамке считывания .
- Белок N является антитерминатором и действует, вовлекая транскрибирующую РНК-полимеразу в определенные сайты зарождающейся транскрибируемой мРНК. Когда РНК-полимераза транскрибирует эти области, она рекрутирует N и образует комплекс с несколькими белками Nus хозяина. Этот комплекс пропускает большинство последовательностей терминации. Расширенные транскрипты («поздние ранние» транскрипты) включают гены N и cro , а также cII и cIII гены xis , int , O , P и Q , которые обсуждаются позже. , а также гены
- Белок cIII защищает белок cII от протеолиза FtsH (мембраносвязанная незаменимая E. протеаза coli ), действуя в качестве конкурентного ингибитора. Это ингибирование может вызвать бактериостатическое состояние, способствующее лизогении. cIII также напрямую стабилизирует белок cII. [ 12 ]
При первоначальном заражении стабильность cII определяет образ жизни фага; стабильный cII приведет к лизогенному пути, тогда как если cII разлагается, фаг перейдет на литический путь. Известно , что низкая температура, голодание клеток и высокая множественность инфекции (MOI) способствуют лизогении (см. дальнейшее обсуждение). [ 13 ]
N антитерминация
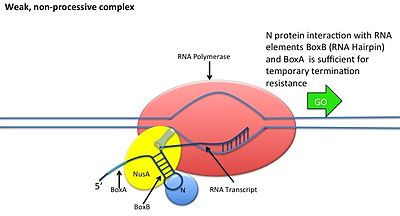
[ редактировать ]Это происходит без взаимодействия белка N с ДНК; вместо этого белок связывается со свежетранскрибированной мРНК. Ореховые сайты содержат 3 консервативных «коробки», из которых важен только BoxB.
- Последовательности РНК boxB расположены близко к 5'-концу транскриптов pL и pR. При транскрипции каждая последовательность образует структуру шпильки, с которой может связываться белок N.
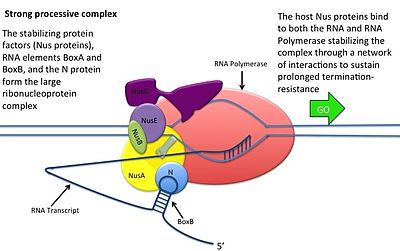
- Белок N связывается с boxB в каждом транскрипте и контактирует с транскрибирующей РНК-полимеразой посредством образования петель РНК. Комплекс N-RNAP стабилизируется путем последующего связывания нескольких белков хозяина Nus (вещества, утилизирующего N) (которые включают факторы терминации/антитерминации транскрипции и, как ни странно, субъединицу рибосомы).
- Весь комплекс (включая связанный сайт Nut на мРНК) продолжает транскрипцию и может пропускать последовательности терминации.
Литический жизненный цикл
[ редактировать ]
Это жизненный цикл, которому следует фаг после большинства инфекций, когда белок cII не достигает достаточно высокой концентрации из-за деградации и поэтому не активирует свои промоторы. [ нужна ссылка ]
- Продолжают писать «поздние ранние» транскрипты, включая xis , int , Q и гены репликации лямбда-генома ( OP ). Кро доминирует в сайте репрессора (см. «Репрессоры» ), подавляя синтез промотора PRM раздел (который является промотором лизогенного цикла).
- Белки О и Р инициируют репликацию фаговой хромосомы (см. «Литическая репликация»).
- Q, еще один антитерминатор , связывается с Qut . сайтами
- Транскрипция с промотора PR ' теперь может распространяться на продукцию мРНК для лизиса, а также белков головы и хвоста.
- Структурные белки и фаговые геномы самособираются в новые фаговые частицы.
- Продукты генов S , R , Rz и Rz1 вызывают лизис клеток. S — холин , небольшой мембранный белок, который в момент, определяемый последовательностью белка, внезапно проделывает дыры в мембране. R представляет собой эндолизин , фермент, который выходит через S-отверстия и расщепляет клеточную стенку. Rz и Rz1 представляют собой мембранные белки, которые образуют комплекс, который каким-то образом разрушает внешнюю мембрану после того, как эндолизин разрушил клеточную стенку. Для лямбды дикого типа лизис происходит примерно через 50 минут после начала заражения и высвобождает около 100 вирионов.
Правая транскрипция
[ редактировать ]Правая транскрипция экспрессирует O , P и Q. гены O и P ответственны за инициацию репликации, а Q является еще одним антитерминатором, который обеспечивает экспрессию генов головы, хвоста и лизиса из PR ' . [ 6 ]
Pr является промотором правой транскрипции, а ген cro является геном-регулятором. Ген cro будет кодировать белок Cro, который затем будет репрессировать промотор Prm. Как только начнется транскрипция Pr, ген Q будет транскрибироваться на дальнем конце оперона для правосторонней транскрипции. Ген Q представляет собой ген-регулятор, обнаруженный в этом опероне, который будет контролировать экспрессию последующих генов правой транскрипции. Как только регуляторные белки гена допускают экспрессию, белок Q начинает действовать как антитерминатор. Это позволит прочитать остальную часть оперона, пока он не достигнет терминатора транскрипции. Это позволяет экспрессировать более поздние гены в опероне и приводит к экспрессии литического цикла. [ 15 ]
Было обнаружено, что промотор Pr активирует ориджин при использовании правой транскрипции, но вся картина этого до сих пор несколько неправильно понята. Учитывая некоторые оговорки, например, этот процесс отличается для других фагов, таких как фаг N15, который может кодировать ДНК-полимеразу. Другой пример: фаг P22 может заменить ген p, который кодирует важный белок репликации, способный кодировать спирали DnaB. [ 6 ]
Литическая репликация
[ редактировать ]- В течение первых нескольких циклов репликации лямбда-геном подвергается θ-репликации (от круга к кругу).
- Это инициируется в сайте ori , расположенном в О. гене Белок O связывает сайт ori , а белок P связывает субъединицу DnaB механизма репликации хозяина, а также связывает O. Это эффективно контролирует ДНК-полимеразу хозяина.
- Вскоре фаг переключается на репликацию по катящемуся кругу, аналогичную той, которую использует фаг М13. ДНК разрезается, и 3'-конец служит праймером. Обратите внимание, что при этом высвобождаются не отдельные копии фагового генома, а скорее одна длинная молекула со многими копиями генома: конкатемер .
- Эти конкатемеры расщепляются по своим кос -сайтам при упаковке. Упаковка не может происходить из кольцевой фаговой ДНК, а только из конкатомерной ДНК.
Q-антизавершение
[ редактировать ]Q по своему эффекту подобен N: Q связывается с РНК-полимеразой в сайтах Qut , и образующийся комплекс может игнорировать терминаторы, однако механизм совсем другой; белок Q сначала связывается с последовательностью ДНК, а не с последовательностью мРНК. [ 16 ]
- Сайт Qut расположен очень близко к промотору PR ' , достаточно близко, чтобы σ-фактор не высвобождался из голофермента РНК-полимеразы. Часть сайта Qut напоминает ящик Прибнова -10 , что заставляет голофермент приостанавливать работу.
- Затем белок Q связывается и вытесняет часть σ-фактора, и транскрипция возобновляется.
- Гены головы и хвоста транскрибируются, и соответствующие белки самособираются.
Левая транскрипция
[ редактировать ]
Левая транскрипция экспрессирует гены gam, xis , bar и int . [ 6 ] Гам-белки участвуют в рекомбинации. Gam также важен тем, что он препятствует нуклеазе RecBCD хозяина разрушать 3'-концы при репликации по катящемуся кругу. Int и xis представляют собой белки интеграции и удаления, жизненно важные для лизогении. [ нужна ссылка ]
Процесс левой транскрипции
[ редактировать ]- Фаг лямбда встраивает хромосому в цитоплазму бактериальной клетки-хозяина.
- Фаговая хромосома встраивается в бактериальную хромосому хозяина посредством ДНК-лигазы.
- Транскрипция фаговой хромосомы продолжается влево, когда РНК-полимераза хозяина прикрепляется к промоторному сайту pL , что приводит к трансляции гена N.
- Ген N действует как регуляторный ген, в результате чего РНК-полимераза не может распознавать сайты терминации трансляции. [ 17 ]
Мутации левой транскрипции
[ редактировать ]Считается, что левая транскрипция приводит к делеционной мутации гена rap , приводящей к отсутствию роста фага лямбда. Это связано с тем, что РНК-полимераза прикрепляется к промоторному сайту pL, а не к промоторному сайту pR. Транскрипция влево приводит к транскрипции бара I и бара II на левом опероне. Бар-положительный фенотип присутствует, когда ген rap отсутствует. Считается, что отсутствие роста фага лямбда происходит из-за чувствительности к температуре, приводящей к ингибированию роста. [ 18 ]
xis и int регулирование введения и иссечения
[ редактировать ]- xis и int находятся на одном и том же участке мРНК, поэтому xis и int образуются примерно равные концентрации белков . Это приводит (первоначально) к удалению любых вставленных геномов из генома хозяина.
- мРНК промотора PL участке образует стабильную вторичную структуру со стеблем-петлей в sib- мРНК. Это нацелено на 3'-конец ( sib ) мРНК для деградации РНКазы III, что приводит к более низкой эффективной концентрации int -мРНК, чем xis -мРНК (поскольку цистрон int находится ближе к последовательности sib , чем цистрон xis к последовательности sib ). более высокая концентрация xis , чем int . , поэтому наблюдается
- Более высокие концентрации xis , чем int, не приводят к вставке или удалению фаговых геномов, что является эволюционно предпочтительным действием - оставление любых предварительно вставленных фаговых геномов вставленными (что снижает конкуренцию) и предотвращение вставки фагового генома в геном обреченного хозяина.
Лизогенный (или лизогенный) жизненный цикл
[ редактировать ]Лизогенный жизненный цикл начинается, когда белок cI достигает достаточно высокой концентрации, чтобы активировать его промоторы, после небольшого количества инфекций.
- Продолжают писать «поздние ранние» транскрипты, включая xis , int , Q и гены репликации лямбда-генома.
- Стабилизированный cII способствует PRE транскрипции , PI с и Pantiq промоторов .
- Промотор P antiq продуцирует антисмысловую мРНК к Q сообщению гена PR транскрипта промотора , тем самым отключая продукцию Q. Промотор PRE транскрипта продуцирует антисмысловую мРНК на участке cro PR промотора , подавляя выработку cro, и имеет транскрипт гена cI . Это выражается в включении продукции репрессора cI. Промотор P I экспрессирует ген int , что приводит к высоким концентрациям белка Int. Этот int-белок интегрирует ДНК фага в хромосому хозяина (см. «Интеграция профагов»).
- Отсутствие Q не приводит к расширению рамки считывания промотора PR ' , поэтому не образуются литические или структурные белки. Повышенные уровни int (намного выше, чем у xis) приводят к вставке лямбда-генома в геном хозяина (см. Диаграмму). связыванию cI с сайтами OR1 и OR2 в промоторе PR Продукция cI приводит к , отключая cro и другую раннюю экспрессию генов. cI также связывается с промотором PL . , отключая и там транскрипцию
- Отсутствие cro оставляет сайт OR3 может происходить транскрипция с промотора PRM несвязанным, поэтому , поддерживая уровни cI.
- Отсутствие транскрипции с PL приводит к и PR промоторов прекращению дальнейшего образования cII и cIII.
- Когда концентрации cII и cIII уменьшаются, транскрипция с P antiq , P RE и PI . перестает стимулироваться, поскольку они больше не нужны
- Только промоторы PRM . и PR ' остаются активными, первый продуцирует белок cI, а второй - короткий неактивный транскрипт Геном остается включенным в геном хозяина в спящем состоянии.
Профаг дублируется при каждом последующем делении клетки-хозяина. Гены фага, экспрессируемые в этом состоянии покоя, кодируют белки, которые подавляют экспрессию других генов фага (таких как структурные гены и гены лизиса), чтобы предотвратить вход в литический цикл. Эти репрессивные белки разрушаются, когда клетка-хозяин находится в состоянии стресса, что приводит к экспрессии репрессированных фаговых генов. Стресс может быть вызван голоданием , ядами (например, антибиотиками ) или другими факторами, которые могут повредить или уничтожить хозяина. В ответ на стресс активированный профаг вырезается из ДНК клетки-хозяина одним из недавно экспрессированных генных продуктов и вступает в свой литический путь.
Интеграция профагов
[ редактировать ]Интеграция фага λ происходит в специальном месте прикрепления в бактериальном и фаговом геноме, называемом att. л . Последовательность бактериального сайта att называется attB , находится между оперонами gal и bio и состоит из частей BOB', тогда как комплементарная последовательность в кольцевом геноме фага называется attP и состоит из частей POP'. Сама интеграция представляет собой последовательный обмен (см. генетическую рекомбинацию ) через соединение Холлидея и требует как фагового белка Int, так и бактериального белка IHF ( фактора хозяина интеграции ). И Int, и IHF связываются с attP и образуют интасому, комплекс ДНК-белок, предназначенный для сайт-специфической рекомбинации фага и ДНК хозяина. Исходная последовательность BOB' изменяется в результате интеграции с BOP'-фаговой ДНК-POB'. ДНК фага теперь является частью генома хозяина. [ 19 ]
Поддержание лизогении
[ редактировать ]
- Лизогения поддерживается исключительно cI. репрессирует транскрипцию PL , и PR одновременно усиливая и контролируя собственную экспрессию PRM cI . Таким образом, это единственный белок, экспрессируемый лизогенным фагом.

- координируется PL PR и Это операторами . сайта связывания для cI OL1 , OL2 и OL3 для PL и OR1 OR2 , : и OR3 для PR Оба оператора имеют три .
- cI наиболее благоприятно связывается с OR1 ; связывание здесь ингибирует транскрипцию PR с . Поскольку cI легко димеризуется, связывание cI с OR1 значительно увеличивает аффинность связывания cI с OR2 , и это происходит почти сразу после связывания OR1 . Это активирует транскрипцию в другом направлении от PRM и , поскольку N-концевой домен cI на OR2 усиливает связывание РНК-полимеразы с PRM , следовательно, cI стимулирует собственную транскрипцию. Когда он присутствует в гораздо более высокой концентрации, он также связывается с OR3 , ингибируя транскрипцию PRM , тем самым регулируя свои собственные уровни в петле отрицательной обратной связи .
- Связывание cI с оператором PL . очень похоже, за исключением того, что оно не оказывает прямого влияния на транскрипцию cI Однако в качестве дополнительного подавления собственной экспрессии димеры cI, связанные с OR3 и OL3, изгибают ДНК между ними, приводя к тетрамеризации.
- Присутствие cI вызывает иммунитет к суперинфекции другими лямбда-фагами, поскольку он ингибирует PL PR и промоторы их .
Индукция
[ редактировать ]
Классическая индукция лизогена включала облучение инфицированных клеток УФ-светом. Любая ситуация, когда лизоген подвергается повреждению ДНК или иным образом стимулируется SOS-ответ хозяина, приводит к индукции.
- Клетка-хозяин, содержащая спящий фаговый геном, испытывает повреждение ДНК из-за сильного стресса и начинает подвергаться SOS-ответу .
- RecA (клеточный белок) обнаруживает повреждение ДНК и активируется. Теперь это RecA*, высокоспецифичная копротеаза.
- Обычно RecA* связывает LexA ( репрессор транскрипции ), активируя активность аутопротеазы LexA, которая разрушает репрессор LexA, позволяя производить белки репарации ДНК . В лизогенных клетках этот ответ подавляется, и RecA* стимулирует ауторасщепление cI. Это связано с тем, что cI имитирует структуру LexA в сайте авторасщепления.
- Расщепленный cI больше не может димеризоваться и теряет сродство к связыванию ДНК.
- Промоторы PR больше не репрессируются и включаются, и и PL клетка возвращается к литической последовательности событий экспрессии (обратите внимание , что cII нестабилен в клетках, подвергающихся SOS-ответу). Однако есть одно заметное отличие.

Контроль удаления фагового генома при индукции
[ редактировать ]- Геном фага все еще встроен в геном хозяина и требует вырезания для репликации ДНК. Однако участок sib за пределами нормального больше транскрипта промотора PL не включен в эту рамку считывания (см. диаграмму).
- Отсутствие sib -домена на приводит мРНК промотора PL к отсутствию шпильки на 3'-конце, и транскрипт больше не подвергается деградации РНКазой III.
- Новый интактный транскрипт имеет по одной копии как xis , так и int , поэтому образуются примерно равные концентрации белков xis и int.
- Равные концентрации xis и int приводят к вырезанию вставленного генома из генома хозяина для репликации и последующего производства фага.
Реактивация множественности и реактивация профагов
[ редактировать ]Реактивация множественности (MR) — это процесс, при котором несколько вирусных геномов, каждый из которых содержит инактивирующие повреждения генома, взаимодействуют внутри инфицированной клетки с образованием жизнеспособного вирусного генома. Первоначально MR был обнаружен с помощью фага Т4, но впоследствии был обнаружен у фага λ (а также у многих других бактериальных вирусов и вирусов млекопитающих). [ 20 ] ). MR фага λ, инактивированного УФ-светом, зависит от рекомбинационной функции либо хозяина, либо инфицирующего фага. [ 21 ] Отсутствие обеих рекомбинационных систем приводит к потере MR.
Выживаемость фага λ, облученного УФ-излучением, увеличивается, когда хозяин E. coli лизогенен для гомологичного профага - явление, называемое реактивацией профага. [ 22 ] Реактивация профага в фаге λ, по-видимому, происходит посредством процесса рекомбинационной репарации, аналогичного процессу MR.
Репрессор
[ редактировать ]
Репрессор , обнаруженный в фаге лямбда, является ярким примером уровня контроля над экспрессией генов с помощью очень простой системы. Он образует «бинарный переключатель» с двумя генами, которые экспрессируются взаимоисключающе, как это обнаружила Барбара Дж. Мейер . [ 23 ]
Генная система лямбда-репрессора состоит из (слева направо на хромосоме):
- cI ген
- ОР 3
- О Р 2
- О Р 1
- кро ген
Лямбда-репрессор представляет собой самособирающийся димер, также известный как белок cI . [ 24 ] Он связывает ДНК по мотиву связывания спираль-поворот-спираль. Он регулирует транскрипцию белка cI и белка Cro.
Жизненный цикл лямбда-фагов контролируется белками cI и Cro. Фаг лямбда останется в лизогенном состоянии, если преобладают белки cI, но перейдет в литический цикл, если преобладают белки cro.
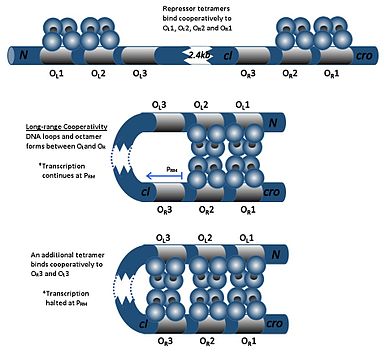
Димер cI может связываться с любым из трех операторов: O R 1, O R 2 и O R 3 в порядке O R 1 > O R 2 > O R 3. Связывание димера cI с O R 1 усиливает связывание второго димера cI с O R 2, эффект, называемый кооперативностью . Таким образом, O R 1 и O R 2 почти всегда одновременно заняты cI. Однако это не увеличивает сродство между cI и O R 3, которое будет занято только при высокой концентрации cI.
При высоких концентрациях cI димеры также будут связываться с операторами OL 1 и OL 2 (которые находятся более чем на 2 килобайта ниже операторов R). Когда димеры cI связываются с O L 1, O L 2, O R 1 и O R 2, в ДНК индуцируется петля, позволяющая этим димерам связываться вместе с образованием октамера. Это явление называется долгосрочным сотрудничеством . При образовании октамера димеры cI могут совместно связываться с O L 3 и O R 3, подавляя транскрипцию cI. Эта аутонегативная регуляция обеспечивает стабильную минимальную концентрацию молекулы-репрессора и, в случае возникновения SOS-сигналов, обеспечивает более эффективную индукцию профагов. [ 25 ]
- В отсутствие белков cI ген cro может транскрибироваться.
- В присутствии белков cI cI . может транскрибироваться только ген
- При высокой концентрации cI подавляются транскрипции обоих генов.
-
Некоторые пары оснований выполняют двойную функцию: промотор и оператор для белков cl и cro.
-
Белок cl включен, при этом репрессор, связанный с полимеразой OR2, увеличивается, а OR1 выключается.
-
Репрессия лизогена во всех трех связанных сайтах встречается редко из-за слабого сродства связывания OR3. Репрессия OR1 увеличивает аффинность связывания с OR2 за счет взаимодействия репрессора-репрессора. Повышенные концентрации репрессора усиливают связывание.
Обзор функций белка
[ редактировать ]| Белок | Функция в жизненном цикле | Регион-промоутер | Описание |
|---|---|---|---|
| III | Регуляторный белок CIII. Лизогения, стабильность cII | П Л | (Четкий 3) HflB Связывающий белок (FtsH) защищает cII от деградации протеазами. |
| cII | Лизогения, активатор транскрипции | П Р | (Очистить 2) Активирует транскрипцию с промоторов P AQ , P RE и PI , транскрибируя cI и int . Низкая стабильность из-за чувствительности к клеточным протеазам HflB (FtsH) (особенно в здоровых клетках и клетках, подвергающихся SOS-ответу). Высокие уровни cII подтолкнут фаг к интеграции и лизогении, тогда как низкие уровни cII приведут к лизису. |
| Там | Репрессор, поддержание лизогении | П РМ , П РЭ | (Четкий 1) Ингибитор транскрипции, связывает O R 1, O R 2 и O R 3 (аффинность O R 1 > O R 2 = O R 3, т.е. преимущественно связывает O R 1). В низких концентрациях блокирует промотор PR ( предотвращая продукцию кронов). В высоких концентрациях подавляет собственную продукцию посредством связывания O R 3. Репрессор также ингибирует транскрипцию с промотора PL . Подвержен расщеплению RecA * в клетках, подвергающихся SOS-ответу. |
| кро | Лизис, контроль над оператором репрессора | П Р | Ингибитор транскрипции связывает O R 3, O R 2 и O R 1 (аффинность O R 3 > O R 2 = O R 1, т.е. преимущественно связывает O R 3). В низких концентрациях блокирует промотор pRM (предотвращая выработку cI ). В высоких концентрациях подавляет собственную продукцию посредством связывания O R 2 и O R 1. Нет кооперативного связывания (см. ниже связывание cI) |
| ТО | Лизис, репликация ДНК | П Р | Репликационный белок O. Инициирует репликацию ДНК фага Lambda путем связывания в сайте ori . |
| П | Лизис, репликация ДНК | П Р | Инициирует репликацию ДНК фага лямбда путем связывания с субъединицей O и DnaB . Эти связывания обеспечивают контроль над ДНК-полимеразой хозяина. |
| граммы | Лизис, репликация ДНК | П Л | Предотвращает RecBCD разрушение 3'-концов нуклеазой репликации по катящемуся кругу хозяина, обеспечивая продолжение . |
| С | Лизис | П Р' | Холин , мембранный белок, который перфорирует мембрану во время лизиса. |
| Р | Лизис | П Р' | Эндолизин , лизоцим, фермент, который выходит из клетки через отверстия, образованные холином, и расщепляет клеточную стенку. |
| Рз и Рз1 | Лизис | П Р' | Образует мембранный белковый комплекс, который разрушает внешнюю клеточную мембрану после разрушения клеточной стенки эндолизином. Спанин, Rz1 (субъединица внешней мембраны) и Rz (субъединица внутренней мембраны). |
| Ф | Лизис | П Р' | Белки головки фагового капсида. |
| Д | Лизис | П Р' | Белок для украшения головы. |
| И | Лизис | П Р' | Главный головной белок. |
| С | Лизис | П Р' | Минорный капсидный белок. |
| Б | Лизис | П Р' | Портальный белок Б. |
| А | Лизис | П Р' | Большой белок-терминаза. |
| Дж | Лизис | П Р' | Белок специфичности хозяина J. |
| МВУГЛТЗ | Лизис | П Р' | Минорный хвостовой белок М. |
| К | Лизис | П Р' | Вероятная эндопептидаза. |
| ЧАС | Лизис | П Р' | Хвостовая рулетка, белок H. |
| я | Лизис | П Р' | Белок сборки хвоста I. |
| БЫТЬ | Лизис | П Р' | ДНК-упаковывающий белок FI. |
| БЫТЬ | Лизис | П Р' | Белок крепления хвоста. |
| тфа | Лизис | П Р' | Белок сборки хвостового волокна. |
| интервал | Интеграция генома, удаление | П И , П Л | Интеграза управляет вставкой генома фага в геном хозяина. В условиях низкой концентрации int эффекта нет. Если xis концентрация низкая, а int высокая, это приводит к внедрению фагового генома. Если xis и int имеют высокие (и примерно равные) концентрации, это приводит к вырезанию фаговых геномов из генома хозяина. |
| комфорт | Удаление генома | П И , П Л | Эксцизионаза и регулятор внутреннего белка управляют вырезанием и вставкой фагового генома в геном хозяина. |
| Н | Антитерминация транскрипции поздних ранних генов | П Л | Антитерминатор , РНК-связывающий белок и кофактор РНК-полимеразы, связывает РНК (в сайтах ореха) и переносится на зарождающийся РНКпол, который только что транскрибировал сайт ореха. Эта модификация РНКпола предотвращает распознавание сайтов терминации, поэтому нормальные сигналы терминации РНК-полимеразы игнорируются, и синтез РНК продолжается в дистальных генах фага ( cII, cIII, xis, int, O, P, Q ). |
| вопрос | Антитерминация транскрипции поздних литических генов | П Р | Антитерминатор , ДНК-связывающий белок и кофактор РНКпола, связывает ДНК (в сайтах Qut) и переносится на инициирующую РНКпол. Эта модификация RNApol изменяет распознавание терминирующих последовательностей, поэтому нормальные последовательности игнорируются; эффективны специальные терминирующие последовательности Q, расположенные на расстоянии около 20 000 п.н. Q-расширенные транскрипты включают структурные белки фага (AF, ZJ) и гены лизиса ( S, R, Rz и Rz1 ). Снижение уровня регуляции антисмысловой мРНК P antiq во время лизогении. |
| РекА | SOS-ответ | Белок-хозяин | Белок репарации ДНК действует как копротеаза во время SOS-ответа, автоматически расщепляя LexA и cI и способствуя лизису. |
Литический против лизогенного
[ редактировать ]
Здесь существует важное различие между этими двумя решениями; лизогения и лизис при инфекции, а также продолжающаяся лизогения или лизис профага. Последнее определяется исключительно активацией RecA в SOS-ответе клетки, как подробно описано в разделе индукции. Это также повлияет на первого; клетка, подвергающаяся SOS-ответу, всегда будет лизирована, поскольку белок cI не сможет накапливаться. Однако первоначальное литическое/лизогенное решение об инфекции также зависит от белков cII и cIII.
В клетках с достаточным количеством питательных веществ высока активность протеаз, расщепляющих cII. Это приводит к литическому образу жизни. В клетках с ограниченным количеством питательных веществ активность протеазы низкая, что делает cII стабильным. Это приводит к лизогенному образу жизни. cIII, по-видимому, стабилизирует cII как напрямую, так и действуя в качестве конкурентного ингибитора соответствующих протеаз. Это означает, что клетка, «попавшая в беду», т. е. испытывающая недостаток питательных веществ и находящаяся в более спящем состоянии, с большей вероятностью будет лизогенизироваться. Это будет выбрано потому, что теперь фаг может бездействовать в бактерии до тех пор, пока не наступят лучшие времена, и, таким образом, фаг может создавать больше копий самого себя с доступными дополнительными ресурсами и с более вероятной близостью дальнейших инфекционных клеток.
Полную биофизическую модель для принятия решения о лизисе-лизогении лямбды еще предстоит разработать. Компьютерное моделирование и моделирование позволяют предположить, что случайные процессы во время инфекции приводят к выбору лизиса или лизогении внутри отдельных клеток. [ 26 ] Однако недавние эксперименты показывают, что физические различия между клетками, существующие до заражения, предопределяют, будет ли клетка лизироваться или станет лизогеном. [ 27 ]
Как генетический инструмент
[ редактировать ]Фаг лямбда широко использовался в качестве модельного организма и стал отличным инструментом сначала в микробной генетике , а затем и в молекулярной генетике . [ 28 ] Некоторые из его применений включают применение в качестве вектора для клонирования рекомбинантной ДНК ; использование сайт-специфической рекомбиназы (int) для перетасовки клонированных ДНК методом шлюза ; [ 29 ] и применение его красного оперона , включая белки Red альфа (также называемый «экзо»), бета и гамма, в методе инженерии ДНК, называемом рекомбинированием . Фрагмент ДНК фага лямбда длиной 48 т.п.н. не является необходимым для продуктивной инфекции и может быть заменен чужеродной ДНК. [ 30 ] который затем может быть реплицирован фагом. Фаг лямбда легче проникает в бактерии, чем в плазмиды, что делает его полезным вектором, который может либо разрушить ДНК хозяина, либо стать его частью. [ 31 ] Фагом лямбда также можно манипулировать и использовать в качестве противораковой вакцины, нацеленной на аспартил (аспарагинил) β-гидроксилазу человека (ASPH, HAAH), которая, как было показано, полезна в случаях гепатоцеллюлярной карциномы у мышей. [ 32 ] Фаг лямбда также сыграл важную роль в изучении специализированной трансдукции . [ 33 ]
См. также
[ редактировать ]- Эстер Ледерберг
- Семья лямбда холинов
- Маркер размера молекулярной массы
- Санкар Адхья
- Зиготическая индукция
- Коринебактериофаги - коринефаги β (бета) и ω (омега) являются (предполагаемыми) представителями рода Lambdavirus.
Ссылки
[ редактировать ]- ^ Падилья-Санчес В (16 июля 2021 г.). «Структурная модель бактериофага лямбда с атомным разрешением» . дои : 10.5281/zenodo.5134493 . Проверено 24 июля 2021 г.
- ^ Ледерберг Э. (январь 1950 г.). «Лизогенность штамма Escherichia coli К-12». Бюллетень микробной генетики . 1 :5–8. ; с последующим Ледерберг Э.М., Ледерберг Дж. (январь 1953 г.). «Генетические исследования лизогенности Escherichia Coli» . Генетика . 38 (1): 51–64. дои : 10.1093/генетика/38.1.51 . ПМК 1209586 . ПМИД 17247421 .
- ^ Гриффитс А., Миллер Дж., Сузуки Д., Левонтин Р., Гелбарт В. (2000). Введение в генетический анализ (7-е изд.). Нью-Йорк: WH Freeman. ISBN 978-0-7167-3520-5 . Проверено 19 мая 2017 г.
- ^ Ван С., Цзэн Дж., Ван Дж. (апрель 2022 г.). «Структурные основы созревания капсида бактериофага лямбда» . Структура . 30 (4): 637–645.е3. дои : 10.1016/j.str.2021.12.009 . ПМИД 35026161 . S2CID 245933331 .
- ^ Jump up to: а б с д Раджагопала С.В., Касьенс С., Утц П. (сентябрь 2011 г.). «Карта белкового взаимодействия бактериофага лямбда» . БМК Микробиология . 11 : 213. дои : 10.1186/1471-2180-11-213 . ПМК 3224144 . ПМИД 21943085 .
- ^ Jump up to: а б с д и Касьенс С.Р., Хендрикс Р.В. (май 2015 г.). «Бактериофаг лямбда: пионер и все еще актуален» . Вирусология . 479–480: 310–330. дои : 10.1016/j.virol.2015.02.010 . ПМК 4424060 . ПМИД 25742714 .
- ^ «Фаг эшерихии Лямбда, полный геном» . 6 января 2020 г.
- ^ Jump up to: а б Кэмпбелл AM (1996). «Бактериофаги». В Neidhardt FC, Кёртисс Р. (ред.). Escherichia coli и Salmonella typhimurium : клеточная и молекулярная биология . Вашингтон, округ Колумбия: ASM Press. OCLC 1156862867 .
- ^ Вертс К., Мишель В., Хофнунг М., Чарбит А. (февраль 1994 г.). «Адсорбция бактериофага лямбда на белке LamB Escherichia coli K-12: точечные мутации в гене J лямбда, ответственном за расширение круга хозяев» . Журнал бактериологии . 176 (4): 941–947. дои : 10.1128/jb.176.4.941-947.1994 . ПМК 205142 . ПМИД 8106335 .
- ^ Эрни Б., Занолари Б., Кочер Х.П. (апрель 1987 г.). «Манозопермеаза Escherichia coli состоит из трех различных белков. Аминокислотная последовательность и функция в транспорте сахара, фосфорилировании сахара и проникновении ДНК фага лямбда» . Журнал биологической химии . 262 (11): 5238–5247. дои : 10.1016/S0021-9258(18)61180-9 . ПМИД 2951378 .
- ^ Лю X, Цзэн Дж, Хуан К., Ван Дж (август 2019 г.). «Строение маннозного переносчика бактериальной фосфотрансферазной системы» . Клеточные исследования . 29 (8): 680–682. дои : 10.1038/s41422-019-0194-z . ПМК 6796895 . ПМИД 31209249 .
- ^ Кобилер О., Рокни А., Оппенгейм А.Б. (апрель 2007 г.). «Фаг лямбда CIII: ингибитор протеазы, регулирующий решение лизис-лизогении» . ПЛОС ОДИН . 2 (4): е363. Бибкод : 2007PLoSO...2..363K . дои : 10.1371/journal.pone.0000363 . ПМЦ 1838920 . ПМИД 17426811 .
- ^ Хенкин, Тина М.; Питерс, Джозеф Э. (2020). «Бактериофаги и трансдукция». Молекулярная генетика бактерий Снайдера и Чампнесса (Пятое изд.). Хобокен, Нью-Джерси: John Wiley & Sons, Inc., стр. 293–294. ISBN 9781555819750 .
- ^ Jump up to: а б Сантанджело Т.Дж., Арцимович I (май 2011 г.). «Терминация и антитерминация: РНК-полимераза запускает знак остановки» . Обзоры природы. Микробиология . 9 (5): 319–329. дои : 10.1038/nrmicro2560 . ПМК 3125153 . ПМИД 21478900 .
- ^ Томасон LC, Шильц CJ, Корт C, Хосфорд CJ, Адамс MC, Чаппи Дж.С., Корт DL (октябрь 2021 г.). «Функции бактериофага λ RexA и RexB способствуют переходу от лизогении к литическому росту» . Молекулярная микробиология . 116 (4): 1044–1063. дои : 10.1111/mmi.14792 . ПМЦ 8541928 . ПМИД 34379857 .
- ^ Дейган П., Хохшильд А. (февраль 2007 г.). «Антитерминаторный белок бактериофага лямбдаQ регулирует позднюю экспрессию генов как стабильный компонент комплекса элонгации транскрипции» . Молекулярная микробиология . 63 (3): 911–920. дои : 10.1111/j.1365-2958.2006.05563.x . ПМИД 17302807 .
- ^ Браммар В.Дж., Хэдфилд С. (ноябрь 1984 г.). «Программа построения фага лямбда». Журнал эмбриологии и экспериментальной морфологии . 83 (Приложение): 75–88. ПМИД 6241940 .
- ^ Гусман П., Гуарнерос Г. (март 1989 г.). «Генетические сайты фага, участвующие в ингибировании роста лямбда рэп-мутантом Escherichia coli» . Генетика . 121 (3): 401–409. дои : 10.1093/генетика/121.3.401 . ПМК 1203628 . ПМИД 2523838 .
- ^ Грот AC, депутат Калоса (январь 2004 г.). «Фаговые интегразы: биология и приложения». Журнал молекулярной биологии . 335 (3): 667–678. дои : 10.1016/j.jmb.2003.09.082 . ПМИД 14687564 .
- ^ Мишод Р.Э., Бернштейн Х., Недельку А.М. (май 2008 г.). «Адаптационное значение пола у микробных патогенов». Инфекция, генетика и эволюция . 8 (3): 267–285. дои : 10.1016/j.meegid.2008.01.002 . ПМИД 18295550 .
- ^ Хаски Р.Дж. (апрель 1969 г.). «Реактивация множественности как тест на функцию рекомбинации». Наука . 164 (3877): 319–320. Бибкод : 1969Sci...164..319H . дои : 10.1126/science.164.3877.319 . ПМИД 4887562 . S2CID 27435591 .
- ^ Бланко М., Деворет Р. (март 1973 г.). «Механизмы восстановления, участвующие в реактивации профагов и УФ-реактивации УФ-облученного фага лямбда». Мутационные исследования . 17 (3): 293–305. дои : 10.1016/0027-5107(73)90001-8 . ПМИД 4688367 .
- ^ «Барбара Дж. Мейер» . HHMI интерактивный .
- ^ Берц Д.С., Беккет Д., Бенсон Н., Акерс Г.К. (июль 1994 г.). «Самосборка репрессора бактериофага лямбда cI: влияние односайтовых мутаций на равновесие мономер-димер». Биохимия . 33 (28): 8399–8405. дои : 10.1021/bi00194a003 . ПМИД 8031775 .
- ^ Пташне М (2004). Генетический переключатель: новый взгляд на фаг лямбда (3-е изд.). Колд-Спринг-Харбор, Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор. п. 112. ИСБН 978-0-87969-716-7 .
- ^ Аркин А., Росс Дж., МакАдамс Х.Х. (август 1998 г.). «Стохастический кинетический анализ бифуркации путей развития в клетках Escherichia coli, инфицированных фагом лямбда» . Генетика . 149 (4): 1633–1648. дои : 10.1093/генетика/149.4.1633 . ПМК 1460268 . ПМИД 9691025 .
- ^ Сен-Пьер Ф., Энди Д. (декабрь 2008 г.). «Определение выбора судьбы клеток при инфекции фагом лямбда» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (52): 20705–20710. Бибкод : 2008PNAS..10520705S . дои : 10.1073/pnas.0808831105 . ПМК 2605630 . ПМИД 19098103 .
- ^ Питре, Эммануэль; те Велтуис, Артьян Дж.В. (01 января 2021 г.), Кэмерон, Крейг Э.; Арнольд, Джейми Дж.; Кагуни, Лори С. (ред.), «Глава четвертая. Понимание репликации и транскрипции вируса с использованием методов одиночных молекул» , Ферменты , ферменты репликации вируса и их ингибиторы, часть A, 49 , Academic Press: 83–113, doi : 10.1016. /bs.enz.2021.07.005 , PMID 34696840 , S2CID 239573473 , получено 28 ноября 2023 г.
- ^ Рис-Хойс, Джон С.; Уолхаут, Альберта Дж. М. (01 января 2018 г.). «Шлюзовое рекомбинационное клонирование» . Протоколы Колд-Спринг-Харбора . 2018 (1): pdb.top094912. дои : 10.1101/pdb.top094912 . ISSN 1940-3402 . ПМК 5935001 . ПМИД 29295908 .
- ^ Фейс, Майкл; Каталано, Карлос Энрике (2013), «Лямбда-терминаза бактериофага и механизм упаковки вирусной ДНК» , База данных биологических наук мадам Кюри [Интернет] , Landes Bioscience , получено 28 ноября 2023 г.
- ^ Смит, Джордж П. (1985). «Нитевидный слитый фаг: новые векторы экспрессии, которые отображают клонированные антигены на поверхности вириона» . Наука . 228 (4705): 1315–1317. Бибкод : 1985Sci...228.1315S . дои : 10.1126/science.4001944 . ISSN 0036-8075 . JSTOR 1694587 . ПМИД 4001944 .
- ^ Ивагами, Ёсифуми; Казулли, Сара; Нагаока, Кацуя; Ким, Миран; Карлсон, Рольф И.; Огава, Косукэ; Лебовиц, Майкл С.; Фуллер, Стив; Бисвас, Бисваджит; Стюарт, Соломон; Донг, Сяоцюнь; Ганбари, Хосейн; Уандс, Джек Р. (2017). «Вакцина на основе лямбда-фага индуцирует противоопухолевый иммунитет при гепатоцеллюлярной карциноме» . Гелион . 3 (9): e00407. Бибкод : 2017Heliy...300407I . doi : 10.1016/j.heliyon.2017.e00407 . ПМК 5619992 . ПМИД 28971150 .
- ^ «7.14E: Бактериофаг Лямбда как вектор клонирования» . Свободные тексты по биологии . 17 мая 2017 г. Проверено 28 ноября 2023 г.
Дальнейшее чтение
[ редактировать ]- Уотсон Дж., Бейкер Т., Белл С., Ганн А., Левин М., Лосик Р. Молекулярная биология гена (международное издание) (6-е изд.).
- Пташне М. , Хопкинс Н. (август 1968 г.). «Операторы, управляемые репрессором фага лямбда» . Труды Национальной академии наук Соединенных Штатов Америки . 60 (4): 1282–7. Бибкод : 1968PNAS...60.1282P . дои : 10.1073/pnas.60.4.1282 . ПМК 224915 . ПМИД 5244737 .
- Мейер Б.Дж., Клейд Д.Г., Пташне М. (декабрь 1975 г.). «Лямбда-репрессор выключает транскрипцию собственного гена» . Труды Национальной академии наук Соединенных Штатов Америки . 72 (12): 4785–89. Бибкод : 1975PNAS...72.4785M . дои : 10.1073/pnas.72.12.4785 . ПМЦ 388816 . ПМИД 1061069 .
- Брюссов Х., Хендрикс Р.В. (январь 2002 г.). «Фаговая геномика: маленькое — красивое» . Клетка . 108 (1): 13–16. дои : 10.1016/S0092-8674(01)00637-7 . ПМИД 11792317 .
- Додд И.Б., Ширвин К.Е., Иган Дж.Б. (апрель 2005 г.). «Пересмотр регуляции генов в бактериофаге лямбда». Текущее мнение в области генетики и развития . 15 (2): 145–152. дои : 10.1016/j.где.2005.02.001 . ПМИД 15797197 .
- Фридман Д.И., Суд Д.Л. (апрель 2001 г.). «Бактериофаг лямбда: жив-здоров и все еще делает свое дело». Современное мнение в микробиологии . 4 (2): 201–207. дои : 10.1016/S1369-5274(00)00189-2 . ПМИД 11282477 .
- Готтесман М.Е., Вайсберг Р.А. (декабрь 2004 г.). «Маленькая лямбда, кто тебя создал?» . Обзоры микробиологии и молекулярной биологии . 68 (4): 796–813. дои : 10.1128/MMBR.68.4.796-813.2004 . ПМК 539004 . ПМИД 15590784 .
- Хендрикс Р.В., Смит М.К., Бернс Р.Н., Форд М.Э., Хэтфулл Г.Ф. (март 1999 г.). «Эволюционные взаимоотношения между различными бактериофагами и профагами: весь мир — фаг» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (5): 2192–2197. Бибкод : 1999PNAS...96.2192H . дои : 10.1073/pnas.96.5.2192 . ПМК 26759 . ПМИД 10051617 .
- Китано Х (март 2002 г.). «Системная биология: краткий обзор». Наука . 295 (5560): 1662–1664. Бибкод : 2002Sci...295.1662K . дои : 10.1126/science.1069492 . ПМИД 11872829 . S2CID 2703843 .
- Пташне, М. «Генетический переключатель: новый взгляд на лямбду фага», 3-е издание, 2003 г.
- Пташне М (июнь 2005 г.). «Регуляция транскрипции: от лямбды к эукариотам» . Тенденции биохимических наук . 30 (6): 275–279. дои : 10.1016/j.tibs.2005.04.003 . ПМИД 15950866 .
- Снайдер Л., Чемпнесс В. (2007). Молекулярная генетика бактерий (3-е изд.). (Содержит информативный и хорошо иллюстрированный обзор бактериофага лямбда)
- «Бактериофаговая лямбда-инфекция» . Сплэшо . Архивировано из оригинала 19 марта 2014 г. (изображены гены, активные на всех стадиях жизненного цикла).
Внешние ссылки
[ редактировать ]- Жизненный цикл, базовая анимация жизненного цикла лямбда (иллюстрирует инфекцию и литические/лизогенные пути с некоторыми подробностями о белках и транскрипции)
- Видео покадровой микроскопии из Массачусетского технологического института, показывающее как лизис, так и лизогению с помощью фага лямбда.
- Жизненный цикл лямбда-фага (базовая визуальная демонстрация жизненного цикла лямбда-бактериофага)
- Геном лямбда-фага в GenBank
- Эталонный протеом лямбда-фага от UniProt
- Структуры белка лямбда-фага в NCBI (3D-отображение белковых структур бактериофага лямбда)