Маркер размера молекулярной массы

Маркер размера молекулярной массы , также называемый белковой лестницей , ДНК -лестницей или РНК- лестницей , представляет собой набор стандартов , которые используются для определения приблизительного размера молекулы, проходящей через гель во время электрофореза , используя принцип , согласно которому молекулярная масса вес обратно пропорционален скорости миграции через гелевую матрицу. Следовательно, при использовании в гель-электрофорезе маркеры эффективно обеспечивают логарифмическую шкалу , по которой можно оценить размер других фрагментов (при условии, что известны размеры фрагментов маркера).
Маркеры белка, ДНК и РНК с заранее определенными размерами и концентрациями фрагментов коммерчески доступны. Их можно проводить в агарозном или полиакриламидном геле . Маркеры загружаются на дорожки, прилегающие к дорожкам для проб, перед началом анализа.
ДНК-маркеры
[ редактировать ]
Разработка
[ редактировать ]Хотя концепция маркеров молекулярной массы сохранилась, методы разработки с течением времени менялись. Новые изобретения маркеров молекулярной массы распространяются в наборах, специфичных для типа маркера.
Первой проблемой при разработке маркеров было достижение высокого разрешения по всей длине маркера. [1] В зависимости от условий гель-электрофореза фрагменты могли сжиматься, нарушая прозрачность. Для решения этой проблемы в 1990 году был разработан набор для Саузерн-блот -анализа, предоставивший первый маркер, сочетающий в себе целевую ДНК и ДНК-зонд. В этом методе использовались преимущества логарифмического интервала, и его можно было использовать для идентификации целевых полос длиной более 20 000 нуклеотидов . [2]
Дизайн
[ редактировать ]Существует два распространенных метода создания маркера размера молекулярной массы ДНК. [3] Один из таких методов использует технику частичного лигирования . [3] Лигирование ДНК — это процесс, при котором линейные фрагменты ДНК соединяются друг с другом ковалентными связями ; более конкретно, эти связи представляют собой фосфодиэфирные связи . [4] Здесь фрагмент дуплексной ДНК длиной 100 пар оснований частично лигирован. Следствием этого является образование димеров 200 п.н., тримеров 300 п.н., тетрамеров 400 п.н., пентамеров 500 п.н. и т. д. Кроме того, останется часть дцДНК длиной 100 п.н. В результате «лестница» ДНК, состоящая из фрагментов ДНК известной молекулярной массы . на геле создается [3]
Второй метод предполагает использование ферментов рестрикции и известной последовательности ДНК. [3] ДНК переваривается определенным ферментом рестрикции, в результате чего образуются фрагменты ДНК различной молекулярной массы. Одним из преимуществ этого метода является то, что можно легко создать больше маркеров, просто переварив больше известной ДНК. [3] С другой стороны, размер фрагментов ДНК зависит от мест, где разрезается фермент рестрикции. Это затрудняет контроль размера фрагментов в маркере. [5]
Совсем недавно в лабораториях начал использоваться другой метод создания маркеров размера молекулярной массы ДНК. Эта стратегия предполагает использование полимеразной цепной реакции (ПЦР) . [5] Это достигается одним или двумя способами: 1) мишень ДНК амплифицируется одновременно с помощью наборов праймеров или 2) различные мишени ДНК амплифицируются независимо с помощью определенных праймеров. [5]
Эффекты условий геля
[ редактировать ]Как и в случае с экспериментальными образцами, условия геля могут влиять на маркер размера молекулярной массы, который проходит рядом с ними. Такие факторы, как буфер , заряд/ напряжение и концентрация геля, могут повлиять на подвижность и/или внешний вид вашего маркера/лестницы/стандарта. Эти элементы необходимо учитывать при выборе маркера и при анализе конечных результатов на геле.

- Буферы
- Буферы действуют: 1) устанавливают pH и 2) обеспечивают ионы для поддержания проводимости. При электрофорезе ДНК TAE (трис-ацетат-ЭДТА) и TBE (трис-борат-ЭДТА) . обычно предпочтительными буферами являются [6] Буфер TBE предпочтителен для небольших фрагментов ДНК, тогда как TAE лучше подходит для фрагментов длиной более 1500 пар оснований. Что касается буферной емкости, TAE ниже по сравнению с TBE; обычно это приводит к замедлению подвижности ДНК. TBE также обеспечивает лучшее разрешение. [7]
- Следует отметить, что вода не может заменить один из этих буферов, поскольку ДНК не будет мигрировать по гелю. [6] Кроме того, использование воды вместо буфера приведет к плавлению геля . [8]
- Заряд/напряжение
- Что касается напряжения, рекомендуемый диапазон составляет от 4 до 10 В/см (т. е. вольт/см). [8] Агарозные гели обычно работают при напряжении 5 В/см. [3] [6] Единица расстояния, см , относится к расстоянию между электродами (т. е. анодом и катодом ), а не к длине самого геля. [3] [6]
- Напряжения, находящиеся слишком ниже или выше этого диапазона, повлияют на подвижность и разрешение полос. Низкое напряжение уменьшит подвижность и приведет к расширению полос. С другой стороны, высокие напряжения уменьшают разрешение полос. Во многом это связано с тем, что слишком высокое напряжение может привести к перегреву и даже плавлению геля. [8]
- Концентрация
- При выборе маркера необходимо учитывать концентрацию агарозы. геля Процент влияет на миграцию ДНК. [3] [6] Как правило, чем выше концентрация геля, тем медленнее скорость движения ДНК через гель. И это в дополнение к роли молекулярной массы в миграции маркера или образца ДНК, то есть чем выше молекулярная масса, тем медленнее будет мигрировать ДНК. [3] [6]
- Концентрация геля также влияет на возможность визуализировать выходящие из геля полосы. Полосы меньшего размера лучше разрешаются на геле с более высоким процентным содержанием, тогда как полосы с увеличенной молекулярной массой легче визуализируются на геле с более низким процентным содержанием. [6]
Белковые маркеры
[ редактировать ]Разработка
[ редактировать ]Ранее белковые маркеры были разработаны с использованием различных цельных белков. Разработка набора, включающего маркер размера молекулярной массы на основе белковых фрагментов, началась в 1993 году. Этот белковый маркер, состоящий из 49 различных аминокислотных последовательностей, включал мультидоменные белки и позволял анализировать белки, расщепленные в разных сайтах. [9]
Текущие усовершенствования техники белковых маркеров включают использование саморазвития. Первый автоматически разработанный белковый маркер регулярного веса был изобретен в 2012 году. [10]
Дизайн
[ редактировать ]Подобно маркерам ДНК, эти маркеры обычно состоят из очищенных белков, молекулярные массы которых уже известны. [3] В приведенном ниже списке указаны некоторые белки, а также их молекулярная масса, которые обычно используются при создании белковых маркеров.

| Белок | Молекулярная масса ( кДа ) |
| Бета-галактозидаза | 120 [11] |
| Фосфорилаза Б | 94 [3] [12] |
| Бычий сывороточный альбумин (БСА) | 67 [3] [12] |
| Овальбумин | 43 [3] |
| Индейский альбумин | 40 [12] |
| Карбоангидраза | 30 [3] [12] |
| соевого трипсина Ингибитор | 20.1 [3] [12] |
| а-лактальбумин | 14.4 [3] [12] |
| Лизоцим | 14 [13] |
Выбор правильного белкового маркера
[ редактировать ]Маркеры размера молекулярной массы можно разделить на две категории: маркеры молекулярной массы и маркеры молекулярной лестницы. [14] Маркеры бывают окрашенными или неокрашенными, и в зависимости от обстоятельств один может оказаться более подходящим, чем другой. Маркеры размера молекулярной массы также могут быть изменены биохимически. [15] Конъюгация с биотином является наиболее распространенной. Маркеры размера молекулярной массы чаще всего используются при электрофорезе в SDS-полиакриламидном геле и вестерн-блоттинге .Учитывая разнообразие типов и способов применения маркеров размера молекулярной массы, важно выбрать соответствующий белковый стандарт. Помимо наиболее распространенного использования в качестве способа расчета молекулярной массы образцов, другие применения включают предоставление визуального доказательства миграции белка и эффективности переноса, а иногда даже используются для положительного контроля. [16]
- Маркер MW против протеиновых лестниц
- Маркер молекулярной массы представляет собой один из типов белкового стандарта. Они могут быть предварительно окрашенными или неокрашенными перед загрузкой; в зависимости от типа эксперимента один может быть более выгодным. В любом случае они обычно анализируются на внешней дорожке геля, а образец загружается на средних дорожках. [14] Молекулярные маркеры отличаются от белковых лестниц тем, что они состоят из смеси нативных белков, характеристики которых хорошо классифицированы, но не соответствуют целым числам. [14] Как правило, они намного дешевле, но анализ позволяет определить только приблизительную стоимость белков, выделенных электрофорезом. [14]
- Белковая лестница — это еще один тип белкового стандарта. Они почти всегда окрашены. [14] Белковые лестницы отличаются от молекулярных маркеров тем, что они состоят из смеси высокоочищенных белков, характеристики которых известны и соответствуют целым числам. [14] Обычно белковые лестницы состоят из 10–12 белков. [14] В конце эксперимента, после того как произойдет миграция размеров, одна полоса будет представлять размер каждого белка, содержащегося в лестнице. [17] Маркеры расположены равномерно, и анализ размера с использованием этих маркеров позволяет точно определить значение интересующего белка. В некоторых случаях в качестве метода молекулярного подтверждения маркеры MW сравниваются с белковыми лестницами для проверки. [14]
- Предварительно окрашенные и неокрашенные маркеры
- Белковые маркеры могут быть неокрашенными или предварительно окрашенными, но оба имеют свои преимущества и недостатки. [18] Простая визуализация разделения и переноса белков стала возможной благодаря использованию предварительно окрашенных маркеров. [18] Их обычно используют как при электрофорезе в полиакриламидном геле с ДСН, так и при вестерн-блоттинге. В SDS-PAGE он позволяет контролировать миграцию белка, поскольку полосы белка разделяются и их можно увидеть во время электрофореза. В вестерн-блоттинге окрашенные стандарты белка позволяют визуализировать перенос белка на мембрану. [17] Однако определение размера с помощью этих маркеров не столь точное (более подробное объяснение см. в разделе «Рекомбинантные и природные маркеры»). [18]
- Хотя неокрашенные маркеры позволяют более точно определить размер, их нельзя просмотреть во время действия геля. Таким образом, гель необходимо окрасить, чтобы визуализировать полосы. [19]
- Рекомбинантные и природные маркеры
- Помимо окрашенных и неокрашенных маркеров, белковые маркеры можно рассматривать как рекомбинантные и природные. [18] Рекомбинантные маркеры состоят из рекомбинантных белков, прошедших тщательную очистку. Эти маркеры разработаны таким образом, чтобы подчеркнуть определенные характеристики. [18] Примеры этих характеристик включают аффинные метки и молекулярные массы, которые равномерно расположены относительно друг друга. [18]
- Природные маркеры, как следует из названия, представляют собой смесь белков, которые встречаются в природе. [18] Предварительно окрашенные натуральные маркеры хорошо подходят для визуализации разделения геля. Однако эти маркеры имеют тенденцию связываться с пятном ковалентным образом в разных количествах и в разных положениях. [18] Следовательно, результирующие полосы могут быть шире. Это особенно актуально при сравнении с предварительно окрашенными рекомбинантными маркерами. Из-за этого эффекта определение молекулярной массы, вероятно, будет менее точным с использованием предварительно окрашенных природных маркеров. [18]
- Биохимически измененный
- Стандарты белка также можно изменить химически. Распространенным изменением является использование биотина . Биотин имеет очень высокое сродство к стрептавидину , поэтому связывание образует очень прочный комплекс. Для визуализации к стрептавидину прикрепляют цветную метку. [15]
Эффекты условий геля
[ редактировать ]Как и при электрофорезе ДНК, при выборе белкового маркера следует учитывать такие условия, как буферы, заряд/напряжение и концентрация.
- Буферы
- Буферы могут влиять на подвижность как маркера, так и образцов. pH буфера варьируется в зависимости от используемой системы и, следовательно, каждая буферная система будет иметь различное влияние на заряд белка или белков. [20] Кроме того, в случае SDS-PAGE на аффинность связывания SDS может влиять система буферизации. [20] Даже при использовании одного и того же процентного содержания и типа геля одни и те же белки будут мигрировать с разной скоростью в зависимости от используемого буфера. [20]
- Заряд/напряжение
- Напряжение играет роль в подвижности белков в геле. Белки будут мигрировать быстрее при более высоких напряжениях. Следовательно, время действия геля будет короче. И наоборот, более высокие напряжения могут привести к большей диффузии зон. [20] Кроме того, если напряжение слишком велико, температура в камере электрофореза может стать такой, что гель начнет плавиться. [20]
- Напряжение, при котором должен работать гель, зависит от типа геля. Для некоторых гелей напряжение остается постоянным на протяжении всего цикла, тогда как для других гелей начальное напряжение может оставаться постоянным в течение определенного времени, прежде чем оно будет увеличено. [20] Это второе напряжение затем используется в течение определенного периода времени, после чего его также можно увеличить. [20]
- Концентрация
- По процентному содержанию гели, используемые для электрофореза белков, можно разделить на однопроцентные и градиентные гели. [18] Однопроцентные гели еще называют линейными гелями. [20] Для линейных гелей выбранный процент обычно составляет от 7,5% до 20%. [18] Обычные процентные диапазоны для градиентных гелей составляют 4–15% и 10–20%. Каждый вид геля имеет свои преимущества. [18] Например, линейные гели предпочтительнее, когда несколько белков имеют одинаковую молекулярную массу; лучшее разделение этих белков будет обеспечиваться линейным гелем. [18] С другой стороны, градиентные гели являются лучшим выбором, когда интересующие образцы содержат белки с совершенно разной молекулярной массой или которые охватывают широкий диапазон молекулярных масс. [18] [20]
РНК-маркеры
[ редактировать ]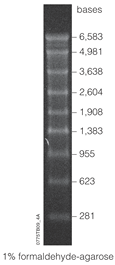
Разработка
[ редактировать ]Лестницы РНК, состоящие из маркеров размера молекулярной массы РНК, первоначально были разработаны с использованием метода синтетического круга. [21] для изготовления маркеров разного размера. Этот метод был усовершенствован изобретателем Эриком Т. Кулом для использования векторов кольцевой ДНК в качестве метода получения маркеров размера молекулярной массы РНК. Улучшения этого метода, называемые методом катящегося круга, обусловлены его эффективностью при синтезе олигонуклеотидов РНК . Из кольцевой матрицы ДНК можно получить одноцепочечную РНК длиной от 4 до 1500 п.о. без необходимости использования праймеров и путем переработки нуклеотидтрифосфата . ДНК также можно синтезировать из кольцевой матрицы, что повышает универсальность этого метода. По сравнению со стоковой транскрипцией , метод синтетического круга дает олигонуклеотиды РНК без стока. По сравнению с ПЦР , метод синтетического круга производит олигонуклеотиды РНК без необходимости использования полимеразы или термоциклера . Этот метод также экономически эффективен, поскольку позволяет синтезировать большие объемы продукта с меньшим количеством ошибок, чем машинные синтезаторы. [21]
Дизайн
[ редактировать ]Маркеры РНК состоят из транскриптов РНК различной увеличивающейся длины. Например, маркер Lonza 0,5-9 кбит/с. [22] имеет полосы, обозначающие 0,5, 1, 1,5, 2, 2,5, 3, 4, 5, 6 и 9 пар килобаз . Маркеры растворяются в буфере для хранения, таком как ЭДТА , и могут иметь срок годности до 2 лет при хранении при температуре -80 °C. Чтобы использовать маркер, например, для нозерн-блот-анализа, его сначала размораживают , а затем окрашивают, чтобы его можно было обнаружить при гель-электрофорезе. Одним из наиболее распространенных красителей, используемых для маркеров, является бромистый этидий .
Диапазон конкретного маркера относится к множеству полос, которые он может отображать. «Высокий» диапазон относится к относительно большим фрагментам (измеряется в т.п.н.), тогда как «низкий» диапазон относится к маркерам, которые различают небольшие фрагменты (измеряются в п.н.). Некоторые маркеры можно даже охарактеризовать как «сверхмалого диапазона». [16] но еще более точным является маркер микроРНК. Маркер микроРНК можно использовать для измерения фрагментов РНК в пределах дюжины нуклеотидов, например маркер микроРНК длиной 17–25 нуклеотидов. [23]
Использовать
[ редактировать ]При эквивалентной молекулярной массе РНК будет мигрировать быстрее, чем ДНК. Однако и РНК, и ДНК имеют отрицательный линейный наклон между расстоянием миграции и логарифмической молекулярной массой. [24] То есть образцы меньшего веса способны мигрировать на большее расстояние. Эту взаимосвязь следует учитывать при выборе маркеров РНК или ДНК в качестве стандарта.
При анализе РНК-маркеров и образцов РНК на геле важно предотвратить загрязнение нуклеазой , поскольку РНК очень чувствительна к деградации рибонуклеазой (РНКазой) посредством катализа . [25] [26] Таким образом, необходимо учитывать все материалы, которые будут использоваться в процедуре. Любая стеклянная посуда, которая будет контактировать с РНК, должна быть предварительно обработана диэтилпирокарбонатом (DEPC), а пластиковые материалы должны быть одноразовыми. [25]
Маркеры размера молекулярной массы и SDS-PAGE
[ редактировать ]
Одним из наиболее распространенных применений маркеров размера молекулярной массы является гель-электрофорез. Целью гель-электрофореза является разделение белков по физическим или химическим свойствам , которые включают заряд, размер молекулы и pH . При разделении по размеру идеальным методом является SDS-PAGE или электрофорез в полиакриламидном геле , при этом используются маркеры размера молекулярной массы. соответствующие стандарты для использования.
Гели могут различаться по размеру. Количество анализируемых образцов определит подходящий размер геля. Все гели разделены на дорожки, идущие параллельно через гель. Каждая полоса будет содержать определенный образец. Обычно стандарты размера молекулярной массы размещаются на внешней дорожке. Если гель имеет особенно большое количество дорожек, то для большей прозрачности поперек геля можно разместить несколько лестниц.
Белки и стандарты наносятся пипеткой на гель по соответствующим дорожкам. Додецилсульфат натрия (ДСН) взаимодействует с белками, денатурируя их и придавая им отрицательный заряд. Поскольку все белки имеют одинаковое соотношение заряда к массе, подвижность белков в геле будет зависеть исключительно от молекулярной массы. Как только электрическое поле будет включено, начнется миграция белка. По завершении можно использовать такой механизм обнаружения, как вестерн-блоттинг, который выявит наличие полос. Каждая полоса представляет собой определенный белок. Расстояние путешествия зависит исключительно от молекулярной массы; следовательно, молекулярную массу каждого белка можно определить путем сравнения расстояния неизвестного белка до стандарта известной молекулярной массы. [27]
Различные варианты использования маркеров размера молекулярной массы
[ редактировать ]Существует множество видов маркеров размера молекулярной массы, каждый из которых обладает уникальными характеристиками, что позволяет использовать их в ряде биологических методов. Выбор маркера размера молекулярной массы зависит от типа маркера (ДНК, РНК или белок) и предлагаемого диапазона длин (например, 1 т.п.н.). Прежде чем выбрать маркер размера молекулярной массы, важно ознакомиться с этими характеристиками и свойствами. В конкретном случае один тип может оказаться более подходящим, чем другой. Хотя конкретные маркеры могут различаться в зависимости от протокола для конкретного метода, в этом разделе будут описаны общие маркеры и их роль.
Аллозимы
[ редактировать ]Первым типом молекулярных маркеров, разработанных и использованных с помощью гель-электрофореза, были аллозимы . Эти маркеры используются для обнаружения вариаций белка. Слово «аллозим» (также известное как «аллофермент») происходит от « аллельных вариантов ферментов ». [28] При анализе геля белки разделяются по размеру и заряду. Хотя аллозимы могут показаться устаревшими по сравнению с другими доступными маркерами, они все еще используются сегодня, главным образом из-за их низкой стоимости. Одним из основных недостатков является то, что, поскольку доступно лишь ограниченное количество, специфичность является проблемой. [28]
Маркеры на основе ДНК (1960-е годы)
[ редактировать ]Хотя аллозимы могут обнаруживать изменения в ДНК, это делается косвенным методом и не очень точно. Маркеры на основе ДНК были разработаны в 1960-х годах. [28] Эти маркеры гораздо эффективнее различают варианты ДНК. Сегодня это наиболее часто используемые маркеры. Маркеры на основе ДНК работают путем исследования нуклеотидов, которые могут выполнять различные функции, такие как обнаружение различий в нуклеотидах или даже количественная оценка количества мутаций . [28]
- ПДРФ
- Полиморфизм длины рестрикционных фрагментов — это метод, используемый для обнаружения вариаций гомологичной ДНК. [29] специфические эндонуклеазы Для переваривания ДНК используются рестрикции. Молекулярный маркер RFLP специфичен к одному фрагменту. Наряду с аллейными маркерами ПДРФ, маркер размера молекулярной массы, в данном случае ДНК-маркер, [30] также включен в агарозный гель, подвергнутый электрофорезу . ДНК-маркер позволяет оценить размер рестрикционных фрагментов.
- Миниспутники
- Подобно RFLP, этот метод также использует эндонуклеазы рестрикции для переваривания геномной ДНК. Минисателлиты представляют собой короткие последовательности тандемных повторов, длиной примерно 10–60 пар оснований. Минисателлиты можно использовать для отслеживания ДНК и в качестве регуляторов генного контроля. [28]
Маркеры на основе ПЦР (1980-е годы)
[ редактировать ]Успех маркеров на основе ДНК привел к развитию ПЦР. ПЦР ( полимеразная цепная реакция ) — это метод амплификации ДНК , который можно применять к различным типам фрагментов. До этого для амплификации ДНК ее приходилось клонировать или выделять. Вскоре после открытия ПЦР возникла идея использовать маркеры на основе ПЦР для гель-электрофореза. Маркеры этого типа основаны на праймерах для ПЦР и относятся к категории полиморфизма последовательностей ДНК . [28]
- Микроспутники
- , также известные как SSR ( повторы простой последовательности ) или STR ( короткие тандемные повторы ), Микросателлиты отличаются от минисателлитов тем, что они короче, обычно 2-6 пар оснований. Это свойство микросателлитов позволяет легко их изолировать. Микросателлиты чаще всего используются в популяционной генетике . Микросателлиты имеют высокую и сложную частоту мутаций, что является их основным недостатком. [28]
- АФЛП
- Полиморфизм длин амплифицированных фрагментов на основе ПЦР - это метод снятия отпечатков пальцев ДНК . ДНК сначала расщепляется эндонуклеазами. Затем рестрикционные фрагменты лигируют вместе. [31] Молекулярный маркер затем генерируется, когда определенные фрагменты выбираются для амплификации . Маркеры AFLP наносятся на гель вместе с маркером ДНК. Длина обычного ДНК-маркера AFLP составляет 30–330 пар оснований. [32] Фрагменты этого маркера расположены с интервалом 10 пар оснований для повышения точности.
- РАПД
- Случайная амплификация полиморфной ДНК — это метод, который проводится аналогично AFLP. Разница в том, что молекулярные маркеры генерируются случайным образом. [31] Наиболее распространенным маркером размера молекулярной массы для этого метода является лестница ДНК размером 1 КБ. [33] [34]
Полиморфизм последовательностей ДНК
[ редактировать ]Хотя с технической точки зрения полиморфизм последовательностей ДНК существует с момента использования ПДРФ в 1960-х годах, с течением времени анализ существенно изменился. Полиморфизм последовательностей ДНК использует более старые методы, такие как RFLP, но в большем масштабе. Секвенирование происходит намного быстрее и эффективнее. Анализ автоматизирован, поскольку в нем используется метод, известный как секвенирование дробовика. Этот высокопроизводительный метод обычно используется в популяционной генетике. [28]
- SNP
- SNP ( однонуклеотидный полиморфизм ) используются для обнаружения вариаций отдельных нуклеотидов. Техника очень похожа на RFLP. SNP часто используются для популяционно-генетических исследований. [35] После амплификации с помощью ПЦР эти небольшие фрагменты можно визуализировать с помощью гель-электрофореза, и снова маркеры ДНК играют роль в определении длины фрагмента.
Анализ полисахаридов методом углеводного гель-электрофореза
[ редактировать ]Углеводные маркеры используются в методе, известном как анализ полисахаридов с помощью электрофореза в углеводном геле (PACE), который представляет собой измеримый метод разделения. [36] Позволяет проводить анализ продуктов ферментативного гидролиза . [36] Он использовался в таких приложениях, как характеристика ферментов, участвующих в деградации гемицеллюлозы , определение структуры полисахаридов гемицеллюлозы и анализ ферментативного расщепления продуктов целлюлозы . [36]
PACE зависит от деривитизации, то есть превращения химического соединения в производное . [36] [37] Здесь моносахариды , олигосахариды представляющие интерес соединения представляют собой и полисахариды. Их восстанавливающие концы помечены флуоресцентной меткой (т.е. флуорофором ). [36] Такая деривитизация с помощью флуорофора позволяет как разделение на геле при желаемых обстоятельствах, так и флуоресцентную визуализацию геля. В этом случае используется полиакриламидный гель. [36]
Как и в случае электрофореза ДНК, РНК и белков, при электрофорезе в углеводном геле маркеры наносятся рядом с интересующими образцами. [36] Маркеры состоят из олигосахаридов известной молекулярной массы. Как и интересующие образцы, маркер также дериватизируется с помощью флуорофора (обычно с 8-аминонафталин - 1,3,6- трисульфоновой кислотой (ANTS) или 2- аминоакридоном ). [36]
Ссылки
[ редактировать ]- ^ Карлсон, Дэвид П. «Маркеры размера для электрофоретического анализа ДНК» . Патент США № 5316908A . Гугл Патенты . Проверено 30 октября 2013 г.
- ^ Карлсон, Дэвид П. «Маркеры размера для электрофоретического анализа ДНК» . Патент EP № 0466404B1 . Гугл Патенты . Проверено 30 октября 2013 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п Блабер, Майк. «Лекция 20: Гель-электрофорез» . BCH5425 Молекулярная биология и биотехнология .
- ^ Боуэн, Р. (20 октября 1999 г.). «Лигирование ДНК» . Биотехнология и генная инженерия . Проверено 12 ноября 2013 г.
- ^ Jump up to: а б с Лан, Во Тхи Тхыонг; Кредит, Фам Тхи Тхань; Дуонг, Фам Ань Туи; Тхань, Ле Тхи; Ха, Нго Тхи; Туан, Та Бич (2012). «Простая процедура лабораторного изготовления лестницы ДНК» . Журнал нуклеиновых кислот . 2012 : 254630. doi : 10.1155/2012/254630 . ПМК 3306978 . ПМИД 22496965 .
- ^ Jump up to: а б с д и ж г Боуэн, Р. (2000). «Электрофорез ДНК в агарозном геле» . Гипертексты для биомедицинских наук – Университет штата Колорадо .
- ^ «Трис-борат ЭДТА и трис-ацетат-ЭДТА-буфер (TAE и TBE, pH 8,3)» (PDF) . Аниара .
- ^ Jump up to: а б с «Советы и рекомендации по электрофорезу в агарозном геле» . Технологии жизни .
- ^ Хартли, Джеймс. «Маркерная лестница размера белка» . Патент США № 5449758A . Гугл Патенты . Проверено 30 октября 2013 г.
- ^ Ченг, Тянь Лу. «Авторазрабатывающий набор маркеров молекулярной массы белка с регулярным взвешиванием и способ его приготовления» . Патент США № 20130217133A1 . Гугл Патенты . Проверено 30 октября 2013 г.
- ^ «Предварительно окрашенный маркер молекулярной массы белка» . Термонаучный . Проверено 12 ноября 2013 г.
- ^ Jump up to: а б с д и ж Ингельман, Маргарета (2004). «Разделение и анализ белков» . KE7001 Биохимические лаборатории . Проверено 12 ноября 2013 г.
- ^ «Маркеры молекулярной массы белков» . Помогите Биотехнологиям . 2011 . Проверено 12 ноября 2013 г.
- ^ Jump up to: а б с д и ж г час «Руководство по сравнению и выбору маркеров молекулярной массы белков» . Проверено 16 ноября 2013 г.
- ^ Jump up to: а б «Биотинилированный маркер молекулярной массы» . Проверено 16 ноября 2013 г.
- ^ Jump up to: а б «Маркеры молекулярной массы» . Проверено 16 ноября 2013 г.
- ^ Jump up to: а б «Маркер молекулярной массы белка, предварительно окрашенный Пирсом» . Проверено 16 ноября 2013 г.
- ^ Jump up to: а б с д и ж г час я дж к л м н «Электрофорез. Руководство по электрофорезу и обнаружению в полиакриламидном геле» (PDF) . Био-Рад .
- ^ «Руководство по сравнению и выбору маркеров молекулярной массы белков» . Термонаучный . Проверено 12 ноября 2013 г.
- ^ Jump up to: а б с д и ж г час я «Справочник по белкам 2013» (PDF) . Технологии жизни .
- ^ Jump up to: а б Кул, Эрик Т. «Кольцевые векторы ДНК для синтеза РНК и ДНК» . Патент США № 6096880A . Гугл Патенты . Проверено 27 ноября 2013 г.
- ^ Лонца. «РНК-маркеры 0,5–9 т.п.н.» (PDF) . Документ № 18123-0807-06 . Лонза Рокленд Инк . Проверено 27 ноября 2013 г.
- ^ Биолаборатории Новой Англии. «Маркер микроРНК» . Биолабы Новой Англии . Проверено 27 ноября 2013 г.
- ^ Уикс, Ричард Дж. (1986). «Определение молекулярной массы РНК методом электрофореза в агарозном геле с использованием формальдегида в качестве денатуранта: сравнение маркеров молекулярной массы РНК и ДНК». Международный журнал биохимии . 18 (3): 277–278. дои : 10.1016/0020-711x(86)90118-7 . ПМИД 2937672 .
- ^ Jump up to: а б «Каталог №: R0004» . РНК-маркер Высокий Легко . Абнова . Проверено 14 декабря 2013 г.
- ^ «Электрофорез РНК: Введение» . Электрофорез РНК . Термо Фишер Сайентифик Инк . Проверено 14 декабря 2013 г.
- ^ «Определение молекулярной массы белков» (PDF) . Проверено 14 декабря 2013 г.
- ^ Jump up to: а б с д и ж г час Шлоттерер, Кристиан. «Эволюция молекулярных маркеров» (PDF) . Проверено 26 ноября 2013 г.
- ^ «Улучшение народонаселения» . Проверено 30 октября 2013 г.
- ^ Хиггинс, Л. (апрель 2012 г.). «ДНК-лестница для гель-электрофореза» . Колледж Льюиса и Кларка . Проверено 15 ноября 2013 г.
- ^ Jump up to: а б Мюллер, Ульрих (1999). «Генотипирование и дактилоскопия AFLP» (PDF) . Тенденции в экологии и эволюции . 14 (10): 389–394. дои : 10.1016/s0169-5347(99)01659-6 . ПМИД 10481200 . Проверено 30 октября 2013 г.
- ^ Корпорация Инвитроген (2003 г.). «ДНК-лестница AFLP® 30–330 п.н.» (PDF) . Руководство . Корпорация «Технологии жизни» . Проверено 15 ноября 2013 г.
- ^ Джаннини, Кристина; и др. (май 2004 г.). «UnRAPD-анализ мтДНК из цветов томата без артефактов ядерной ДНК» (PDF) . БиоТехники . 36 (5): 772–776. дои : 10.2144/04365BM04 . ПМИД 15152595 . Проверено 15 ноября 2013 г.
- ^ Робертс, Массачусетс; Кроуфорд, Д.Л. (1 июня 2000 г.). «Использование случайно амплифицированной полиморфной ДНК как средства разработки родо- и штамм-специфичных ДНК-зондов Streptomyces» . Прикладная и экологическая микробиология . 66 (6): 2555–2564. дои : 10.1128/АЕМ.66.6.2555-2564.2000 . ПМК 110581 . ПМИД 10831438 .
- ^ МакКлин, Филипп. «Классы молекулярных маркеров» . Проверено 30 октября 2013 г.
- ^ Jump up to: а б с д и ж г час Косик, Ондрей; Бромли, Дженнифер Р.; Буссе-Вичер, Марта; Чжан, Чжинонг; Дюпри, Поль (2012). Исследования ферментативного расщепления целлюлозы с использованием анализа полисахаридов методом электрофореза в углеводном геле (PACE) . Методы энзимологии. Том. 510. стр. 51–67. дои : 10.1016/B978-0-12-415931-0.00004-5 . ISBN 9780124159310 . ISSN 0076-6879 . ПМИД 22608721 .
- ^ Каммак Р., Эттвуд Т.К., Кэмпбелл П.Н., Пэриш Х.Дж., Смит А., Стирлинг Дж.Л., Велла Ф (2006). «Флуорофор». Оксфордский словарь биохимии и молекулярной биологии (второе изд.). Издательство Оксфордского университета.