Токсикодинамика
Токсикодинамика , называемая фармакодинамикой в фармакологии , описывает динамические взаимодействия токсиканта с биологической мишенью и его биологические эффекты. [1] , Биологической мишенью также известной как место действия, могут быть связывающие белки, ионные каналы , ДНК или множество других рецепторов. Когда токсикант попадает в организм, он может взаимодействовать с этими рецепторами и вызывать структурные или функциональные изменения. Механизм действия токсиканта, определяемый химическими свойствами токсиканта, определяет, на какие рецепторы он нацелен, а также общий токсический эффект на клеточном и организменном уровне.
Токсиканты сгруппированы по их химическим свойствам с помощью количественных соотношений структура-активность (QSAR), что позволяет прогнозировать токсическое действие на основе этих свойств. Химические вещества, нарушающие работу эндокринной системы (EDC), и канцерогены являются примерами классов токсикантов, которые могут действовать как QSAR. EDC имитируют или блокируют активацию транскрипции, обычно вызываемую природными стероидными гормонами . Эти типы химических веществ могут действовать на рецепторы андрогенов , рецепторы эстрогена и рецепторы гормонов щитовидной железы . Этот механизм может включать такие токсиканты, как дихлордифенилтрихлорэтан (ДДЭ) и полихлорированные бифенилы (ПХБ). Другой класс химических веществ, канцерогены, представляет собой вещества, вызывающие рак , и их можно классифицировать как генотоксичные или негенотоксичные канцерогены. К этим категориям относятся такие токсичные вещества, как полициклические ароматические углеводороды (ПАУ) и четыреххлористый углерод (CCl 4 ).
Процесс токсикодинамики может быть полезен для применения в оценке экологического риска путем реализации токсикокинетико-токсикодинамических (ТКТД) моделей. Модели TKTD включают такие явления, как изменяющееся во времени воздействие, переносимая токсичность , время восстановления организма, воздействие смесей и экстраполяция на непроверенные химические вещества и виды . Благодаря своим преимуществам эти типы моделей могут быть более применимы для оценки рисков, чем традиционные подходы к моделированию.
Обзор
[ редактировать ]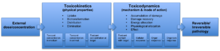
В то время как токсикокинетика описывает изменения концентрации токсиканта с течением времени вследствие поглощения, биотрансформации , распределения и выведения токсикантов, токсикодинамика включает в себя взаимодействие токсиканта с биологической мишенью и функциональные или структурные изменения в клетке, которые в конечном итоге могут привести к к токсическому эффекту. В зависимости от химической активности и близости токсиканта он может взаимодействовать с биологической мишенью. Взаимодействия между токсикантом и биологической мишенью также могут быть более специфичными, когда сайты связывания с высоким сродством повышают селективность взаимодействий. По этой причине токсичность может проявляться преимущественно в определенных тканях или органах . Мишенью часто являются рецепторы на поверхности клетки или в цитоплазме и ядре . Токсиканты могут либо вызывать ненужную реакцию, либо подавлять естественную реакцию, что может привести к повреждению. Если биологическая цель является критической и ущерб достаточно серьезен, необратимые повреждения могут произойти сначала на молекулярном уровне, что приведет к последствиям на более высоких уровнях организации. [1]
Эндокринные разрушители
[ редактировать ]EDC обычно считаются токсичными веществами, которые либо имитируют, либо блокируют активацию транскрипции, обычно вызываемую природными стероидными гормонами. [2] К этим химическим веществам относятся те, которые действуют на рецепторы андрогенов, рецепторы эстрогена и рецепторы гормонов щитовидной железы. [2]
Эффекты эндокринных разрушителей
[ редактировать ]Химические вещества, нарушающие эндокринную систему, могут влиять на эндокринную систему различными способами, включая синтез гормонов, хранение/высвобождение, транспорт и выведение, распознавание и связывание рецепторов, а также пострецепторную активацию. [3]
В дикой природе воздействие EDC может привести к изменению фертильности, снижению жизнеспособности потомства, нарушению секреции или активности гормонов и изменению репродуктивной анатомии. [4] Репродуктивная анатомия потомства может особенно пострадать в случае воздействия на мать. [5] У женщин это молочные железы , маточные трубы , матка , шейка матки и влагалище . У мужчин это включает простату , семенные пузырьки , эпидидимит и яички . [5] Воздействие на рыбу EDC также было связано с нарушением функции щитовидной железы, снижением плодовитости, снижением успешности вылупления, дефеминизацией и маскулинизацией самок рыб и изменением иммунной функции . [5]
Эндокринные нарушения как способ действия ксенобиотиков . были раскрыты в книге Наше украденное будущее» Тео Колборна « [2] Известно, что химические вещества, нарушающие работу эндокринной системы, накапливаются в тканях организма и обладают высокой стойкостью в окружающей среде. [6] Многие токсиканты являются известными EDC, включая пестициды , фталаты , фитоэстрогены , некоторые промышленные/коммерческие продукты и фармацевтические препараты . [3] Известно, что эти химические вещества вызывают эндокринные нарушения по нескольким различным механизмам. Хотя механизм, связанный с рецептором гормона щитовидной железы, не совсем понятен, еще два установленных механизма включают ингибирование рецептора андрогена и активацию рецептора эстрогена.
Опосредовано андрогенными рецепторами
[ редактировать ]Некоторые токсиканты действуют как нарушители эндокринной системы, взаимодействуя с рецепторами андрогенов. ДДЕ является одним из примеров химического вещества, действующего по такому механизму. ДДЕ – это метаболит ДДТ , широко распространенный в окружающей среде. [1] Хотя производство ДДТ запрещено в западном мире, это химическое вещество чрезвычайно стойко и до сих пор широко встречается в окружающей среде вместе со своим метаболитом ДДЕ. [1] ДДЕ является антиандрогеном , что означает, что он изменяет экспрессию специфических генов, регулируемых андрогенами, и представляет собой механизм, опосредованный андрогенными рецепторами (АР). [1] ДДЕ представляет собой липофильное соединение, которое диффундирует в клетку и связывается с АР. [1] В результате связывания рецептор инактивируется и не может связываться с элементом ответа на андроген на ДНК. [1] Это ингибирует транскрипцию генов, чувствительных к андрогенам. [1] которые могут иметь серьезные последствия для подвергшихся воздействию диких животных. В 1980 году в озере Апопка во Флориде произошел разлив пестицида дикофола и ДДТ вместе с его метаболитами. [4] Неонатальные и молодые аллигаторы, обитающие в этом озере, были тщательно изучены и отмечены изменения концентрации гормонов в плазме , снижение жизнеспособности кладки, увеличение смертности молоди и морфологические аномалии в семенниках и яичниках. [4]
Опосредованный рецептором эстрогена
[ редактировать ]Токсиканты также могут вызывать нарушения эндокринной системы за счет взаимодействия с рецепторами эстрогена. Этот механизм хорошо изучен на печатных платах. Эти химикаты использовались в качестве охлаждающих и смазочных материалов в трансформаторах и другом электрооборудовании из-за их изоляционных свойств. [7] Являясь чисто антропогенным веществом, ПХБ больше не производятся в Соединенных Штатах из-за неблагоприятных последствий для здоровья, связанных с воздействием, но они очень стойкие и по-прежнему широко распространены в окружающей среде. [7] ПХБ представляют собой ксеноэстрогены , которые вызывают усиливающую (а не ингибирующую) реакцию и опосредуются рецептором эстрогена. [1] Их часто называют имитаторами эстрогена, потому что они имитируют эффекты эстрогена. ПХД часто накапливаются в отложениях и биоаккумулируются в организмах. [1] Эти химические вещества диффундируют в ядро и связываются с рецептором эстрогена. [1] Рецептор эстрогена сохраняется в неактивной конформации за счет взаимодействия с белками, такими как белки теплового шока 59, 70 и 90. [8] После того, как происходит связывание токсиканта, рецептор эстрогена активируется и образует гомодимерный комплекс, который ищет элементы ответа на эстроген в ДНК. [8] Связывание комплекса с этими элементами вызывает перестройку хроматина и транскрипцию гена, в результате чего образуется специфический белок. [8] При этом ПХБ вызывают эстрогенную реакцию, которая может повлиять на многочисленные функции организма. [1] Эти эффекты наблюдаются у различных водных видов. Уровни ПХБ в морских млекопитающих часто очень высоки в результате биоаккумуляции. [9] Исследования показали, что ПХБ ответственны за репродуктивные нарушения у обыкновенного тюленя ( Phoca vitulina ). [9] Аналогичные эффекты были обнаружены у серого тюленя ( Halichoerus grypus ), кольчатой нерпы ( Pusa hispida ) и калифорнийского морского льва ( Zalophys Californianus ). [9] У серых тюленей и кольчатых нерп непроходимость и стеноз обнаружены матки, что привело к бесплодию . [9] Также было замечено, что при воздействии ксеноэстрогенов, таких как ПХБ, самцы рыб производят вителлогенин . [8] Вителлогенин – это яичный белок, который обычно вырабатывается самками рыб, но обычно не присутствует у самцов, за исключением очень низких концентраций. [8] Его часто используют в качестве биомаркера EDC. [8]
Канцерогены
[ редактировать ]Канцерогены определяются как любое вещество, вызывающее рак . Токсикодинамика канцерогенов может быть сложной из-за различных механизмов действия различных канцерогенных токсикантов. Из-за своей сложной природы канцерогены классифицируются как генотоксичные и негенотоксичные канцерогены.
Эффекты канцерогенов
[ редактировать ]Воздействие канцерогенов чаще всего связано с воздействием на человека, но млекопитающие — не единственные виды, на которых могут влиять канцерогенные токсиканты. [10] Многие исследования показали, что рак может развиваться и у рыб. [10] Новообразования, возникающие в эпителиальных тканях, таких как печень , желудочно-кишечный тракт и поджелудочная железа , связаны с различными токсикантами окружающей среды. [10] Канцерогены преимущественно поражают печень рыб и вызывают гепатоцеллюлярные и желчные поражения. [10]
Генотоксичные канцерогены
[ редактировать ]Генотоксичные канцерогены взаимодействуют непосредственно с ДНК и генетическим материалом или косвенно через свои реактивные метаболиты. [11] Токсиканты, такие как ПАУ, могут быть генотоксичными канцерогенами для водных организмов. [10] [12] ПАУ широко распространяются в окружающей среде в результате неполного сгорания угля, древесины или нефтепродуктов. [12] Хотя ПАУ не биоаккумулируются в тканях позвоночных, многие исследования подтвердили, что некоторые соединения ПАУ, такие как бензо(а)пирен , бенз(а)антрацен и бензофлуорантен, являются биодоступными и ответственны за заболевания печени , такие как рак, в популяциях диких рыб. [12] Один из механизмов действия генотоксичных канцерогенов включает образование аддуктов ДНК . Как только соединение ПАУ попадает в организм, оно метаболизируется и становится доступным для биотрансформации.
Процесс биотрансформации может активировать соединение ПАУ и превратить его в диолэпоксид. [ нужна ссылка ] который является очень реактивным промежуточным продуктом . Эти диолэпоксиды ковалентно связываются с парами оснований ДНК , чаще всего с гуанином и аденином, образуя стабильные аддукты внутри структуры ДНК. [ нужна ссылка ] Связывание диолэпоксидов и пар оснований ДНК блокирует репликационную активность полимеразы . Эта блокировка в конечном итоге способствует увеличению повреждений ДНК за счет снижения репарационной активности. [ нужна ссылка ]
Считается, что благодаря этим процессам соединения ПАУ играют роль в инициации и ранней стадии развития канцерогенеза . У рыб, подвергшихся воздействию ПАУ, развивается ряд поражений печени , некоторые из которых характеризуются гепатоканцерогенностью . [12]
Негенотоксичные канцерогены
[ редактировать ]Негенотоксичные или эпигенетические канцерогены отличаются и немного более неоднозначны, чем генотоксичные канцерогены, поскольку они не являются прямыми канцерогенами. Негенотоксичные канцерогены действуют посредством вторичных механизмов, которые не повреждают гены напрямую. Этот тип канцерогенеза не меняет последовательность ДНК; вместо этого он изменяет экспрессию или репрессию определенных генов посредством широкого спектра клеточных процессов. [11] Поскольку эти токсиканты не действуют напрямую на ДНК, о механизме их действия мало что известно. [10] Было высказано предположение, что модификация экспрессии генов негенотоксичными канцерогенами может происходить за счет окислительного стресса , пролиферации пероксисом, подавления апоптоза , изменения межклеточной коммуникации и модуляции метаболизирующих ферментов. [11]
Четыреххлористый углерод является примером вероятного негенотоксичного канцерогена для водных позвоночных. Исторически четыреххлористый углерод использовался в фармацевтическом производстве, нефтепереработке и в качестве промышленного растворителя. [13] Из-за широкого промышленного использования и попадания в окружающую среду тетрахлорметан был обнаружен в питьевой воде и, следовательно, стал угрозой для водных организмов. [14] Из-за своих высоких гепатотоксических свойств четыреххлористый углерод потенциально может быть связан с раком печени. Экспериментальные исследования рака показали, что четыреххлористый углерод может вызывать доброкачественные и злокачественные печени опухоли у радужной форели . [13] [14] Четыреххлористый углерод действует как негенотоксичный канцероген, образуя свободные радикалы , которые вызывают окислительный стресс. [12] Было высказано предположение, что при попадании в организм четыреххлористого углерода он метаболизируется до трихлорметильных и трихлорметилпероксирадикалов под действием CYP2E1 фермента . [12] [15] Более реактивный радикал, трихлорметилперокси, может атаковать полиненасыщенные жирные кислоты в клеточной мембране , образуя свободные радикалы жирных кислот и инициируя перекисное окисление липидов . [15] Атака клеточной мембраны увеличивает ее проницаемость, вызывая утечку ферментов и разрушая клеточный гомеостаз кальция . [15] Эта потеря гомеостаза кальция активирует кальций-зависимые деградационные ферменты и цитотоксичность , вызывая повреждение печени. [15] Регенеративные и пролиферативные изменения, происходящие в печени в это время, могут увеличить частоту генетических повреждений, что приведет к возможному увеличению заболеваемости раком. [15]
Приложения
[ редактировать ]Токсикодинамика может использоваться в сочетании с токсикокинетикой при оценке экологического риска для определения потенциальных последствий выброса токсиканта в окружающую среду. Наиболее широко используемым методом учета этого являются модели TKTD.
Настройка моделей ТКТД
[ редактировать ]К настоящему времени описаны как токсикокинетика, так и токсикодинамика, и с использованием этих определений были сформированы модели, в которых моделируются внутренняя концентрация (ТК) и повреждение (TD) в ответ на воздействие. В модели ТЗ и ТД разделены, чтобы можно было идентифицировать свойства токсикантов, которые определяют ТЗ и те, которые определяют TD. Чтобы использовать модель этого типа, параметров сначала необходимо получить значения для процессов ТЗ. Во-вторых, необходимо оценить параметры ТД. Оба эти шага требуют большой базы данных информации о токсичности для параметризации . После установления всех значений параметров модели TKTD и применения основных научных мер предосторожности модель можно использовать для прогнозирования токсических эффектов, расчета времени восстановления организмов или экстраполяции модели на токсичность непроверенных токсикантов и видов. [16] [17]
История моделей ТКТД
[ редактировать ]Утверждалось, что текущие проблемы, с которыми сталкиваются оценки рисков, можно решить с помощью моделирования TKTD. [16] Модели TKTD были созданы в ответ на несколько факторов. Одним из них является нехватка времени, которая рассматривается как фактор оценки токсичности и риска. Некоторые из самых ранних разработанных моделей TKTD, такие как модель критического остатка тела (CBR) и модель критического целевого занятия (CTO), рассматривали время как фактор, но критика заключалась в том, что они предназначены для очень специфических обстоятельств, таких как обратимо действующие токсиканты. или необратимо действующие токсиканты. Дальнейшей экстраполяцией моделей CTO и CBR являются DEBtox , который может моделировать сублетальные конечные точки, и опасные версии CTO, которые учитывают стохастическую смерть, а не индивидуальную толерантность . [18] Еще одним важным шагом в разработке моделей TKTD стало включение переменной состояния для ущерба. Используя повреждение в качестве токсикодинамической переменной состояния, можно моделировать промежуточные скорости восстановления для токсикантов, которые обратимо действуют на свои цели, без предположений о мгновенном восстановлении (модель CBR) или необратимых взаимодействиях (модель CTO). Модели TKTD, учитывающие ущерб, — это Модель оценки ущерба (DAM) и Модель порогового повреждения (TDM). [16] [18] Для того, что может показаться простым конечными точками , существует множество различных подходов TKTD. Обзор предположений и гипотез каждого из них был ранее опубликован при создании общей единой пороговой модели выживания (GUTS). [18]
Преимущества для оценки рисков
[ редактировать ]Как упоминалось выше, модели TKTD имеют ряд преимуществ по сравнению с традиционными моделями оценки рисков. Основными преимуществами использования моделей TKTD являются: [16]
- Последствия изменяющихся во времени или повторяющихся воздействий можно объяснить и смоделировать с помощью модели TKTD.
- Можно смоделировать переносную токсичность, а также отсроченные эффекты, независимо от того, вызвана ли переносная токсичность ТЗ, ТД или тем и другим. [19] Таким образом, модели TKTD могут количественно оценивать риски от импульсных или колебательных воздействий.
- Время восстановления организма зависит от временного хода ТК и ТД, что делает модели ТКТД пригодными для расчета времени восстановления организма.
- Модели TKTD обладают потенциалом для прогнозирования воздействия смесей, включая как экологические, так и химические стрессоры, а также могут использоваться в качестве экстраполяции на основе механизмов на непроверенные токсиканты или неиспытанные виды. [20]
- Объединение моделей TKTD с моделями индивидуального подхода (IBM) может улучшить оценку риска токсикантов за счет моделирования временных , а также экологических аспектов.
Благодаря своим преимуществам модели TKTD могут быть более мощными, чем традиционные модели «доза-реакция» , поскольку в них учитываются химические концентрации , а также временные измерения. [16] Было показано, что токсикодинамическое моделирование (например, модели TKTD) является полезным инструментом для токсикологических исследований, при этом расширяются возможности использования этих результатов при оценке риска, чтобы обеспечить более научно обоснованную оценку риска, которая менее надежна при испытаниях на животных . [21] В целом, эти типы моделей могут формализовать знания о токсичности токсикантов и чувствительности организма , создавать новые гипотезы и моделировать временные аспекты токсичности, что делает их полезными инструментами для оценки риска. [16] [18]
См. также
[ редактировать ]Примечания
[ редактировать ]- ^ Jump up to: а б с д и ж г час я дж к л Боелстерли, 2003 г.
- ^ Jump up to: а б с Табб и Блумберг, 2006 г.
- ^ Jump up to: а б Чой и др., 2010 г.
- ^ Jump up to: а б с Гийетт и др., 2000 г.
- ^ Jump up to: а б с Колборн и др., 1993 г.
- ^ Клотфелтер и др., 2003 г.
- ^ Jump up to: а б АЦДР
- ^ Jump up to: а б с д и ж Зубило, 2002 г.
- ^ Jump up to: а б с д Перрин, 2009 г.
- ^ Jump up to: а б с д и ж Рэнд, 1995 г.
- ^ Jump up to: а б с ВанДелфт и др., 2004 г.
- ^ Jump up to: а б с д и ж Ньюман, 2010 г.
- ^ Jump up to: а б Национальная программа токсикологии, 2011 г.
- ^ Jump up to: а б Раберг и Липски, 1997 г.
- ^ Jump up to: а б с д и Манипусан и Истмонд, 2007 г.
- ^ Jump up to: а б с д и ж Ашауэр и Эшер 2010 г.
- ^ Ашауэр и др., 2016.
- ^ Jump up to: а б с д Джагер и др. 2011 год
- ^ Ашауэр и др. 2010 год
- ^ Гуссен и др., 2020 г.
- ^ Блаубоер 2003
Ссылки
[ редактировать ]- Ашауэр, Роман; Эшер, Беате И. (2010). «Преимущества токсикокинетического и токсикодинамического моделирования в водной экотоксикологии и оценке риска». Журнал экологического мониторинга . 12 (11): 2056–2061. дои : 10.1039/c0em00234h . ПМИД 20862435 .
- Ашауэр, Роман; Хинтермейстер, Анита; Караватти, Иво; Кречманн, Андреас; Эшер, Беате I (15 мая 2010 г.). «Токсикокинетическое и токсикодинамическое моделирование объясняет перенос токсичности от воздействия диазинона медленным восстановлением организма». Экологические науки и технологии . 44 (10): 3963–3971. Бибкод : 2010EnST...44.3963A . дои : 10.1021/es903478b . ПМИД 20397634 .
- Ашауэр Р., Альберт К., Августин С., Седергрин Н., Чарльз, С., Дюкро В., Фокс А., Габси, Ф., Гергс, А., Гуссен, Б, Ягер, Т., Крамер, Н.И., Найман, А.-М. , Поульсен, В., Райхенбергер, С., Шефер, Р.Б., Ван ден Бринк, П.Дж., Велтман, К., Фогель, С., Циммер, Э.И., Пройсс, Т.Г. 2016. Моделирование выживания: характер воздействия, чувствительность видов и неопределенность. Научные отчеты 6:29178 DOI: 10.1038/srep29178
- АЦДР. Агентство по регистрации токсичных веществ и заболеваний. ToxFAQ™ по полихлорированным дифенилам (ПХБ). Веб. < https://wwwn.cdc.gov/TSP/ToxFAQs/ToxFAQsLanding.aspx?id=140&tid=26 >.
- Блаубоер Б. 2003. Биокинетическое и токсикодинамическое моделирование и его роль в токсикологических исследованиях и оценке риска. Альтернативы лабораторным животным 31: 277-281.
- Бёлстерли, Урс. Механистическая токсикология: молекулярная основа того, как химические вещества разрушают биологические цели. Нью-Йорк: Тейлор и Фрэнсис, 2003. 258–263. Распечатать.
- Чой С.М., Ю С.Д., Ли Б.М. 2010. Токсикологические характеристики химических веществ, нарушающих работу эндокринной системы: токсичность для развития, канцерогенность и мутагенность. Журнал токсикологии и гигиены окружающей среды, Часть B: Критические обзоры, 7:1, 1-23
- Клотфелтер, Итан Д.; Белл, Элисон М.; Леверинг, Кейт Р. (октябрь 2004 г.). «Роль поведения животных в изучении химических веществ, нарушающих работу эндокринной системы». Поведение животных . 68 (4): 665–676. дои : 10.1016/j.anbehav.2004.05.004 . S2CID 51690424 .
- Колборн Т., Саал ФСВ и Сото А.М. 1993. Влияние химических веществ, нарушающих работу эндокринной системы, на развитие дикой природы и человека. Перспективы гигиены окружающей среды 101, 378-384.
- Гуссен Б., Рендал К., Шеффилд Д., Батлер Э., Прайс О.Р. и Ашауэр Р. 2020. Биоэнергетическое моделирование для анализа и прогнозирования совместных эффектов нескольких стрессоров: метаанализ и подтверждение моделей. Наука об общей окружающей среде 749, 141509 DOI: doi:10.1016/j.scitotenv.2020.141509
- Гийетт, Л.Дж., Крэйн, Д.А., Гандерсон, М.П., Кулс, САЭ, Милнс, М.Р., Орландо, Э.Ф., Руни, А.А. и Вудворд, А.Р. 2000. *Аллигаторы и загрязняющие вещества, нарушающие работу эндокринной системы: современный взгляд. Американский зоолог 40, 438–452.
- Ягер Т., Альберт С., Прейсс Т., Ашауэр Р. 2011. Общая унифицированная пороговая модель выживания – токсикокинетико-токсикодинамическая основа для экотоксикологии. Экологические науки и технологии 45: 2529-2540.
- Манибусан МК, Один М, Истмонд Д.А. 2007. Постулируемый механизм действия тетрахлорида углерода: обзор. J Environ Sci Health C Environ Carcinog Ecotropicol Rev. 25(3): 185-209.
- Национальная программа токсикологии (НТП). 2011. Четыреххлористый углерод: Отчет о канцерогенах (12-е изд.). https://ntp.niehs.nih.gov/ntp/roc/content/profiles/carbontetrachromide.pdf
- Ньюман, MC (2010). Основы экотоксикологии (3-е изд.). Бока-Ратон, Флорида: CRC Press.
- Пейт, А.С. и Дж.О. Нельсон. 2002. Эндокринные нарушения у рыб: оценка последних исследований и результатов. НОАА Тех. Памятка. NOS NCCOS CCMA 149. Силвер-Спринг, Мэриленд: NOAA, NOS, Центр прибрежного мониторинга и оценки. 55. 4-5.
- Перрин, Уильям. Энциклопедия морских млекопитающих. 2-е изд. Нью-Йорк: Academic Press, 2009. 894. Электронная книга.
- Rabergh CMI и Lipsky MM 1997. Токсичность хлороформа и тетрахлорида углерода в первичных культурах гепатоцитов радужной форели. Акват Токсикол. 37: 169-182.
- Рэнд, генеральный директор (1995). Основы водной токсикологии: последствия, экологическая судьба и оценка рисков (2-е изд.). Вашингтон, округ Колумбия: Тейлор и Фрэнсис.
- Табб М.М. и Блумберг Б. 2006. Новые способы действия химических веществ, нарушающих работу эндокринной системы. Молекулярная эндокринология 20, 475-482.
- ВанДелфт Дж.Х.М., Ван Аген Э., Ван Бреда С.Г.Дж., Хервинен М.Х., Стаал Ю.К.М., Кляйнджанс Дж.С.С. 2004. Отличие генотоксичных от негенотоксичных канцерогенов с помощью профилирования экспрессии генов. Канцерогенез. 25:1265-1276.