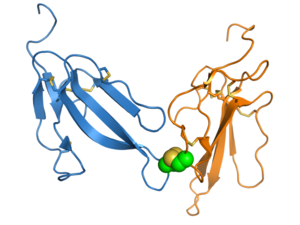
Токсин трех пальцев
| Змеиный токсин и токсиноподобный белок | |||
|---|---|---|---|
 Эрабутоксин А — нейротоксин , принадлежащий к суперсемейству 3FTx. Три «пальца» обозначены I, II и III, а четыре консервативные дисульфидные связи показаны желтым цветом. Визуализировано из PDB : 1QKD . [ 1 ] | |||
| Идентификаторы | |||
| Символ | Токсин_ТОЛИП | ||
| Пфам | PF00087 | ||
| Пфам Клан | CL0117 | ||
| ИнтерПро | ИПР003571 | ||
| PROSITE | PS00272 | ||
| КАТ | 1 кв.м. | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 1qkd / SCOPe / СУПФАМ | ||
| Суперсемейство OPM | 53 | ||
| белок OPM | 1 чашка | ||
| CDD | cd00206 | ||
| |||
Трёхпальцевые токсины (сокращенно 3FTx ) представляют собой суперсемейство небольших белков- токсинов, обнаруженных в яде змей белковое . Токсины с тремя пальцами, в свою очередь, являются членами более крупного суперсемейства белковых доменов с тремя пальцами , которое включает нетоксичные белки, имеющие схожую белковую структуру . Группа названа в честь своей общей структуры, состоящей из трех петель бета-цепи , соединенных с центральным ядром, содержащим четыре консервативные дисульфидные связи . 3FP Домен белка не обладает ферментативной активностью и обычно имеет длину от 60 до 74 аминокислотных остатков . [ 2 ] [ 3 ] [ 4 ] [ 5 ] Несмотря на консервативную структуру, белки трехпальцевого токсина обладают широким спектром фармакологического действия. Большинство членов этого семейства представляют собой нейротоксины , которые действуют на холинергическую межклеточную передачу сигналов; семейство альфа -нейротоксинов взаимодействует с мышечными никотиновыми рецепторами ацетилхолина (нАХР), семейство каппа-бунгаротоксинов с нейрональными нАХР, а мускариновые токсины с мускариновыми рецепторами ацетилхолина (мАХР). [ 2 ]
Структура
[ редактировать ]Суперсемейство трехпальцевых токсинов определяется общей третичной структурой, состоящей из трех петель, содержащих бета-цепь (обозначаемых петлями I, II и III), выступающих из небольшого гидрофобного ядра, содержащего четыре консервативные дисульфидные связи . Считается, что эта структура напоминает руку с тремя пальцами, отсюда и название. [ 2 ] Белки обычно имеют длину 60–74 аминокислотных остатка , хотя некоторые из них имеют дополнительные N- или C-концевые расширения. Дополнительная дисульфидная связь может присутствовать либо в петле I, либо в петле II. [ 2 ] Суперсемейство можно условно разделить на три класса: [ 2 ] [ 3 ] [ 6 ]
- Короткоцепочечные токсины содержат менее 66 остатков и четыре основные дисульфидные связи.
- длинноцепочечные токсины имеют по меньшей мере 66 остатков, дисульфидную связь в петле II и, возможно, С-концевое удлинение.
- нетрадиционные токсины имеют дисульфидную связь в петле I и, возможно, концевые отростки.
Олигомеризация
[ редактировать ]Большинство белков 3FTx являются мономерами . Однако некоторые подгруппы 3FTx образуют функциональные нековалентные гомодимеры . [ 2 ] Группа каппа-бунгаротоксина представляет собой наиболее охарактеризованный димерный 3FTx и взаимодействует через антипараллельный димерный интерфейс, состоящий из внешней цепи петли III. [ 7 ] Хадитоксин – еще один пример димерного 3FTx; он принадлежит к группе короткоцепочечных и имеет аналогичный интерфейс димеров, но отличается фармакологией по сравнению с длинноцепочечными каппа-бунгаротоксинами. [ 9 ]
Также было описано несколько примеров ковалентно связанных димеров. [ 2 ] Эти белки из нетрадиционной группы связаны межмолекулярными дисульфидными связями. Некоторые из них, такие как ирдитоксин , представляют собой гетеродимеры, связанные цистеинами в петлях I и II. [ 8 ] Другие, такие как α-кобратоксин , могут образовывать как гомодимеры, так и гетеродимеры, которые обладают различной фармакологической активностью in vitro , хотя их функциональное значение неясно из-за их очень низкой концентрации в яде. [ 10 ]
Функция
[ редактировать ]Несмотря на консервативную общую структуру, белки 3FTx обладают широким спектром фармакологических эффектов, опосредующих их токсичность. Многие члены этого семейства представляют собой нейротоксины , которые связываются с рецепторными белками клеточной мембраны, особенно с никотиновыми рецепторами ацетилхолина . Другие, включая вторую по величине подгруппу 3FTx, представляют собой кардиотоксины . [ 2 ]
Клеточные цели
[ редактировать ]Никотиновые рецепторы ацетилхолина
[ редактировать ]Многие из наиболее хорошо изученных белков 3FTx оказывают токсическое действие посредством связывания с никотиновыми рецепторами ацетилхолина (nAChR), семейством лиганд-управляемых ионных каналов . Связывание 3FTx препятствует холинергической межклеточной передаче сигналов, особенно в нервно-мышечных соединениях , и вызывает паралич . Семейство альфа-нейротоксинов представляет собой группу белков 3FTx, которые связывают мышечные nAChR , предотвращая связывание нейромедиатора ацетилхолина . [ 11 ] [ 2 ] Альфа-бунгаротоксин , альфа-нейротоксин из многополосного крайта ( Bungarus multicinctus ), имеет долгую историю использования в в области молекулярной биологии исследованиях ; именно благодаря изучению этого токсина были выделены и охарактеризованы нАХР, что облегчило изучение субъединичного состава тканеспецифичных нАХР и детальное фармакологическое понимание нервно-мышечного соединения . [ 12 ] В общем, члены этой группы с короткой цепью 3FTx связывают только мышечные nAChR, а члены с длинной цепью связывают как мышечные, так и нейрональные рецепторы. Эту группу 3FTx иногда называют «кураремиметическими» токсинами из-за сходства их действия с растительным алкалоидом кураре . [ 2 ]
Другие группы белков 3FTx также связываются с различными подтипами nAChR; например, каппа-нейротоксины , которые представляют собой димеры с длинной цепью, связывают нейрональные nAChR, а хадитоксин , который представляет собой димер с короткой цепью, связывает как мышечные, так и нейрональные подтипы. Нетрадиционные белки 3FTx также часто связывают nAChR; Когда они были впервые обнаружены, считалось, что это более слабые токсины, но было обнаружено, что этот класс обладает рядом свойств связывания . [ 2 ] Недавно был описан новый класс белков-антагонистов nAChR 3FTx, названных омега-нейротоксинами. [ 13 ]
Мускариновые рецепторы ацетилхолина
[ редактировать ]Меньший класс белков 3FTx вместо этого связывается с мускариновыми рецепторами ацетилхолина , семейством рецепторов, связанных с G-белком . Мускариновые токсины могут быть либо агонистами , либо антагонистами рецепторов , а в некоторых случаях один и тот же белок 3FTx является агонистом одного подтипа рецептора и антагонистом другого. Мускариновые токсины обычно относятся к короткоцепочечным типам. [ 2 ]
Ацетилхолинэстераза
[ редактировать ]Класс белков 3FTx, называемый фасцикулинами, связывает фермент ацетилхолинэстеразу и ингибирует его активность, блокируя доступ ацетилхолина фермента к активному центру , тем самым предотвращая распад ацетилхолина. Этот класс получил свое название из-за его клинического эффекта, вызывающего мышечные фасцикуляции . [ 2 ] [ 14 ]
Сердечные цели
[ редактировать ]Второй по величине класс белков 3FTx вызывает токсичность в кардиомиоцитах и может вызывать увеличение частоты сердечных сокращений и, в конечном итоге, остановку сердца . Эти кардиотоксины также часто обладают генерализованным цитотоксическим действием и иногда известны как цитолизины. Белковые мишени в миоцитах для этого класса обычно не известны, хотя некоторые представители могут вызывать физическое повреждение клетки, образуя поры в клеточной мембране . [ 2 ]
Другой класс, называемый бета-кардиотоксинами , вызывает снижение частоты сердечных сокращений и, как полагают, действует как бета-блокаторы , антагонисты бета -1 и бета-2 адренергических рецепторов . [ 2 ] [ 15 ]
Менее распространенные цели
[ редактировать ]Известны белки 3FTx, которые воздействуют на множество дополнительных белков-мишеней, оказывая токсическое воздействие. Например, кальциевые каналы L-типа воздействует на кальцисептин , а агрегация тромбоцитов ингибируется за счет взаимодействия с белками адгезии дендроаспина и родственных белков. [ 2 ] В некоторых случаях токсичности в результате взаимодействия 3FTx-мишени не наблюдается; например, мамбалгина семейство белков 3FTx взаимодействует с кислоточувствительными ионными каналами , вызывая аналгезию без явного токсического эффекта в лабораторных тестах. [ 16 ]
Сиротские белки 3FTx
[ редактировать ], основанные на биоинформатике, Исследования известных белковых последовательностей часто выявляют ряд последовательностей, которые, вероятно, образуют структуру белка 3FTx, но функция которых не была охарактеризована экспериментально. Таким образом, неизвестно, являются ли эти «сиротские» белки на самом деле токсинами и каковы могут быть их клеточные мишени. [ 2 ] [ 17 ] Геномные исследования экспрессии генов у змей показали, что члены белковых семейств, традиционно считающихся токсинами, широко экспрессируются в тканях тела змей и что этот образец экспрессии встречается за пределами высокоядовитого надсемейства Caenophidia . [ 18 ]
Структурно-функциональные связи деятельности
[ редактировать ]
Поскольку белки 3FTx со схожей структурой связывают широкий спектр клеточных белков-мишеней, взаимосвязь между последовательностью белка 3FTx и их биологической активностью широко изучалась, особенно среди альфа-нейротоксинов . Известные функциональные сайты, обеспечивающие аффинность и специфичность связывания , сосредоточены в петлях белков 3FTx. [ 2 ] Например, кристаллическая структура в альфа-бунгаротоксина комплексе с внеклеточным доменом субъединицы альфа-9 нАХР указывает на белок-белковое взаимодействие, опосредованное через петли I и II, без контактов, образуемых петлей III. [ 19 ] Поверхности взаимодействия были картированы для ряда токсинов и различаются в зависимости от того, какие петли участвуют в связывании; [ 2 ] эрабутоксин А использует все три петли для связывания нАХР, [ 20 ] а взаимодействие дендроаспина с белками адгезии опосредовано тремя остатками в петле III. [ 21 ] В некоторых белках 3FTx с С-концевым удлинением эти остатки также участвуют в формировании ключевых связывающих взаимодействий. [ 2 ]
Подгруппа кардиотоксинов/цитолизинов 3FTx имеет несколько иной набор функционально значимых остатков из-за особого механизма действия, вероятно, включающего взаимодействие с фосфолипидами клеточной мембраны . [ 22 ] а также возможные функционально значимые взаимодействия с другими молекулами клеточной поверхности, такими как гликозаминогликаны . [ 23 ] Гидрофобный , но распределенных по всем трем петлям , участок остатков, смежных в третичной структуре был идентифицирован как функционально значимый в сочетании с набором консервативных остатков лизина, придающих локальный положительный заряд. [ 2 ]
Из-за структурного сходства и функционального разнообразия белки 3FTx использовались в качестве модельных систем для изучения белковой инженерии . [ 24 ] Их высокая специфичность связывания с мишенями, представляющими фармакологический интерес, отсутствие ферментативной активности и низкая иммуногенность также вызвали интерес к их потенциалу в качестве ведущих лекарственных средств . [ 25 ] [ 26 ] [ 4 ]
Эволюция
[ редактировать ]Хотя трехпалые белки в целом широко распространены среди многоклеточных животных , трехпалые токсины появляются только у змей . [ 4 ] [ 18 ] Обычно считается, что они ограничены линией Caenophidia (таксон, содержащий всех ядовитых змей), хотя по крайней мере один предполагаемый гомолог 3FTx был идентифицирован в геноме бирманского питона , члена сестринского таксона . [ 18 ] Ранние работы по анализу гомологии белков путем выравнивания последовательностей в 1970-х годах предположили, что белки 3FTx, возможно, произошли от предковой рибонуклеазы ; [ 27 ] однако более поздние исследования молекулярной филогении показывают, что белки 3FTx произошли от нетоксичных трехпальцевых белков. [ 17 ] [ 28 ] [ 29 ]
Среди ядовитых змей распределение белков 3FTx варьируется; они особенно обогащены ядом семейства Elapidae . [ 4 ] [ 30 ] У королевской кобры ( Ophiophagus Hannah ) [ 31 ] и мамба восточная зеленая ( Dendroaspis angusticeps ), [ 32 ] Белки 3FTx составляют около 70% белковых токсинов яда; у пустынной коралловой змеи ( Micrurus tschudii ) эта доля достигает 95%. [ 33 ]
Считается, что гены, кодирующие токсины трех пальцев, возникли в результате дупликации генов . [ 28 ] Традиционно это концептуализировалось как повторяющиеся события дупликации с последующей неофункционализацией и рекрутированием паттернов экспрессии генов, ограниченных ядовитыми железами. [ 28 ] [ 31 ] [ 34 ] Однако утверждалось, что этот процесс должен быть крайне редким и что субфункционализация лучше объясняет наблюдаемое распределение. [ 35 ] Совсем недавно было обнаружено, что нетоксичные белки 3FP широко экспрессируются во многих различных тканях змей, что подтолкнуло к альтернативной гипотезе о том, что белки с ограниченной экспрессией в слюне избирательно рекрутируются для выполнения токсических функций. [ 18 ] Есть свидетельства того, что большинство типов белков 3FTx подвергались положительному отбору (то есть диверсифицирующему отбору) в своей недавней эволюционной истории. [ 36 ] возможно, из-за эволюционной гонки вооружений с видами добычи. [ 29 ] [ 31 ] Заметными исключениями являются семейство димерных каппа-бунгаротоксинов , вероятно, возникшее в результате эволюционных ограничений на интерфейсе димеров, и семейство кардиотоксинов/цитотоксинов, в котором считается, что большая часть белковых остатков играет функциональную роль. [ 36 ]
Ссылки
[ редактировать ]- ^ Настопулос В., Канеллопулос П.Н., Церноглу Д. (сентябрь 1998 г.). «Структура димерного и мономерного эрабутоксина, уточненная с разрешением 1,5 А». Acta Crystallographica Раздел D. 54 (Часть 5): 964–74. Бибкод : 1998AcCrD..54..964N . дои : 10.1107/S0907444998005125 . ПМИД 9757111 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в Кини Р.М., Доли Р. (ноябрь 2010 г.). «Структура, функции и эволюция трехпальцевых токсинов: мини-белки с несколькими мишенями». Токсикон . 56 (6): 855–67. дои : 10.1016/j.токсикон.2010.07.010 . ПМИД 20670641 .
- ^ Jump up to: а б Хегде Р.П., Раджагопалан Н., Доли Р., Кини М. (2010). «Змеиный яд трехпалых токсинов». В Макесси С.П. (ред.). Справочник ядов и токсинов рептилий . Бока-Ратон: CRC Press. стр. 287–302. ISBN 9781420008661 .
- ^ Jump up to: а б с д Кесслер П., Маршо П., Сильва М., Сервент Д. (август 2017 г.). «Токсиновая складка из трех пальцев: многофункциональный структурный каркас, способный модулировать холинергические функции» . Журнал нейрохимии . 142 (Приложение 2): 7–18. дои : 10.1111/jnc.13975 . ПМИД 28326549 .
- ^ Уткин Ю., Сунагар К., Джексон Т., Рикс Т., Фрай Б.Г. (2015). «Глава 8: Токсины трех пальцев». Во Фрае Б. (ред.). Ядовитые рептилии и их токсины: эволюция, патофизиология и биооткрытие . Издательство Оксфордского университета. стр. 218–227. ISBN 9780199309405 .
- ^ «Семейство змеиных трехпалых токсинов» . ВеномЗона . Проверено 21 апреля 2017 г.
- ^ Jump up to: а б Деван Дж. К., Грант Г. А., Саккеттини Дж. К. (ноябрь 1994 г.). «Кристаллическая структура каппа-бунгаротоксина при разрешении 2,3-А». Биохимия . 33 (44): 13147–54. дои : 10.1021/bi00248a026 . ПМИД 7947721 .
- ^ Jump up to: а б Павлак Дж., Макесси С.П., Сиксберри Н.М., Стура Э.А., Ле Дю М.Х., Менез Р., Фу К.С., Менез А., Ниртанан С., Кини Р.М. (февраль 2009 г.). «Ирдитоксин, новый ковалентно связанный гетеродимерный трехпальцевый токсин с высокой таксон-специфической нейротоксичностью» . Журнал ФАСЭБ . 23 (2): 534–45. дои : 10.1096/fj.08-113555 . ПМИД 18952712 . S2CID 4816592 .
- ^ Рой А., Чжоу Х, Чонг М.З., Д'ходт Д., Фу К.С., Раджагопалан Н., Ниртханан С., Бертран Д., Шивараман Дж., Кини Р.М. (март 2010 г.). «Структурная и функциональная характеристика нового гомодимерного трехпальцевого нейротоксина из яда офиофага Ханны (королевской кобры)» . Журнал биологической химии . 285 (11): 8302–15. дои : 10.1074/jbc.M109.074161 . ПМЦ 2832981 . ПМИД 20071329 .
- ^ Осипов А.В., Кашеверов И.Е., Макарова Ю.В., Старков В.Г., Воронцова О.В., Зиганшин Р.К., Андреева Т.В., Серебрякова М.В., Бенуа А., Хогг Р.К., Бертран Д., Цетлин В.И., Уткин Ю.Н. (май 2008 г.). «Природные дисульфидсвязанные димеры трехпалых токсинов: парадигма диверсификации биологической активности» . Журнал биологической химии . 283 (21): 14571–80. дои : 10.1074/jbc.M802085200 . ПМИД 18381281 .
- ^ де ла Роса, Гильермо; Ольвера, Фелипе; Арчундиа, Ирвинг Г.; Ломонте, Бруно; Алагон, Алехандро; Корсо, Херардо (декабрь 2019 г.). «Иммунизация лошадей консенсусным короткоцепочечным α-нейротоксином генерирует антитела против широкого спектра ядовитых видов элапидных» . Природные коммуникации . 10 (1): 3642. Бибкод : 2019NatCo..10.3642D . дои : 10.1038/s41467-019-11639-2 . ISSN 2041-1723 . ПМК 6692343 . ПМИД 31409779 .
- ^ Ниртанан С., Gwee MC (январь 2004 г.). «А-нейротоксины трех пальцев и никотиновый рецептор ацетилхолина, сорок лет спустя» . Журнал фармакологических наук . 94 (1): 1–17. дои : 10.1254/jphs.94.1 . ПМИД 14745112 .
- ^ Хасан-Путтасвами В., Адамс диджей, Кини Р.М. (декабрь 2015 г.). «Отличный функциональный участок Ω-нейротоксинов: новые антагонисты никотиновых рецепторов ацетилхолина из змеиного яда». АКС Химическая биология . 10 (12): 2805–15. doi : 10.1021/acschembio.5b00492 . ПМИД 26448325 .
- ^ Карлссон Э., Мбугуа П.М., Родригес-Итурральде Д. (1 января 1984 г.). «Фасцикулины, антихолинэстеразные токсины из яда зеленой мамбы Dendroaspis angusticeps». Журнал физиологии . 79 (4): 232–40. ПМИД 6530667 .
- ^ Раджагопалан Н., Пунг Ю.Ф., Чжу Ю.З., Вонг П.Т., Кумар П.П., Кини Р.М. (ноябрь 2007 г.). «Бета-кардиотоксин: новый трехпальцевый токсин из яда офиофага Ханны (королевской кобры) с бета-блокирующей активностью» . Журнал ФАСЭБ . 21 (13): 3685–95. дои : 10.1096/fj.07-8658com . ПМИД 17616557 . S2CID 21235585 .
- ^ Диошо С., Барон А., Салинас М., Дуге Д., Скарцелло С., Дабер-Гей А.С., Дебайль Д., Френд В., Аллуи А., Лаздунски М., Лингуэлья Е (октябрь 2012 г.). «Пептиды яда черной мамбы воздействуют на кислоточувствительные ионные каналы, чтобы облегчить боль» (PDF) . Природа . 490 (7421): 552–5. Бибкод : 2012Natur.490..552D . дои : 10.1038/nature11494 . ПМИД 23034652 . S2CID 4337253 .
- ^ Jump up to: а б Фрай Б.Г., Вюстер В., Кини Р.М., Брусич В., Хан А., Венкатараман Д., Руни А.П. (июль 2003 г.). «Молекулярная эволюция и филогения трехпалых токсинов яда элапидной змеи». Журнал молекулярной эволюции . 57 (1): 110–29. Бибкод : 2003JMolE..57..110F . CiteSeerX 10.1.1.539.324 . дои : 10.1007/s00239-003-2461-2 . ПМИД 12962311 . S2CID 12358977 .
- ^ Jump up to: а б с д Рейес-Веласко Дж., Кард Д.С., Эндрю А.Л., Шейни К.Дж., Адамс Р.Х., Шильд Д.Р., Кейсвелл Н.Р., Макесси С.П., Касто Т.А. (январь 2015 г.). «Экспрессия гомологов генов яда в различных тканях питона предполагает новую модель эволюции змеиного яда» . Молекулярная биология и эволюция . 32 (1): 173–83. дои : 10.1093/molbev/msu294 . ПМИД 25338510 .
- ^ Jump up to: а б Зуридакис М., Гиастас П., Заркадас Э., Хрони-Царту Д., Брегестовский П., Цартос С.Дж. (ноябрь 2014 г.). «Кристаллические структуры свободных и связанных с антагонистами состояний внеклеточного домена никотинового рецептора α9 человека». Структурная и молекулярная биология природы . 21 (11): 976–80. дои : 10.1038/nsmb.2900 . ПМИД 25282151 . S2CID 30096256 .
- ^ Тремо О., Лемэр С., Древет П., Пинкасфельд С., Дюкансель Ф., Булен Х.К., Менез А. (апрель 1995 г.). «Генная инженерия змеиных токсинов. Функциональный сайт эрабутоксина а, определенный методом направленного мутагенеза, включает варианты остатков» . Журнал биологической химии . 270 (16): 9362–9. дои : 10.1074/jbc.270.16.9362 . ПМИД 7721859 .
- ^ Лу Икс, Дэвис Дж, Лу Д, Ся М, Ваттам Б, Шан Д, Сунь Ю, Скалли М, Каккар В (01 января 2006 г.). «Влияние однократной замены аргинина в трипептидном мотиве RGD модифицированного нейротоксина дендроаспина на его активность агрегации тромбоцитов и клеточной адгезии» . Клеточная связь и адгезия . 13 (3): 171–83. дои : 10.1080/15419060600726183 . ПМИД 16798616 .
- ^ Коншина А.Г., Болдырев И.А., Уткин Ю.Н., Омельков А.В., Ефремов Р.Г. (апрель 2011). «Змеиные цитотоксины связываются с мембранами посредством взаимодействия с головными группами липидов фосфатидилсерина» . ПЛОС ОДИН . 6 (4): e19064. Бибкод : 2011PLoSO...619064K . дои : 10.1371/journal.pone.0019064 . ПМЦ 3084733 . ПМИД 21559494 .
- ^ Ли С.К., Линь CC, Ван CH, Ву PL, Хуан HW, Чанг CI, Ву WG (июль 2014 г.). «Эндоцитотические пути кардиотоксинов кобры зависят от пространственного распределения положительно заряженных и гидрофобных доменов, направленных на различные типы сульфатированных гликоконъюгатов на поверхности клеток» . Журнал биологической химии . 289 (29): 20170–81. дои : 10.1074/jbc.M114.557157 . ПМЦ 4106332 . ПМИД 24898246 .
- ^ Фрюшар-Гайяр С., Мурье Г., Бланше Г., Вера Л., Жиль Н., Менез Р., Маркон Э., Стура Э.А., Сервент Д. (14 июня 2012 г.). «Разработка трехпальцевых токсинов создает лиганды с оригинальными фармакологическими профилями для мускариновых и адренергических рецепторов» . ПЛОС ОДИН . 7 (6): e39166. Бибкод : 2012PLoSO...739166F . дои : 10.1371/journal.pone.0039166 . ПМЦ 3375269 . ПМИД 22720062 .
- ^ Георгиева Д., Арни Р.К., Бецель С. (декабрь 2008 г.). «Протеомный анализ токсинов змеиного яда: фармакологические открытия». Экспертное обозрение по протеомике . 5 (6): 787–97. дои : 10.1586/14789450.5.6.787 . ПМИД 19086859 . S2CID 29126350 .
- ^ Савиола А.Дж., Пейчото М.Е., Макесси С.П. (01 декабря 2014 г.). «Яды змей с задними клыками: неиспользованный источник новых соединений и потенциальных потенциальных лекарств». Обзоры токсинов . 33 (4): 185–201. дои : 10.3109/15569543.2014.942040 . hdl : 11336/17030 . ISSN 1556-9543 . S2CID 30100277 .
- ^ Стридом, ди-джей (декабрь 1973 г.). «Токсины змеиного яда: эволюция некоторых токсинов, обнаруженных в змеиных ядах». Систематическая зоология . 22 (4): 596–608. дои : 10.2307/2412964 . JSTOR 2412964 .
- ^ Jump up to: а б с Фрай Б.Г. (март 2005 г.). «От генома к «яду»: молекулярное происхождение и эволюция протеома змеиного яда, сделанные на основе филогенетического анализа последовательностей токсинов и связанных с ними белков организма» . Геномные исследования . 15 (3): 403–20. дои : 10.1101/гр.3228405 . ПМЦ 551567 . ПМИД 15741511 .
- ^ Jump up to: а б Кейсвелл Н.Р., Вюстер В., Вонк Ф.Дж., Харрисон Р.А., Фрай Б.Г. (апрель 2013 г.). «Сложные коктейли: эволюционная новизна ядов». Тенденции в экологии и эволюции . 28 (4): 219–29. дои : 10.1016/j.tree.2012.10.020 . ПМИД 23219381 .
- ^ де ла Роса, Гильермо; Корралес-Гарсия, Лигия Л.; Родригес-Руис, Химена; Лопес-Вера, Эстуардо; Корсо, Херардо (июль 2018 г.). «Короткоцепочечный консенсусный альфа-нейротоксин: синтетический 60-мерный пептид с общими характеристиками и повышенными иммуногенными свойствами» . Аминокислоты . 50 (7): 885–895. дои : 10.1007/s00726-018-2556-0 . ISSN 0939-4451 . ПМИД 29626299 . S2CID 4638613 .
- ^ Jump up to: а б с Вонк Ф.Дж., Кейсвелл Н.Р., Хенкель К.В., Хеймберг А.М., Янсен Х.Дж., Макклири Р.Дж., Керккамп Х.М., Вос Р.А., Геррейро И., Кальвете Дж.Дж., Вюстер В., Вудс А.Е., Логан Дж.М., Харрисон Р.А., Касто Т.А., де Конинг А.П., Поллок Д.Д., Янделл М., Кальдерон Д., Ренджифо К., Карриер Р.Б., Сальгадо Д., Пла Д., Санс Л., Хайдер А.С., Рибейро Х.М., Арнтцен Дж.В., ван ден Тилларт Г.Е., Бетцер М., Пировано В., Диркс Р.П., Спэнек Х.П., Дюбул Д., МакГлинн Э., Кини Р.М., Ричардсон М.К. (декабрь 2013 г.). «Геном королевской кобры демонстрирует динамическую эволюцию и адаптацию генов в системе змеиного яда» . Труды Национальной академии наук Соединенных Штатов Америки . 110 (51): 20651–6. Бибкод : 2013PNAS..11020651V . дои : 10.1073/pnas.1314702110 . ПМК 3870661 . ПМИД 24297900 .
- ^ Лауридсен Л.П., Лаустсен А.Х., Ломонте Б., Гутьеррес Х.М. (март 2016 г.). «Токсиковеномика и профиль противоядия восточной зеленой змеи мамбы (Dendroaspis angusticeps)» (PDF) . Журнал протеомики . 136 : 248–61. дои : 10.1016/j.jprot.2016.02.003 . ПМИД 26877184 .
- ^ Санс Л., Пла Д., Перес А., Родригес Ю., Завалета А., Салас М., Ломонте Б., Кальвете Х.Дж. (июнь 2016 г.). «Веномный анализ плохо изученной пустынной коралловой змеи Micrurus tschudii tschudii подтверждает дихотомию 3FTx/PLA₂ среди ядов Micrurus» . Токсины . 8 (6): 178. doi : 10.3390/toxins8060178 . ПМЦ 4926144 . ПМИД 27338473 .
- ^ Фрай Б.Г., Кейсвелл Н.Р., Вюстер В., Видал Н., Янг Б., Джексон Т.Н. (сентябрь 2012 г.). «Структурное и функциональное разнообразие системы яда рептилий Toxicofera». Токсикон . Прогресс в базовой и трансляционной веномике. 60 (4): 434–48. дои : 10.1016/j.токсикон.2012.02.013 . ПМИД 22446061 .
- ^ Харгривз А.Д., Суэйн М.Т., Хегарти М.Дж., Логан Д.В., Малли Дж.Ф. (август 2014 г.). «Дупликация генов ограничения и набора, а также происхождение и эволюция токсинов змеиного яда» . Геномная биология и эволюция . 6 (8): 2088–95. дои : 10.1093/gbe/evu166 . ПМЦ 4231632 . ПМИД 25079342 .
- ^ Jump up to: а б Сунагар К., Джексон Т.Н., Ундхейм Э.А., Али С.А., Антунес А., Фрай Б.Г. (ноябрь 2013 г.). «Трехпалые RAVER: быстрое накопление изменений в открытых остатках токсинов змеиного яда» . Токсины . 5 (11): 2172–208. дои : 10.3390/toxins5112172 . ПМЦ 3847720 . ПМИД 24253238 .