Гиббереллин
Эта статья может содержать чрезмерное количество сложных деталей, которые могут заинтересовать только определенную аудиторию . ( сентябрь 2019 г. ) |
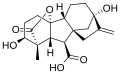
Гиббереллины ( ГА ) представляют собой растительные гормоны , которые регулируют различные процессы развития , включая удлинение стебля , прорастание , период покоя , цветение , цветков развитие , а также старение листьев и плодов . [1] ГК являются одним из старейших известных классов растительных гормонов. Считается, что селекция (хотя и бессознательная) сортов сельскохозяйственных культур с дефицитом синтеза ГК была одной из ключевых движущих сил « зеленой революции » в 1960-х годах. [2] революция, которая, как считается, спасла более миллиарда жизней во всем мире. [3]
Химия
[ редактировать ]Все известные гиббереллины представляют собой дитерпеноидные кислоты, которые синтезируются терпеноидным путем в пластидах , а затем модифицируются в эндоплазматическом ретикулуме и цитозоле до достижения биологически активной формы. [4] Все гиббереллины образуются через энт -гиббереллановый скелет, но синтезируются через энт -каурен. Гиббереллины получили названия от GA 1 до GA n в порядке открытия. [5] Гиббереллиновая кислота , которая была первым гиббереллином, структурно охарактеризованным, представляет собой GA 3 . [6]
По состоянию на 2020 год [update], [5] из растений, грибов и бактерий идентифицировано 136 ГК. [1] [6] [5]
Гиббереллины представляют собой тетрациклические дитерпеновые кислоты. Существует два класса в зависимости от наличия 19 или 20 атомов углерода. 19-углеродные гиббереллины, такие как гиббереллиновая кислота, потеряли углерод 20 и вместо этого обладают пятичленным лактонным мостиком, соединяющим атомы углерода 4 и 10. 19-углеродные формы, как правило, являются биологически активными формами гиббереллинов. . Гидроксилирование также оказывает большое влияние на биологическую активность гиббереллина. В целом, наиболее биологически активными соединениями являются дигидроксилированные гиббереллины, которые обладают гидроксильными группами как на углероде 3, так и на углероде 13. Гиббереллиновая кислота представляет собой дигидроксилированный гиббереллин. [7]
Биоактивные ГК
[ редактировать ]Биоактивными ГК являются GA 1 , GA 3 , GA 4 и GA 7 . [8] Между этими ГК есть три общие структурные особенности: гидроксильная группа на C-3β, карбоксильная группа на C-6 и лактон между C-4 и C-10. [8] 3β-гидроксильная группа может быть заменена на другие функциональные группы в положениях С-2 и/или С-3. [8] GA 5 и GA 6 являются примерами биоактивных ГК, не имеющих гидроксильной группы на C-3β. [8] Присутствие ГК 1 у различных видов растений позволяет предположить, что это обычная биоактивная ГК. [9]
- Гиббереллин А 1 (ГА 1 )
- Гибберелловая кислота (GA 3 )
- ент -Гиббереллан
- но -Каурин
Биологическая функция
[ редактировать ]
Гиббереллины участвуют в естественном процессе нарушения покоя и других аспектах прорастания . Прежде чем на ранних стадиях прорастания фотосинтетический аппарат достаточно разовьется, запасенные энергетические запасы крахмала проросток питают . Обычно при прорастании расщепление крахмала до глюкозы в эндосперме начинается вскоре после того, как семена подвергаются воздействию воды. [10] Считается, что гиббереллины в зародышах семян сигнализируют о гидролизе крахмала , индуцируя синтез фермента α- амилазы в алейроновых клетках. В модели индуцированной гиббереллином продукции α-амилазы показано, что гиббереллины (обозначенные GA), продуцируемые в щитке, диффундируют в алейроновые клетки, где стимулируют секрецию α-амилазы. [4] Затем α-амилаза гидролизует крахмал, которого много во многих семенах, до глюкозы, которая может использоваться в клеточном дыхании для производства энергии для зародыша семени. Исследования этого процесса показали, что гиббереллины вызывают более высокие уровни транскрипции гена, кодирующего фермент α-амилазы, чтобы стимулировать синтез α-амилазы. [7]
Гиббереллины производятся в большей массе, когда растение подвергается воздействию низких температур. Они стимулируют удлинение клеток, ломку и почкование, бессемянные плоды и прорастание семян. Гиббереллины вызывают прорастание семян, нарушая период покоя семян и действуя как химический посредник. Его гормон связывается с рецептором, а кальций активирует белок кальмодулин , а комплекс связывается с ДНК, вырабатывая фермент, стимулирующий рост эмбриона.
Метаболизм
[ редактировать ]Биосинтез
[ редактировать ]ГК обычно синтезируются по пути метилэритритфосфата (МЭП) у высших растений. [11] В этом пути биоактивная ГК образуется из транс -геранилгеранилдифосфата (GGDP). [11] В пути MEP для получения ГК из GGDP используются три класса ферментов: терпеновый синтез (TPS), монооксигеназы цитохрома P450 (P450) и 2-оксоглутарат-зависимые диоксигеназы (2ODD). [8] Путь MEP состоит из восьми этапов: [8]
- GGDP превращается в энт-копалилдифосфат (энт-ЦДФ) под действием энт -копалилдифосфатсинтазы (CPS).
- энт-ЦДФ преобразуется в энт-каурен под действием энт -кауренсинтазы (KS).
- энт-каурен превращается в энт-кауренол под действием энт -кауреноксидазы (КО).
- энт-кауренол преобразуется в энт-кауренал нокаутом
- энт-кауренал превращается в энт-кауреновую кислоту путем КО.
- энт-кауреновая кислота превращается в энт-7а-гидроксикауреновую кислоту под действием оксидазы энт -кауреновой кислоты (КАО).
- энт-7а-гидроксикауреновая кислота превращается в GA12-альдегид под действием КАО.
- GA12-альдегид преобразуется в GA12 с помощью КАО. GA12 преобразуется в биоактивный GA4 путем окисления C-20 и C-3, что осуществляется двумя растворимыми ODD: GA 20-оксидазой и GA 3-оксидазой.
Один или два гена кодируют ферменты, ответственные за первые этапы биосинтеза ГК у арабидопсиса и риса. [8] Нулевые аллели генов, кодирующих CPS, KS и KO, приводят к появлению карликовых арабидопсисов с дефицитом GA . [12] Семейства мультигенов кодируют 2ODDs, которые катализируют образование GA 12 в биоактивную GA 4 . [8]
AtGA3ox1 и AtGA3ox2, два из четырех генов, кодирующих GA3ox у Arabidopsis , влияют на вегетативное развитие. [13] Стимулы окружающей среды регулируют активность AtGA3ox1 и AtGA3ox2 во время прорастания семян. [14] [15] У Arabidopsis сверхэкспрессия GA20ox приводит к увеличению концентрации GA. [16] [17]
Места биосинтеза
[ редактировать ]Большинство биоактивных ГК локализовано в активно растущих органах растений. [11] Гены GA20ox и GA3ox (гены, кодирующие GA 20-оксидазу и GA 3-оксидазу), а также ген SLENDER1 ( ген передачи сигнала GA ) обнаружены в растущих органах риса, что позволяет предположить, что биоактивный синтез GA происходит в месте их действия в Растущие органы у растений. [18] Считается, что во время развития цветка тапетум пыльников является основным местом биосинтеза ГК. [18] [19]
Различия биосинтеза у грибов и низших растений
[ редактировать ]Arabidopsis Растение Gibberella fujikuroi обладают разными путями ГК и ферментами. и гриб [8] Р450 у грибов выполняют функции, аналогичные функциям КАО у растений. [20] Функцию CPS и KS у растений выполняет один фермент CPS/KS у грибов. [21] [22] [23] У грибов гены биосинтеза ГК находятся на одной хромосоме, а у растений они обнаруживаются случайным образом на нескольких хромосомах. [24] [25] Растения производят небольшое количество ГК 3 , поэтому ГК 3 производится микроорганизмами для промышленных целей. В промышленности гиббереллиновую кислоту можно производить методом глубинной ферментации, но этот процесс дает низкий выход с высокими производственными затратами и, следовательно, более высокой продажной стоимостью. Тем не менее, другим альтернативным процессом, позволяющим снизить затраты на производство GA 3, является твердофазная ферментация (SSF), которая позволяет использование отходов агропромышленного производства. [26]
Катаболизм
[ редактировать ]Было идентифицировано несколько механизмов инактивации ГК. 2β-гидроксилирование дезактивирует GA и катализируется GA2-оксидазами (GA2oxs). [11] Некоторые GA2ox используют C19-GA в качестве субстратов, а другие GA2ox используют C20-GA. [27] [28] Цитохром P450 монооксигеназа, кодируемая удлиненным верхним междоузлием (eui), превращает ГК в 16α,17-эпоксиды. [29] Мутанты eui риса накапливают биоактивные ГК на высоких уровнях, что позволяет предположить, что монооксигеназа цитохрома P450 является основным ферментом, ответственным за дезактивацию ГК в рисе. [29] Гены Gamt1 и gamt2 кодируют ферменты, метилирующие карбоксильную группу C-6 ГК. [30] У мутантов gamt1 и gamt2 концентрация ГК в развивающихся семенах увеличена. [30]
Гомеостаз
[ редактировать ]Регулирование по принципу обратной связи и прямой связи поддерживает уровень биоактивных ГК в растениях. [31] [32] Уровни экспрессии AtGA20ox1 и AtGA3ox1 повышаются в среде с дефицитом ГК и снижаются после добавления биоактивных ГК. [14] [33] [34] [35] [36] И наоборот, экспрессия AtGA2ox1 и AtGA2ox2, генов дезактивации GA, увеличивается при добавлении GA. [27]
Регулирование
[ редактировать ]Регуляция другими гормонами
[ редактировать ]Ауксин индол-3-уксусная кислота (ИУК) регулирует концентрацию GA 1 в удлиняющихся междоузлиях гороха. [37] Удаление IAA путем удаления апикальной почки, источника ауксина, снижает концентрацию GA 1 , а повторное введение IAA обращает эти эффекты вспять, увеличивая концентрацию GA 1 . [37] Это явление также наблюдалось у табачных растений. [38] Ауксин увеличивает окисление GA 3 и снижает окисление GA 2 в ячмене. [39] Ауксин также регулирует биосинтез ГК во время развития плодов гороха. [40] Эти открытия на различных видах растений позволяют предположить, что ауксиновая регуляция метаболизма ГК может быть универсальным механизмом.
Этилен снижает концентрацию биоактивных ГК. [41]
Регулирование факторами окружающей среды
[ редактировать ]Недавние данные свидетельствуют о том, что колебания концентрации ГК влияют на регулируемое светом прорастание семян, фотоморфогенез во время деэтиоляции и регуляцию фотопериода удлинения стебля и цветения. [8] Микроматричный анализ показал, что около четверти генов, реагирующих на холод, связаны с генами, регулируемыми ГК, что позволяет предположить, что ГК влияет на реакцию на холодные температуры. [15] Растения снижают скорость роста при стрессе. Взаимосвязь между уровнями ГК и количеством пережитого стресса была предположена для ячменя. [42]
Роль в развитии семян
[ редактировать ]Биоактивные ГК и уровни абсцизовой кислоты имеют обратную зависимость и регулируют развитие и прорастание семян. [43] [44] Уровни FUS3, транскрипционного фактора арабидопсиса , повышаются с помощью АБК и понижаются с помощью ГК, что позволяет предположить, что существует цикл регуляции, который устанавливает баланс ГК и АБК. [45]
Сигнальный механизм
[ редактировать ]Рецептор
[ редактировать ]В начале 1990-х годов было несколько доказательств того, что в семенах овса существует рецептор ГК , расположенный на плазматической мембране . Однако, несмотря на интенсивные исследования, на сегодняшний день не выделен ни один мембраносвязанный рецептор ГК. Это, наряду с открытием растворимого рецептора, нечувствительного к GA карлика 1 (GID1), заставило многих усомниться в существовании мембраносвязанного рецептора. [1]
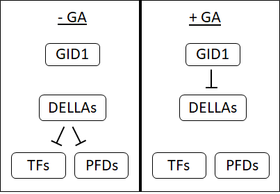
GID1 впервые был обнаружен в рисе. [46] а у Arabidopsis есть три ортолога GID1, AtGID1a, b и c. [1] GID1 обладают высоким сродством к биоактивным ГК. [46] GA связывается со специфическим связывающим карманом на GID1; C3-гидроксил на GA вступает в контакт с тирозином-31 в кармане связывания GID1. [47] [48] Привязка GA к GID1 вызывает изменения в структуре GID1, в результате чего «крышка» на GID1 закрывает карман привязки GA. Движение этой крышки приводит к обнажению поверхности, которая позволяет связывать GID1 с белками DELLA. [47] [48]
Белки DELLA: репрессия репрессора
[ редактировать ]Белки DELLA, такие как SLR1 у риса или GAI и RGA у арабидопсиса, являются репрессорами развития растений. DELLA подавляют прорастание семян, рост семян и цветение, а GA обращает эти эффекты вспять. [49] Белки DELLA характеризуются наличием мотива DELLA ( аспартат - глутамат - лейцин -лейцин- аланин или DELLA в однобуквенном аминокислотном коде ). [50]
Когда GA связывается с рецептором GID1, он усиливает взаимодействие между белками GID1 и DELLA, образуя комплекс GA-GID1-DELLA. Считается, что в комплексе GA-GID1-DELLA белки DELLA претерпевают изменения в структуре, которые позволяют им связываться с белками F-box (SLY1 у Arabidopsis или GID2 у риса). [51] [50] [52] Белки F-box катализируют добавление убиквитина к своим мишеням. [51] Добавление убиквитина к белкам DELLA способствует их деградации через 26S-протеосому . [50] Деградация белков DELLA освобождает клетки от их репрессивного воздействия.
Мишени белков DELLA
[ редактировать ]Транскрипционные факторы
[ редактировать ]Первыми идентифицированными мишенями белков DELLA были ФАКТОРЫ ВЗАИМОДЕЙСТВИЯ ФИТОХРОМА (PIF). PIFs представляют собой факторы транскрипции , которые негативно регулируют передачу световых сигналов и являются сильными промоутерами роста элонгации. В присутствии GA DELLA разрушаются, что позволяет PIF способствовать удлинению. [53] Позже было обнаружено, что DELLA репрессируют большое количество других факторов транскрипции, среди которых положительные регуляторы передачи сигналов ауксина , брассиностероида и этилена . [54] [55] DELLA могут подавлять факторы транскрипции, либо останавливая их связывание с ДНК, либо способствуя их деградации. [53]
Префолдины и сборка микротрубочек
[ редактировать ]Помимо репрессии факторов транскрипции, DELLA также связываются с префолдинами (PFD). PFD являются молекулярными шаперонами , то есть помогают в сворачивании других белков. PFD функционируют в цитозоле, но когда DELLA связываются с PFD, они ограничиваются ядром . Важной функцией PFD является помощь в сворачивании β-тубулина . Таким образом, в отсутствие GA (при высоком уровне белков DELLA) функция PDF снижается и клеточный пул β-тубулина снижается. Когда присутствует GA, DELLA разрушаются, PDFs могут перемещаться в цитозоль и способствовать сворачиванию β-тубулина. β-тубулин является жизненно важным компонентом цитоскелета ( в форме микротрубочек ). Таким образом, ГК позволяет реорганизовать цитоскелет и удлинить клетки. [56]
Микротрубочки также необходимы для транспортировки мембранных везикул . Транспортировка мембранных пузырьков необходима для правильного позиционирования нескольких переносчиков гормонов . Одними из наиболее хорошо изученных переносчиков гормонов являются белки PIN , которые отвечают за перемещение гормона ауксина между клетками. В отсутствие GA белки DELLA снижают уровень микротрубочек и тем самым ингибируют транспорт мембранных везикул. Это снижает уровень белков PIN на клеточной мембране и уровень ауксина в клетке. ГК обращает этот процесс вспять и обеспечивает транспортировку белка PIN к клеточной мембране, повышая уровень ауксина в клетке. [57]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Хедден П., Спонсел В. (2015). «Век исследований гиббереллинов» . Журнал регулирования роста растений . 34 (4): 740–60. дои : 10.1007/s00344-015-9546-1 . ПМЦ 4622167 . ПМИД 26523085 .
- ^ Спилмейер В., Эллис М.Х., Чендлер П.М. (июнь 2002 г.). «Полуварф (sd-1), рис «зеленой революции», содержит дефектный ген гиббереллин-20-оксидазы» . Труды Национальной академии наук Соединенных Штатов Америки . 99 (13): 9043–8. Бибкод : 2002PNAS...99.9043S . дои : 10.1073/pnas.132266399 . ПМК 124420 . ПМИД 12077303 .
- ^ «Норман Борлоуг: Миллиард спасенных жизней» . www.agbioworld.org . Проверено 11 мая 2018 г.
- ^ Jump up to: а б Кэмпбелл Н. , Рик Дж.Б. (2002). Биология (6-е изд.). Сан-Франциско: Бенджамин Каммингс. ISBN 9780805366242 .
- ^ Jump up to: а б с Спонсел, Валери М.; Хедден, Питер (2010), Дэвис, Питер Дж. (редактор), «Биосинтез и инактивация гиббереллина» , Растительные гормоны , Дордрехт: Springer Нидерланды, стр. 63–94, номер документа : 10.1007/978-1-4020-2686- 7_4 , ISBN 978-1-4020-2684-3 , получено 29 января 2022 г.
- ^ Jump up to: а б Хедден, Питер (23 ноября 2020 г.). «Современное состояние исследований биосинтеза гиббереллина» . Физиология растений и клеток . 61 (11): 1832–1849. дои : 10.1093/pcp/pcaa092 . ISSN 1471-9053 . ПМЦ 7758035 . ПМИД 32652020 .
- ^ Jump up to: а б «Гиббереллины». ДоступНаука . дои : 10.1036/1097-8542.289000 .
- ^ Jump up to: а б с д и ж г час я дж Ямагути С (2008). «Метаболизм гиббереллина и его регуляция». Ежегодный обзор биологии растений . 59 : 225–51. doi : 10.1146/annurev.arplant.59.032607.092804 . ПМИД 18173378 .
- ^ Макмиллан Дж. (декабрь 2001 г.). «Наличие гиббереллинов в сосудистых растениях, грибах и бактериях». Журнал регулирования роста растений . 20 (4): 387–442. дои : 10.1007/s003440010038 . ПМИД 11986764 . S2CID 44504525 .
- ^ Дэвис П.Дж. «Рост растений». ДоступНаука . дои : 10.1036/1097-8542.523000 .
- ^ Jump up to: а б с д Хедден П., Томас С.Г. (май 2012 г.). «Биосинтез гиббереллина и его регуляция». Биохимический журнал . 444 (1): 11–25. дои : 10.1042/BJ20120245 . ПМИД 22533671 . S2CID 25627726 .
- ^ Курниф М., ван дер Вин Дж. Х. (ноябрь 1980 г.). «Индукция и анализ чувствительных к гиббереллину мутантов Arabidopsis thaliana (L.) heynh». Теоретическая и прикладная генетика . 58 (6): 257–63. дои : 10.1007/BF00265176 . ПМИД 24301503 . S2CID 22824299 .
- ^ Митчум М.Г., Ямагути С., Ханада А., Кувахара А., Ёсиока Ю., Като Т., Табата С., Камия Ю., Сан Т.П. (март 2006 г.). «Различные и перекрывающиеся роли двух гиббереллин-3-оксидаз в развитии Arabidopsis» . Заводской журнал . 45 (5): 804–18. дои : 10.1111/j.1365-313X.2005.02642.x . ПМИД 16460513 .
- ^ Jump up to: а б Ямагучи С., Смит М.В., Браун Р.Г., Камия Ю., Сан Т. (декабрь 1998 г.). «Регуляция фитохромов и дифференциальная экспрессия генов гиббереллин-3-бета-гидроксилазы в прорастающих семенах арабидопсиса» . Растительная клетка . 10 (12): 2115–26. дои : 10.1105/tpc.10.12.2115 . ПМК 143973 . ПМИД 9836749 .
- ^ Jump up to: а б Ямаути Ю, Огава М, Кувахара А, Ханада А, Камия Ю, Ямагути С (февраль 2004 г.). «Активация биосинтеза гиббереллина и пути реакции на низкую температуру при пропитывании семян Arabidopsis thaliana» . Растительная клетка . 16 (2): 367–78. дои : 10.1105/tpc.018143 . ПМК 341910 . ПМИД 14729916 .
- ^ Коулз Дж. П., Филлипс А. Л., Крокер С. Дж., Гарсиа-Лепе Р., Льюис М. Дж., Хедден П. (март 1999 г.). «Модификация производства гиббереллина и развития растений у Arabidopsis путем смысловой и антисмысловой экспрессии генов гиббереллин-20-оксидазы». Заводской журнал . 17 (5): 547–56. дои : 10.1046/j.1365-313X.1999.00410.x . ПМИД 10205907 .
- ^ Хуанг С., Раман А.С., Реам Дж.Э., Фудзивара Х., Черни Р.Э., Браун С.М. (ноябрь 1998 г.). «Сверхэкспрессия 20-оксидазы приводит к фенотипу сверхпродукции гиббереллина у арабидопсиса» . Физиология растений . 118 (3): 773–81. дои : 10.1104/стр.118.3.773 . ПМК 34787 . ПМИД 9808721 .
- ^ Jump up to: а б Канеко М., Ито Х., Инукай Ю., Сакамото Т., Уэгути-Танака М., Асикари М., Мацуока М. (июль 2003 г.). «Где в растениях риса происходит биосинтез гиббереллина и передача сигналов гиббереллина?» . Заводской журнал . 35 (1): 104–15. дои : 10.1046/j.1365-313X.2003.01780.x . ПМИД 12834406 .
- ^ Ито Х., Танака-Уэгучи М., Кавайде Х., Чен Х., Камия Ю., Мацуока М. (октябрь 1999 г.). «Ген, кодирующий 3-бета-гидроксилазу гиббереллина табака, экспрессируется в месте действия ГК во время удлинения стебля и развития цветочных органов» . Заводской журнал . 20 (1): 15–24. дои : 10.1046/j.1365-313X.1999.00568.x . ПМИД 10571861 .
- ^ Рохас М.К., Хедден П., Гаскин П., Тудзинский Б. (май 2001 г.). «Ген P450-1 Gibberella fujikuroi кодирует многофункциональный фермент биосинтеза гиббереллина» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (10): 5838–43. Бибкод : 2001PNAS...98.5838R . дои : 10.1073/pnas.091096298 . ПМК 33300 . ПМИД 11320210 .
- ^ Кавайде Х., Имаи Р., Сасса Т., Камия Ю. (август 1997 г.). «Энт-кауренсинтаза из гриба Phaeosphaeria sp. L487. Выделение кДНК, характеристика и бактериальная экспрессия бифункциональной дитерпенциклазы в биосинтезе гиббереллина грибов» . Журнал биологической химии . 272 (35): 21706–12. дои : 10.1074/jbc.272.35.21706 . ПМИД 9268298 .
- ^ Тойомасу Т., Кавайде Х., Ишизаки А., Шинода С., Оцука М., Мицухаси В., Сасса Т. (март 2000 г.). «Клонирование полноразмерной кДНК, кодирующей энт-кауренсинтазу из Gibberella fujikuroi: функциональный анализ бифункциональной дитерпенциклазы» . Бионауки, биотехнологии и биохимия . 64 (3): 660–4. дои : 10.1271/bbb.64.660 . ПМИД 10803977 .
- ^ Тудзинский Б., Кавайде Х., Камия Ю. (сентябрь 1998 г.). «Биосинтез гиббереллина у Gibberella fujikuroi: клонирование и характеристика гена копалилдифосфатсинтазы». Современная генетика . 34 (3): 234–40. дои : 10.1007/s002940050392 . ПМИД 9745028 . S2CID 3021994 .
- ^ Хедден П., Филлипс А.Л., Рохас М.К., Каррера Э., Тудзинский Б. (декабрь 2001 г.). «Биосинтез гиббереллина в растениях и грибах: случай конвергентной эволюции?». Журнал регулирования роста растений . 20 (4): 319–331. дои : 10.1007/s003440010037 . ПМИД 11986758 . S2CID 25623658 .
- ^ Кавайде Х (март 2006 г.). «Биохимический и молекулярный анализ биосинтеза гиббереллина у грибов» . Бионауки, биотехнологии и биохимия . 70 (3): 583–90. дои : 10.1271/bbb.70.583 . ПМИД 16556972 . S2CID 20952424 .
- ^ Лопес А.Л., Силва Д.Н., Родригес К., Коста Х.Л., Мачадо М.П., Пенья Р.О., Биаси Л.А., Рикардо К. (2013). «Экстракт, ферментированный гиббереллиновой кислотой, полученный твердофазной ферментацией с использованием цитрусовой мякоти Fusarium moniliforme: влияние на Lavandula angustifolia Mill., культивируемую in vitro». Мистер Джей Бот . 45 : 2057–2064.
- ^ Jump up to: а б Томас С.Г., Филлипс А.Л., Хедден П. (апрель 1999 г.). «Молекулярное клонирование и функциональная экспрессия гиббереллин-2-оксидаз, многофункциональных ферментов, участвующих в дезактивации гиббереллина» . Труды Национальной академии наук Соединенных Штатов Америки . 96 (8): 4698–703. Бибкод : 1999PNAS...96.4698T . дои : 10.1073/pnas.96.8.4698 . ПМК 16395 . ПМИД 10200325 .
- ^ Шомбург FM, Биззелл CM, Ли DJ, Zeevaart JA, Амасино RM (январь 2003 г.). «Сверхэкспрессия нового класса гиббереллин-2-оксидаз снижает уровень гиббереллина и приводит к образованию карликовых растений» . Растительная клетка . 15 (1): 151–63. дои : 10.1105/tpc.005975 . ПМК 143488 . ПМИД 12509528 .
- ^ Jump up to: а б Чжу Ю, Номура Т, Сюй Ю, Чжан Ю, Пэн Ю, Мао Б, Ханада А, Чжоу Х, Ван Р, Ли П, Чжу Х, Мандер Л.Н., Камия Ю, Ямагути С, Хэ З (февраль 2006 г.). «Удлиненное верхнее междоузлие кодирует монооксигеназу цитохрома P450, которая эпоксидирует гиббереллины в новой реакции дезактивации в рисе» . Растительная клетка . 18 (2): 442–56. дои : 10.1105/tpc.105.038455 . ПМК 1356550 . ПМИД 16399803 .
- ^ Jump up to: а б Варбанова М, Ямагучи С, Ян Й, МакКелви К, Ханада А, Борохов Р, Ю Ф, Джикумару Й, Росс Дж, Кортес Д, Ма СиДжей, Ноэль Дж. П., Мандер Л, Шулаев В, Камия Й, Родермель С, Вайс Д. , Пичерский Э (январь 2007 г.). «Метилирование гиббереллинов арабидопсисом GAMT1 и GAMT2» . Растительная клетка 19 (1): 32–4 дои : 10.1105/tpc.106.044602 . ПМК 1820973 . ПМИД 17220201 .
- ^ Хедден П., Филлипс А.Л. (декабрь 2000 г.). «Метаболизм гиббереллина: новые открытия, открытые генами». Тенденции в науке о растениях . 5 (12): 523–30. дои : 10.1016/S1360-1385(00)01790-8 . ПМИД 11120474 .
- ^ Ольшевский Н., Сан Т.П., Гублер Ф. (2002). «Передача сигналов гиббереллина: биосинтез, катаболизм и пути ответа» . Растительная клетка . 14 Дополнение (Дополнение): S61–80. дои : 10.1105/tpc.010476 . ПМК 151248 . ПМИД 12045270 .
- ^ Чан Х.Х., Хван И, Гудман Х.М. (февраль 1995 г.). «Выделение локуса Arabidopsis GA4» . Растительная клетка . 7 (2): 195–201. дои : 10.1105/tpc.7.2.195 . ПМК 160775 . PMID 7756830 .
- ^ Мацусита А., Фурумото Т., Исида С., Такахаши Ю. (март 2007 г.). «AGF1, белок AT-крючка, необходим для отрицательной обратной связи AtGA3ox1, кодирующего GA-3-оксидазу» . Физиология растений . 143 (3): 1152–62. дои : 10.1104/стр.106.093542 . ПМК 1820926 . ПМИД 17277098 .
- ^ Филлипс А.Л., Уорд Д.А., Укнес С., Эпплфорд Н.Е., Ланге Т., Хаттли А.К., Гаскин П., Гребе Дж.Э., Хедден П. (июль 1995 г.). «Выделение и экспрессия трех клонов кДНК гиббереллин-20-оксидазы из Arabidopsis» . Физиология растений . 108 (3): 1049–57. дои : 10.1104/стр.108.3.1049 . ПМК 157456 . ПМИД 7630935 .
- ^ Сюй Ю.Л., Ли Л., Гейдж Д.А., Зиваарт Дж.А. (май 1999 г.). «Регуляция экспрессии GA5 по обратной связи и метаболическая инженерия уровней гиббереллина у арабидопсиса» . Растительная клетка . 11 (5): 927–36. дои : 10.1105/tpc.11.5.927 . ПМК 144230 . ПМИД 10330476 .
- ^ Jump up to: а б Росс Дж.Дж., О'Нил Д.П., Смит Дж.Дж., Керкхоффс Л.Х., Эллиотт Р.К. (март 2000 г.). «Доказательства того, что ауксин способствует биосинтезу гиббереллина А1 в горохе» . Заводской журнал . 21 (6): 547–52. дои : 10.1046/j.1365-313x.2000.00702.x . ПМИД 10758505 .
- ^ Вольбанг CM, Росс Джей-Джей (ноябрь 2001 г.). «Ауксин способствует биосинтезу гиббереллина в обезглавленных растениях табака» . Планта . 214 (1): 153–7. Бибкод : 2001Plant.214..153W . дои : 10.1007/s004250100663 . ПМИД 11762165 . S2CID 31185063 .
- ^ Волбанг СМ, Чендлер ПМ, Смит Дж. Дж., Росс Дж. Дж. (февраль 2004 г.). «Ауксин из развивающегося соцветия необходим для биосинтеза активных гиббереллинов в стеблях ячменя» . Физиология растений . 134 (2): 769–76. дои : 10.1104/стр.103.030460 . ПМЦ 344552 . ПМИД 14730077 .
- ^ Нго П., Озга Дж.А., Райнеке Д.М. (июль 2002 г.). «Специфика ауксиновой регуляции экспрессии гена гиббереллин-20-оксидазы в околоплоднике гороха». Молекулярная биология растений . 49 (5): 439–48. дои : 10.1023/A:1015522404586 . ПМИД 12090620 . S2CID 22530544 .
- ^ Ачард П., Багур М., Чаппл А., Хедден П., Ван дер Страетен Д., Генщик П., Мориц Т., Харберд Н.П. (апрель 2007 г.). «Гормон стресса растений этилен контролирует цветочный переход посредством DELLA-зависимой регуляции генов, определяющих меристему цветка» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (15): 6484–9. Бибкод : 2007PNAS..104.6484A . дои : 10.1073/pnas.0610717104 . ПМК 1851083 . ПМИД 17389366 .
- ^ Веттаккоруманкав Н.Н., Фальк Д., Саксена П., Флетчер Р.А. (1999). «Решающая роль гиббереллинов в защите растений от стресса» . Физиология растений и клеток . 40 (5): 542–548. doi : 10.1093/oxfordjournals.pcp.a029575 .
- ^ Батдж С.Л., Росс Дж.Дж., Рид Дж.Б. (1999). «Уровни абсцизовой кислоты в семенах мутанта lh-2 с дефицитом гиббереллина гороха (Pisum sativum)» . Физиология Плантарум . 195 (3): 485–490. дои : 10.1034/j.1399-3054.1999.105313.x .
- ^ Уайт CN, Пробстинг WM, Хедден П., Ривин CJ (апрель 2000 г.). «Гиббереллины и развитие семян кукурузы. I. Доказательства того, что баланс гиббереллина и абсцизовой кислоты регулирует пути прорастания и созревания» . Физиология растений . 122 (4): 1081–8. дои : 10.1104/стр.122.4.1081 . ПМК 58942 . ПМИД 10759503 .
- ^ Газзаррини С., Цучия Ю., Лумба С., Окамото М., МакКорт П. (сентябрь 2004 г.). «Фактор транскрипции FUSCA3 контролирует сроки развития Arabidopsis посредством гормонов гиббереллина и абсцизовой кислоты» . Развивающая клетка . 7 (3): 373–85. дои : 10.1016/j.devcel.2004.06.017 . ПМИД 15363412 .
- ^ Jump up to: а б Уэгути-Танака М, Накадзима М, Като Э, Омия Х, Асано К, Саджи С, Хонгю Икс, Асикари М, Китано Х, Ямагути И, Мацуока М (июль 2007 г.). «Молекулярные взаимодействия растворимого рецептора гиббереллина GID1 с рисовым белком DELLA SLR1 и гиббереллином» . Растительная клетка . 19 (7): 2140–55. дои : 10.1105/tpc.106.043729 . ЧВК 1955699 . ПМИД 17644730 .
- ^ Jump up to: а б Мурасе К., Хирано Й., Сан Т.П., Хакошима Т. (ноябрь 2008 г.). «Индуцированное гиббереллином распознавание DELLA рецептором гиббереллина GID1». Природа . 456 (7221): 459–63. Бибкод : 2008Natur.456..459M . дои : 10.1038/nature07519 . ПМИД 19037309 . S2CID 16280595 .
- ^ Jump up to: а б Симада А., Уэгути-Танака М., Накацу Т., Накадзима М., Наоэ Ю., Омия Х., Като Х., Мацуока М. (ноябрь 2008 г.). «Структурная основа распознавания гиббереллина его рецептором GID1». Природа 456 (7221): 520–3. Бибкод : 2008Nature.456..520S . дои : 10.1038/nature07546 . ПМИД 19037316 . S2CID 205215510 .
- ^ Ахард П., Генщик П. (2009). «Освобождение тормозов роста растений: как ГА отключают белки DELLA» . Журнал экспериментальной ботаники . 60 (4): 1085–92. дои : 10.1093/jxb/ern301 . ПМИД 19043067 .
- ^ Jump up to: а б с Давьер Ж.М., Ашар П. (март 2013 г.). «Передача сигналов гиббереллина в растениях» . Разработка . 140 (6): 1147–51. дои : 10.1242/dev.087650 . ПМИД 23444347 .
- ^ Jump up to: а б Лехнер Э., Ахард П., Вансири А., Потушак Т., Генщик П. (декабрь 2006 г.). «Белки F-box повсюду». Современное мнение в области биологии растений . 9 (6): 631–8. Бибкод : 2006COPB....9..631L . дои : 10.1016/j.pbi.2006.09.003 . ПМИД 17005440 .
- ^ Макгиннис К.М., Томас С.Г., Соул Дж.Д., Стрейдер Л.К., Зейл Дж.М., Сан Т.П., Стебер К.М. (май 2003 г.). «Ген SLEEPY1 арабидопсиса кодирует предполагаемую субъединицу F-бокса убиквитинлигазы SCF E3» . Растительная клетка . 15 (5): 1120–30. дои : 10.1105/tpc.010827 . ПМК 153720 . ПМИД 12724538 .
- ^ Jump up to: а б Чжэн Ю, Гао З, Чжу Цз (октябрь 2016 г.). «Модули DELLA-PIF: старые собаки учатся новым трюкам» . Тенденции в науке о растениях . 21 (10): 813–815. doi : 10.1016/j.tplants.2016.08.006 . ПМИД 27569991 .
- ^ О Э, Чжу Цзюй, Бай МЮ, Аренхарт Р.А., Сунь Ю, Ван Цзы (май 2014 г.). «Удлинение клеток регулируется посредством центральной цепи взаимодействующих факторов транскрипции в гипокотиле Arabidopsis» . электронная жизнь . 3 . doi : 10.7554/eLife.03031 . ПМК 4075450 . ПМИД 24867218 .
- ^ Марин-де ла Роса Н., Сотильо Б., Мишкольци П., Гиббс Д.Д., Висенте Дж., Карбонеро П., Онате-Санчес Л., Холдсворт М.Дж., Бхалерао Р., Алабади Д., Бласкес М.А. (октябрь 2014 г.). «Крупномасштабная идентификация связанных с гиббереллином факторов транскрипции определяет ФАКТОРЫ РЕАКЦИИ НА ЭТИЛЕН группы VII как функциональных партнеров DELLA» . Физиология растений . 166 (2): 1022–32. дои : 10.1104/стр.114.244723 . ПМК 4213073 . ПМИД 25118255 .
- ^ Локасио А., Бласкес М.А., Алабади Д. (май 2013 г.). «Динамическая регуляция организации корковых микротрубочек посредством взаимодействия префолдин-DELLA» . Современная биология . 23 (9): 804–9. Бибкод : 2013CBio...23..804L . дои : 10.1016/j.cub.2013.03.053 . hdl : 10251/66422 . ПМИД 23583555 .
- ^ Саланенко Ю., Верстратен И., Лёфке С., Табата К., Нарамото С., Гланк М., Фримл Дж. (апрель 2018 г.). «Передача сигналов гиббереллина DELLA нацелена на ретромерный комплекс, чтобы перенаправить транспорт белка на плазматическую мембрану» . Труды Национальной академии наук Соединенных Штатов Америки . 115 (14): 3716–3721. Бибкод : 2018PNAS..115.3716S . дои : 10.1073/pnas.1721760115 . ПМЦ 5889667 . ПМИД 29463731 .
Внешние ссылки
[ редактировать ]- Гиббереллин в базе данных свойств пестицидов (PPDB)