Дигидрокатион
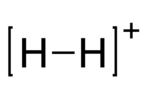 | |
| Идентификаторы | |
|---|---|
| |
3D model ( JSmol ) |
|
| ЧЭБИ |
|
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Ч 2 + | |
| Молярная масса | 2.015 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Катион диводорода или молекулярный ион водорода представляет собой катион (положительный ион ) с формулой H +
2 . Он состоит из двух водорода ядер ( протонов ), каждое из которых имеет один общий электрон . Это простейший молекулярный ион .
Ион может образоваться в результате ионизации нейтральной молекулы водорода ( H
2 ) электронным ударом. Обычно он образуется в молекулярных облаках в космосе под действием космических лучей .
Дигидрокатион представляет большой исторический, теоретический и экспериментальный интерес.Исторически он представляет интерес тем, что, имея только один электрон, уравнения квантовой механики , описывающие его структуру, могут быть решены приближенно и относительно прямолинейно, если пренебречь движением ядер, релятивистскими и квантовыми электродинамическими эффектами. Первое такое решение было получено О. Буррау в 1927 году, [1] всего через год после публикации волновой теории квантовой механики.
Теоретический интерес возникает потому, что возможно точное математическое описание, учитывающее квантовое движение всех составляющих, а также взаимодействие электрона с полем излучения. Точность описания неуклонно улучшалась на протяжении более полувека, что в конечном итоге привело к созданию теоретической основы, позволяющей со сверхвысокой точностью предсказать энергии вращательных и колебательных уровней в основном электронном состоянии, которые в основном метастабильны.
Параллельно экспериментальный подход к изучению катиона претерпел фундаментальную эволюцию по сравнению с более ранними экспериментальными методами, использовавшимися в 1960-х и 1980-х годах. Используя передовые методы, такие как захват ионов и лазерное охлаждение, вращательные и колебательные переходы можно исследовать в чрезвычайно мелких деталях. Соответствующие частоты переходов можно точно измерить, а результаты сравнить с точными теоретическими предсказаниями. Другой подход к прецизионной спектроскопии основан на охлаждении в криогенной магнитоэлектрической ловушке ( ловушка Пеннинга ); здесь движение катионов охлаждается резистивно, а внутренняя вибрация и вращение затухают за счет спонтанного излучения. Тогда можно будет точно изучить переходы электронного спинового резонанса.
Эти достижения превратили катионы диводорода в еще одно семейство связанных систем, важных для определения фундаментальных констант атомной и ядерной физики, после семейства атомов водорода (включая водородоподобные ионы ) и семейства атомов гелия . [2]
Физические свойства
[ редактировать ]Склеивание в H +
2 можно описать как ковалентную одноэлектронную связь которой , формальный порядок связи равен половине. [3]
Энергия основного состояния иона равна -0,597 Хартри . [4]
Длина связи в основном состоянии равна 2,00 боровского радиуса .
изотопологи
[ редактировать ]Катион диводорода имеет шесть изотопологов . Каждое из двух ядер может быть одним из следующих: протон (p, наиболее распространенный), дейтрон (d) или тритон (t). [5] [6]
- Ч + 2 = 1 H + 2 (катион диводорода, общий) [5] [6]
- [HD] + = [ 1 ЧАС 2 ЧАС] + (катион водорода-дейтерия) [5]
- Д + 2 = 2 H + 2 (катион дидейтерия) [5] [6]
- [ХТ] + = [ 1 ЧАС 3 ЧАС] + (катион водорода трития)
- [ДТ] + = [ 2 ЧАС 3 ЧАС] + (катион дейтерия-трития)
- Т + 2 = 3 H + 2 (катион дитрита) [6]
Квантово-механический анализ
[ редактировать ]Приближение зажатых ядер
[ редактировать ]Приблизительное описание диводородного катиона начинается с пренебрежения движением ядер — так называемое приближение зажатых ядер. Это хорошее приближение, поскольку ядра (протон, дейтрон или тритон) более чем в 1000 раз тяжелее электрона. Поэтому сначала рассматривается движение электрона для заданного (произвольного) расстояния ядро-ядро R . Электронная энергия молекулы E и расчет повторяется для разных значений R. вычисляется , Энергия ядро-ядерного отталкивания e 2 /(4 π ε 0 R ) необходимо добавить к электронной энергии, в результате чего получится полная энергия молекулы E tot ( R ).
Энергия E является собственным значением уравнения Шредингера для одиночного электрона. Уравнение можно решить относительно простым способом из-за отсутствия электрон-электронного отталкивания ( электронной корреляции ). Волновое уравнение ( уравнение в частных производных ) распадается на два связанных обыкновенных дифференциальных уравнения при использовании вытянутых сфероидальных координат вместо декартовых координат.Аналитическое решение уравнения, волновая функция , следовательно, пропорционально произведению двух бесконечных степенных рядов . [7] Численную оценку ряда можно легко выполнить на компьютере.Аналитические решения для собственных значений электронной энергии также являются обобщением . W-функции Ламберта [8] который можно получить с помощью системы компьютерной алгебры в рамках экспериментального математического подхода.
В учебниках по квантовой химии и физике связывание молекулы в основном электронном состоянии обычно рассматривается с помощью простейшего возможного анзаца для волновой функции: (нормированной) суммы двух волновых функций водорода 1s с центрами на каждом ядре. Этот анзац правильно воспроизводит переплет, но численно неудовлетворителен.
Исторические заметки
[ редактировать ]Ранние попытки лечения H +
2 с использованием старой квантовой теории были опубликованы в 1922 году Карелом Ниссеном. [9] и Вольфганг Паули , [10] и в 1925 году Гарольдом Юри . [11]
Первое успешное квантовомеханическое лечение H +
2 был опубликован датским физиком Ойвиндом Буррау в 1927 году. [1] всего через год после публикации Эрвина Шрёдингера «Волновая механика» .
В 1928 году Лайнус Полинг опубликовал обзор, объединивший работу Буррау с работами Уолтера Хайтлера и Фрица Лондона по молекуле водорода. [12] Полное математическое решение проблемы электронной энергии для H +
2 в приближении зажатых ядер была предоставлена Уилсоном (1928) и Яффе (1934). Джонсон (1940) дает краткое изложение своего решения. [7]
Решения уравнения Шредингера с зажатыми ядрами
[ редактировать ]
2 с зажатыми ядрами A и B , межъядерным расстоянием R плоскостью симметрии M. и
Электронное волновое уравнение Шрёдингера для молекулярного иона водорода H +
2 с двумя фиксированными ядерными центрами, обозначенными A и B , и одним электроном, можно записать как
где V – электронно-ядерная функция потенциальной энергии Кулона:
и E - (электронная) энергия данного квантовомеханического состояния (собственного состояния), с функцией электронного состояния ψ = ψ ( r ) в зависимости от пространственных координат электрона. Аддитивный термин 1 / R , которое является постоянным для фиксированного межъядерного расстояния R , было исключено из потенциала V , поскольку оно просто смещает собственное значение. Расстояния между электроном и ядрами обозначаются r a и r b . В атомных единицах ( ħ = m = e = 4 π ε 0 = 1) волновое уравнение имеет вид
В качестве начала координат выберем середину между ядрами. Из общих принципов симметрии следует, что волновые функции можно охарактеризовать своим поведением симметрии относительно операции обращения точечной группы i ( r ↦ − r ). Существуют волновые функции ψ g ( r ), симметричные относительно i , и есть волновые функции ψ u ( r ), которые антисимметричны относительно этой операции симметрии:
Суффиксы g и u от немецкого gerade и ungerade ), встречающиеся здесь, обозначают поведение симметрии при операции инверсии точечной группы i . Их использование является стандартной практикой для обозначения электронных состояний двухатомных молекул, тогда как для атомных состояний термины четное и нечетное используются . Основное состояние (самое низкое состояние) H +
2 обозначается X 2 С +
г [13] или 1sσ g и это гераде. Существует также первое возбужденное состояние A 2 С +
u (2pσ u ), что является негерадным.

2 как функция межъядерного расстояния ( R , в боровских радиусах, атомная единица длины). Подробности смотрите в тексте.
Асимптотически (суммарные) собственные энергии E g / u для этих двух нижних состояний имеют одинаковое асимптотическое разложение по обратным степеням межъядерного расстояния R : [14] [15]
Эта и энергетические кривые включают межъядерный член 1/R . Фактическая разница между этими двумя энергиями называется расщеплением обменной энергии и определяется выражением: [16]
межъядерного расстояния R. которое экспоненциально исчезает с увеличением Ведущий термин 4 / e Re − Р впервые был получен методом Гольштейна–Херринга . Аналогично, асимптотические разложения по степеням 1 / R были получены в высоком порядке Cizek et al. для десяти нижних дискретных состояний молекулярного иона водорода (случай зажатых ядер). Таким образом, для обычных двухатомных и многоатомных молекулярных систем обменную энергию очень трудно рассчитать на больших межъядерных расстояниях, но, тем не менее, она необходима для дальнодействующих взаимодействий, включая исследования, связанные с магнетизмом и эффектами перезарядки. Они имеют особое значение в физике звезд и атмосферы.
Энергии самых низких дискретных состояний показаны на графике выше. Их можно получить с любой точностью, используя компьютерную алгебру из обобщенной функции Ламберта W (см. уравнение (3) на этом сайте и ссылку. [8] ). Первоначально они были получены численным методом с точностью до двойной точности с помощью самой точной доступной программы, а именно ODKIL. [17] Красные сплошные линии — это 2 С +
г говорится. Зеленые пунктирные линии 2 С +
ты утверждаешь. Синяя пунктирная линия – это 2 Π u состояние, а розовая пунктирная линия — это 2 Π г состояние. Обратите внимание, что хотя обобщенные решения для собственных значений функции Ламберта W заменяют эти асимптотические разложения, на практике они наиболее полезны вблизи длины связи .
Полный гамильтониан H +
2 (как и для всех центросимметричных молекул) не коммутирует с операцией обращения точечной группы i из-за влияния ядерного сверхтонкого гамильтониана. Ядерный сверхтонкий гамильтониан может смешивать вращательные уровни электронных состояний g и u (так называемое орто - пара -смешивание) и вызывать орто - пара -переходы. [18] [19]
Приближение Борна-Оппенгеймера
[ редактировать ]Как только энергетическая функция E tot ( R ) получена, можно вычислить квантовые состояния вращательного и колебательного движения ядер и, следовательно, молекулы в целом. Соответствующее «ядерное» уравнение Шредингера представляет собой одномерное обыкновенное дифференциальное уравнение, в котором расстояние ядро-ядро R. независимой координатой является Уравнение описывает движение фиктивной частицы с массой, равной приведенной массе двух ядер, в потенциале E tot ( R )+ V L ( R ), где второй член — центробежный потенциал, обусловленный вращением с угловым моментом описывается квантовым L. числом Собственные энергии этого уравнения Шредингера представляют собой полные энергии всей молекулы, электронной плюс ядерной.
Теория ab initio высокой точности
[ редактировать ]Приближение Борна-Оппенгеймера непригодно для описания дигидрокатиона достаточно точно, чтобы объяснить результаты прецизионной спектроскопии.
Полное уравнение Шредингера для этого катиона без приближения зажатых ядер гораздо более сложное, но тем не менее может быть решено численно практически точно с использованием вариационного подхода. [20] Тем самым точно рассматривается одновременное движение электрона и ядер. Когда решения ограничиваются орбиталью с самой низкой энергией, можно получить энергии и волновые функции вращательных и колебательных состояний. Численная неопределенность энергий и волновых функций, найденных таким способом, незначительна по сравнению с систематической ошибкой, возникающей при использовании уравнения Шредингера, а не принципиально более точных уравнений. Действительно, уравнение Шрёдингера не включает в себя всю значимую физику, как это известно из проблемы атома водорода. Более точные методы лечения должны учитывать физику, описываемую уравнением Дирака или, что еще точнее, квантовой электродинамикой. Наиболее точные решения вращательно-колебательных состояний находятся с помощью нерелятивистской квантовой электродинамики ( NRQED ).
Для сравнения с экспериментом необходимы различия энергий состояний, т.е. частот переходов. Для переходов между вращательно-колебательными уровнями, имеющими малые вращательные и умеренные колебательные квантовые числа, частоты были рассчитаны с теоретической дробной неопределенностью примерно 8 × 10. −12 . [21] Дополнительный вклад в неопределенность предсказанных частот возникает из-за неопределенностей фундаментальных констант , которые учитываются в теоретических расчетах, особенно из-за соотношения массы протона и массы электрона.
Используя сложный формализм ab initio, можно также точно рассчитать сверхтонкие энергии, см. Ниже.
Экспериментальные исследования
[ редактировать ]Прецизионная спектроскопия
[ редактировать ]Из-за своей относительной простоты катион диводорода является наиболее точно изученной молекулой в том смысле, что теоретические расчеты его энергетических уровней соответствуют экспериментальным результатам с наивысшим уровнем согласия.
В частности, спектроскопически определенные частоты чистых вращательных и колебательных переходов конкретного изотополога HD. + согласуются с теоретически рассчитанными частотами перехода. Четыре высокоточных эксперимента дали сравнения с общей погрешностью между 2 × 10 −11 и 5 × 10 −11 , дробно. [22] Уровень согласия фактически ограничен ни теорией, ни экспериментом, а, скорее, неопределенностью текущих значений масс частиц, которые используются в качестве входных параметров расчета.
Чтобы измерить частоты переходов с высокой точностью, спектроскопию диводородного катиона пришлось проводить в особых условиях. Следовательно, ансамбли HD + Ионы были пойманы в квадрупольную ионную ловушку в сверхвысоком вакууме, сочувственно охлаждены ионами бериллия, охлажденными лазером , и исследованы с использованием определенных спектроскопических методов.
Сверхтонкая структура гомоядерного изотополога H 2 + была тщательно и точно измерена Джеффертсом в 1969 году. Наконец, в 2021 году расчеты теории ab initio смогли предоставить количественные детали структуры с неопределенностью меньшей, чем неопределенность экспериментальных данных, 1 кГц . Теоретически подтверждены некоторые вклады в измеренную сверхтонкую структуру на уровне примерно 50 Гц . [23]
m d , Следствием этих соглашений является то, что можно вывести спектроскопическое значение отношения массы электрона к приведенной массе протона и дейтрона, me / что является входными данными для m p + me / теории ab initio. Соотношение подбирается таким образом, чтобы теоретические предсказания и экспериментальные результаты согласовывались. Неопределенность полученного отношения сравнима с неопределенностью, полученной из прямых измерений масс протона, дейтрона, электрона и HD. + посредством циклотронного резонанса в ловушках Пеннинга .
Появление в космосе
[ редактировать ]Формирование
[ редактировать ]Ион диводорода образуется в природе при взаимодействии космических лучей и молекулы водорода. Электрон выбивается, оставляя катион. [24]
- H 2 + космические лучи → H +
2+ и − + космический луч.
Частицы космических лучей обладают достаточной энергией, чтобы ионизировать многие молекулы, прежде чем они остановятся.
Энергия ионизации молекулы водорода равна 15,603 эВ. Высокоскоростные электроны также вызывают ионизацию молекул водорода с пиковым сечением около 50 эВ. Пиковое сечение ионизации высокоскоростных протонов составляет 70 000 эВ при сечении 2,5 × 10 −16 см 2 . Протон космических лучей с более низкой энергией также может оторвать электрон от нейтральной молекулы водорода с образованием нейтрального атома водорода и катиона диводорода ( p + + Ч2 → Ч + Ч +
2 ) с пиковым сечением около эВ 8 × 8000 10 −16 см 2 . [25]
Разрушение
[ редактировать ]В природе ион разрушается в результате реакции с другими молекулами водорода:
- ЧАС +
2 + Ч 2 → Ч +
3 + Х.
Производство в лаборатории
[ редактировать ]В лаборатории ион легко получить путем бомбардировки электронами из электронной пушки.
Искусственная плазменная разрядная ячейка также может производить ион. [ нужна ссылка ]
См. также
[ редактировать ]- Симметрия двухатомных молекул
- Модель функции Дельта Дирака (одномерная версия H +
2 ) - Ди-позитроний
- Задача трех тел Эйлера (классический аналог)
- Малочастичные системы
- Атом гелия
- Ион гидрида гелия
- Триводородный катион
- Трехатомный водород
- Функция Ламберта W
- Молекулярная астрофизика
- Метод Гольштейна – Херринга
- Задача трех тел
- Список квантовомеханических систем с аналитическими решениями
Ссылки
[ редактировать ]- ^ Jump up to: а б Буррау, О. (1927). «Расчет энергетической ценности иона молекулы водорода ( H +
2 ) im Normalzustand» (PDF) . Danske Vidensk. Selskab. Math.-phys. Meddel. (на немецком языке). M 7:14: 1–18.
Буррау, О. (1927). «Расчет Энергетической ценности ионов молекул Водорода ( H +
2 ) (in German). 15 (1): 16–7. Bibcode:1927NW.....15...16B. doi:10.1007/BF01504875. S2CID 19368939. [ постоянная мертвая ссылка ] - ^ Шиллер, С. (2022). «Прецизионная спектроскопия молекулярных ионов водорода: введение» . Современная физика . 63 : 247–279.
- ^ Кларк Р. Лэндис; Фрэнк Вейнхольд (2005). Валентность и связь: взгляд на донорно-акцепторную орбитальную орбиту естественной связи . Кембридж, Великобритания: Издательство Кембриджского университета. стр. 91–92. ISBN 978-0-521-83128-4 .
- ^ Брессанини, Дарио; Мелла, Массимо; Морози, Габриэле (1997). «Неадиабатические волновые функции как линейные разложения коррелированных экспонент. Квантовое приложение Монте-Карло к H2 + и Ps2». Письма по химической физике . 272 (5–6): 370–375. Бибкод : 1997CPL...272..370B . дои : 10.1016/S0009-2614(97)00571-X .
- ^ Jump up to: а б с д Фабри, Чаба; Чако, Габор; Таси, Дьюла; Часар, Аттила Г. (2009). «Адиабатические поправки Якоби на колебательных уровнях энергии H 2 ( + ) изотопологов». Журнал химической физики . 130 (13): 134314. Bibcode : 2009JChPh.130m4314F . doi : 10.1063/1.3097327 . PMID 19355739 .
- ^ Jump up to: а б с д Скарлетт, Лиам Х.; Заммит, Марк С.; Фурса Дмитрий В.; Брей, Игорь (2017). «Кинетико-энергетическое выделение фрагментов диссоциации электронным ударом молекулярного иона водорода и его изотопологов» . Физический обзор А. 96 (2): 022706. Бибкод : 2017PhRvA..96b2706S . дои : 10.1103/PhysRevA.96.022706 .
- ^ Jump up to: а б Джонсон, Вирджиния (1941). «Поправка на движение ядер в H 2 + ". Phys. Rev. 60 : 373–77. doi : 10.1103/PhysRev.60.373 .
- ^ Jump up to: а б Скотт, штат Техас; Обер-Фрекон, М.; Гротендорст, Дж. (2006). «Новый подход к исследованию электронных энергий молекулярного иона водорода». хим. Физ . 324 (2–3): 323–338. arXiv : физика/0607081 . Бибкод : 2006CP....324..323S . doi : 10.1016/j.chemphys.2005.10.031 . S2CID 623114 .
- ^ Карел Ф. Ниссен О квантовой теории молекулярного иона водорода , докторская диссертация, Утрехтский университет, Утрехт: И. Ван Друтен (1922), как цитируется в Мехре, Том 5, Часть 2, 2001, стр. 932.
- ^ Паули В. (1922). «О модели иона молекулы водорода». Анналы физики . 373 (11): 177–240. дои : 10.1002/andp.19223731101 . Расширенная докторская диссертация; поступило 4 марта 1922 г., напечатано в номере № 1. 11 от 3 августа 1922 года.
- ^ Юри ХК (октябрь 1925 г.). «Строение иона молекулы водорода» . Учеб. Натл. акад. наук. США . 11 (10): 618–21. Бибкод : 1925ПНАС...11..618У . дои : 10.1073/pnas.11.10.618 . ПМЦ 1086173 . ПМИД 16587051 .
- ^ Полинг, Л. (1928). «Применение квантовой механики к структуре молекулы водорода и молекулы-иона водорода и к смежным проблемам». Химические обзоры . 5 (2): 173–213. дои : 10.1021/cr60018a003 .
- ^ Хубер, К.-П.; Герцберг, Г. (1979). Молекулярные спектры и молекулярная структура IV. Константы двухатомных молекул . Нью-Йорк: Ван Ностранд Рейнхольд.
- ^ Чижек Ю.; Дамбург, Р.Дж.; Граффи, С.; Грекки, В.; Харрел II, EM; Харрис, Дж. Г.; Накаи, С.; Палдус, Дж .; Пропин Р.Х.; Сильверстоун, HJ (1986). "1/ R расширение для H +
2 : Расчет экспоненциально малых членов и асимптотики». Phys. Rev. A. 33 ( 1): 12–54. Bibcode : 1986PhRvA..33...12C . doi : 10.1103/PhysRevA.33.12 . PMID 9896581 . - ^ Морган III, Джон Д.; Саймон, Барри (1980). «Поведение кривых молекулярной потенциальной энергии при больших ядерных разделениях» . Межд. Дж. Квантум Хим . 17 (6): 1143–1166.
- ^ Скотт, штат Техас; Далгарно, А .; Морган, JD III (1991). «Обменная энергия H +
2 Рассчитано на основе теории возмущений поляризации и метода Гольштейна-Херринга». Phys. Rev. Lett. 67 (11): 1419–1422. Bibcode : 1991PhRvL..67.1419S . doi : 10.1103/PhysRevLett.67.1419 . PMID 10044142 . - ^ Хадингер, Г.; Обер-Фрекон, М.; Хадингер, Г. (1989). «Метод Киллингбека для одноэлектронной задачи двух центров». Дж. Физ. Б. 22 (5): 697–712. Бибкод : 1989JPhB...22..697H . дои : 10.1088/0953-4075/22/5/003 . S2CID 250741775 .
- ^ Пике, JP; и др. (1984). «Сверхтонкоиндуцированное нарушение симметрии Унгераде-Гераде в гомоядерной двухатомной молекуле вблизи предела диссоциации: 127 я 2 в 2 П 3/2 − 2 P 1/2 Limit». Phys. Rev. Lett . 52 (4): 267–269. Bibcode : 1984PhRvL..52..267P . doi : 10.1103/PhysRevLett.52.267 .
- ^ Кричли, ADJ; и др. (2001). «Прямое измерение перехода чистого вращения в H +
2 ". Phys. Rev. Lett . 86 (9): 1725–1728. Bibcode : 2001PhRvL..86.1725C . doi : 10.1103/PhysRevLett.86.1725 . PMID 11290233 . - ^ Коробов, В.И. (2022). «Вариационные методы в квантовомеханической задаче трех тел с кулоновским взаимодействием». Физика частиц и ядер . 53 (1): 1–20. Бибкод : 2022ППН....53....1К . дои : 10.1134/S1063779622010038 . S2CID 258696598 .
- ^ Коробов Владимир И.; Карр, Жан-Филипп (2021). «Ровибрационные усредненные по спину переходы в молекулярных ионах водорода». Физический обзор А. 104 (3): 032806. arXiv : 2107.14497 . Бибкод : 2021PhRvA.104c2806K . дои : 10.1103/PhysRevA.104.032806 . S2CID 236635049 .
- ^ Алиганбари, С.; Кортунов И.В.; Гири, Г.Г.; Шиллер, С. (2023). «Тест взаимодействия заряженных барионов с помощью колебательной спектроскопии высокого разрешения молекулярных ионов водорода». Физика природы . дои : 10.1038/s41567-023-02088-2 . S2CID 259567529 .
- ^ Хайдар, М.; Коробов В.И.; Хилико, Л.; Карр, Дж.Ф. (2022). «Поправки высшего порядка к спин-орбитальным и спин-спиновым тензорным взаимодействиям в молекулярных ионах водорода: теория и применение к H 2 + ". Physical Review A. 106 ( 2): 022816. arXiv : 2207.01535 . Bibcode : 2022PhRvA.106b2816H . doi : 10.1103/PhysRevA.106.022816 . S2CID 251946960 .
- ^ Хербст, Э. (2000). «Астрохимия H +
3 ". Philosophical Transactions of the Royal Society A. 358 ( 1774): 2523–2534. Бибкод : 2000RSPTA.358.2523H . doi : 10.1098/rsta.2000.0665 . S2CID 97131120 . - ^ Падовани, Марко; Галли, Даниэле; Глассголд, Альфред Э. (2009). «Ионизация молекулярных облаков космическими лучами». Астрономия и астрофизика . 501 (2): 619–631. arXiv : 0904.4149 . Бибкод : 2009A&A...501..619P . дои : 10.1051/0004-6361/200911794 . S2CID 7897739 .





![{\displaystyle \Delta E=E_{u}-E_{g}={\frac {4}{e}}\,R\,e^{-R}\left[\,1+{\frac {1 }{2R}}+O\влево(R^{-2}\вправо)\,\вправо]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9abc25405617f09082349bc59b37b3afde137f84)