Неканоническое спаривание оснований
Неканонические пары оснований представляют собой плоские , связанные водородными связями пары нуклеиновых оснований , имеющие структуру водородных связей, которая отличается от структуры, наблюдаемой в парах оснований Уотсона-Крика , как в классической двойной спирали ДНК . Структуры полинуклеотидных цепей молекул ДНК и РНК можно понимать как сахарофосфатные остовы, состоящие из фосфодиэфир -связанных фрагментов D 2'-дезоксирибофуранозы ( D-рибофуранозы в РНК) с пуриновыми или пиримидиновыми нуклеиновыми основаниями , ковалентно связанными с ними. При этом атомы N9 пуринов, гуанина и аденина и атомы N1 пиримидинов, цитозина и тимина ( урацила в РНК) соответственно образуют гликозидные связи с атомом С1' сахаров. Эти азотистые основания схематически можно представить в виде треугольников, одна из вершин которых связана с сахаром, а три стороны составляют три ребра, через которые они могут образовывать водородные связи с другими фрагментами, в том числе с другими азотистыми основаниями. Сторона, противоположная вершине, связанной с сахаром, традиционно называется ребром Уотсона-Крика, поскольку они участвуют в формировании пар оснований Уотсона-Крика, которые составляют строительные блоки двойной спирали ДНК. Две стороны, прилегающие к вершине, связанной с сахаром, называются соответственно сахаром и Края Хугстина (CH для пиримидинов).
Каждое из четырех различных азотистых оснований характеризуется различными паттернами распределения по краям соответствующих донорных и акцепторных атомов водородных связей, комплементарность которых, в свою очередь, определяет паттерны водородных связей, участвующих в спаривании оснований. Обычно известно, что двойные спиральные структуры ДНК или РНК имеют пары оснований между комплементарными основаниями: аденин:тимин (аденин:урацил в РНК) или гуанин:цитозин. Они включают в себя определенные структуры водородных связей, соответствующие их соответствующим краям Уотсона-Крика, и считаются каноническими парами оснований. В то же время спирально закрученные остовы двойной спиральной дуплексной ДНК образуют две бороздки, большую и малую, через которые донорные и акцепторные атомы водородной связи, соответствующие соответственно хугстиновскому и сахарному краям, доступны для дополнительных потенциальных событий молекулярного узнавания .
Экспериментальные данные показывают, что нуклеотидные основания также способны образовывать самые разнообразные спаривания между основаниями различной геометрии, имея структуру водородных связей, отличную от той, которая наблюдается в канонических парах оснований. Эти пары оснований, которые обычно называют неканоническими парами оснований, удерживаются вместе множественными водородными связями и в основном плоские и стабильные. Большинство из них играют очень важную роль в формировании структуры и функций различных функциональных молекул РНК. Помимо того, что они встречаются в нескольких областях двухцепочечного стебля, большинство петель и выпуклостей, которые появляются во вторичных структурах одноцепочечной РНК, образуют повторяющиеся трехмерные мотивы, где неканонические пары оснований играют центральную роль. Неканонические пары оснований также играют решающую роль в обеспечении третичных контактов в трехмерных структурах РНК.
История
[ редактировать ]

Теперь известно, что двуспиральные структуры ДНК, а также свернутая одноцепочечная РНК стабилизируются спариванием оснований Уотсона-Крика между пуринами, аденином и гуанином, с пиримидинами, тимином (или урацилом для РНК) и цитозином. В этой схеме атомы N1 пуриновых остатков соответственно образуют водородную связь с атомами N3 пиримидиновых остатков в комплементарности A:T и G:C. Вторая водородная связь в парах оснований A:T включает аминогруппу N6 аденина и атом O4 тимина (или урацила в РНК). Аналогичным образом, вторая водородная связь в парах оснований G:C включает атом O6 и аминогруппу N4 гуанина и цитозина соответственно. Пары оснований G:C также имеют третью водородную связь, включающую аминогруппу N2 гуанина и атом O2 цитозина. Однако даже спустя примерно двадцать лет после того, как эта схема была первоначально предложена Джеймсом Д. Уотсоном и Фрэнсисом Х. Криком , [ 1 ] экспериментальные данные, предполагающие другие формы взаимодействия оснований, продолжали привлекать внимание исследователей, исследующих структуру ДНК. [ 2 ] [ 3 ] Первая структура пары оснований аденин: тимин с высоким разрешением, раскрытая Карстом Хугстином с помощью рентгеновской кристаллографии монокристалла в 1959 году. [ 4 ] выявил структуру, геометрия которой сильно отличалась от предложенной Уотсоном и Криком. Он имел две водородные связи с участием атомов N7 и N6 аденина и атомов N3 и O4 (или O2) тимина. Можно отметить, что за счет использования тиминового основания, метильная группа которого представляет собой сахар, появляется ось симметрии, проходящая через атомы N1 и C6, а атомы O2 и O4 кажутся идентичными. Чтобы отличить эту альтернативную схему спаривания оснований от схемы Уотсона-Крика, пары оснований, в которых водородная связь включает атом N7 пуринового остатка, называются парой оснований Хугстина, а позже - краем пуринового основания, который включает его N7. атом называется его ребром Хугстина. Первая структура пары гуанин:цитозин с высоким разрешением, полученная В. Гушельбауэром, также была подобна паре оснований Хугстина, хотя эта структура требовала необычного протонирования имино-азота N1 цитозина, что возможно только при значительно более низком pH . [ 5 ] Экспериментальные данные, включая исследования ЯМР низкого разрешения. [ 6 ] а также рентгеновские кристаллографические исследования высокого разрешения, [ 7 ] подтверждающие пары оснований Уотсона-Крика были получены еще в начале 70-х годов. Почти десять лет спустя, с появлением эффективных методов синтеза ДНК, Ричард Дикерсон [ 8 ] за ними последовали еще несколько групп, решивших структуры физиологической двойной спиральной B-ДНК с полным спиральным витком, основанные на кристаллах синтетических олигомеров ДНК. [ 9 ] [ 10 ] [ 11 ] Геометрия спаривания пар A:T (A:U в РНК) и G:C в этих структурах подтвердила общую или каноническую форму спаривания оснований, предложенную Уотсоном и Криком, в то время как пары со всеми другими геометриями и составами являются теперь называемые неканоническими парами оснований.
Было замечено, что даже в двухцепочечной ДНК, где канонические пары оснований Уотсона-Крика связывают две комплементарные антипараллельные цепи вместе, время от времени встречаются пары оснований Хугстина и других пар оснований, не принадлежащих Уотсону-Крику. [ 12 ] [ 13 ] [ 14 ] [ 15 ] [ 16 ] [ 17 ] Было также высказано предположение, что в паре оснований Уотсона-Крика доминируют двойные спирали ДНК, образование пар оснований Хугстина может быть временным явлением. [ 17 ]
Хотя канонические пары оснований Уотсона-Крика наиболее распространены и обычно наблюдаются в большинстве хромосомных ДНК и в большинстве функциональных РНК, наличие стабильных неканонических пар оснований также чрезвычайно важно в биологии ДНК. Пример неканонического спаривания оснований Уотсона-Крика можно найти на концах хромосомной ДНК. 3'-концы хромосом содержат одноцепочечные выступы с некоторыми консервативными мотивами последовательности (такими как TTAGGG у большинства позвоночных ). Одноцепочечная область принимает некоторые определенные трехмерные структуры, которые были решены с помощью рентгеновской кристаллографии, а также с помощью ЯМР- спектроскопии. [ 18 ] [ 19 ] [ 20 ] Обнаружено, что одиночные цепи, содержащие вышеуказанные мотивы последовательности, образуют интересные четырехцепочечные мини-спиральные структуры, стабилизированные спариванием оснований Хугстина между остатками гуанина. В этих структурах четыре остатка гуанина образуют почти плоский квартет оснований, называемый G-квадруплексом, где каждый гуанин участвует в спаривании оснований с соседним гуанином, циклически вовлекая их края Уотсона-Крика и Хугстина. Четыре центральные карбонильные группы часто стабилизируются ионами калия (K + ). Из полных геномных последовательностей различных организмов было замечено, что теломероподобные последовательности иногда также прерывают двойные спиральные области вблизи места начала транскрипции некоторых онкогенов, таких как c-myc . Возможно, эти участки последовательности образуют структуры, подобные G-квадруплексу, которые могут подавлять экспрессию родственных генов. Комплементарные последовательности, богатые цитозином, на другой цепи могут принимать другую аналогичную четырехцепочечную структуру, i-мотив , стабилизированный неканоническими парами оснований цитозин:цитозин.


Хотя неканонические пары оснований все еще относительно редки в ДНК, в молекулах РНК, где обычно одна полимерная цепь сворачивается сама в себя с образованием различных вторичных и третичных структур, появление пар оснований, не принадлежащих Уотсону-Крику, оказывается гораздо более частым. распространенный. Еще в 1970-е годы был проведен анализ кристаллической структуры дрожжевой тРНК. Пхе показали, что структуры РНК обладают значительными неканоническими вариациями в схемах спаривания оснований. Впоследствии структуры рибозимов , рибосом , рибопереключателей и т. д. выявили их обилие и, следовательно, необходимость всесторонней характеристики неканонических пар оснований. Эти трехмерные структуры РНК обычно обладают несколькими вторичными структурными мотивами , такими как двойные спиральные стебли, стебли со шпильками, симметричные и асимметричные внутренние петли, целующиеся петли между двумя шпильками, псевдоузлы , непрерывные стопки между двумя сегментами спиралей, многоспиральные соединения. [ 21 ] [ 22 ] и т. д. вместе с одноцепочечными областями. Эти вторичные структурные мотивы, за исключением одноцепочечных мотивов, стабилизированы парами оснований, связанными водородными связями, и некоторые из них являются неканоническими парами оснований, включая пары оснований G:U Wobble.
В этом контексте примечательно, что гипотеза Воббла Фрэнсиса Крика предсказала возможность того, что пара оснований G:U вместо канонических пар оснований G:C или A:U также опосредует распознавание между кодонами мРНК и тРНК антикодонами . во время синтеза белка. Пара оснований G:U-колебание является наиболее часто наблюдаемой неканонической парой оснований. Хотя из-за геометрического сходства с каноническими парами оснований они часто встречаются в областях двойного спирального ствола структур РНК, геометрические различия продолжают привлекать внимание исследователей нуклеиновых кислот, обеспечивая новое понимание, связанное с их структурным значением. Можно отметить, что хотя пары оснований в свернутых структурах РНК образуют двойные спиральные стебли, две ее области расщепления – большая бороздка и малая бороздка – отличаются по своим соответствующим размерам от размеров в двойных спиралях ДНК. В отличие от таковых в ДНК, последовательность, определяющая основные бороздки в двойных спиралях РНК, очень узкая и глубокая. С другой стороны, области малых бороздок, хотя они и широкие и неглубокие, не несут особой информации, специфичной для последовательности, с точки зрения донорно-акцепторного положения водородных связей на краях соответствующих пар оснований. [ 23 ] Колеблющиеся пары оснований G:U, наряду с различными другими неканоническими парами оснований, вносят изменения в структуры двойных спиралей РНК, тем самым улучшая доступность различающих краев главных бороздок связанных пар оснований. Было замечено, что это очень важно для этапов молекулярного распознавания во время аминоацилирования тРНК, а также для функций рибосом. [ 24 ]
Учитывая огромную важность неканонических пар оснований в структуре, укладке и функциях РНК, исследователи из разных областей – биологии, химии, физики, математики, информатики и т. д. – объединились в попытках понять их структуру, динамику, функции и их последствия. Сложности, связанные с экспериментальной обработкой РНК, еще раз подчеркивают важность разнообразных теоретических знаний для решения этих проблем.
Типы
[ редактировать ]Два основания могут сближаться друг с другом по-разному, что в конечном итоге приводит к специфическому молекулярному распознаванию, опосредованному, часто неканоническими, взаимодействиями пар оснований в дополнение к сильным взаимодействиям стэкинга . Они необходимы для процесса сворачивания одиночных нитей РНК в трехмерные структуры. Ранние исследования таких необычных пар оснований, проведенные Иржи Спонером, Павлом Хобзой и их группой, были в некоторой степени невыгодны из-за отсутствия подходящих однозначных системных схем наименования. [ 25 ] Некоторым из наблюдаемых пар оснований были присвоены имена в соответствии со схемой номенклатуры Сенгера . [ 26 ] другим имена были присвоены произвольно разными исследователями. и его коллеги также предприняли некоторые попытки Можно упомянуть, что Майкл Левитт классифицировать ассоциации оснований с точки зрения смежности оснований посредством парных или стековых взаимодействий. [ 27 ] Очевидно, существовала потребность в схеме классификации различных типов неканонических пар оснований, которая могла бы всесторонне и однозначно обрабатывать новые варианты, возникающие из-за быстрого увеличения пространства выборки. Ниже описаны различные подходы, которые были разработаны в ответ на эту потребность.
На основе водородной связи
[ редактировать ]| Взаимодействующие края | Ориентация гликозидных связей | Номенклатура | Местное направление прядей |
|---|---|---|---|
| Уотсон-Крик/Уотсон-Крик | СНГ | cWW или цис Уотсон-Крик/Уотсон-Крик | Антипараллельность |
| Уотсон-Крик/Уотсон-Крик | Транс | tWW или транс Уотсон-Крик/Уотсон-Крик | Параллельно |
| Уотсон-Крик/Хугстин | СНГ | cWH или цис Уотсон-Крик/Хугстин | Параллельно |
| Уотсон-Крик/Хугстин | Транс | tWH или транс Уотсон-Крик/Хугстин | Антипараллельность |
| Уотсон-Крик / Шугар Эдж | СНГ | cWS или цис- край Уотсона-Крика/Сахарного края | Антипараллельность |
| Уотсон-Крик / Шугар Эдж | Транс | tWS или транс Уотсон-Крик/Шугар Эдж | Параллельно |
| Хугстин / Хугстин | СНГ | CHH или цис- Хугстин/Хугстин | Антипараллельность |
| Хугстин / Хугстин | Транс | tHH или транс Хугстин/Хугстин | Параллельно |
| Хугстин/Сахарный край | СНГ | CHS или цис- Хогстин/Сахарный край | Параллельно |
| Хугстин/Сахарный край | Транс | THS или транс Хугстин/Сахарный край | Антипараллельность |
| Сахарная кромка/Сахарная кромка | СНГ | cSS или цис-сахарный край/сахарный край | Антипараллельность |
| Сахарная кромка/Сахарная кромка | Транс | tSS или транс Sugar Edge/Sugar Edge | параллельный |

Нуклеотидные основания представляют собой почти плоские гетероциклические фрагменты с сопряженным пи-электронным облаком и с несколькими донорами и акцепторами водородных связей, распределенными по краям, обычно обозначаемыми как W, H или S, в зависимости от того, могут ли края соответственно участвовать в формировании Уотсона. -Пара оснований Крика, пара оснований Хугстина или примыкает ли край к группе C2'-OH сахара рибозы. Эрик Вестхоф и Неоклес Леонтис [ 28 ] использовали эти обозначения ребер, чтобы предложить широко принятую в настоящее время схему номенклатуры пар оснований. Таким образом, атомы донора и акцептора водородной связи можно классифицировать по их расположению вдоль трех краев, а именно края Уотсона-Крика или W-края, Хугстина или H-края и Сахара или S-края. Поскольку пары оснований опосредованы взаимодействиями водородных связей, основанными на комплементарности доноров-акцепторов водородных связей, это, в свою очередь, обеспечивает удобный восходящий подход к классификации геометрии пар оснований с точки зрения соответствующих взаимодействующих краев участвующих оснований. Можно отметить, что, в отличие от хугстинового края пуринов, соответствующие края пиримидиновых оснований не имеют полярного атома-акцептора водородной связи, такого как N7. Однако эти основания имеют группы C—H при атомах C6 и C5, которые могут действовать как слабые доноры водородных связей , как предложил Гаутам Дезираджу . [ 29 ] Поэтому край Хугстина также называют краем Хугстина/CH в единой схеме обозначения эквивалентных положений пуринов, а также пиримидинов. Таким образом, общее количество возможных реберных комбинаций, участвующих в спаривании оснований, равно 6, а именно: Уотсон-Крик/Уотсон-Крик (или W:W), Уотсон-Крик/Хугстин (или W:H), Уотсон-Крик/Сахар (или W:S), Хугстин/Хугстин (или H:H), Хугстин/Сахар (или H:S) и Сахар/Сахар (или S:S).
В канонических парах оснований Уотсона-Крика гликозидные связи , соединяющие N9 (пурина) и N1 (пиримидина) парных оснований с соответствующими сахарными фрагментами, находятся по одну сторону от средней оси водородных связей и, следовательно, называемые парами оснований Цис-Уотсона-Крика. Однако относительная ориентация двух сахаров также может быть транс-по отношению к среднему направлению водородных связей, что приводит к возникновению отдельного геометрического класса Транс-Уотсона-Крика, состоящего из видов, которые ранее назывались обратными парами оснований Уотсона-Крика в соответствии с Номенклатура Сенгера . Возможность ориентации как цис-, так и транс-гликозидных связей для каждой из 6 возможных комбинаций ребер приводит к образованию 12 геометрических семейств пар оснований (см. Таблицу).
Согласно схеме Леонтиса-Вестгофа, любая пара оснований может быть систематически и однозначно названа с использованием синтаксиса <Base_1: Base_2><Edge_1: Edge_2><Ориентация гликозидных связей>, где Base_1 и Base_2 несут информацию об идентичности соответствующих оснований и их количестве нуклеотидов. Эта номенклатурная схема также позволяет нам перечислить общее количество различных возможных типов базовых пар. Для данной ориентации гликозидной связи, скажем, Цис , каждое из четырех природных оснований имеет по три возможных ребра для образования пар оснований, что приводит к 12 таким возможным тождествам ребер спаривания оснований, каждое из которых в принципе может образовывать спаривание оснований с любым краем другого. основе, независимо от взаимодополняемости. Это приводит к созданию симметричной матрицы 12x12 , отображающей 144 попарных перестановки идентификаторов ребер спаривания оснований, где, помимо 12 диагональных записей, другие включают повторяющиеся комбинации. Таким образом, существует 78 (= 12 + 132/2) уникальных записей, соответствующих ориентации цис- гликозидной связи. Учитывая оба ориентации цис- и транс- гликозидных связей, число типов пар оснований достигает 156.
Конечно, это число 156 — лишь показатель. Он включает комбинации оснований и ребер, в которых пары оснований не могут образовываться из-за отсутствия комплементарности доноров-акцепторов водородных связей. Например, потенциальное спаривание между двумя остатками гуанина с использованием их краев Уотсона-Крика в цис- форме (cWW) не поддерживается донорно-акцепторной комплементарностью водородных связей и не наблюдается при последовательном характере водородных связей. Этот метод подсчета возможного числа различных типов пар оснований также не учитывает возможности мультимодальности или раздвоенных пар оснований или даже примеры пар оснований, включающих модифицированные основания, протонированные основания и посредничество воды или ионов в образовании водородных связей. Два основания цитозина могут образовывать пары оснований транс-Уотсона-Крика/Уотсона-Крика (tWW) с их нейтральными, а также гемипротонированными формами, возможно, с обеими, что приводит к образованию i-мотива ДНК . Однако как C(+):C tWW, так и C:C tWW считаются одним типом среди 156 возможных типов.
На основе изостер
[ редактировать ]Хотя между структурами неканонических пар оснований, принадлежащих к разным геометрическим семействам, существуют значительные различия, было обнаружено, что некоторые пары оснований внутри одного и того же геометрического семейства заменяют друг друга без нарушения общей структуры. Эти пары оснований называются изостерическими парами оснований. Изостерические пары оснований всегда принадлежат к одним и тем же геометрическим семействам, но все пары оснований в определенном геометрическом семействе не всегда изостеричны. Две пары оснований называются изостерическими, если они соответствуют следующим трем критериям: (i) расстояния C1’–C1’ должны быть одинаковыми; (ii) парные основания должны быть связаны одинаковым вращением в трехмерном пространстве; и (iii) образование Н-связей должно происходить между эквивалентными положениями оснований. [ 30 ] [ 31 ] Подробный подход к количественной оценке изостеричности с точки зрения индекса изостеричности (IDI), который может облегчить надежный прогноз относительно того, какие замены пар оснований потенциально могут произойти в консервативных мотивах, был сформулирован Неоклесом Леонтисом, Крейгом Зирбелем и Эриком Вестхофом. [ 32 ] Основываясь на значениях IDI и доступных структурных данных пар оснований, группа поддерживает курируемый онлайн-каталог пар оснований и обновленный набор матриц изостеричности (IM), соответствующих каждому из 12 геометрических семейств. Используя этот ресурс, можно всесторонне классифицировать различные типы канонических и неканонических пар оснований с точки зрения их положения в матрицах изостеричности. Этот подход, например, указывает на то, что четыре типа пар оснований: A:U cWW, U:A cWW, G:C cWW и C:G cWW изостеричны друг другу. Таким образом, как также подтверждается подробным сравнением последовательностей, двойные мутации, изменяющие A:U cWW на U:A cWW или даже на G:C cWW, могут не нарушать структуру и, если не затронуты проблемы стабильности, функцию родственной РНК. Было также обнаружено, что колебательная пара оснований G:U cWW на самом деле не изостерична паре оснований U:G cWW, что указывает на то, что такие двойные мутации могут существенно влиять на функционирование соответствующей РНК. С другой стороны, некоторые пары оснований, которые стабилизируются с помощью сахарного края оснований, взаимно изостеричны.
На основе местного направления прядей
[ редактировать ]Здесь можно отметить, что из-за геометрической связи оснований с сахарофосфатным остовом эти 12 геометрических семейств пар оснований связаны с двумя возможными локальными ориентациями цепей, а именно параллельной и антипараллельной. Для 6 семейств с комбинациями ребер, включающими ребра Уотсона-Крика и Шугара, W:W, W:S и S:S, цис- и транс- семейства соответственно связаны с антипараллельным и параллельным направлением локальных цепей от 5' до 3'. Введение ребра Хугстина, как одного из партнеров в комбинации, вызывает инверсию отношений. Таким образом, для W:H и H:S цис и транс соответственно соответствуют параллельной и антипараллельной ориентации локальных цепей. Как и ожидалось, когда оба края имеют форму H, наблюдается двойная инверсия, а H:H цис и транс соответствуют соответственно антипараллельной и параллельной локальным ориентациям цепей. Обозначение ориентации локальной цепи в терминах параллельного и антипараллельного направлений помогает понять, какие грани отдельных оснований можно увидеть для данной пары оснований с 5'- или 3'-сторон. Эта аннотация также помогает классифицировать 12 геометрий на две группы по 6 в каждой, где геометрии потенциально могут конвертироваться внутри каждой группы путем относительного вращения оснований в плоскости. Однако следует отметить, что изложенная теория применима только в том случае, когда гликозидные торсионные углы обоих нуклеотидных остатков равны анти . В частности, кристаллографические наблюдения [ 33 ] и энергичный [ 34 ] Соображения показывают, что . вполне возможны и сингликозидные перекруты Следовательно, приведенная выше классификация параллельности или антипараллельности направлений нитей сама по себе не всегда дает полное понимание.

Различные функциональные молекулы РНК стабилизируются по их специфической складчатой структуре как каноническими, так и неканоническими парами оснований. Например, известно, что большинство молекул тРНК имеют четыре коротких сегмента двойной спирали, что приводит к образованию двумерной структуры, напоминающей клеверный лист. Однако трехмерная структура тРНК принимает L-образную форму. Это опосредовано несколькими неканоническими парами оснований и тройками оснований. D-петля и петля TψC удерживаются вместе несколькими такими парами оснований. Существует множество разновидностей неканонических пар оснований, которые можно просмотреть на различных веб-сайтах, таких как NDB, [ 36 ] РНКБПДБ, [ 37 ] РНКБП КОГЕСТ [ 38 ] и т. д., чтобы лучше понять.
Можно отметить, что приведенная выше схема справедлива для встречающихся в природе нуклеотидных оснований. Однако существует множество примеров посттранскрипционных химических модификаций оснований, многие из которых наблюдаются в тРНК или рибосомах. Возможно, важно также понять их структурные особенности. [ 39 ] [ 40 ]
Идентификация
[ редактировать ]В случае двухспиральной ДНК идентификация пар оснований довольно тривиальна с использованием молекулярных визуализаторов, таких как VMD , RasMol , PyMOL и т. д. Однако для одноцепочечных свернутых функциональных молекул РНК все не так просто. Несколько алгоритмов были реализованы в программных средствах для автоматического обнаружения пар оснований в структурах РНК, решенных с помощью рентгеновской кристаллографии , ЯМР или других методов. По сути, программы обнаруживают водородные связи между двумя основаниями и обеспечивают их (почти) плоскую ориентацию, прежде чем сообщить, что они составляют пару оснований. Поскольку большинство структур РНК, доступных в открытом доступе, решены с помощью рентгеновской кристаллографии, положения атомов водорода сообщаются редко. Следовательно, обнаружение водородной связи становится нетривиальной задачей.
Алгоритм DSSR [ 41 ] Лу и Вильма К. Олсон считает два основания спаренными, когда они обнаруживают одну или несколько водородных связей между основаниями, фактически моделируя положения атомов водорода и гарантируя, что перпендикуляры к двум основаниям почти равны параллельно друг другу. Положения атомов водорода можно определить путем преобразования внутренних координат ( длины связи, валентного угла и торсионного угла ) вместе с положениями атомов-предшественников, таких как атомы азота аминогруппы и атомы, связанные с азотом или Z-матрицей , во внешние декартовы координаты. . Пары оснований, идентифицированные этим методом, перечислены в NDB. [ 42 ] и ФР3Д [ 43 ] базы данных.
В MC-Annotate заложен уникальный способ идентификации пар оснований в РНК [ 44 ] Франсуа Майор. В этом алгоритме они используют положения атомов водорода, а также неподеленных пар электронов, используя подходящие силовые поля молекулярной механики/динамики. [ 45 ] и вывести для них вероятности образования водородных связей. Окончательная идентификация пар оснований осуществляется на основе этих вероятностей и приближения атомов водорода к неподеленным парам электронов азота или кислорода. В этом методе также была предпринята попытка классифицировать номенклатуру пар оснований с помощью дополнительной информации о каждом взаимодействующем ребре, такой как Ws, обозначающая угол сахарного края ребра Уотсона-Крика, Wh, обозначающий угол ребра Хугстина ребра Уотсона-Крика, Bw, обозначающий раздвоенный трехгранный край. центральная водородная связь с участием обоих атомов водорода аминогруппы с образованием водородных связей с карбонильным кислородом с участием обеих его неподеленных пар и т. д. По утверждению авторов, такая номенклатурная схема добавляет некоторые дополнительные функции в Leontis-Westhof (LW) [ 28 ] Схема и может называться схемой LW+. Основное преимущество этой схемы заключается в ее способности различать альтернативные геометрии спаривания оснований, где мультимодальность наблюдается внутри семейства LW. Однако этот метод не учитывает возможное участие 2'-ОН-группы рибозных сахаров в образовании пары оснований.
Другой алгоритм, а именно BPFIND, разработанный Дхананджаем Бхаттачарьей и его коллегами, [ 46 ] требует как минимум двух водородных связей с использованием двух различных наборов атомов доноров и акцепторов между основаниями. Этот алгоритм, основанный на гипотезе, учитывает расстояния между двумя парами атомов (донором водородной связи (D1 и D2) и акцептором (A1 и A2) и четырьмя подходяще выбранными атомами-предшественниками (PD1, PD2, PA1, PA2), соответствующими D и A. Малый значения таких расстояний в сочетании с большими значениями углов, определяемых θ 1 (ПД1—Д1—А1), θ 2 (Д1—А1—ПА1), θ 3 (ПД2—Д2—А2), θ 4 (Д2—А2 —PA2) (около 180 тот или π с ) обеспечивает две структурные особенности, которые характеризуют четко определенные пары оснований: i) водородные связи прочные и линейные и ii) два основания находятся в одной плоскости. Примечательно, что пока ограничивается поиск парами оснований, которые стабилизированы по крайней мере двумя различными водородными связями, приведенные выше алгоритмы, в целом, дают один и тот же набор пар оснований в разных структурах РНК.
Иногда в кристаллических структурах наблюдают, что два близко расположенных основания ориентированы таким образом, что помимо регулярных водородных связей два дополнительных электроотрицательных атома-акцептора водородных связей расположены очень близко друг к другу, что может вызвать электростатическое отталкивание. Концепция спаривания протонированных оснований, предполагающая возможное протонирование одного из этих электроотрицательных (потенциально) атомов-акцепторов водородной связи, превращая его таким образом в донора водородной связи, была введена для объяснения стабильности такой геометрии. [ 47 ] [ 48 ] [ 46 ] Некоторые из структур, полученных ЯМР, также подтверждают гипотезу протонирования, но, возможно, более строгие исследования с использованием нейтронной дифракции или других методов смогут подтвердить ее. Если позволяло качество кристаллических структур, некоторые алгоритмы также пытались обнаружить образование пар оснований, опосредованное водой или катионами.

Стабильность
[ редактировать ]Канонические пары оснований Уотсона-Крика, G:C и A:T/U, а также большинство неканонических пар стабилизированы двумя или более (например, 3 в случае G:C cWW) водородными связями. Вполне оправданно, что значительный объем исследований неканонических пар оснований был проведен с целью сравнения их сильных сторон (энергий взаимодействия) и (геометрической) стабильности с таковыми у канонических пар оснований. Здесь можно отметить, что на геометрию пар оснований, наблюдаемую в кристаллических структурах, часто влияют несколько взаимодействий, присутствующих в кристаллическом окружении, тем самым нарушая их внутренне стабильную геометрию, возникающую в результате водородных связей и связанных с ними взаимодействий между двумя основаниями. Поэтому в принципе возможно, что наблюдаемая геометрия в некоторых случаях внутренне нестабильна и стабилизируется за счет других взаимодействий, обеспечиваемых средой. Несколько групп попытались определить энергии взаимодействия в этих неканонических парах оснований, используя различные Подходы, основанные на квантовой химии , такие как теория функционала плотности (DFT) или MP2 . методы [ 49 ] [ 50 ] [ 51 ] [ 52 ] [ 53 ] [ 54 ] [ 55 ] [ 56 ] [ 57 ] Эти методы были применены к соответствующим образом усеченным, добавленным водородом и оптимизированным по геометрии моделям пар оснований (или нуклеозидов), извлеченных из PDB структур . В зависимости от протокола оптимизации обычно сообщается о трех типах энергии взаимодействия. В первом методе геометрия модели базовой пары, изолированная от соответствующей среды, полностью оптимизируется без каких-либо ограничений. [ 50 ] [ 52 ] [ 55 ] [ 56 ] таким образом обеспечивая внутреннюю геометрию и энергию взаимодействия изолированных моделей. Однако эта процедура иногда приводит к оптимизации геометрии пар оснований, включающей края, отличные от исходной геометрии кристалла. Абхиджит Митра и его коллеги также использовали дополнительный второй протокол, в котором координаты тяжелого атома (неводорода) сохраняются, как и в геометрии кристалла, оптимизируя только положения добавленных атомов водорода. [ 51 ] [ 54 ] [ 57 ] В третьем протоколе, за которым в основном следят Иржи Спонер и его группа: [ 49 ] оптимизация проводилась с ограничениями на некоторые углы и двугранники. Учитывая, что модели извлекаются из соответствующих кристаллических структур и изолированы от их кристаллического окружения, второй и третий протоколы предоставляют два разных подхода к аппроксимации эффектов окружающей среды без явного рассмотрения каких-либо конкретных взаимодействий с окружающей средой. В некоторых отчетах эта проблема также рассматривается с учетом конкретных факторов окружающей среды, таких как координация с магнием или даже некоторые ковалентные модификации оснований. [ 50 ]
Все три протокола полезны в своих контекстах. Кроме того, сравнение геометрии модели, полученной с помощью различных протоколов, дает представление как о стабильности геометрии соответствующих пар оснований, так и о вероятной степени и характере воздействия окружающей среды. Было обнаружено, что большинство неканонических пар оснований, имеющих две или более водородные связи, обычно сохраняют одинаковую структуру водородных связей в кристалле и полностью оптимизированную геометрию изоляции соответственно, что указывает на их внутреннюю геометрическую стабильность. Энергии взаимодействия, рассчитанные на основе этих оптимизированных моделей, также указывают на энергетическую стабильность соответствующих неканонических пар оснований. Предыдущее представление о том, что неканонические пары оснований слабее пар оснований Уотсона-Крика, оказалось неверным. Энергии взаимодействия между основаниями нескольких пар оснований, таких как G:G tWW, G:G cWH, A:U chW, G:A cWW, G:U cWW и т. д., оказываются больше, чем у канонического A. :U базовая пара cWW. [ 58 ]
Конечно, все неканонические пары оснований не обязательно очень сильны или стабильны с точки зрения энергии взаимодействия. Несколько пар оснований обнаружены на основе слабых водородных связей с участием атомов C—H...O/N, где энергии взаимодействия весьма малы. Кроме того, было обнаружено, что оптимизация геометрии некоторых наблюдаемых пар оснований, в частности, помимо прочего, тех, которые включают слабые водородные связи или тех, стабилизированных одиночными водородными связями, принимает альтернативную геометрию, [ 51 ] [ 52 ] [ 57 ] тем самым указывая на присущее им отсутствие геометрической устойчивости. Эти изменения схем водородных связей, приводящие к изменениям в семействе пар оснований при свободной оптимизации, могут иметь некоторые функциональные последствия для РНК, например, их действие в качестве конформационного переключения. Соответственно, как упоминалось выше в протоколе Спонера, были некоторые попытки ограничить экспериментально наблюдаемую геометрию при проведении оптимизации геометрии. [ 49 ] для расчетов энергии взаимодействия. Интересно, что в некоторых случаях энергии взаимодействия, рассчитанные для этих « не внутренне стабильных » геометрий, также указывают на хорошую энергетическую стабильность.
Хотя энергетика и геометрическая стабильность различных неканонических пар оснований не показывают каких-либо обобщенных корреляций, анализ нескольких баз данных, таких как RNABPDB и RNABP COGEST, которые каталогизируют структурные и энергетические особенности некоторых наблюдаемых пар оснований и их стеков, показывает некоторые интересные общие тенденции.
Например, оптимизация геометрии нескольких пар оснований, включающих 2'-ОН-группу остатка сахара, привела к значительным изменениям по сравнению с их первоначальной геометрией. Возможно, это связано с гибкостью сахарных складок и гликозидными перекручиваниями. Отдельного упоминания в этом контексте заслуживают и значительно высокие энергии взаимодействия протонированных пар оснований, несмотря на высокую энергетическую стоимость протонирования оснований. В основном это можно объяснить дополнительными дипольными взаимодействиями, индуцированными зарядом, которые связаны с протонированными парами оснований.
Структура
[ редактировать ]Базовое соединение
[ редактировать ]
По оценкам, 60% оснований в структурированной РНК участвуют в канонических парах оснований Уотсона-Крика. [ 28 ] Спаривание оснований происходит, когда два основания образуют водородные связи друг с другом. Эти водородные связи могут быть как полярными, так и неполярными. Полярные водородные связи образуются в результате взаимодействий NH...O/N и/или OH...O/N. Между CH...O/N образуются неполярные водородные связи. [ 59 ]
Краевые взаимодействия
[ редактировать ]У каждой базы есть три потенциальных края, по которым она может взаимодействовать с другой базой. Пуриновые основания имеют три ребра, способные образовывать водородные связи. Они известны как ребро Уотсона-Крика (WC), ребро Хугстина (H) и ребро Шугара (S). Пиримидиновые основания также имеют три края водородных связей. [ 28 ] Как и у пурина, есть край Уотсона-Крика (WC) и край Сахара (S), но третий край на пиримидиновых основаниях называется краем «CH» (H). Это ребро CH для простоты иногда также называют ребром Хугстина. Различные края пуриновых и пиримидиновых оснований показаны на рисунке 2. [ 59 ]

Помимо трех краев взаимодействия, пары оснований также могут различаться по своим цис / транс-формам. Цис- и транс-структуры зависят от ориентации сахара рибозы, а не от взаимодействия водородных связей. Эти различные ориентации показаны на рисунке 3. Таким образом, с учетом цис/транс-форм и трех краев водородных связей существует 12 основных типов геометрии спаривания оснований, которые можно обнаружить в структурах РНК. Эти 12 типов: WC:WC (цис/транс), WC:HC (цис/транс), WC:S (цис/транс), H:S (цис/транс), H:H (цис/транс) и S:S (цис/транс).
Классификация
[ редактировать ]Эти 12 типов можно разделить на дополнительные подгруппы, которые зависят от направленности гликозидных связей и стерических расширений. [ 60 ] Среди всех различных комбинаций пар оснований существует 169 теоретически возможных комбинаций пар оснований. Фактическое количество комбинаций пар оснований ниже, поскольку некоторые комбинации приводят к неблагоприятным взаимодействиям. Это количество возможных неканонических пар оснований все еще определяется, поскольку оно сильно зависит от критериев спаривания оснований. [ 61 ] Понимание конфигурации пар оснований также сложно, поскольку спаривание зависит от окружения баз. Это окружение может состоять из соседних пар оснований, соседних петель или третьих взаимодействий (например, тройки оснований). [ 62 ]

Связи между различными основаниями хорошо выражены благодаря их жесткой и плоской форме. Пространственные взаимодействия между двумя основаниями можно классифицировать по 6 параметрам твердого тела или параметрам пар внутри оснований (3 поступательных, 3 вращательных), как показано на рисунке 4. [ 63 ] Эти параметры описывают трехмерную конформацию пар оснований.
Три поступательных механизма известны как сдвиг, растяжение и шатание. Эти три параметра напрямую связаны с близостью и направлением водородных связей. Вращательные устройства представляют собой пряжку, пропеллер и отверстие. Вращательные механизмы относятся к неплоскому подтверждению (по сравнению с идеальной копланарной геометрией). [ 59 ] Параметры пар внутри оснований используются для определения структуры и стабильности неканонических пар оснований и изначально были созданы для пар оснований в ДНК, но было обнаружено, что они также соответствуют неканоническим базовым моделям. [ 63 ]
Типы
[ редактировать ]Наиболее распространенными неканоническими парами оснований являются транс-пары A:G Hoogsteen/sugar Edge, A:U Hoogsteen/WC и G:U Wobble . [ 64 ]
Пары оснований Хугстина
[ редактировать ]
Пары оснований Хугстина встречаются между аденином (А) и тимином (Т); и гуанин (G) и цитозин (C); аналогично парам оснований Уотсона-Крика. Однако пурин (A и G) принимает альтернативную конформацию по отношению к пиримидину . В паре оснований AU Hoogsteen аденин повернут на 180° вокруг гликозидной связи , что приводит к альтернативной схеме образования водородных связей, в которой одна водородная связь является общей с парой оснований Уотсона-Крика (аденин N6 и тимин N4), а другая - Водородная связь вместо того, чтобы возникать между аденином N1 и тимином N3, как в паре оснований Уотсона-Крика, возникает между аденином N7 и тимином N3. [ 65 ] Пара оснований AU показана на рисунке 5. В паре оснований GC Hoogsteen, как и в паре оснований AT Hoogsteen, пурин (гуанин) повернут на 180° вокруг гликозидной связи, в то время как пиримидин (цитозин) остается на месте. Одна водородная связь пары оснований Уотсона-Крика сохраняется (гуанин O6 и цитозин N4), а другая возникает между гуанином N7 и протонированным цитозином N3 (обратите внимание, что пара оснований Hoogsteen GC имеет две водородные связи, тогда как пара оснований Watson-Crick GC базовая пара имеет три). [ 65 ]

Колебание пар оснований
[ редактировать ]Спаривание оснований колебания происходит между двумя нуклеотидами, которые не являются парами оснований Уотсона-Крика, и было предложено Уотсоном в 1966 году. Четырьмя основными примерами являются гуанин-урацил (GU), гипоксантин -урацил (IU), гипоксантин-аденин (IA) и гипоксантин-цитозин (ИК). Эти колебательные пары оснований очень важны в тРНК. Большинство организмов имеют менее 45 молекул тРНК, хотя технически для канонического спаривания с кодоном необходима 61 молекула тРНК. Колеблющееся спаривание оснований позволяет 5'-антикодону связываться с нестандартной парой оснований. Примеры колебательных пар оснований приведены на рисунке 6.
3-D структура
[ редактировать ]Вторичные и трехмерные структуры РНК формируются и стабилизируются за счет неканонических пар оснований. Пары оснований составляют множество вторичных структурных блоков, которые способствуют сворачиванию комплексов РНК и трехмерных структур. Общая свернутая РНК стабилизируется за счет канонического спаривания оснований третичной и вторичной структур. [ 59 ] Из-за множества возможных неканонических пар оснований существует неограниченное количество структур, что обеспечивает разнообразные функции РНК. [ 28 ] Расположение неканонических оснований также обеспечивает взаимодействие РНК на большие расстояния, распознавание белков и других молекул, а также структурных стабилизирующих элементов. [ 63 ] Многие из распространенных неканонических пар оснований можно добавить к стеблю РНК, не нарушая его спиральный характер. [ 66 ]
вторичный
[ редактировать ]
Основные вторичные структурные элементы РНК включают выпуклости, двойные спирали , шпильки и внутренние петли . Пример шпильки РНК приведен на рисунке 7. Как показано на рисунке, шпильки и внутренние петли требуют внезапного изменения направления основной цепи. Неканоническое спаривание оснований обеспечивает повышенную гибкость в местах соединений или поворотов, необходимую во вторичной структуре. [ 59 ]
Третичный
[ редактировать ]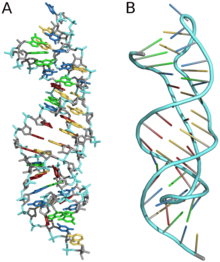
Трехмерные структуры образуются за счет дальнодействующих внутримолекулярных взаимодействий между вторичными структурами. Это приводит к образованию псевдоузлов, рибозных застежек, целующихся шпилек или коаксиальных псевдонепрерывных спиралей. [ 59 ] Трехмерные структуры РНК в основном определяются посредством молекулярного моделирования или измерений, управляемых компьютером. [ 63 ] Пример псевдоузла приведен на рисунке 8.
Структурные особенности пары оснований, образованной двумя плоскими жесткими единицами, можно оценить количественно, используя шесть параметров - три поступательных и три вращательных. Рекомендуемые параметры IUPAC: пропеллер, пряжка, угол раскрытия, сдвиг, сдвиг и растяжение ( рис. 8 ). [ 67 ] Существует несколько общедоступных программ, таких как Curves. [ 68 ] Ричард Лавери, 3DNA [ 69 ] Олсон, НУПАРМ [ 70 ] [ 71 ] автор Manju Bansal и т. д., которые можно использовать для расчета этих параметров. В то время как первые два вычисляют параметры канонических и неканонических пар оснований относительно стандартной канонической геометрии пар оснований Уотсона-Крика, алгоритм NUPARM вычисляет в абсолютных величинах, используя систему осей, специфичную для спаривания оснований. Следовательно, для большинства неканонических пар оснований, которые включают ребра, не являющиеся ребрами Уотсона-Крика, некоторые параметры (Открытие, Сдвиг и Растяжение), рассчитанные с помощью Curves или 3DNA, обычно велики даже в их соответствующих, по сути, наиболее стабильных геометриях. С другой стороны, значения, предоставленные NUPARM, более реалистично указывают на качество водородных связей и плоскостность двух оснований. Таким образом, значения растяжения NUPARM, указывающие на разделение двух оснований пары оснований и зависящие от оптимальных расстояний водородных связей, всегда составляют около 3 Ϻ. Представляют интерес и некоторые другие общие тенденции, наблюдаемые в значениях указанных выше параметров. Видно, что большинство цис- пар оснований имеют значения Пропеллера около -10. тот и небольшие значения Buckle и Stagger. Значения Open и Shear часто зависят от положения атомов водородной связи. Например, пары оснований колебания GU cWW имеют значение сдвига около -2,2 Ϻ, тогда как пары оснований GC или AU cWW имеют значения сдвига около нуля. Значения Open для большинства пар оснований близки к нулю, но значения часто довольно велики для пар, включающих 2'-OH-группу сахара в наборе параметров, производных от NUPARM. Однако пары трансоснований не демонстрируют какой-либо систематической тенденции в своих значениях Пропеллера.
Роли
[ редактировать ]В РНК
[ редактировать ]Структурная иерархия в РНК обычно описывается в терминах двумерной вторичной структуры «стебель-петля», которая в дальнейшем складывается, образуя трехмерную третичную структуру, стабилизированную так называемыми третичными контактами на большие расстояния. Чаще всего в этих третичных контактах или внестволовых парах оснований участвуют неканонические пары оснований. Например, некоторые из неканонических пар оснований в тРНК появляются между D-стеблем и петлями TψC (рис. 5), близкими по трехмерной структуре. Такие взаимодействия пар оснований придают стабильность L-образной структуре тРНК. Обнаружено, что в этой области некоторые пары оснований дополнительно связаны водородными связями с третьим основанием. Таким образом, 23-й остаток одновременно спаривается с 9-м и 12-м остатками, вместе образуя тройку оснований, наименьший член класса мультиплетов более высокого порядка.
Мультиплеты
[ редактировать ]Одно основание, помимо формирования правильного плоского спаривания оснований со вторым основанием, часто может участвовать в образовании пары оснований, при этом третье основание образует тройку оснований. Одним из таких классических примеров является образование тройной спирали ДНК , где два основания двух антипараллельных цепей образуют последовательные пары оснований Уотсона-Крика в двойной спирали, а основание третьей цепи образует пару оснований Хугстина с пуриновыми основаниями Уотсона-Крика. пары оснований. В доступных структурах РНК описано множество различных типов троек оснований, которые были элегантно классифицированы в литературе. [ 72 ] Однако мультиплеты не ограничиваются образованием триплетов. Четыре основания, дающие начало квартету оснований, теперь хорошо документированы в структуре G-квадруплекса, характерного для теломер . Здесь четыре остатка гуанина соединяются внутри себя в циклическую форму с использованием схемы спаривания цис - оснований Уотсона-Крика/Хугстина (cWH), и обнаружено, что каждое из гуаниновых оснований соответственно взаимодействует с двумя другими гуаниновыми основаниями. Три-четыре таких G-квадруплекса оснований укладываются друг на друга, образуя четырехцепочечную структуру ДНК. В дополнение к такой циклической топологии возможны несколько других топологий пар оснований: оснований для мультиплетов более высокого порядка, таких как квартеты, пентеты и т. Д. [ 73 ]
Двойные спиральные области
[ редактировать ]Неканонические пары оснований довольно часто встречаются в двойных спиральных областях РНК . Неканонические пары оснований G:U cWW очень часто встречаются в двойных спиральных областях, поскольку эта пара оснований почти изостерична другим каноническим парам. [ 74 ] Из-за сложности направления цепи, как подробно описано в разделе «Классификация» ( Таблица 1 ), не все типы неканонических пар оснований могут быть размещены в двойных спиральных областях с антигликозидными торсионными углами. Однако многие неканонические пары оснований, например, A:G tHS ( транс -Хугстин/Сахарный край) или A:U tHW ( транс- Хугстин/Уотсон-Крик), A:G cWW и т. д., часто встречаются внутри двойных спиральных областей. создавая симметричные внутренние петли, подобные мотивам. Были предприняты попытки классифицировать все такие ситуации, когда две пары оснований (канонические или неканонические) укладываются в антипараллельном смысле, что, возможно, приводит к образованию двойных спиральных областей в структурах РНК. Эти пары оснований довольно стабильны и способны хорошо сохранять спиральные свойства. Углы скручивания основной цепи вокруг этих остатков также обычно находятся в разумных пределах: C3'-эндосахарная складка с антигликозидным скручиванием, углы скручивания α/γ около -60°. тот /60 тот , б/е углы кручения около 180 тот .
Повторяющиеся структурные мотивы
[ редактировать ]
Неканонические пары оснований часто появляются в различных структурных мотивах, в том числе в псевдоузлах, с особыми особенностями водородных связей. Структурные особенности этих повторяющихся мотивов заархивированы в доступных для поиска базах данных, таких как FR3D. [ 75 ] и РНК ФРАБАЗА. [ 76 ] Кроме того, некоторые из этих мотивов могут быть идентифицированы в заданном файле PDB запроса с помощью NASSAM. [ 77 ] веб-сервер. Чаще всего они обнаруживаются на концах сегментов двойной спирали, выступая в качестве кэп-остатков, часто предшествуя петлям-шпилькам . Наиболее часто встречающаяся неканоническая пара оснований, а именно G:A tSH, является неотъемлемой частью тетрапетли GNRA , где N может быть любым нуклеотидным остатком, а R — пуриновым остатком. Этот мотив демонстрирует некоторую гибкость и изменения структурных особенностей в зависимости от того, спарены ли гуанин и аденин или нет. В доступных структурах РНК было обнаружено несколько других типов мотивов тетрапетли, таких как UNCG, YNMG, GNAC, CUYG (где Y означает пиримидин, а M означает аденин или цитозин) и т. д. Однако они обычно не демонстрируют участия неканонического спаривания оснований. В дополнение к этим обычным мотивам «шпильки», где остатки петли в основном остаются неспаренными, существует также несколько мотивов, в которых остатки петли активно взаимодействуют между собой или с другими остатками, внешними по отношению к петле. Типичным примером является мотив C-петли. [ 78 ] [ 79 ] где остатки выпуклой петли образуют неканоническое спаривание оснований с основаниями двойных спиральных областей, образуя неканоническое спаривание оснований ( рис. 9 ). Дополнительные пары оснований в этих случаях приводят к дополнительной стабилизации сложного мотива, содержащего двойную спираль. Неканонические пары оснований также участвуют во взаимодействии рецептор-петля, например, в мотиве Т-петли. [ 78 ] Еще один интересный пример участия неканонических пар оснований в рекуррентных контекстах был обнаружен как мотив рецептора GAAA, который состоит из пары оснований A:A cHS, за которой следует пара оснований U:A tWH, уложенная с обеих сторон основанием G:C cWW. пары. Здесь мы имеем последовательные неканонические пары оснований внутри антипараллельного двухспирального домена РНК. Аналогичным образом существует пара оснований A:A cSH, включающая в этот мотив два последовательных остатка. Такое спаривание последовательных остатков, которое также называют мотивом динуклеотидной платформы, наблюдается довольно часто. Они появляются во многих структурах РНК, а спаривание может происходить и между другими основаниями. Такая динуклеотидная платформа была обнаружена в парах оснований A:A, A:G, A:U, G:A, G:U, принадлежащих классу cSH, а также в парах оснований A:A chHH. Эти мотивы могут изменять направление нитей внутри двойной спирали за счет образования изломов. Такая динуклеотидная платформа наряду с образованием триплета также является неотъемлемым компонентом мотива сарцин-рицин. [ 80 ]
Моделирование
[ редактировать ]Прогнозирование биомолекулярной структуры только на основе последовательности — долгосрочная цель ученых, работающих в области биоинформатики, вычислительной химии, статистической физики, а также в области информатики. Предсказание белковых структур по аминокислотной последовательности с помощью таких методов, как моделирование гомологии , сравнительное моделирование, нарезка нитей и т. д., было в значительной степени успешным благодаря наличию около 1200 уникальных белковых складок . Вдохновленные опытом работы с белками, сейчас существует несколько подходов к предсказанию структур РНК, хотя и с разной степенью успеха.
Видно, что большинство подходов по существу ограничиваются предсказанием двумерной структуры «стебель-петля» РНК, также называемой вторичной структурой РНК. Например, предсказание минимальной вычисленной свободной энергии двойных спиральных областей последовательностей РНК на основе энергии взаимодействий спаривания оснований и стэкинга, по существу полученное вычислительным путем на основе экспериментальных термодинамических данных, было первоначально введено Рут Нусиновой , а затем Майклом Цукером. Это, в свою очередь, послужило толчком к созданию нескольких связанных модифицированных алгоритмов, включая данные о взаимодействиях соседних групп и т. д. [ 74 ] Однако большинство этих подходов в основном рассматривают данные о каноническом спаривании оснований, и лишь немногие также учитывают термодинамические данные о парах оснований Хугстина. Таким образом, помимо вычислительных затрат и сложностей, связанных с идентификацией псевдоузлов, все эти методы страдают еще и недостатком, связанным с нехваткой экспериментальных данных по неканоническим парам оснований.
Однако существует также несколько подходов, которые пытаются предсказать третичную трехмерную структуру, соответствующую данным предсказанным двумерным структурам. Есть также несколько моделей, включающих моделирование на основе 3D-фрагментов. [ 81 ] которые становятся еще более облегченными с увеличением доступности данных о трехмерной структуре РНК, курируемых по мотивам. [ 74 ] Также отрадно отметить, что сейчас существует некоторое программное обеспечение и серверы, такие как MC-Fold, [ 82 ] РНАПДБи, [ 83 ] РН Вольф, [ 84 ] и т. д., доступных для изучения неканонических спариваний оснований в трехмерных структурах РНК. Некоторые из этих методов зависят от структурных баз данных РНК, таких как FRABASE, [ 76 ] получить трехмерные координаты мотивов, содержащих неканонические пары оснований, и сшить информацию с трехмерной структурой двойных спиралей, содержащих канонические пары оснований.
В этом контексте может быть уместным упомянуть о подходе к построению 3D-модели двойных спиральных областей как с каноническими, так и с неканоническими парами оснований, используемом в 3ДНК Олсоном или в RNAHelix. [ 85 ] Бхаттачарья и Бансал. Эти программные пакеты используют параметры пар оснований для генерации трехмерных координат отдельных динуклеотидных ступеней, которые можно расширить для моделирования двойных спиралей произвольной длины с каноническими или неканоническими парами оснований.
Вышеупомянутые методы пытаются смоделировать единую структуру (2D или 3D) данной последовательности РНК. Однако все больше данных указывает на то, что данная последовательность РНК может принимать ансамбль структур и, возможно, взаимопревращаться между ними. [ 86 ] Эти ансамбли, очевидно, принимают разные модели спаривания оснований между разными наборами остатков. [ 87 ] Таким образом, есть достаточно указаний, чтобы предположить, что сосредоточенность на моделировании отдельных структур, по-видимому, была узким местом для точного моделирования структуры РНК.
Теоретическое предсказание двумерной и, следовательно, трехмерной структуры РНК также может быть подтверждено различными методами химического зондирования. Одним из последних таких инструментов является SHAPE (селективное 2'-гидроксильное ацилирование, анализируемое путем удлинения праймера) и SHAPE-направленное предсказание вторичной структуры РНК. [ 88 ] представляется наиболее перспективным. В сочетании с мутационным профилированием с использованием подхода SHAPE-MaP можно экспериментально изучать ансамбли структур РНК, которые часто включают неканонические пары оснований. [ 89 ] Одним из перспективных направлений на сегодняшний день, по-видимому, является интеграция подхода Цукера по минимальной свободной энергии с экспериментально полученными данными SHAPE, включая смоделированные данные SHAPE, как описано в Montaseri et al. (2016) [ 90 ] и Спасич и др. (2017). [ 91 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]![]() Эта статья была адаптирована из следующего источника под лицензией CC BY 4.0 ( 2023 г. ) ( отчеты рецензента ):
Дхананджай Бхаттачарья; Абхиджит Митра (8 апреля 2023 г.). «Неканоническая пара оснований» (PDF) . Викижурнал науки . 6 (1): 2. doi : 10.15347/WJS/2023.002 . ISSN 2470-6345 . Викиданные Q39049436 .
Эта статья была адаптирована из следующего источника под лицензией CC BY 4.0 ( 2023 г. ) ( отчеты рецензента ):
Дхананджай Бхаттачарья; Абхиджит Митра (8 апреля 2023 г.). «Неканоническая пара оснований» (PDF) . Викижурнал науки . 6 (1): 2. doi : 10.15347/WJS/2023.002 . ISSN 2470-6345 . Викиданные Q39049436 .
- ^ Уотсон Дж. Д., Крик Ф. Х. (апрель 1953 г.). «Молекулярная структура нуклеиновых кислот; структура нуклеиновой кислоты дезоксирибозы». Природа . 171 (4356): 737–738. Бибкод : 1953Natur.171..737W . дои : 10.1038/171737a0 . ПМИД 13054692 . S2CID 4253007 .
- ^ Николова Е.Н., Чжоу Х., Готтардо Ф.Л., Алви Х.С., Кимси И.Дж., Аль-Хашими Х.М. (декабрь 2013 г.). «Исторический отчет о парах оснований Хугстина в дуплексной ДНК» . Биополимеры . 99 (12): 955–968. дои : 10.1002/bip.22334 . ПМЦ 3844552 . ПМИД 23818176 .
- ^ Вестхоф Э., Фрич В. (март 2000 г.). «Складывание РНК: за пределами пар Уотсона-Крика» . Структура . 8 (3): Р55–Р65. дои : 10.1016/s0969-2126(00)00112-x . ПМИД 10745012 .
- ^ Хугстин К. (10 октября 1959 г.). «Строение кристаллов, содержащих комплекс 1-метилтимина и 9-метиладенина с водородными связями» . Акта Кристаллографика . 12 (10): 822–823. Бибкод : 1959AcCry..12..822H . дои : 10.1107/s0365110x59002389 . ISSN 0365-110X .
- ^ Куртуа И., Фромажо П., Гушльбауэр В. (декабрь 1968 г.). «Протонированные полинуклеотидные структуры. 3. Исследование оптической вращательной дисперсии протонирования ДНК» . Европейский журнал биохимии . 6 (4): 493–501. дои : 10.1111/j.1432-1033.1968.tb00472.x . ПМИД 5701966 .
- ^ Патель DJ, Тонелли А.Е. (октябрь 1974 г.). «Отнесение химических сдвигов протонного ЯМР протонных резонансов T-N3H и G-N1H в изолированных парах оснований AT и GC Watson-Crick в двухцепочечных дезоксиолигонуклеотидах в водном растворе». Биополимеры . 13 (10): 1943–1964. дои : 10.1002/bip.1974.360131003 . ПМИД 4433696 . S2CID 39908141 .
- ^ Симан Н.К., Розенберг Дж.М., Суддат Ф.Л., Ким Дж.Дж., Рич А. (июнь 1976 г.). «Двойные спиральные фрагменты РНК с атомным разрешением. I. Кристаллическая и молекулярная структура гексагидрата аденилил-3',5'-уридина натрия». Журнал молекулярной биологии . 104 (1): 109–144. дои : 10.1016/0022-2836(76)90005-х . ПМИД 957429 .
- ^ Дрю ХР, Винг Р.М., Такано Т., Брока С., Танака С., Итакура К., Дикерсон Р.Э. (21 мая 1981 г.). «Структура додекамера B-ДНК: конформация и динамика» . Труды Национальной академии наук Соединенных Штатов Америки . 78 (4): 2179–2183. Бибкод : 1981PNAS...78.2179D . дои : 10.1073/pnas.78.4.2179 . ПМК 319307 . ПМИД 6941276 .
- ^ Ван А., Фуджи С., Ван Бум Дж., Ван дер Марел Г., Ван Бекель С., Рич А. (1993). «Молекулярная структура R (GCG) D (TATACGC): гибридная спираль ДНК-РНК, соединенная с двойной спиральной ДНК» . дои : 10.2210/pdb1d96/pdb .
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Хайнеманн У., Алингс К. (ноябрь 1989 г.). «Кристаллографическое исследование одного витка B-ДНК, богатой G/C». Журнал молекулярной биологии . 210 (2): 369–381. дои : 10.1016/0022-2836(89)90337-9 . ПМИД 2600970 .
- ^ Док-Брегеон А.С., Шеврие Б., Поджарный А., Джонсон Дж., де Беар Дж.С., Гоф Г.Р. и др. (октябрь 1989 г.). «Кристаллографическая структура спирали РНК: [U(UA)6A]2». Журнал молекулярной биологии . 209 (3): 459–474. дои : 10.1016/0022-2836(89)90010-7 . ПМИД 2479753 .
- ^ Патикоглу Г.А., Ким Дж.Л., Сунь Л., Ян Ш.Х., Кодадек Т., Берли С.К. (декабрь 1999 г.). «Распознавание элементов ТАТА белком, связывающим ТАТА-бокс, сохранялось на протяжении всей эволюции» . Гены и развитие . 13 (24): 3217–3230. дои : 10.1101/gad.13.24.3217 . ПМК 317201 . ПМИД 10617571 .
- ^ Айшима Дж., Гитти Р., Ной Дж., Ган Х., Шлик Т., Вольбергер С. (11 декабря 2002 г.). «Гомеодомен MATalpha2, связанный с ДНК» . Всемирный банк данных по белкам . дои : 10.2210/pdb1k61/pdb . Проверено 17 декабря 2019 г.
- ^ Наир Д.Т., Джонсон Р.Э., Пракаш С., Пракаш Л., Аггарвал А.К. (июль 2004 г.). «Репликация ДНК-полимеразой-йота человека происходит путем спаривания оснований Хугстина». Природа . 430 (6997): 377–380. Бибкод : 2004Natur.430..377N . дои : 10.1038/nature02692 . ПМИД 15254543 . S2CID 4379848 .
- ^ Китайнер М., Розенберг Х., Рохс Р., Суад О., Рабинович Д., Хониг Б., Шаккед З. (апрель 2010 г.). «Разнообразие в распознавании ДНК р53, выявленное кристаллическими структурами с парами оснований Хугстина» . Структурная и молекулярная биология природы . 17 (4): 423–429. дои : 10.1038/nsmb.1800 . ПМК 3280089 . ПМИД 20364130 .
- ^ Этаятулла А., Це П., Нгуен С., Виадиу Х. (2012). «Структура тетрамера ДНК-связывающего домена p73 модулирует трансактивацию p73» . Труды Национальной академии наук Соединенных Штатов Америки . 109 (16): 6066–6071. дои : 10.2210/pdb3vd2/pdb . ПМК 3341074 . ПМИД 22474346 .
- ^ Перейти обратно: а б Сюй Ю., МакСалли Дж., Андрисиоаи И., Аль-Хашими Х.М. (апрель 2018 г.). «Модуляция динамики Хугстина при распознавании ДНК» . Природные коммуникации . 9 (1): 1473. Бибкод : 2018NatCo...9.1473X . дои : 10.1038/s41467-018-03516-1 . ПМК 5902632 . ПМИД 29662229 .
- ^ Паркинсон Г.Н., Ли MP, Нидл С. (июнь 2002 г.). «Кристаллическая структура параллельных квадруплексов теломерной ДНК человека». Природа . 417 (6891): 876–880. Бибкод : 2002Natur.417..876P . дои : 10.1038/nature755 . ПМИД 12050675 . S2CID 4422211 .
- ^ Луу К.Н., Фан А.Т., Курявый В., Лакруа Л., Патель DJ (август 2006 г.). «Структура теломеры человека в растворе К+: внутримолекулярный (3 + 1) G-квадруплексный каркас» . Журнал Американского химического общества . 128 (30): 9963–9970. дои : 10.1021/ja062791w . ПМЦ 4692383 . ПМИД 16866556 .
- ^ Фан А.Т., Курявый В., Луу К.Н., Патель DJ (25 сентября 2007 г.). «Структура двух внутримолекулярных G-квадруплексов, образованных природными последовательностями теломер человека в растворе К+» . Исследования нуклеиновых кислот . 35 (19): 6517–6525. дои : 10.1093/нар/gkm706 . ПМК 2095816 . ПМИД 17895279 .
- ^ Хендрикс Д.К., Бреннер С.Е., Холбрук С.Р. (август 2005 г.). «Структурные мотивы РНК: строительные блоки модульной биомолекулы». Ежеквартальные обзоры биофизики . 38 (3): 221–243. дои : 10.1017/s0033583506004215 . ПМИД 16817983 . S2CID 2632921 .
- ^ Лэнг С., Юнг С., Икбал А., Шлик Т. (октябрь 2009 г.). «Третичные мотивы, выявленные при анализе соединений РНК высшего порядка» . Журнал молекулярной биологии . 393 (1): 67–82. дои : 10.1016/j.jmb.2009.07.089 . ПМЦ 3174529 . ПМИД 19660472 .
- ^ Гальдер С., Бхаттачарья Д. (ноябрь 2013 г.). «Структура и динамика РНК: взгляд на спаривание оснований». Прогресс биофизики и молекулярной биологии . 113 (2): 264–283. doi : 10.1016/j.pbiomolbio.2013.07.003 . ПМИД 23891726 .
- ^ Анант П., Голдсмит Г., Ятиндра Н. (август 2013 г.). «Врожденный поворот между колебанием Крика и парами оснований Уотсона-Крика» . РНК . 19 (8): 1038–1053. дои : 10.1261/rna.036905.112 . ПМЦ 3708525 . ПМИД 23861536 .
- ^ Шпонер Ю., Лещинский Ю., Хобза П. (январь 1996 г.). «Структура и энергия пар оснований ДНК с водородными связями. Неэмпирическое исследование с учетом электронной корреляции» . Журнал физической химии . 100 (5): 1965–1974. дои : 10.1021/jp952760f . ISSN 0022-3654 .
- ^ Сенгер В. (1984). Принципы структуры нуклеиновых кислот . Расширенные тексты Springer по химии. Нью-Йорк, штат Нью-Йорк: Springer New York. стр. 1–8. дои : 10.1007/978-1-4612-5190-3 . ISBN 978-0-387-90761-1 .
- ^ Сайкс М.Т., Левитт М. (август 2005 г.). «Описание структуры РНК с помощью библиотек кластерных дублетов нуклеотидов» . Журнал молекулярной биологии . 351 (1): 26–38. дои : 10.1016/j.jmb.2005.06.024 . ПМЦ 2746451 . ПМИД 15993894 .
- ^ Перейти обратно: а б с д и Леонтис Н.Б., Вестхоф E (апрель 2001 г.). «Геометрическая номенклатура и классификация пар оснований РНК» . РНК . 7 (4): 499–512. дои : 10.1017/S1355838201002515 . ПМК 1370104 . ПМИД 11345429 .
- ^ Стомбо Дж., Зирбель К.Л., Вестхоф Э., Леонтис Н.Б. (апрель 2009 г.). «Частота и изостеричность пар оснований РНК» . Исследования нуклеиновых кислот . 37 (7): 2294–2312. дои : 10.1093/нар/gkp011 . ПМК 2673412 . ПМИД 19240142 .
- ^ Леонтис Н.Б., Стомбо Дж., Вестхоф Э. (август 2002 г.). «Пары оснований, не относящиеся к Уотсону-Крику, и связанные с ними матрицы изостеричности» . Исследования нуклеиновых кислот . 30 (16): 3497–3531. дои : 10.1093/nar/gkf481 . ПМЦ 134247 . ПМИД 12177293 .
- ^ Насалян Л., Стомбо Дж., Зирбель К.Л., Леонтис Н.Б. (2009). «3D-структурные мотивы РНК: определение, идентификация, аннотации и поиск в базе данных». В Уолтере Н.Г., Вудсоне С.А., Бэти RT (ред.). Некодирующие белки РНК . Серия Спрингера по биофизике. Том. 13. Берлин, Гейдельберг: Springer Berlin Heidelberg. стр. 1–26. дои : 10.1007/978-3-540-70840-7_1 . ISBN 978-3-540-70833-9 .
- ^ Стомбо Дж., Зирбель К.Л., Вестхоф Э., Леонтис Н.Б. (апрель 2009 г.). «Частота и изостеричность пар оснований РНК» . Исследования нуклеиновых кислот . 37 (7): 2294–2312. дои : 10.1093/нар/gkp011 . ПМК 2673412 . ПМИД 19240142 .
- ^ Соколоски Дж. Э., Годфри С. А., Домбровски С. Е., Бевилаква ПК (октябрь 2011 г.). «Распространенность синнуклеиновых оснований в активных центрах функциональных РНК» . РНК . 17 (10): 1775–1787. дои : 10.1261/rna.2759911 . ПМК 3185911 . ПМИД 21873463 .
- ^ Райхерт Дж., Зюнель Дж. (январь 2002 г.). «Библиотека изображений биологических макромолекул IMB в Йене: обновление 2002 г.» . Исследования нуклеиновых кислот . 30 (1): 253–254. дои : 10.1093/нар/30.1.253 . ПМК 99077 . ПМИД 11752308 .
- ^ Дарти К., Дениз А., Понти Ю. (август 2009 г.). «ВАРНА: Интерактивное рисование и редактирование вторичной структуры РНК» . Биоинформатика . 25 (15): 1974–1975. doi : 10.1093/биоинформатика/btp250 . ПМЦ 2712331 . ПМИД 19398448 .
- ^ «Каталог базовых пар РНК» . ndbserver.rutgers.edu . Проверено 17 декабря 2019 г.
- ^ «База данных пар оснований РНК (RNABPDB)» . hdrnas.saha.ac.in . Проверено 17 декабря 2019 г.
- ^ Бхаттачарья С., Миттал С., Паниграхи С., Шарма П., Прити С.П., Пол Р. и др. (январь 2015 г.). «RNABP COGEST: ресурс для исследования функциональных РНК» . База данных . 2015 . дои : 10.1093/база данных/bav011 . ПМК 4360618 . ПМИД 25776022 .
- ^ Чавла М., Олива Р., Буйницки Дж. М., Кавалло Л. (август 2015 г.). «Атлас пар оснований РНК, включающий модифицированные азотистые основания с оптимальной геометрией и точной энергией» . Исследования нуклеиновых кислот . 43 (14): 6714–6729. дои : 10.1093/нар/gkv606 . ПМЦ 4538814 . ПМИД 26117545 .
- ^ Силам П.П., Шарма П., Митра А. (июнь 2017 г.). «Структурный ландшафт пар оснований, содержащих посттранскрипционные модификации РНК» . РНК . 23 (6): 847–859. дои : 10.1261/rna.060749.117 . ПМЦ 5435857 . ПМИД 28341704 .
- ^ Лу XJ, Олсон В.К. (сентябрь 2003 г.). «3DNA: пакет программ для анализа, восстановления и визуализации трехмерных структур нуклеиновых кислот» . Исследования нуклеиновых кислот . 31 (17): 5108–5121. дои : 10.1093/нар/gkg680 . ПМК 212791 . ПМИД 12930962 .
- ^ Берман Х.М., Олсон В.К., Беверидж Д.Л., Вестбрук Дж., Гелбин А., Демени Т. и др. (сентябрь 1992 г.). «База данных нуклеиновых кислот. Комплексная реляционная база данных трехмерных структур нуклеиновых кислот» . Биофизический журнал . 63 (3): 751–759. Бибкод : 1992BpJ....63..751B . дои : 10.1016/s0006-3495(92)81649-1 . ПМК 1262208 . ПМИД 1384741 .
- ^ Сарвер М., Зирбель К.Л., Стомбо Дж., Мокдад А., Леонтис Н.Б. (январь 2008 г.). «FR3D: поиск локальных и сложных рекуррентных структурных мотивов в трехмерных структурах РНК» . Журнал математической биологии . 56 (1–2): 215–252. дои : 10.1007/s00285-007-0110-x . ПМЦ 2837920 . ПМИД 17694311 .
- ^ Лемье С., майор Ф (октябрь 2002 г.). «Канонические и неканонические типы спаривания оснований РНК: метод распознавания и полный репертуар» . Исследования нуклеиновых кислот . 30 (19): 4250–4263. дои : 10.1093/нар/gkf540 . ПМК 140540 . ПМИД 12364604 .
- ^ Корнелл В.Д., Чеплак П., Бэйли С.И., Гулд И.Р., Мерц К.М., Фергюсон Д.М. и др. (май 1995 г.). «Силовое поле второго поколения для моделирования белков, нуклеиновых кислот и органических молекул». Журнал Американского химического общества . 117 (19): 5179–5197. дои : 10.1021/ja00124a002 . ISSN 0002-7863 .
- ^ Перейти обратно: а б Дас Дж., Мукерджи С., Митра А., Бхаттачарья Д. (октябрь 2006 г.). «Неканонические пары оснований и структуры высшего порядка в нуклеиновых кислотах: анализ базы данных кристаллической структуры». Журнал биомолекулярной структуры и динамики . 24 (2): 149–161. дои : 10.1080/07391102.2006.10507108 . ПМИД 16928138 . S2CID 21066195 .
- ^ Чавла М., Шарма П., Гальдер С., Бхаттачарья Д., Митра А. (февраль 2011 г.). «Протонирование пар оснований в РНК: контекстный анализ и квантово-химические исследования их геометрии и стабильности». Журнал физической химии Б. 115 (6): 1469–1484. дои : 10.1021/jp106848h . ПМИД 21254753 .
- ^ Келли Р.Э., Ли Ю.Дж., Канторович Л.Н. (июнь 2005 г.). «Возможности гомоспаривания основания ДНК аденина». Журнал физической химии Б. 109 (24): 11933–11939. дои : 10.1021/jp050962y . ПМИД 16852470 .
- ^ Перейти обратно: а б с Спонер Дж. Э., Лещинский Дж., Сихровский В., Спонер Дж. (октябрь 2005 г.). «Пары оснований сахарный край / сахарный край в РНК: стабильность и структура на основе квантово-химических расчетов». Журнал физической химии Б. 109 (39): 18680–18689. дои : 10.1021/jp053379q . ПМИД 16853403 .
- ^ Перейти обратно: а б с Олива Р., Кавалло Л., Трамонтано А. (6 февраля 2006 г.). «Точные энергии пар и триплетов оснований нуклеиновых кислот с водородными связями в третичных взаимодействиях тРНК» . Исследования нуклеиновых кислот . 34 (3): 865–879. дои : 10.1093/nar/gkj491 . ПМЦ 1361619 . ПМИД 16461956 .
- ^ Перейти обратно: а б с Бхаттачария Д., Корипелла С.С., Митра А., Раджендран В.Б., Синха Б. (август 2007 г.). «Теоретический анализ неканонических взаимодействий пар оснований в молекулах РНК». Журнал биологических наук . 32 (5): 809–825. дои : 10.1007/s12038-007-0082-4 . ПМИД 17914224 . S2CID 10937466 .
- ^ Перейти обратно: а б с Рой А., Паниграхи С., Бхаттачарья М., Бхаттачарья Д. (март 2008 г.). «Структура, стабильность и динамика канонических и неканонических пар оснований: квантово-химические исследования». Журнал физической химии Б. 112 (12): 3786–3796. дои : 10.1021/jp076921e . ПМИД 18318519 .
- ^ Шарма П., Митра А., Шарма С., Сингх Х., Бхаттачарья Д. (июнь 2008 г.). «Квантово-химические исследования структур и связывания в неканонических парах оснований РНК: семейство транс-Уотсон-Крик: Уотсон-Крик». Журнал биомолекулярной структуры и динамики . 25 (6): 709–732. дои : 10.1080/07391102.2008.10507216 . ПМИД 18399704 . S2CID 13471262 .
- ^ Перейти обратно: а б Шарма П., Спонер Дж. Э., Спонер Дж., Шарма С., Бхаттачарья Д., Митра А. (март 2010 г.). «О роли цис-Хугстина: семейства пар оснований с сахарным краем в платформах и триплетах - квантово-химический взгляд на структурную биологию РНК». Журнал физической химии Б. 114 (9): 3307–3320. дои : 10.1021/jp910226e . ПМИД 20163171 .
- ^ Перейти обратно: а б Броварец О.О., Юренко Ю.П., Говорун Д.М. (03.06.2013). «Межмолекулярные H-связи CH···O/N в биологически важных парах природных азотистых оснований: тщательное квантово-химическое исследование». Журнал биомолекулярной структуры и динамики . 32 (6): 993–1022. дои : 10.1080/07391102.2013.799439 . ПМИД 23730732 . S2CID 205574305 .
- ^ Перейти обратно: а б Марино Т. (июнь 2014 г.). «Исследование методом DFT несовпадающих пар оснований (T-Hg-T)3, (U-Hg-U)3, d(T-Hg-T)2 и d(U-Hg-U)2». Журнал молекулярного моделирования . 20 (6): 2303. doi : 10.1007/s00894-014-2303-8 . ПМИД 24878806 . S2CID 1986713 .
- ^ Перейти обратно: а б с Младек А., Шарма П., Митра А., Бхаттачария Д., Спонер Дж., Спонер Дж.Е. (февраль 2009 г.). «Спаривание оснований Транс-Хугстина и края сахара в РНК. Структуры, энергии и стабильность на основе квантово-химических расчетов». Журнал физической химии Б. 113 (6): 1743–1755. дои : 10.1021/jp808357m . ПМИД 19152254 .
- ^ Мукерджи Д., Маити С., Гауда П.К., Шарма Р., Рой П., Бхаттачарья Д. (сентябрь 2022 г.). «RNABPDB: Молекулярное моделирование структуры РНК - от анализа пар оснований в кристаллах до прогнозирования структуры». Междисциплинарные науки, вычислительные науки о жизни . 14 (3): 759–774. дои : 10.1007/s12539-022-00528-w . ПМИД 35705797 . S2CID 249709744 .
- ^ Перейти обратно: а б с д и ж Гальдер С., Бхаттачарья Д. (ноябрь 2013 г.). «Структура и динамика РНК: взгляд на спаривание оснований». Прогресс биофизики и молекулярной биологии . 113 (2): 264–83. doi : 10.1016/j.pbiomolbio.2013.07.003 . ПМИД 23891726 .
- ^ Спонер Дж. Э., Лещинский Дж., Сихровский В., Спонер Дж. (октябрь 2005 г.). «Пары оснований сахарный край / сахарный край в РНК: стабильность и структура на основе квантово-химических расчетов». Журнал физической химии Б. 109 (39): 18680–9. дои : 10.1021/jp053379q . ПМИД 16853403 .
- ^ Шарма П., Спонер Дж. Э., Спонер Дж., Шарма С., Бхаттачарья Д., Митра А. (март 2010 г.). «О роли цис-Хугстина: семейства пар оснований с сахарным краем в платформах и триплетах - квантово-химический взгляд на структурную биологию РНК». Журнал физической химии Б. 114 (9): 3307–20. дои : 10.1021/jp910226e . ПМИД 20163171 .
- ^ Хеус Х.А., Хильберс К.В. (октябрь 2003 г.). «Структуры неканонических тандемных пар оснований в спиралях РНК: обзор». Нуклеозиды, нуклеотиды и нуклеиновые кислоты . 22 (5–8): 559–71. дои : 10.1081/NCN-120021955 . ПМИД 14565230 . S2CID 23265089 .
- ^ Перейти обратно: а б с д Олсон В.К., Ли С., Кауконен Т., Коласанти А.В., Синь Ю, Лу XJ (май 2019 г.). «Влияние неканонического спаривания оснований на сворачивание РНК: структурный контекст и пространственное расположение пар G · A» . Биохимия . 58 (20): 2474–2487. doi : 10.1021/acs.biochem.9b00122 . ПМК 6729125 . ПМИД 31008589 .
- ^ Рой А., Паниграхи С., Бхаттачарья М., Бхаттачарья Д. (март 2008 г.). «Структура, стабильность и динамика канонических и неканонических пар оснований: квантово-химические исследования». Журнал физической химии Б. 112 (12): 3786–96. дои : 10.1021/jp076921e . ПМИД 18318519 .
- ^ Перейти обратно: а б Николова Е.Н., Чжоу Х., Готтардо Ф.Л., Алви Х.С., Кимси И.Дж., Аль-Хашими Х.М. (декабрь 2013 г.). «Исторический отчет о парах оснований Хугстина в дуплексной ДНК» . Биополимеры . 99 (12): 955–68. дои : 10.1002/bip.22334 . ПМЦ 3844552 . ПМИД 23818176 .
- ^ Герман Т., Вестхоф Э (декабрь 1999 г.). «Пары оснований, отличные от Уотсона-Крика, в распознавании РНК-белков» (PDF) . Химия и биология . 6 (12): Р335-43. дои : 10.1016/s1074-5521(00)80003-4 . ПМИД 10631510 .
- ^ Дикерсон Р.Э. (март 1989 г.). «Определения и номенклатура компонентов структуры нуклеиновых кислот» . Исследования нуклеиновых кислот . 17 (5): 1797–1803. дои : 10.1093/нар/17.5.1797 . ПМК 317523 . ПМИД 2928107 .
- ^ Бланше С., Паси М., Закшевска К., Лавери Р. (июль 2011 г.). «Веб-сервер CURVES+ для анализа и визуализации параметров спирали, основной цепи и канавок структур нуклеиновых кислот» . Исследования нуклеиновых кислот . 39 (проблема с веб-сервером): W68–W73. дои : 10.1093/nar/gkr316 . ПМК 3125750 . ПМИД 21558323 .
- ^ Лу XJ, Олсон В.К. (июль 2008 г.). «3ДНК: универсальная интегрированная программная система для анализа, восстановления и визуализации трехмерных структур нуклеиновых кислот» . Протоколы природы . 3 (7): 1213–1227. дои : 10.1038/nprot.2008.104 . ПМК 3065354 . ПМИД 18600227 .
- ^ Бансал М., Бхаттачарья Д., Рави Б. (июнь 1995 г.). «NUPARM и NUCGEN: программное обеспечение для анализа и создания последовательно-зависимых структур нуклеиновых кислот» . Компьютерные приложения в биологических науках . 11 (3): 281–287. дои : 10.1093/биоинформатика/11.3.281 . ПМИД 7583696 .
- ^ Мукерджи С., Бансал М., Бхаттачария Д. (24 ноября 2006 г.). «Конформационная специфичность неканонических пар оснований и структур высшего порядка в нуклеиновых кислотах: анализ базы данных кристаллических структур». Журнал компьютерного молекулярного дизайна . 20 (10–11): 629–645. Бибкод : 2006JCAMD..20..629M . дои : 10.1007/s10822-006-9083-x . ПМИД 17124630 . S2CID 9275640 .
- ^ Абу Алмакарем А.С., Петров А.И., Стомбо Дж., Зирбель К.Л., Леонтис Н.Б. (февраль 2012 г.). «Комплексный обзор и геометрическая классификация троек оснований в структурах РНК» . Исследования нуклеиновых кислот . 40 (4): 1407–1423. дои : 10.1093/nar/gkr810 . ПМК 3287178 . ПМИД 22053086 .
- ^ Бхаттачарья С., Джунджхунвала А., Гальдер А., Бхаттачарья Д., Митра А. (май 2019 г.). «Выходя за рамки пар оснований: топологическая характеристика мультиплетов оснований в РНК» . РНК . 25 (5): 573–589. дои : 10.1261/rna.068551.118 . ПМК 6467009 . ПМИД 30792229 .
- ^ Перейти обратно: а б с Табей Ю, Цуда К, Кин Т, Асаи К (июль 2006 г.). «SCARNA: быстрое и точное структурное выравнивание последовательностей РНК путем сопоставления фрагментов стебля фиксированной длины» . Биоинформатика . 22 (14): 1723–1729. doi : 10.1093/биоинформатика/btl177 . ПМИД 16690634 .
- ^ Сарвер М., Зирбель К.Л., Стомбо Дж., Мокдад А., Леонтис Н.Б. (январь 2008 г.). «FR3D: поиск локальных и сложных рекуррентных структурных мотивов в трехмерных структурах РНК» . Журнал математической биологии . 56 (1–2): 215–252. дои : 10.1007/s00285-007-0110-x . ПМЦ 2837920 . ПМИД 17694311 .
- ^ Перейти обратно: а б Попенда М., Шачнюк М., Блажевич М., Васик С., Берк Е.К., Блажевич Дж., Адамиак Р.В. (май 2010 г.). «RNA FRABASE 2.0: расширенная доступная через Интернет база данных с возможностью поиска трехмерных фрагментов внутри структур РНК» . БМК Биоинформатика . 11 (1): 231. дои : 10.1186/1471-2105-11-231 . ПМЦ 2873543 . ПМИД 20459631 .
- ^ Хамдани Х.Ю., Аппасами С.Д., Уиллетт П., Артымюк П.Дж., Фирдаус-Райх М. (июль 2012 г.). «НАССАМ: сервер для поиска и аннотирования третичных взаимодействий и мотивов в трехмерных структурах сложных молекул РНК» . Исследования нуклеиновых кислот . 40 (проблема с веб-сервером): W35–W41. дои : 10.1093/нар/gks513 . ПМЦ 3394293 . ПМИД 22661578 .
- ^ Перейти обратно: а б Петров А.И., Зирбель К.Л., Леонтис Н.Б. (октябрь 2013 г.). «Автоматическая классификация 3D-мотивов РНК и Атлас 3D-мотивов РНК» . РНК . 19 (10): 1327–1340. дои : 10.1261/rna.039438.113 . ПМЦ 3854523 . ПМИД 23970545 .
- ^ «Атлас 3D-мотивов РНК» . rna.bgsu.edu . Проверено 17 декабря 2019 г.
- ^ Шевчак А.А., Мур П.Б. (март 1995 г.). «Петля сарцин/рицин, модульная РНК» . Журнал молекулярной биологии . 247 (1): 81–98. дои : 10.1006/jmbi.1994.0124 . ПМИД 7897662 .
- ^ Баулин Е, Яковлев В, Хачко Д, Спирин С, Ройтберг М (2016). «База данных URS: вселенная структур РНК и их мотивов» . База данных . 2016 : baw0 дои : 10.1093/база данных/baw085 . ПМЦ 4885603 . ПМИД 27242032 .
- ^ Парижьен М, майор Ф (март 2008 г.). «Конвейер MC-Fold и MC-Sym определяет структуру РНК на основе данных о последовательностях». Природа . 452 (7183): 51–55. Бибкод : 2008Natur.452...51P . дои : 10.1038/nature06684 . ПМИД 18322526 . S2CID 4415777 .
- ^ Зок Т., Анчак М., Зурковски М., Попенда М., Блажевич Дж., Адамяк Р.В., Шачнюк М. (июль 2018 г.). «RNApdbee 2.0: многофункциональный инструмент для аннотации структур РНК» . Исследования нуклеиновых кислот . 46 (П1): П30–П35. дои : 10.1093/nar/gky314 . ПМК 6031003 . ПМИД 29718468 .
- ^ Рыбарчик А., Шостак Н., Анчак М., Зок Т., Попенда М., Адамиак Р. и др. (сентябрь 2015 г.). «Новый in silico подход к оценке вторичных структур РНК с неканоническими парами оснований» . БМК Биоинформатика . 16 (1): 276. дои : 10.1186/s12859-015-0718-6 . ПМЦ 4557229 . ПМИД 26329823 .
- ^ Бхаттачарья Д., Гальдер С., Басу С., Мукерджи Д., Кумар П., Бансал М. (февраль 2017 г.). «RNAHelix: компьютерное моделирование структур нуклеиновых кислот с использованием Уотсона-Крика и неканонических пар оснований». Журнал компьютерного молекулярного дизайна . 31 (2): 219–235. Бибкод : 2017JCAMD..31..219B . дои : 10.1007/s10822-016-0007-0 . ПМИД 28102461 . S2CID 356097 .
- ^ Рэй П.С., Цзя Дж., Яо П., Маджумдер М., Хацоглу М., Фокс П.Л. (февраль 2009 г.). «Переключатель РНК, реагирующий на стресс, регулирует экспрессию VEGFA» . Природа . 457 (7231): 915–919. Бибкод : 2009Natur.457..915R . дои : 10.1038/nature07598 . ПМЦ 2858559 . ПМИД 19098893 .
- ^ Круз Дж. А., Вестхоф Е (февраль 2009 г.). «Динамические ландшафты архитектуры РНК» . Клетка . 136 (4): 604–609. дои : 10.1016/j.cell.2009.02.003 . ПМИД 19239882 . S2CID 10174208 .
- ^ Лоу JT, Weeks KM (октябрь 2010 г.). «Предсказание вторичной структуры РНК, направленное на SHAPE» . Методы . 52 (2): 150–158. дои : 10.1016/j.ymeth.2010.06.007 . ПМК 2941709 . ПМИД 20554050 .
- ^ Зигфрид Н.А., Пусан С., Райс ГМ, Нельсон Дж.А., Уикс К.М. (сентябрь 2014 г.). «Обнаружение мотива РНК с помощью SHAPE и мутационное профилирование (SHAPE-MaP)» . Природные методы . 11 (9): 959–965. дои : 10.1038/nmeth.3029 . ПМЦ 4259394 . ПМИД 25028896 .
- ^ Монтасери С., Ганджтабеш М., Заре-Миракабад Ф (28 ноября 2016 г.). «Эволюционный алгоритм прогнозирования вторичной структуры РНК на основе смоделированных данных SHAPE» . ПЛОС ОДИН . 11 (11): e0166965. Бибкод : 2016PLoSO..1166965M . дои : 10.1371/journal.pone.0166965 . ПМК 5125645 . ПМИД 27893832 .
- ^ Спасич А., Ассманн С.М., Бевилаква ПК, Мэтьюз Д.Х. (январь 2018 г.). «Моделирование ансамблей складок вторичной структуры РНК с использованием данных картирования SHAPE» . Исследования нуклеиновых кислот . 46 (1): 314–323. дои : 10.1093/nar/gkx1057 . ПМЦ 5758915 . ПМИД 29177466 .