Кардиостимулятор
Эта статья нуждается в дополнительных цитатах для проверки . ( декабрь 2009 г. ) |

Сокращение потенциалы ( сердечной мышцы сердечной мышцы ) у всех животных инициируется электрическими импульсами, известными как действия , которые в сердце известны как сердечные потенциалы действия . Скорость возникновения этих импульсов контролирует скорость сердечного сокращения, то есть частоту сердечных сокращений . Клетки , создающие эти ритмические импульсы, задающие темп перекачивания крови, называются клетками-водителями ритма, и они непосредственно контролируют частоту сердечных сокращений. Они составляют кардиостимулятор, то есть естественный водитель ритма сердца. У большинства людей наибольшая концентрация пейсмекерных клеток наблюдается в синоатриальном (СА) узле , естественном и первичном водителе ритма, и результирующий ритм представляет собой синусовый ритм .
Иногда темп задает вторичный водитель ритма, если поврежден СА-узел или имеются проблемы с электропроводящей системой сердца . Сердечные аритмии могут вызвать сердечную блокаду , при которой сокращения теряют ритм. У людей, а иногда и у других животных, механическое устройство, называемое искусственным водителем ритма (или просто «кардиостимулятор»), может использоваться после повреждения внутренней проводящей системы организма для синтетической генерации этих импульсов.
Контроль
[ редактировать ]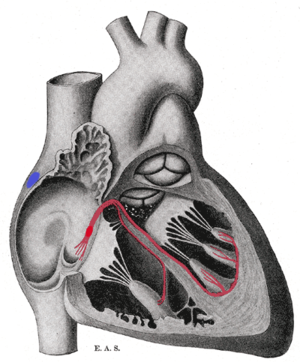
Первичный кардиостимулятор
[ редактировать ]Синоатриальный узел (СА-узел) является основным водителем ритма сердца. Это участок сердечной мышцы на стенке верхнего правого предсердия рядом с входом в верхнюю полую вену . Клетки, составляющие узел SA, представляют собой специализированные кардиомиоциты, известные как пейсмекерные клетки , которые могут спонтанно генерировать сердечные потенциалы действия . сердца Эти сигналы распространяются через систему электропроводности . [1] [2] Лишь один процент клеток сердечной мышцы является проводящим, остальные кардиомиоциты - сократительными .
Клетки водителя ритма соединены с соседними сократительными клетками через щелевые контакты , что позволяет им локально деполяризовать соседние клетки. Щелевые соединения позволяют проходить положительным катионам из деполяризованной пейсмекерной клетки в соседние сократительные клетки. Это запускает деполяризацию и потенциал действия в сократительных клетках. Соединение кардиомиоцитов через щелевые соединения позволяет всем сократительным клеткам сердца действовать скоординировано и сокращаться как единое целое. При этом быть синхронизированным с клетками водителя ритма; это свойство позволяет клеткам-водителям ритма контролировать сокращение всех остальных кардиомиоцитов.
Клетки в узле SA спонтанно деполяризуются , что в конечном итоге приводит к сокращению примерно 100 раз в минуту. Эта естественная частота постоянно изменяется под действием активности симпатических и парасимпатических нервных волокон через вегетативную нервную систему , так что средняя частота сердечных сокращений в состоянии покоя у взрослых людей составляет около 70 ударов в минуту.
Вторичный (AV-переходник и Пучок Его)
[ редактировать ]Импульсы из синусового узла достигают атриовентрикулярного узла , который действует как вторичный водитель ритма. Клетки АВ-узла обычно разряжаются со скоростью около 40-60 ударов в минуту и называются вторичным водителем ритма .
Далее по электропроводящей системе сердца находится Пучок Гиса . Левая правая и ветви пучка Гиса , а также волокна Пуркинье также будут генерировать спонтанный потенциал действия с частотой 30-40 ударов в минуту, поэтому, если оба узла SA и AV не функционируют, эти клетки могут стать водителями ритма. Эти клетки будут инициировать потенциалы действия и сокращаться с гораздо меньшей скоростью, чем первичные или вторичные клетки-водители ритма.
Узел SA контролирует скорость сокращения всей сердечной мышцы, поскольку его клетки имеют самую быструю скорость спонтанной деполяризации, поэтому они быстрее всего инициируют потенциалы действия. Потенциал действия, генерируемый СА-узлом, проходит вниз по электропроводящей системе сердца и деполяризует другие потенциальные пейсмекерные клетки (АВ-узел), чтобы инициировать потенциалы действия до того, как эти другие клетки получат возможность генерировать свой собственный спонтанный потенциал действия, таким образом они сокращаются и распространяют электрические импульсы со скоростью, заданной клетками узла SA. Это нормальное проведение электрической активности в сердце.
Генерация потенциалов действия
[ редактировать ]Выделяют 3 основных этапа генерации потенциала действия в пейсмекерной клетке. Поскольку стадии аналогичны сокращению клеток сердечной мышцы , они имеют одинаковую систему наименований. Это может привести к некоторой путанице. Нет фазы 1 или 2, есть фазы 0, 3 и 4.
Фаза 4 – Потенциал кардиостимулятора
[ редактировать ]Ключом к ритмическому срабатыванию пейсмекерных клеток является то, что, в отличие от других нейронов в организме, эти клетки медленно деполяризуются сами по себе и не нуждаются в какой-либо внешней иннервации со стороны вегетативной нервной системы для запуска потенциалов действия.
Во всех остальных клетках потенциал покоя (от -60 мВ до -70 мВ) обусловлен непрерывным оттоком или «утечкой» ионов калия через ионных каналов белки в мембране , окружающей клетки. Однако в клетках-водителях ритма проницаемость (отток) калия со временем уменьшается, вызывая медленную деполяризацию. Кроме того, существует медленный, непрерывный поток натрия внутрь , называемый «веселым» или кардиостимуляторным током . Эти два относительных изменения концентрации ионов медленно деполяризуют (делают более положительным) внутренний мембранный потенциал (напряжение) клетки, придавая этим клеткам пейсмекерный потенциал. Когда мембранный потенциал деполяризуется примерно до -40 мВ, он достигает порога (клетки переходят в фазу 0), что позволяет генерировать потенциал действия.
Фаза 0 – Ход вверх
[ редактировать ]Хотя подъем вверх в пейсмекерной клетке намного быстрее, чем деполяризация в фазе 4, он медленнее, чем в аксоне .
SA и AV-узел не имеют быстрых натриевых каналов, как нейроны, и деполяризация в основном вызвана медленным притоком ионов кальция. (Смешной ток также увеличивается). Кальций поступает в клетку через чувствительные к напряжению кальциевые каналы, которые открываются при достижении порога. Этот приток кальция вызывает фазу роста потенциала действия, что приводит к изменению мембранного потенциала до пика около +10 мВ. Важно отметить, что внутриклеточный кальций вызывает мышечные сокращения сократительных клеток и является эффекторным ионом. В клетках водителя ритма сердца фаза 0 зависит от активации кальциевых каналов L-типа вместо активации потенциалзависимых быстрых натриевых каналов, которые отвечают за инициацию потенциалов действия в сократительных (не пейсмекерных) клетках. По этой причине наклон фазы повышения потенциала действия пейсмекера более постепенный, чем у сократительной клетки (изображение 2).
Фаза 3 – Реполяризация
[ редактировать ]Изменение мембранного потенциала вызывает открытие каналов утечки калия, что приводит к быстрой потере ионов калия изнутри клетки, вызывая реполяризацию (V m становится более отрицательным). Кальциевые каналы также инактивируются вскоре после открытия. Кроме того, по мере инактивации натриевых каналов проницаемость натрия в клетку снижается. Эти изменения концентрации ионов медленно реполяризуют клетку до мембранного потенциала покоя (-60 мВ). Еще одно важное замечание на этом этапе заключается в том, что ионные насосы восстанавливают концентрацию ионов до состояния потенциала предварительного действия. Ионный насос натрий-кальциевого обмена работает для выкачивания кальция из внутриклеточного пространства , тем самым эффективно расслабляя клетку. Натриево -калиевый насос восстанавливает концентрацию ионов натрия и калия, откачивая натрий из клетки и перекачивая (обменивая) калий в клетку. Восстановление этих концентраций ионов жизненно важно, поскольку оно позволяет клетке перезагрузиться и повторить процесс спонтанной деполяризации, приводящий к активации потенциала действия.
Клиническое значение
[ редактировать ]Повреждение узла SA
[ редактировать ]Если СА-узел не функционирует или импульс, генерируемый в СА-узле, блокируется до того, как он пройдет по системе электропроводности, группа клеток, расположенных дальше в сердце, станет его водителем ритма. [3] Этот центр обычно представлен клетками внутри атриовентрикулярного узла (АВ-узла), который представляет собой область между предсердиями и желудочками , внутри межпредсердной перегородки . Если АВ-узел также выходит из строя, волокна Пуркинье иногда могут выступать в качестве кардиостимулятора по умолчанию или «ускользающего» водителя.
Эктопический кардиостимулятор
[ редактировать ]
Эктопический водитель ритма, также известный как эктопический очаг или эктопические очаги, представляет собой возбудимую группу клеток, вызывающую преждевременное сокращение сердца за пределами нормально функционирующего СА-узла сердца. Таким образом, кардиостимулятор является эктопическим, производящим эктопические сокращения. Если это хроническое заболевание, оно может привести к аритмиям, таким как тахикардия , брадикардия или фибрилляция желудочков . искусственный кардиостимулятор Чтобы противостоять этому, можно использовать .
Искусственные кардиостимуляторы
[ редактировать ]Искусственный кардиостимулятор (или искусственный кардиостимулятор, чтобы не путать с естественным кардиостимулятором) или просто кардиостимулятор — это имплантируемое медицинское устройство , генерирующее электрические импульсы, доставляемые электродами в камеры сердца либо верхние предсердия, либо нижние желудочки. заставить целевые камеры сокращаться и перекачивать кровь. При этом искусственный водитель ритма берет на себя функции кардиостимулятора первичного узла SA и регулирует функцию системы электропроводности сердца.
Ссылки
[ редактировать ]- ^ Касё А.Х., Басит Х., Чабра Л. (январь 2020 г.). «Физиология синоатриального узла (СА-узла)» . СтатПерлз. ПМИД 29083608 . Проверено 10 мая 2020 г.
- ^ Нил А. Кэмпбелл; и др. (2006). Биология: понятия и связи (5-е изд.). Сан-Франциско: Пирсон/Бенджамин Каммингс. стр. 473 . ISBN 0-13-193480-5 .
- ^ Соединительный ритм в электронной медицине