Узловой сигнальный путь
В этой статье отсутствует информация об узловом потоке и его обнаружении [PMID 27821522]. ( сентябрь 2021 г. ) |
Сигнальный путь Nodal представляет собой путь передачи сигнала , важный для региональной и клеточной дифференцировки во время эмбрионального развития . [ 1 ]
Семейство белков Nodal , подмножество суперсемейства Transforming Growth Factor Beta (TGFβ) , отвечает за индукцию мезоэнтодермы , формирование паттерна нервной системы и детерминацию дорсально-вентральной оси у эмбрионов позвоночных. Активация пути Nodal включает связывание узлов с активином и активиноподобными рецепторами, что приводит к фосфорилированию Smad2 . P-Smad2/ Smad4 Комплекс перемещается в ядро для взаимодействия с факторами транскрипции , такими как FoxH1 , p53 и Mixer ( Xenopus энтодермальный регулятор, подобный смеси ). Это, в свою очередь, приведет к индукции генов-мишеней, таких как NODAL, Lefty , антагонист узлового цербера и других. [ 2 ]
Активация Nodal-пути индуцирует транскрипцию многих генов-мишеней, в том числе и собственных, но в то же время микроРНК и другие белки отрицательно влияют на эту петлю положительной обратной связи в разных точках пути. [ 2 ] [ 3 ] Этот баланс активации и ингибирования сигнала необходим для достижения точного местоположения, концентрации и продолжительности действия нижестоящих генов-мишеней, которые играют важную роль на ранних этапах развития. В этой статье будет обобщена роль некоторых компонентов, которые положительно и отрицательно участвуют в регуляции сигнального пути. Хотя все основные компоненты передачи сигналов Nodal эволюционно консервативны почти у всех позвоночных, регуляция каждого компонента пути иногда варьируется в зависимости от вида.
История
[ редактировать ]Узловой ген был первоначально обнаружен Конлоном и др. в результате ретровирусной мутации у мышей, которая привела к выделению гена, который препятствовал нормальной гаструляции и развитию эмбрионов мышей. [ 4 ] Дальнейшее исследование этого гена Zhou et al. показали, что узловые гены кодируют секретируемый сигнальный пептид, которого было достаточно для индукции клеток мезодермы у эмбриона мыши. Это было важным открытием, поскольку многие другие факторы были вовлечены в формирование мезодермы у Xenopus , тогда как трудность удаления этих факторов из-за эмбриональной летальности и материнского вклада генов делала неуловимой возможность анализа нокаутных фенотипов. [ 5 ] Дальнейшие исследования передачи сигналов nodal у других позвоночных, таких как Cyclops и Squint, у рыбок данио доказали, что передача сигналов nodal адекватна для индукции мезодермы у всех позвоночных. [ 2 ]
Отдельные компоненты пути
[ редактировать ]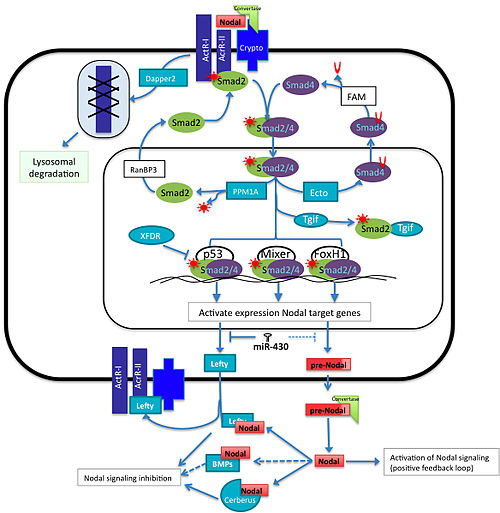
Левша
[ редактировать ]Белки Lefty, дивергентные члены суперсемейства белков TGFβ , действуют как внеклеточные антагонисты передачи сигналов Nodal. Исследования экспрессии гомолога Lefty, antivin, у рыбок данио показывают, что Lefty, вероятно, действует как конкурентный ингибитор передачи сигналов Nodal. [ 6 ] Сверхэкспрессия Lefty приводит к фенотипу, подобному нокауту Nodal, в то время как сверхэкспрессия рецептора активина (nodal-родственного белка) или даже внеклеточного домена рецептора может спасти фенотип. Поскольку индукция Lefty зависит от экспрессии Nodal, lefty действует как классический ингибитор обратной связи для передачи сигналов Nodal. Как и узловые, все позвоночные имеют по крайней мере один ген Lefty, в то время как многие, такие как рыбки данио и мыши, имеют два уникальных гена Lefty.
И белки
[ редактировать ]Белки DAN, такие как Cerberus и Coco у Xenopus и Cerberus-подобные у мышей, также действуют как антагонисты передачи сигналов Nodal. В отличие от белков Lefty, белки DAN связываются непосредственно с внеклеточными белками Nodal и предотвращают передачу сигналов. Более того, не все белки DAN специфичны для передачи сигналов Nodal и также блокируют костные морфогенетические белки (BMPs), а в случае Cerberus и Coco также передачу сигналов Wnt. [ 7 ] Эта деятельность важна для развития нейронов и симметрии левых и правых, о чем будет сказано позже.
БМП
[ редактировать ]Lefty и Cerberus не единственные, кто способен взаимодействовать во внеклеточном пространстве с Nodal; существуют биохимические доказательства того, что BMP3 и BMP7 образуют гетеродимеры с Nodal, вызывая взаимное ингибирование задействованных путей. [ 8 ]
Конвертазы: фурин и PACE4.
[ редактировать ]мРНК Nodal продуцирует незрелую форму белка Nodal, которая расщепляется белками, называемыми конвертазами, с образованием зрелого Nodal. Субтилизин ( Spc1 -подобные пропротеинконвертазы (SPC) фурин ) и PACE4 (Spc4) распознают специфическую последовательность предшественника белка Nodal и расщепляют ее с образованием зрелого лиганда Nodal. [ 9 ] И наоборот, незрелая форма Nodal все еще способна активировать этот путь. [ 10 ] Во время транспортировки Nodal во внеклеточное пространство корецептор Nodal захватывает предшественник Nodal в липидных рафтах, и, попав на поверхность клетки, Cripto взаимодействует с конвертазами и образует комплекс, который облегчает процессинг Nodal. [ 11 ]
Белки EGF-CFC
[ редактировать ]Белки EGF-CFC представляют собой мембраносвязанные внеклеточные факторы, которые служат важным кофактором в передаче сигналов Nodal и в развитии позвоночных в целом. Это семейство кофакторов включает One-eyed Pinhead (oep) у рыбок данио, FRL1 у Xenopus , а также Cripto и Criptic у мышей и людей. Генетические исследования oep у рыбок данио показали, что нокаут как материнского, так и зиготического oep приводит к фенотипу, сходному с таковым при нокауте squint/Cyclops (Nodals). Аналогично, сверхэкспрессия либо Nodal (squint/Cyclops), либо oep с нокаутом другого не обнаруживает фенотипических различий. Эти доказательства в сочетании с данными о том, что сверхэкспрессия oep не обнаруживает фенотипа, подтверждают роль EGF-CFC как важного кофактора в передаче сигналов Nodal. [ 12 ]
щеголеватый2
[ редактировать ]У мышей, лягушек и рыб Dapper2 является негативным регулятором формирования мезодермы , действуя посредством подавления сигнальных путей Wnt и TGFβ/nodal. Известно, что у рыбок данио nodal активирует экспрессию гена dapper2 . [ 13 ] На клеточной поверхности Dapper2 прочно связывается с активной формой рецепторов активина типа 1 и нацеливается на рецептор для лизосомальной деградации. Сверхэкспрессия Dapper2 имитирует потерю функции узловых корецепторов, поскольку узловой сигнал не может быть трансдуцирован и, следовательно, он производит меньше мезодермы. У эмбриона мыши мРНК dpr2 локализована по всему эмбриону через 7,5 дней после зачатия (dpc), однако ее расположение меняется на 8,5 dpc, где она наблюдается в проспективных сомитах, и на 10 dpc, в нервной трубке, слуховом пузырьке и кишечнике; поскольку Dapper2 и Nodal экспрессируются в одной и той же области, это указывает на то, что Dapper противодействует сигналам индукции мезодермы, происходящим от Nodal. [ 14 ] Каким-то образом уменьшение количества рецепторов активина могло привести к снижению активности различных путей TGFb. [ 13 ]
Смад
[ редактировать ]Белки Smad отвечают за передачу узловых сигналов в ядро. Связывание белков Nodal с активином или активиноподобными серин/треонин-киназными рецепторами приводит к фосфорилированию Smad2 . Затем Smad2 будет связываться с Smad4 и транслоцироваться в ядро, тем самым стимулируя транскрипцию узловых генов-мишеней. Было показано, что другой Smad, Smad3 , может фосфорилироваться активированными рецепторами и может также функционировать как активатор узловых генов. Однако нокаут Smad2 у мышей приводит к нарушению формирования примитивной полоски . Этого недостаточно для нокдауна всех мезоэнтодермальных генов, что указывает на то, что Smad3 имеет некоторую перекрывающуюся функцию с Smad2. Однако экспрессия этих генов повсеместна у эмбрионов Smad2 KO, тогда как у дикого типа она ограничена. Нокауты Smad3 не имеют фенотипа, показывающего, что перекрытие экспрессии с Smad2 является достаточным для нормального развития. [ 15 ]
Молекулы, влияющие на активацию узлов через smad
[ редактировать ]Эктодермин отрицательно регулирует узловой путь, ингибируя взаимодействие Smad4 с другими Smad внутри ядра посредством моноубиквитинирования Smad4. Эта модификация позволяет ему транспортироваться из цитоплазмы, где он может быть деубиквитинирован белком FAM, что позволяет ему образовывать комплексы. опять же с другими Смадами. [ 16 ] [ 17 ] Другим негативным регулятором пути, вмешивающегося в Smads, является PPM1A, фосфатаза, которая действует вместе с Phospho-Smad2/3, делая его неактивным. [ 18 ] Впоследствии Smad2/3 транспортируется за пределы ядра с помощью RanBP2. [ 19 ]
Транскрипционные факторы, контролирующие передачу сигналов
[ редактировать ]Smad2/3/4 может ассоциироваться с различными факторами транскрипции, такими как p53, Mixer и FoxH1, и распознавать специфические цис-регуляторные элементы, чтобы активировать экспрессию генов-мишеней Nodal в точное время и в точном месте и активировать гены, необходимые для индукции мезодермы. Существуют некоторые другие транскрипционные факторы, которые конкурируют за некоторые компоненты транскрипционного аппарата за активацию генов-мишеней Nodal. Например, Tgif1 и Tgif2 являются отрицательными корегуляторами, которые конкурируют за активную форму Smad2, снижая относительную концентрацию активного Smad2 в ядре. У Xenopus потеря функции Tgf1 и Tgf2 вызывает активацию Xnr5 и Xnr6. [ 20 ] Другим примером репрессоров транскрипции у лягушки является XFDL, который связывается с p53, препятствуя взаимодействию с комплексом Smad2/3/4. [ 21 ]
микроРНК, контролирующие передачу сигналов
[ редактировать ]У позвоночных эволюционно консервативное семейство микроРНК miR-430/427/302 экспрессируется на ранних стадиях развития. Он играет важную роль в контроле спецификации мезодермы и энтодермы и делает это путем регуляции уровней экспрессии белков некоторых сигнальных компонентов Nodal. Это семейство состоит из миР-430 костистых костей, миР-427 амфибий и миР-302 млекопитающих. У рыбок данио миР-430 ингибирует трансляцию Sqt, Lefty1 и Lefty2, у лягушек миР-427 регулирует Xnr5, Xnr6b, LeftyA и LeftyB, однако в эмбриональных стволовых клетках человека было показано, что миР-302 негативная регулирует экспрессию только Lefty1 и Lefty2, но, по-видимому, не подавляют уровни экспрессии белка Nodal. [ 22 ]
Узловая сигнализация в разработке
[ редактировать ]Мезоэнтодермальная индукция
[ редактировать ]Многочисленные исследования установили, что сигнал Nodal необходим для индукции большинства типов мезодермальных и энтодермальных клеток, а нокаут Squint/Cyclops у рыбок данио не приводит к развитию хорды, сердца, почек или даже крови. [ 23 ] Происхождение и характер экспрессии узловых сигнальных белков различаются у разных видов. Передача сигналов nodal у млекопитающих инициируется повсеместно в эпибластных клетках и поддерживается ауторегуляторной передачей сигналов Wnt3 и ограничивается индукцией антагонистов, таких как Cerberus-like и lefty. [ 24 ] Исследования на Xenopus показали, что экспрессия xnr ( узловые узлы Xenopus ) индуцируется VegT на вегетативном полюсе, а узлы распространяются на бластулу. [ 25 ] Экспрессия Xnr стабилизируется присутствием β-катенина. Эта информация поднимает вопрос о том, как nodal передача сигналов приводит к индукции как энтодермы, так и мезодермы. Ответ приходит в виде градиента узлового белка. Временные и пространственные различия в передаче сигналов nodal приведут к разным судьбам клеток. С добавлением антагонистов и вариабельного диапазона различных узлов для эмбриона можно нарисовать карту судеб клеток, включающую как мезодерму, так и энтодерму. [ 2 ] Однако неясно, суммируется ли передача сигналов nodal или клетки реагируют на амплитуду сигнала. [ 26 ]
Левый-правый узор
[ редактировать ]Анатомия человека асимметрична: сердце расположено слева, а печень справа. Лево-правая асимметрия (биология) — это особенность, общая для всех позвоночных, и даже парно-симметричные органы, такие как легкие, демонстрируют асимметрию количества долей. Доказательства того, что nodal передача сигналов отвечает за лево-правую спецификацию, получены в результате генетического анализа организмов, лишенных лево-правой спецификации. Эти генетические исследования привели к идентификации мутаций в компонентах узлового сигнального пути, таких как ActRIIB, Criptic и FoxH1, у мышей. [ 27 ] Эти исследования показали, что лево-правая симметрия создается в результате экспрессии узловых антагонистов на правой стороне эмбриона, которая уравновешивается усилением регуляции узлов на другой половине эмбриона. Результатом является узловой градиент, который высок на вентральной стороне эмбриона и под действием антагониста снижается как градиент к средней линии. Исследования узлового сигнального пути и его нижестоящих мишеней, таких как PITX2, у других животных показали, что он также может контролировать лево-правое асимметричное паттернирование у асцидий , амфиоксусов , морских ежей и моллюсков . [ 28 ]
Нейронный паттерн
[ редактировать ]Поскольку узловая передача сигналов приводит к эктодерме и мезодерме , формирование нейроэктодермы требует блокирования узловой передачи сигналов, что достигается за счет экспрессии узлового антагониста, Cerberus. Роль передачи сигналов nodal вновь проявляется позже в развитии, когда передача сигналов nodal необходима для спецификации формирования нейронного паттерна вентральных клеток. Потеря функции Cyclops или oep у рыбок данио приводит к циклопическим эмбрионам, характеризующимся отсутствием медиальной пластинки дна и вентральной части переднего мозга. [ 2 ] Не все узлы приводят к образованию мезоэктодермы. Родственный Xenopus nodal 3, (Xnr3), дивергентный член суперсемейства TGFβ, индуцирует экспрессию белка Xbra. Паттерн экспрессии Xbra в сочетании с паттерном экспрессии другого нейроиндуктора, Xlim-1, приводит к формированию паттерна организатора у Xenopus . Эта передача сигналов в сочетании с другими узлами, noggin, chordin, фоллистатином и др. приводит к окончательному формированию паттерна центральной нервной системы позвоночных. [ 29 ]
Ссылки
[ редактировать ]- ^ Шен ММ (март 2007 г.). «Узловая передача сигналов: роль и регуляция развития». Разработка . 134 (6): 1023–34. дои : 10.1242/dev.000166 . ПМИД 17287255 .
- ^ Перейти обратно: а б с д и Шир А.Ф. (2003). «Узловая передача сигналов в развитии позвоночных». Анну. Преподобный Cell Dev. Биол . 19 : 589–621. doi : 10.1146/annurev.cellbio.19.041603.094522 . ПМИД 14570583 .
- ^ Шир А.Ф. (ноябрь 2009 г.). «Узловые морфогены» . Колд Спринг Харб Перспектива Биол . 1 (5): а003459. doi : 10.1101/cshperspect.a003459 . ПМЦ 2773646 . ПМИД 20066122 .
- ^ Конлон Флорида, Барт К.С., Робертсон Э.Дж. (апрель 1991 г.). «Новая эмбриональная летальная мутация, индуцированная ретровирусом у мышей: оценка судьбы развития эмбриональных стволовых клеток, гомозиготных по провирусной интеграции 413.d». Разработка . 111 (4): 969–81. дои : 10.1242/dev.111.4.969 . ПМИД 1879365 .
- ^ Чжоу X, Сасаки Х, Лоу Л., Хоган Б.Л., Куэн М.Р. (февраль 1993 г.). «Nodal — это новый TGF-бета-подобный ген, экспрессируемый в узле мыши во время гаструляции» . Природа . 361 (6412): 543–7. Бибкод : 1993Natur.361..543Z . дои : 10.1038/361543a0 . ПМИД 8429908 . S2CID 4318909 .
- ^ Thisse C, Thisse B (январь 1999 г.). «Антивин, новый и отличающийся член суперсемейства TGFbeta, отрицательно регулирует индукцию мезодермы». Разработка . 126 (2): 229–40. дои : 10.1242/dev.126.2.229 . ПМИД 9847237 .
- ^ Пикколо С., Агиус Э., Лейнс Л., Бхаттачария С., Гранц Х., Баумистер Т., Де Робертис Э.М. (февраль 1999 г.). «Головной индуктор Цербер является многофункциональным антагонистом сигналов Nodal, BMP и Wnt» . Природа . 397 (6721): 707–10. Бибкод : 1999Natur.397..707P . дои : 10.1038/17820 . ПМЦ 2323273 . ПМИД 10067895 .
- ^ Йео С., Уитмен М. (май 2001 г.). «Узловые сигналы для Smads через криптозависимые и криптонезависимые механизмы» . Мол. Клетка . 7 (5): 949–57. дои : 10.1016/S1097-2765(01)00249-0 . ПМИД 11389842 .
- ^ Бек С., Ле Гуд Дж.А., Гусман М., Бен Хаим Н., Рой К., Бирманн Ф., Констам Д.Б. (декабрь 2002 г.). «Экстраэмбриональные протеазы регулируют передачу сигналов Nodal во время гаструляции». Нат. Клеточная Биол . 4 (12): 981–5. дои : 10.1038/ncb890 . ПМИД 12447384 . S2CID 12078090 .
- ^ Бен-Хаим Н., Лю С., Гусман-Аяла М., Пескаторе Л., Меснард Д., Бишофбергер М., Наеф Ф., Робертсон Э.Дж., Констам Д.Б. (сентябрь 2006 г.). «Узловой предшественник, действуя через рецепторы активина, индуцирует мезодерму, поддерживая источник ее конвертаз и BMP4» . Дев. Клетка . 11 (3): 313–23. дои : 10.1016/j.devcel.2006.07.005 . ПМИД 16950123 .
- ^ Бланше М.Х., Ле Гуд Дж.А., Меснар Д., Ооршот В., Бафласт С., Минчиотти Г., Кламперман Дж., Констам Д.Б. (октябрь 2008 г.). «Крипто привлекает фурин и PACE4 и контролирует транспортировку узлов во время протеолитического созревания» . ЭМБО Дж . 27 (19): 2580–91. дои : 10.1038/emboj.2008.174 . ПМК 2567404 . ПМИД 18772886 .
- ^ Шен М.М., Шир А.Ф. (июль 2000 г.). «Семейство генов EGF-CFC в развитии позвоночных». Тенденции Жене . 16 (7): 303–9. дои : 10.1016/S0168-9525(00)02006-0 . ПМИД 10858660 .
- ^ Перейти обратно: а б Чен Ю.Г. (январь 2009 г.). «Эндоцитарная регуляция передачи сигналов TGF-бета» . Сотовый Res . 19 (1): 58–70. дои : 10.1038/cr.2008.315 . ПМИД 19050695 .
- ^ Су Ю, Чжан Л, Гао X, Мэн Ф, Вэнь Дж, Чжоу Х, Мэн А, Чен ЮГ (март 2007 г.). «Эволюционно консервативная активность Dapper2 в противодействии передаче сигналов TGF-бета» . ФАСЕБ Дж . 21 (3): 682–90. дои : 10.1096/fj.06-6246com . ПМИД 17197390 . S2CID 86415243 .
- ^ Уитмен М. (ноябрь 2001 г.). «Узловая передача сигналов у ранних эмбрионов позвоночных: темы и вариации» . Дев. Клетка . 1 (5): 605–17. дои : 10.1016/S1534-5807(01)00076-4 . ПМИД 11709181 .
- ^ Дюпон С., Заккинья Л., Корденонси М., Солиго С., Адорно М., Ругге М., Пикколо С. (апрель 2005 г.). «Спецификация зародышевого слоя и контроль роста клеток с помощью эктодермина, убиквитинлигазы Smad4» . Клетка . 121 (1): 87–99. дои : 10.1016/j.cell.2005.01.033 . hdl : 11577/2439217 . ПМИД 15820681 . S2CID 16628152 .
- ^ Дюпон С., Мамиди А., Корденонси М., Монтаньнер М., Заккинья Л., Адорно М., Мартелло Дж., Стинчфилд М.Дж., Солиго С., Морсут Л., Инуи М., Моро С., Модена Н., Арджентон Ф., Ньюфелд С.Дж., Пикколо С. (январь 2009 г.) ). «FAM/USP9x, деубиквитинирующий фермент, необходимый для передачи сигналов TGFbeta, контролирует моноубиквитинирование Smad4» . Ячейка 136 (1): 123–35. дои : 10.1016/j.cell.2008.10.051 . ПМИД 19135894 . S2CID 16458957 .
- ^ Линь X, Дуань X, Лян YY, Су Y, Райтон К.Х., Лонг Дж., Ху М., Дэвис CM, Ван Дж., Бруникади ФК, Ши Ю., Чен Ю.Г., Мэн А., Фэн XH (июнь 2006 г.). «PPM1A действует как фосфатаза Smad, прекращая передачу сигналов TGFbeta» . Клетка . 125 (5): 915–28. дои : 10.1016/j.cell.2006.03.044 . ПМК 6309366 . ПМИД 16751101 . (В настоящее время в этом документе выражается обеспокоенность , см. дои : 10.1016/j.cell.2016.03.038 , PMID 27058669 , Часы втягивания )
- ^ Дай Ф, Линь X, Чанг С, Фэн XH (март 2009 г.). «Ядерный экспорт Smad2 и Smad3 с помощью RanBP3 облегчает прекращение передачи сигналов TGF-бета» . Дев. Клетка . 16 (3): 345–57. дои : 10.1016/j.devcel.2009.01.022 . ПМЦ 2676691 . ПМИД 19289081 .
- ^ Пауэрс С.Е., Танигучи К., Йен В., Мелхуиш Т.А., Шен Дж., Уолш К.А., Сазерленд А.Е., Уоттон Д. (январь 2010 г.). «Tgif1 и Tgif2 регулируют передачу сигналов Nodal и необходимы для гаструляции» . Разработка . 137 (2): 249–59. дои : 10.1242/dev.040782 . ПМК 2799159 . ПМИД 20040491 .
- ^ Сасаи Н., Якура Р., Камия Д., Наказава Ю., Сасаи Ю. (май 2008 г.). «Эктодермальный фактор ограничивает дифференцировку мезодермы, ингибируя р53» . Ячейка 133 (5): 878–90. дои : 10.1016/j.cell.2008.03.035 . ПМИД 18510931 . S2CID 16711420 .
- ^ Роза А., Спаньоли FM, Бриванлу А.Х. (апрель 2009 г.). «Семейство миР-430/427/302 контролирует спецификацию мезендодермальной судьбы посредством видоспецифического выбора мишени» . Дев. Клетка . 16 (4): 517–27. дои : 10.1016/j.devcel.2009.02.007 . ПМИД 19386261 .
- ^ Грицман К., Талбот В.С., Шир А.Ф. (март 2000 г.). «Узловые сигнальные схемы органайзер». Разработка . 127 (5): 921–32. дои : 10.1242/dev.127.5.921 . ПМИД 10662632 .
- ^ Бреннан Дж., Лу СиСи, Норрис Д.П., Родригес Т.А., Беддингтон Р.С., Робертсон Э.Дж. (июнь 2001 г.). «Узловая передача сигналов в эпибласте паттерн раннего эмбриона мыши». Природа . 411 (6840): 965–9. Бибкод : 2001Natur.411..965B . дои : 10.1038/35082103 . ПМИД 11418863 . S2CID 4402639 .
- ^ Кофрон М., Демель Т., Ксантос Дж., Лор Дж., Сан Б., Сив Х., Осада С., Райт С., Уайли С., Хисман Дж. (декабрь 1999 г.). «Индукция мезодермы у Xenopus - это зиготическое событие, регулируемое материнским VegT через факторы роста TGFbeta». Разработка . 126 (24): 5759–70. дои : 10.1242/dev.126.24.5759 . ПМИД 10572051 .
- ^ Грин Дж (декабрь 2002 г.). «Градиенты морфогена, позиционная информация и Xenopus: взаимодействие теории и эксперимента». Дев. Дин . 225 (4): 392–408. дои : 10.1002/dvdy.10170 . ПМИД 12454918 . S2CID 6480950 .
- ^ Бурдин Р.Д., Шир А.Ф. (апрель 2000 г.). «Консервативные и дивергентные механизмы формирования оси лево-право» . Генс Дев . 14 (7): 763–76. дои : 10.1101/gad.14.7.763 . ПМИД 10766733 . S2CID 34764551 .
- ^ Намигай, Э; Кенни, Нью-Джерси; Шимелд С.М. (2014). «Прямо по древу жизни: эволюция лево-правой асимметрии в Bilateria» . Бытие . 52 (6): 458–470. дои : 10.1002/dvg.22748 . ПМИД 24510729 . S2CID 24995729 .
- ^ Тайра М., Сен-Жанне Ж.П., Давид И.Б. (февраль 1997 г.). «Роль генов Xlim-1 и Xbra в переднезаднем формировании паттерна нервной ткани организатором головы и туловища» . Учеб. Натл. акад. наук. США . 94 (3): 895–900. Бибкод : 1997PNAS...94..895T . дои : 10.1073/pnas.94.3.895 . ЧВК 19610 . ПМИД 9023353 .
Дальнейшее чтение
[ редактировать ]- Бейкер К., Хольцман Н.Г., Бурдин Р.Д. (сентябрь 2008 г.). «Прямая и косвенная роль передачи сигналов Nodal в двухосных преобразованиях во время асимметричного морфогенеза сердца рыбок данио» . Учеб. Натл. акад. наук. США . 105 (37): 13924–9. Бибкод : 2008PNAS..10513924B . дои : 10.1073/pnas.0802159105 . ПМЦ 2544555 . ПМИД 18784369 .
- Чеа Х.К., Райт К.В., Свалла Б.Дж. (октябрь 2005 г.). «Узловая передача сигналов и эволюция гаструляции дейтеростома» . Дев. Дин . 234 (2): 269–78. дои : 10.1002/dvdy.20549 . ПМИД 16127715 . S2CID 24982316 .
- Чен Ю, Шир А.Ф. (май 2001 г.). «Узловой сигнал рыбки данио Squint действует как морфоген». Природа . 411 (6837): 607–10. Бибкод : 2001Natur.411..607C . дои : 10.1038/35079121 . ПМИД 11385578 . S2CID 4325920 .
- Дуган С.Т., Варга Р.М., Кейн Д.А., Шир А.Ф., Талбот В.С. (май 2003 г.). «Роль узловых генов рыб данио, косоглазия и циклопа, в формировании паттерна мезендодермы». Разработка . 130 (9): 1837–51. дои : 10.1242/dev.00400 . ПМИД 12642489 .
- Люксарди Г., Маршал Л., Томе В., Коджабахян Л. (февраль 2010 г.). «Отдельные лиганды Xenopus Nodal последовательно индуцируют мезентодерму и контролируют движения гаструляции параллельно пути Wnt/PCP» . Разработка . 137 (3): 417–26. дои : 10.1242/dev.039735 . ПМИД 20056679 .